ARENES
Hidrokarbon aromatik (arena) – hidrokarbon siklik, disatukan oleh konsep aromatisitas, yang menentukan karakteristik umum dalam struktur dan sifat kimia.
Klasifikasi
Berdasarkan jumlah cincin benzena dalam molekulnya, arena dibagi menjadi ke:
mononuklir
multi-inti

Tata nama dan isomerisme
Nenek moyang struktural hidrokarbon seri benzena adalah benzena C 6 H 6 dari mana nama sistematis homolog berasal.
Untuk senyawa monosiklik, nama nonsistematis (sepele) berikut dipertahankan:

Posisi substituen ditunjukkan dalam angka terkecil (arah penomoran tidak menjadi masalah),
|
|
|
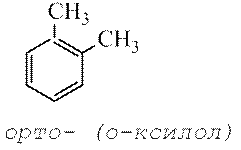
dan untuk senyawa tersubstitusi di dapat menggunakan notasi orto, meta, pasangan.
|
|
|
|
Jika terdapat tiga substituen dalam ring, maka substituen tersebut harus mendapat bilangan terendah, yaitu baris “1,2,4” memiliki keunggulan dibandingkan “1,3,4”.


1,2-dimetil-4-etilbenzena (nama benar) 3,4-dimetil-1-etilbenzena (nama salah)
Isomerisme arena tersubstitusi tunggal disebabkan oleh struktur kerangka karbon substituen; pada homolog benzena tersubstitusi di- dan polisubstitusi, isomerisme tambahan ditambahkan, yang disebabkan oleh perbedaan susunan substituen dalam inti.
Isomerisme hidrokarbon aromatik dengan komposisi C 9 H 12 :
|
|
|
|
|
Sifat fisik
Titik didih dan titik leleh arena lebih tinggi dibandingkan dengan alkana, alkena, alkuna, sedikit polar, tidak larut dalam air dan sangat larut dalam pelarut organik non-polar. Arena adalah cairan atau padatan yang memiliki bau tertentu. Benzena dan banyak arena terkondensasi bersifat racun, beberapa di antaranya menunjukkan sifat karsinogenik. Produk antara oksidasi arena yang terkondensasi dalam tubuh adalah epoksida, yang secara langsung menyebabkan kanker atau merupakan prekursor karsinogen.
Mendapatkan arena
Banyak hidrokarbon aromatik yang sangat penting secara praktis dan diproduksi dalam skala industri besar. Sejumlah metode industri didasarkan pada pengolahan batu bara dan minyak.
Minyak terutama terdiri dari hidrokarbon alifatik dan alisiklik; untuk mengubah hidrokarbon alifatik atau asiklik menjadi hidrokarbon aromatik, metode aromatisasi minyak telah dikembangkan, yang dasar kimianya dikembangkan oleh N.D. Zelinsky, B.A. Kazansky.
1. Siklisasi dan dehidrogenasi:
2. Hidrodesmetilasi:

3. Homolog benzena dibuat dengan alkilasi atau asilasi yang diikuti dengan reduksi gugus karbonil.
a) Alkilasi Friedel-Crafts:

b) asilasi Friedel-Crafts:

4. Pembuatan bifenil dengan reaksi Wurtz-Fitting:
5. Pembuatan difenilmetana melalui reaksi Friedel-Crafts:
Struktur dan sifat kimia.
Kriteria aromatisitas:
Berdasarkan perhitungan teoritis dan studi eksperimental sistem terkonjugasi siklik, ditemukan bahwa suatu senyawa dikatakan aromatik jika mempunyai:
- Kerangka σ siklik datar;
- Sistem elektron π tertutup terkonjugasi, menutupi semua atom cincin dan mengandung 4n + 2, dengan n = 0, 1, 2, 3, dst. Formulasi ini dikenal sebagai aturan Huckel.

Kriteria aromatisitas memungkinkan seseorang untuk membedakan sistem aromatik terkonjugasi dari sistem lainnya. Benzena mengandung enam set elektron π dan mengikuti aturan Hückel pada n = 1.
Apa yang diberikan aromatisitas:
Meskipun tingkat ketidakjenuhannya tinggi, senyawa aromatik tahan terhadap zat pengoksidasi dan suhu, serta lebih rentan mengalami reaksi substitusi dibandingkan reaksi adisi. Senyawa-senyawa ini telah meningkatkan stabilitas termodinamika, yang dijamin oleh energi konjugasi yang tinggi dari sistem cincin aromatik (150 kJ/mol); oleh karena itu, arena lebih disukai masuk ke dalam reaksi substitusi, sehingga mempertahankan aromatisitasnya.
Mekanisme reaksi substitusi elektrofilik pada cincin aromatik:
Kerapatan elektron sistem terkonjugasi π pada cincin benzena merupakan sasaran empuk serangan reagen elektrofilik.
Biasanya, reagen elektrofilik dihasilkan selama reaksi menggunakan katalis dan kondisi yang sesuai.
E – Y → E δ + – Y δ - → E + + Y - Pembentukan kompleks π. Serangan awal elektrofil dari awan elektron π pada cincin menyebabkan koordinasi reagen dengan sistem π dan pembentukan kompleks tipe donor-akseptor yang disebutπ-kompleks.

Sistem aroma tidak terganggu: Pembentukan kompleks σ. Tahap pembatas, di mana elektrofil membentuk ikatan kovalen dengan atom karbon karena dua elektron dari sistem π cincin, yang disertai dengan transisi atom karbon ini dari sp 2 - V sp 3 -

Stabilisasi kompleks σ. Hal ini dilakukan dengan abstraksi proton dari kompleks σ menggunakan basa. Dalam hal ini, karena dua elektron dari pemutusan ikatan kovalen C–H, sistem π tertutup dari cincin dipulihkan, yaitu. molekul kembali ke keadaan aromatik:

Pengaruh substituen terhadap reaktivitas dan orientasi substitusi elektrofilik
Substituen pada cincin benzena mengganggu keseragaman distribusi π- awan elektron cincin dan dengan demikian mempengaruhi reaktivitas cincin.
- Substituen penyumbang elektron (D) meningkatkan kerapatan elektron cincin dan meningkatkan laju substitusi elektrofilik; substituen tersebut disebut mengaktifkan.
- Substituen penarik elektron (A) mengurangi kerapatan elektron cincin dan mengurangi laju reaksi, disebut dekontaminasi.
Hidrokarbon aromatik– senyawa karbon dan hidrogen, molekulnya mengandung cincin benzena. Perwakilan hidrokarbon aromatik yang paling penting adalah benzena dan homolognya - produk penggantian satu atau lebih atom hidrogen dalam molekul benzena dengan residu hidrokarbon.
Struktur molekul benzena
Senyawa aromatik pertama, benzena, ditemukan pada tahun 1825 oleh M. Faraday. Rumus molekulnya ditetapkan - C 6 H 6. Jika kita membandingkan komposisinya dengan komposisi hidrokarbon jenuh yang mengandung jumlah atom karbon yang sama - heksana (C 6 H 14), maka kita dapat melihat bahwa benzena mengandung delapan atom hidrogen lebih sedikit. . Seperti diketahui, munculnya ikatan ganda dan siklus menyebabkan penurunan jumlah atom hidrogen dalam molekul hidrokarbon. Pada tahun 1865, F. Kekule mengusulkan rumus strukturnya sebagai siklohexanthriene - 1, 3, 5.

Jadi, molekulnya bersesuaian rumus Kekule, mengandung ikatan rangkap, oleh karena itu benzena harus tidak jenuh, yaitu harus mudah mengalami reaksi adisi: hidrogenasi, brominasi, hidrasi, dll.
Namun, data dari berbagai percobaan menunjukkan bahwa benzena masuk ke dalam reaksi adisi hanya dalam kondisi yang keras (pada suhu dan pencahayaan tinggi) dan tahan terhadap oksidasi. Reaksi yang paling khas adalah reaksi substitusi; oleh karena itu, benzena lebih dekat sifatnya dengan hidrokarbon marginal.
Mencoba menjelaskan perbedaan ini, banyak ilmuwan telah mengusulkan berbagai pilihan untuk struktur benzena. Struktur molekul benzena akhirnya dikonfirmasi oleh reaksi pembentukannya dari asetilena. Pada kenyataannya, ikatan karbon-karbon dalam benzena adalah setara, dan sifat-sifatnya tidak sama dengan ikatan tunggal atau rangkap.
Saat ini, benzena dilambangkan dengan rumus Kekule atau dengan segi enam yang menggambarkan lingkaran.
![]()
Lalu apa yang istimewa dari struktur benzena? Berdasarkan data dan perhitungan peneliti, disimpulkan bahwa keenam atom karbon berada dalam keadaan sp 2 -hibridisasi dan terletak pada bidang yang sama. Tidak terhibridisasi P-orbital atom karbon yang membentuk ikatan rangkap (rumus Kekule) tegak lurus bidang cincin dan sejajar satu sama lain.
Mereka saling tumpang tindih, membentuk sistem π tunggal. Jadi, sistem ikatan rangkap bolak-balik yang digambarkan dalam rumus Kekulé adalah sistem siklik ikatan terkonjugasi dan tumpang tindih. Sistem ini terdiri dari dua daerah kerapatan elektron toroidal (seperti donat) yang terletak di kedua sisi cincin benzena. Oleh karena itu, lebih logis untuk menggambarkan benzena sebagai segi enam beraturan dengan lingkaran di tengahnya (sistem π) daripada sebagai sikloheksatriena-1,3,5. 
Ilmuwan Amerika L. Pauling mengusulkan untuk merepresentasikan benzena dalam bentuk dua struktur batas yang berbeda dalam distribusi kerapatan elektron dan terus-menerus berubah satu sama lain, yaitu menganggapnya sebagai senyawa perantara, “rata-rata” dari dua struktur.
Pengukuran panjang obligasi mengkonfirmasi asumsi ini. Ditemukan bahwa semua ikatan C-C pada benzena memiliki panjang yang sama (0,139 nm). Mereka sedikit lebih pendek dari ikatan C-C tunggal (0,154 nm) dan lebih panjang dari ikatan rangkap (0,132 nm).
Ada juga senyawa yang molekulnya mengandung beberapa struktur siklik.

Isomerisme dan tata nama
Homolog benzena dicirikan oleh isomerisme posisi beberapa substituen. Homolog benzena yang paling sederhana - toluena (metilbenzena) - tidak memiliki isomer seperti itu; homolog berikut disajikan sebagai empat isomer:

Dasar dari nama hidrokarbon aromatik dengan substituen kecil adalah kata benzena. Atom-atom pada cincin aromatik diberi nomor dari substituen tertinggi hingga terendah:

Menurut nomenklatur lama, disebut posisi 2 dan 6 ortoposisi, 4 - pasangan-, dan 3 dan 5 - ketentuan meta.
Sifat fisik
Dalam kondisi normal, benzena dan homolognya yang paling sederhana adalah cairan yang sangat beracun dengan bau yang tidak sedap. Mereka sulit larut dalam air, tetapi baik dalam pelarut organik.
Sifat kimia benzena
Reaksi substitusi. Hidrokarbon aromatik mengalami reaksi substitusi.
1. Brominasi. Ketika bereaksi dengan brom dengan adanya katalis, besi bromida (ΙΙΙ), salah satu atom hidrogen pada cincin benzena dapat digantikan oleh atom brom:

2. Nitrasi benzena dan homolognya. Ketika hidrokarbon aromatik berinteraksi dengan asam nitrat dengan adanya asam sulfat (campuran asam sulfat dan asam nitrat disebut campuran nitrasi), atom hidrogen digantikan oleh gugus nitro -NO2:

Dengan mereduksi nitrobenzena yang terbentuk dalam reaksi ini, diperoleh anilin, suatu zat yang digunakan untuk memperoleh pewarna anilin:

Nama reaksi ini diambil dari nama kimiawan Rusia Zinin.
Reaksi penambahan. Senyawa aromatik juga dapat mengalami reaksi adisi pada cincin benzena. Dalam hal ini, sikloheksana atau turunannya terbentuk.
1. Hidrogenasi. Hidrogenasi katalitik benzena terjadi pada suhu yang lebih tinggi dibandingkan hidrogenasi alkena:
![]()
2. Klorinasi. Reaksi terjadi bila disinari dengan sinar ultraviolet dan bersifat radikal bebas:

Homolog Benzena
Komposisi molekulnya sesuai dengan rumus C n H 2 n-6. Homolog terdekat dari benzena adalah:
Semua homolog benzena setelah toluena memiliki isomer. Isomerisme dapat dikaitkan dengan jumlah dan struktur substituen (1, 2), dan dengan posisi substituen pada cincin benzena (2, 3, 4). Senyawa rumus umum C 8 H 10 :

Menurut tata nama lama yang digunakan untuk menunjukkan lokasi relatif dua substituen identik atau berbeda pada cincin benzena, digunakan awalan orto- (disingkat o-) - substituen terletak di atom karbon tetangga, meta-(M-) – melalui satu atom karbon dan pasangan— (N-) – substituen terhadap satu sama lain.
Anggota pertama dari deret homolog benzena adalah cairan dengan bau tertentu. Mereka lebih ringan dari air. Mereka adalah pelarut yang baik.
Homolog benzena bereaksi substitusi ( brominasi, nitrasi). Toluena dioksidasi oleh permanganat ketika dipanaskan:

Homolog benzena digunakan sebagai pelarut untuk menghasilkan pewarna, produk perlindungan tanaman, plastik, dan obat-obatan.



















Senyawa kimia aromatik, atau arena, adalah sekelompok besar senyawa karbosiklik yang molekulnya mengandung cincin stabil yang terdiri dari enam atom karbon. Ini disebut “cincin benzena” dan bertanggung jawab atas sifat fisik dan kimia khusus arena.
Hidrokarbon aromatik terutama mencakup benzena dan semua homolog serta turunannya.
Molekul arena mungkin mengandung beberapa cincin benzena. Senyawa seperti ini disebut senyawa aromatik polinuklir. Misalnya, naftalena adalah obat yang terkenal untuk melindungi produk wol dari ngengat.
benzena
Perwakilan arena yang paling sederhana ini hanya terdiri dari cincin benzena. Rumus molekulnya adalah C 6 Η 6. Rumus struktur molekul benzena paling sering diwakili oleh bentuk siklik yang dikemukakan oleh A. Kekule pada tahun 1865.
Keuntungan rumus ini adalah secara akurat mencerminkan komposisi dan kesetaraan semua atom C dan H dalam cincin. Namun, hal ini tidak dapat menjelaskan banyak sifat kimia arena, sehingga pernyataan tentang adanya tiga ikatan rangkap C=C terkonjugasi adalah keliru. Hal ini baru diketahui dengan munculnya teori koneksi modern.
Sementara itu, rumus benzena saat ini sering ditulis seperti yang dikemukakan oleh Kekule. Pertama, dengan bantuannya akan lebih mudah untuk menulis persamaan reaksi kimia. Kedua, ahli kimia modern melihatnya hanya sebagai simbol, dan bukan struktur nyata. Struktur molekul benzena saat ini disampaikan melalui berbagai jenis rumus struktur.
Struktur cincin benzena
Ciri utama cincin benzena adalah tidak adanya ikatan tunggal dan rangkap dalam pengertian tradisional. Sesuai dengan konsep modern, molekul benzena berbentuk segi enam datar dengan panjang sisi 0,140 nm. Ternyata panjang ikatan C-C pada benzena merupakan nilai antara antara tunggal (panjangnya 0,154 nm) dan ganda (0,134 nm). Ikatan C-H juga terletak pada bidang yang sama, membentuk sudut 120° dengan tepi segi enam.
Setiap atom C dalam struktur benzena berada dalam keadaan hibrid sp2. Ia terhubung melalui tiga orbital hibridnya dengan dua atom C yang terletak berdekatan dan satu atom H. Artinya, ia membentuk tiga ikatan s. Orbital 2p lainnya, namun sudah tidak terhibridisasi, tumpang tindih dengan orbital yang sama dari atom C tetangganya (ke kanan dan kiri). Sumbunya tegak lurus terhadap bidang cincin, yang berarti orbitalnya tumpang tindih di atas dan di bawahnya. Dalam hal ini, sistem elektron π tertutup yang umum terbentuk. Karena tumpang tindih yang sama antara orbital 2p dari enam atom C, terjadi semacam “penyetaraan” ikatan C-C dan C=C.
Hasil dari proses ini adalah kemiripan ikatan “satu setengah” tersebut dengan ikatan rangkap dan tunggal. Hal ini menjelaskan fakta bahwa arena menunjukkan sifat kimia yang merupakan karakteristik alkana dan alkena.
Energi ikatan karbon-karbon pada cincin benzena adalah 490 kJ/mol. Yang juga merupakan rata-rata antara energi ikatan rangkap tunggal dan ganda.

Nomenklatur arena
Dasar pemberian nama hidrokarbon aromatik adalah benzena. Atom-atom dalam cincin diberi nomor mulai dari substituen tertinggi. Jika substituennya ekuivalen, maka penomoran dilakukan sepanjang jalur terpendek.
Untuk banyak homolog benzena, nama sepele sering digunakan: stirena, toluena, xilena, dll. Untuk mencerminkan posisi relatif substituen, biasanya menggunakan awalan orto-, meta-, para-.
Jika suatu molekul mengandung gugus fungsi, misalnya karbonil atau karboksil, maka molekul arena dianggap sebagai radikal aromatik yang terikat padanya. Misalnya, -C 6 H 5 - fenil, -C 6 H 4 - fenilena, C 6 H 5 -CH 2 - benzil.
Sifat fisik
Perwakilan pertama dalam deret homolog benzena adalah cairan tidak berwarna dengan bau tertentu. Bobotnya lebih ringan daripada air, sehingga praktis tidak larut, namun larut dengan baik di sebagian besar pelarut organik.
Semua hidrokarbon aromatik terbakar dengan nyala berasap, yang dijelaskan oleh tingginya kandungan C dalam molekulnya. Titik leleh dan titik didihnya meningkat seiring dengan meningkatnya berat molekul dalam deret homolog benzena.
Sifat kimia benzena
Dari berbagai sifat kimia arena, reaksi substitusi harus disebutkan secara terpisah. Yang juga sangat penting adalah beberapa reaksi adisi yang terjadi pada kondisi khusus dan proses oksidasi.
Reaksi substitusi
Elektron π yang cukup mobile pada cincin benzena mampu bereaksi sangat aktif dengan menyerang elektrofil. Substitusi elektrofilik ini melibatkan cincin benzena itu sendiri dalam benzena dan rantai hidrokarbon terkait dalam homolognya. Mekanisme proses ini telah dipelajari secara rinci oleh kimia organik. Sifat kimia arena yang berhubungan dengan serangan elektrofil terjadi melalui tiga tahap.
- Tahap pertama. Munculnya kompleks π disebabkan oleh pengikatan sistem elektron π pada cincin benzena ke partikel X+, yang mengikat enam elektron π.

Brominasi benzena dengan adanya besi atau aluminium bromida tanpa pemanasan menghasilkan produksi bromobenzena:
C 6 Η 6 + Br 2 —> C 6 Η 5 -Br + ΗBr.
Nitrasi dengan campuran asam nitrat dan asam sulfat menghasilkan produksi senyawa dengan gugus nitro di dalam cincin:
C 6 Η 6 + ΗONO 2 -> C 6 Η 5 -NO 2 + Η 2 O.
Sulfonasi dilakukan oleh ion bisulfonium yang terbentuk sebagai hasil reaksi:
3Η 2 JADI 4 ⇄ JADI 3 Η + + Η 3 O + + 2ΗJADI 4 - ,
atau belerang trioksida.
Reaksi yang sesuai dengan sifat kimia arena ini adalah:
C 6 H 6 + JADI 3 H + —> C 6 H 5 — JADI 3 H + H + .
Reaksi substitusi alkil dan asil, atau reaksi Friedel-Crafts, dilakukan dengan adanya AlCl 3 anhidrat.

Reaksi-reaksi ini tidak mungkin terjadi pada benzena dan berlangsung dengan susah payah. Penambahan hidrogen halida dan air pada benzena tidak terjadi. Namun, pada suhu yang sangat tinggi dengan adanya platina, reaksi hidrogenasi dapat terjadi:
C 6 Η 6 + 3H 2 -> C 6 H 12.
Ketika disinari dengan sinar ultraviolet, molekul klorin dapat bergabung dengan molekul benzena:
C 6 Η 6 + 3Cl 2 —> C 6 Η 6 Cl 6 .
Reaksi oksidasi
Benzena sangat tahan terhadap zat pengoksidasi. Dengan demikian, tidak mengubah warna larutan kalium permanganat menjadi merah muda. Namun, dengan adanya vanadium oksida, ia dapat dioksidasi oleh oksigen atmosfer menjadi asam maleat:
C 6 H 6 + 4O -> COOΗ-CΗ = CΗ-COOΗ.
Di udara, benzena terbakar dengan munculnya jelaga:
2C 6 Η 6 + 3O2 → 12C + 6 Η 2 O.
Sifat kimia arena
- Substitusi.


Aturan orientasi
Posisi mana (o-, m- atau p-) yang akan ditempati substituen selama interaksi zat elektrofilik dengan cincin benzena ditentukan oleh aturan:
- jika sudah terdapat substituen pada cincin benzena, maka substituen inilah yang mengarahkan gugus masuk ke posisi tertentu;
- semua substituen yang berorientasi dibagi menjadi dua kelompok: orientan jenis pertama mengarahkan kelompok atom yang masuk ke posisi orto dan para (-NH 2, -OH, -CH 3, -C 2 H 5, halogen); orientasi jenis kedua mengarahkan substituen yang masuk ke posisi meta (-NO 2, -SO 3 H, -COHO, -COOH).
Orientasinya tercantum di sini dalam urutan penurunan gaya arah.
Perlu dicatat bahwa pembagian substituen golongan ini bersifat kondisional, karena fakta bahwa dalam sebagian besar reaksi, pembentukan ketiga isomer diamati. Orientasi hanya mempengaruhi isomer mana yang akan diperoleh dalam jumlah lebih banyak.
Mendapatkan arena
Sumber utama arena adalah penyulingan kering batubara dan penyulingan minyak. Tar batubara mengandung berbagai macam hidrokarbon aromatik dalam jumlah besar. Beberapa jenis minyak mengandung hingga 60% arena, yang dapat dengan mudah diisolasi dengan distilasi sederhana, pirolisis, atau perengkahan.
Metode pembuatan sintetik dan sifat kimia arena seringkali saling berhubungan. Benzena, seperti homolognya, diperoleh dengan salah satu cara berikut.
1. Reformasi produk minyak bumi. Dehidrogenasi alkana adalah metode industri terpenting untuk sintesis benzena dan banyak homolognya. Reaksi dilakukan dengan melewatkan gas di atas katalis yang dipanaskan (Pt, Cr 2 O 3, Mo dan V oksida) pada t = 350-450 o C:
C 6 H 14 —> C 6 Η 6 + 4 Η 2.
2. Reaksi Wurtz-Fittig. Hal ini dilakukan melalui tahap perolehan senyawa organologam. Dari hasil reaksi tersebut dapat diperoleh beberapa produk.
3. Trimerisasi asetilena. Asetilena sendiri, seperti homolognya, mampu membentuk arena ketika dipanaskan dengan katalis:
3C 2 Η 2 -> C 6 Η 6.
4. Reaksi Friedel-Crafts. Metode memperoleh dan mengubah homolog benzena telah dibahas di atas dalam sifat kimia arena.
5. Persiapan dari garam yang sesuai. Benzena dapat diisolasi dengan menyuling garam asam benzoat dengan alkali:
C 6 Η 5 —COONa + NaOΗ —> C 6 Η 6 + Na 2 CO 3 .
6. Pengurangan keton:
C 6 Η 5 -CO-CΗ 3 + Zn + 2ΗCl —> C 6 Η 5 -CΗ 2 -CΗ 3 + Η 2 O + ZnCl 2 ;
CΗ 3 -C 6 Η 5 -CO-CΗ 3 + NΗ 2 -NΗ 2 —> CΗ 3 -C 6 Η 5 -CΗ 2 -CΗ 3 + Η 2 O.
Penerapan arena
Sifat kimia dan bidang penerapan arena berhubungan langsung, karena sebagian besar senyawa aromatik digunakan untuk sintesis lebih lanjut dalam produksi kimia, dan tidak digunakan dalam bentuk jadi. Pengecualian adalah zat yang digunakan sebagai pelarut.
Benzena C 6 × 6 digunakan terutama dalam sintesis etilbenzena, kumena, dan sikloheksana. Atas dasar itu, produk antara diperoleh untuk produksi berbagai polimer: karet, plastik, serat, pewarna, surfaktan, insektisida, dan obat-obatan.

Toluene C 6 H 5 -CH 3 digunakan dalam produksi pewarna, obat-obatan dan bahan peledak.
Xilena C 6 Η 4 (C 3) 2 dalam bentuk campuran (xilena teknis) digunakan sebagai pelarut atau bahan awal untuk sintesis zat organik.
Isopropilbenzena (atau kumena) C 6 H 4 -CH H (CH 3) 2 adalah reagen awal untuk sintesis fenol dan aseton.
Vinylbenzene (styrene) C 6 Η 5 -CΗ=CΗ 2 adalah bahan mentah untuk produksi bahan polimer terpenting - polistiren.
DEFINISI
Hidrokarbon aromatik (arena)– zat yang molekulnya mengandung satu atau lebih cincin benzena. Rumus umum deret homolog benzena C n H 2 n -6
Perwakilan hidrokarbon aromatik yang paling sederhana adalah benzena - C 6 H 6 dan toluena - C 6 H 5 -CH 3. Radikal hidrokarbon yang diperoleh dari arena disebut: C 6 H 5 - - fenil (Ph-) dan C 6 H 5 -CH 2 - - benzil.
Keenam atom karbon dalam molekul benzena berada dalam keadaan hibrid sp2. Setiap atom karbon membentuk ikatan 3σ dengan dua atom karbon lainnya dan satu atom hidrogen, terletak pada bidang yang sama. Enam atom karbon membentuk segi enam beraturan (σ-kerangka molekul benzena).
Setiap atom karbon memiliki satu orbital p tak terhibridisasi yang mengandung satu elektron. Enam elektron p membentuk awan elektron π tunggal (sistem aromatik), yang digambarkan sebagai lingkaran di dalam cincin beranggota enam.
Sifat kimia arena
Benzena dan homolognya dicirikan oleh reaksi substitusi yang berlangsung melalui mekanisme elektrofilik:
- halogenasi (benzena bereaksi dengan klor dan brom dengan adanya katalis - AlCl 3 anhidrat, FeCl 3, AlBr 3)
C 6 H 6 + Cl 2 = C 6 H 5 -Cl + HCl
- nitrasi (benzena mudah bereaksi dengan campuran nitrasi - campuran asam nitrat dan asam sulfat pekat)

- alkilasi dengan alkena
C 6 H 6 + CH 2 = CH-CH 3 → C 6 H 5 -CH(CH 3) 2
Reaksi adisi pada benzena menyebabkan rusaknya sistem aromatik dan hanya terjadi dalam kondisi yang sulit:
— hidrogenasi (reaksi terjadi ketika dipanaskan, katalisnya adalah Pt)

- penambahan klorin (terjadi di bawah pengaruh radiasi UV dengan pembentukan produk padat - hexachlorocyclohexane (hexachlorane) - C 6 H 6 Cl 6)

Sifat fisik arena
Anggota pertama dari deret homolog benzena adalah cairan tidak berwarna dengan bau tertentu. Mereka lebih ringan dari air dan praktis tidak larut di dalamnya. Mereka larut dengan baik dalam pelarut organik dan merupakan pelarut yang baik.
Mendapatkan arena
Metode utama untuk memperoleh benzena dan homolognya:
— dehidrosiklisasi alkana (katalis – Pt, Cr 3 O 2)

— dehidrogenasi sikloalkana (reaksi terjadi ketika dipanaskan, katalisnya adalah Pt)

— trimerisasi asetilena (reaksi terjadi ketika dipanaskan hingga 600C, katalisnya adalah karbon aktif)
3HC≡CH → C6H6
- alkilasi benzena (reaksi Friedel-Crafts) (katalis - aluminium klorida atau asam fosfat)

Contoh pemecahan masalah
CONTOH 1
| Latihan | Massa jenis uap zat tersebut adalah 3,482 g/l. Pirolisisnya menghasilkan 6g jelaga dan 5,6l hidrogen. Tentukan rumus zat tersebut. |
| Larutan | Mari kita cari jumlah zat jelaga (karbon): v(C) = m(C)/M(C) v(C) = 6/12 = 0,5 mol Mari kita cari jumlah zat hidrogen: v(H 2) = V(H 2)/Vm v(H 2) = 5,6/22,4 = 0,25 mol Oleh karena itu, jumlah zat dalam satu atom hidrogen akan sama dengan: v(H) = 2×0,25 = 0,5 mol Mari kita nyatakan jumlah atom karbon dalam molekul hidrokarbon sebagai x, dan jumlah atom hidrogen sebagai y, maka perbandingan atom-atom tersebut dalam molekul adalah: x:y = 0,5: 0,5 = 1:1 Rumus paling sederhana dari hidrokarbon CH Berat molekul hidrokarbon adalah: M(C x H y) = ρ×V m = 3,482×22,4 = 78 g/mol Berat molekul suatu molekul dengan komposisi CH sama dengan: M(CH) = 13 g/mol n = M(C x H y)/ M(CH) = 78/13 = 6, oleh karena itu koefisien x dan y perlu dikalikan 6, maka hidrokarbon yang diinginkan memiliki komposisi C 6 H 6 - ini adalah benzena |
Pertimbangan umum.
Hidrokarbon aromatik (arena) adalah zat yang molekulnya mengandung satu atau lebih cincin benzena - gugus siklik atom karbon dengan sifat ikatan khusus.
Konsep “cincin benzena” perlu segera diuraikan. Untuk melakukan ini, setidaknya perlu mempertimbangkan secara singkat struktur molekul benzena. Struktur benzena pertama diusulkan pada tahun 1865 oleh ilmuwan Jerman A. Kekule:
Rumus ini dengan tepat mencerminkan kesetaraan enam atom karbon, tetapi tidak menjelaskan sejumlah sifat khusus benzena. Misalnya, meskipun tidak jenuh, benzena tidak menunjukkan kecenderungan reaksi adisi: benzena tidak mengubah warna air brom dan larutan kalium permanganat, yaitu. tidak memberikan reaksi kualitatif yang khas untuk senyawa tak jenuh.
Ciri-ciri struktur dan sifat-sifat benzena baru dapat dijelaskan sepenuhnya setelah berkembangnya teori mekanika kuantum modern tentang ikatan kimia. Menurut konsep modern, keenam atom karbon dalam molekul benzena berada dalam keadaan -hibrid. Setiap atom karbon membentuk -ikatan dengan dua atom karbon lain dan satu atom hidrogen, terletak pada bidang yang sama. Sudut ikatan antara ketiga ikatan tersebut adalah 120°. Jadi, keenam atom karbon terletak pada bidang yang sama, membentuk segi enam beraturan (kerangka molekul benzena).
Setiap atom karbon memiliki satu orbital p yang tidak terhibridisasi.
Enam orbital tersebut terletak tegak lurus terhadap kerangka datar dan sejajar satu sama lain (Gbr. 21.1, a). Keenam elektron p berinteraksi satu sama lain, membentuk ikatan - yang tidak terlokalisasi berpasangan, seperti dalam pembentukan ikatan rangkap biasa, tetapi digabungkan menjadi awan elektron tunggal. Jadi, konjugasi melingkar terjadi pada molekul benzena (lihat § 19). Kerapatan -elektron tertinggi dalam sistem terkonjugasi ini terletak di atas dan di bawah bidang -kerangka (Gbr. 21.1, b).

Beras. 21.1. Struktur molekul benzena
Hasilnya, seluruh ikatan antar atom karbon pada benzena sejajar dan memiliki panjang 0,139 nm. Nilai ini merupakan perantara antara panjang ikatan tunggal pada alkana (0,154 nm) dan panjang ikatan rangkap pada alkena (0,133 nm). Kesetaraan hubungan biasanya digambarkan dengan lingkaran di dalam siklus (Gbr. 21.1, c). Konjugasi melingkar menghasilkan perolehan energi sebesar 150 kJ/mol. Nilai ini merupakan energi konjugasi – jumlah energi yang harus dikeluarkan untuk mengganggu sistem aromatik benzena (bandingkan – energi konjugasi pada butadiena hanya 12 kJ/mol).
Struktur elektronik ini menjelaskan semua fitur benzena. Secara khusus, jelas mengapa benzena sulit untuk masuk ke dalam reaksi adisi - hal ini akan menyebabkan pelanggaran konjugasi. Reaksi seperti itu hanya mungkin terjadi dalam kondisi yang sangat keras.
Tata nama dan isomerisme.
Secara konvensional, arena dapat dibagi menjadi dua baris. Yang pertama mencakup turunan benzena (misalnya, toluena atau bifenil), yang kedua mencakup arena terkondensasi (polinuklir) (yang paling sederhana adalah naftalena):

Kami hanya akan mempertimbangkan deret benzena homolog dengan rumus umum.
Isomerisme struktural pada deret homolog benzena disebabkan oleh susunan substituen yang saling menguntungkan dalam inti. Turunan benzena tersubstitusi tunggal tidak memiliki isomer posisi, karena semua atom pada cincin benzena adalah setara. Turunan tersubstitusi ada dalam bentuk tiga isomer, berbeda dalam susunan relatif substituennya. Posisi substituen ditunjukkan dengan angka atau awalan:

Radikal hidrokarbon aromatik disebut radikal aril. Radikalnya disebut fenil.
Sifat fisik.
Anggota pertama dari deret homolog benzena (misalnya, toluena, etilbenzena, dll.) adalah cairan tidak berwarna dengan bau tertentu. Mereka lebih ringan dari air dan tidak larut dalam air. Mereka larut dengan baik dalam pelarut organik. Benzena dan homolognya merupakan pelarut yang baik untuk banyak zat organik. Semua arena terbakar dengan nyala api berasap karena kandungan karbon yang tinggi dalam molekulnya.
Metode memperoleh.
1. Pembuatan dari hidrokarbon alifatik. Ketika alkana rantai lurus dengan setidaknya 6 atom karbon per molekul dilewatkan di atas platina atau kromium oksida yang dipanaskan, terjadi dehidrosiklisasi - pembentukan arena dengan pelepasan hidrogen:
2. Dehidrogenasi sikloalkana. Reaksi terjadi dengan melewatkan uap sikloheksana dan homolognya di atas platina yang dipanaskan:

3. Pembuatan benzena dengan trimerisasi asetilena - lihat § 20.
4. Memperoleh homolog benzena menggunakan reaksi Friedel-Crafts - lihat di bawah.
5. Penggabungan garam asam aromatik dengan alkali:
Sifat kimia.
Pertimbangan umum. Memiliki enam elektron yang bergerak, inti aromatik adalah objek yang mudah diserang oleh reagen elektrofilik. Hal ini juga difasilitasi oleh susunan spasial awan elektron di kedua sisi kerangka datar molekul (Gbr. 21.1, b)
Reaksi yang paling khas untuk arena adalah reaksi yang berlangsung melalui mekanisme substitusi elektrofilik, yang ditandai dengan simbol (dari bahasa Inggris substitusi elektrofilik).
Mekanisme substitusi elektrofilik dapat direpresentasikan sebagai berikut. Reagen elektrofilik XY (X adalah elektrofil) menyerang awan elektron, dan karena interaksi elektrostatik yang lemah, terbentuk kompleks yang tidak stabil. Sistem aromatiknya belum terganggu. Tahap ini berlangsung dengan cepat. Pada tahap kedua, tahap yang lebih lambat, ikatan kovalen terbentuk antara elektrofil X dan salah satu atom karbon pada cincin karena dua elektron pada cincin. Atom karbon ini berpindah dari keadaan -hibrida. Dalam hal ini, aroma sistem terganggu. Empat elektron -elektron yang tersisa digunakan bersama oleh lima atom karbon lainnya, dan molekul benzena membentuk karbokation, atau -kompleks.

Pelanggaran aromatisitas secara energetik tidak menguntungkan, oleh karena itu struktur -kompleks kurang stabil dibandingkan struktur aromatik. Untuk mengembalikan aromatisitas, proton dikeluarkan dari atom karbon yang terikat pada elektrofil (tahap ketiga). Dalam hal ini, dua elektron kembali ke sistem -, dan dengan demikian aromatisitas dipulihkan:

Reaksi substitusi elektrofilik banyak digunakan untuk sintesis banyak turunan benzena.
Sifat kimia benzena.
1. Halogenasi. Benzena tidak bereaksi dengan klor atau brom dalam kondisi normal. Reaksi hanya dapat berlangsung dengan adanya katalis anhidrat. Sebagai hasil reaksi, arena tersubstitusi halogen terbentuk:

Peran katalis adalah untuk mempolarisasi molekul halogen netral untuk membentuk partikel elektrofilik darinya:
2. Nitrasi. Benzena bereaksi sangat lambat dengan asam nitrat pekat bahkan ketika dipanaskan. Namun, di bawah pengaruh apa yang disebut campuran nitrasi (campuran asam nitrat dan asam sulfat pekat), reaksi nitrasi terjadi dengan cukup mudah:
3. Sulfonasi. Reaksi mudah terjadi di bawah pengaruh asam sulfat (oleum) yang “berasap”:
4. Alkilasi Friedel-Crafts. Sebagai hasil reaksi, gugus alkil dimasukkan ke dalam cincin benzena untuk menghasilkan homolog benzena. Reaksi terjadi ketika benzena terkena haloalkana dengan adanya katalis - aluminium halida. Peran katalis direduksi menjadi polarisasi molekul dengan pembentukan partikel elektrofilik:
Tergantung pada struktur radikal dalam haloalkana, homolog benzena yang berbeda dapat diperoleh:
5. Alkilasi dengan alkena. Reaksi ini banyak digunakan secara industri untuk menghasilkan etilbenzena dan isopropilbenzena (kumena). Alkilasi dilakukan dengan adanya katalis. Mekanisme reaksinya mirip dengan mekanisme reaksi sebelumnya:
Semua reaksi yang dibahas di atas berlangsung melalui mekanisme substitusi elektrofilik.
Reaksi penambahan arena menyebabkan rusaknya sistem aromatik dan memerlukan energi dalam jumlah besar, sehingga hanya terjadi dalam kondisi yang keras.
6. Hidrogenasi. Reaksi penambahan hidrogen pada arena terjadi pada pemanasan dan tekanan tinggi dengan adanya katalis logam (Ni, Pt, Pd). Benzena diubah menjadi sikloheksana, dan homolog benzena diubah menjadi turunan sikloheksana:

7. Halogenasi radikal. Interaksi uap benzena dengan klorin terjadi melalui mekanisme radikal hanya di bawah pengaruh radiasi ultraviolet yang keras. Dalam hal ini, benzena menambahkan tiga molekul klorin dan membentuk produk padat - hexachlorocyclohexane:

8. Oksidasi oleh oksigen udara. Dalam hal ketahanannya terhadap zat pengoksidasi, benzena menyerupai alkana. Hanya dengan pemanasan kuat (400 °C) uap benzena dengan oksigen atmosfer dengan adanya katalis, campuran asam maleat dan anhidridanya diperoleh:

Sifat kimia homolog benzena.
Homolog benzena memiliki sejumlah sifat kimia khusus yang terkait dengan pengaruh timbal balik radikal alkil pada cincin benzena, dan sebaliknya.
Reaksi berantai samping. Sifat kimia radikal alkil mirip dengan alkana. Atom hidrogen di dalamnya digantikan oleh halogen melalui mekanisme radikal bebas. Oleh karena itu, dengan tidak adanya katalis, ketika dipanaskan atau disinari UV, reaksi substitusi radikal terjadi pada rantai samping. Pengaruh cincin benzena pada substituen alkil menyebabkan atom hidrogen pada atom karbon yang terikat langsung pada cincin benzena (atom karbon-a) selalu tergantikan.

Substitusi pada cincin benzena hanya dimungkinkan melalui mekanisme dengan adanya katalis:
Di bawah ini Anda akan mengetahui yang mana dari tiga isomer klorotoluena yang terbentuk dalam reaksi ini.
Ketika homolog benzena terkena kalium permanganat dan zat pengoksidasi kuat lainnya, rantai sampingnya teroksidasi. Betapapun rumitnya rantai substituen, ia akan hancur, kecuali atom -karbon, yang dioksidasi menjadi gugus karboksil.
Homolog benzena dengan satu rantai samping menghasilkan asam benzoat:

Aturan orientasi (substitusi) pada cincin benzena.
Faktor terpenting yang menentukan sifat kimia suatu molekul adalah distribusi kerapatan elektron di dalamnya. Sifat distribusinya bergantung pada pengaruh timbal balik atom-atom.
Dalam molekul yang hanya memiliki ikatan -, pengaruh timbal balik atom terjadi melalui efek induktif (lihat § 17). Dalam molekul yang merupakan sistem terkonjugasi, efek mesomerik muncul.
Pengaruh substituen yang ditransmisikan melalui sistem ikatan - terkonjugasi disebut efek mesomerik (M).
Dalam molekul benzena, awan elektron didistribusikan secara merata ke seluruh atom karbon karena konjugasi.
Jika ada substituen yang dimasukkan ke dalam cincin benzena, distribusi seragam ini terganggu dan terjadi redistribusi kerapatan elektron dalam cincin. Tempat masuknya substituen kedua pada cincin benzena ditentukan oleh sifat substituen yang ada.
Substituen dibagi menjadi dua kelompok tergantung pada efek yang ditunjukkannya (mesomerik atau induktif): pendukung elektron dan penarik elektron.
Substituen penyumbang elektron mempunyai efek dan meningkatkan kerapatan elektron dalam sistem terkonjugasi. Ini termasuk gugus hidroksil -OH dan gugus amino. Pasangan elektron bebas dalam gugus ini masuk ke dalam konjugasi umum dengan sistem -elektronik cincin benzena dan meningkatkan panjang sistem terkonjugasi. Akibatnya, kerapatan elektron terkonsentrasi pada posisi orto dan para:

Gugus alkil tidak dapat berpartisipasi dalam konjugasi umum, tetapi mereka menunjukkan efek dimana terjadi redistribusi kerapatan elektron yang serupa.
Substituen penarik elektron menunjukkan efek -M dan mengurangi kerapatan elektron dalam sistem terkonjugasi. Ini termasuk gugus nitro, gugus sulfo, gugus aldehida -CHO dan karboksil -COOH. Substituen ini membentuk sistem terkonjugasi yang sama dengan cincin benzena, namun keseluruhan awan elektron bergeser ke arah gugus ini. Dengan demikian, kerapatan elektron total dalam cincin berkurang, dan paling sedikit berkurang pada posisi meta:
Misalnya, toluena yang mengandung substituen jenis pertama dinitrasi dan brominasi pada posisi para dan orto:

Nitrobenzena yang mengandung substituen tipe kedua dinitrasi dan brominasi pada posisi meta:

Selain efek orientasi, substituen juga mempengaruhi reaktivitas cincin benzena: orientasi jenis pertama (kecuali halogen) memfasilitasi masuknya substituen kedua; Orientasi jenis ke-2 (dan halogen) mempersulitnya.