Без регуляторных механизмов , действующих на многих этапах, система комплемента оказалась бы неэффективной; неограниченное расходование ее компонентов могло бы привести к тяжелым, потенциально смертельным повреждениям клеток и тканей организма. На первом этапе ингибитор С1 блокирует ферментативную активность Clr и Cls и, следовательно, расщепление С4 и С2. Активированный С2 сохраняется лишь короткое время, и его относительная нестабильность ограничивает время существования С42 и С423. Активирующий СЗ фермент альтернативного пути, С3bВb, также обладает коротким временем полувыведения, хотя связывание пропердина ферментным комплексом продлевает время существования комплекса.
В сыворотке присутствует инактиватор анафилатоксинов - фермент, отщепляющий N-концевой аргинин от С4а, С3а и С5а и тем самым резко снижающий их биологическую активность. Фактор I инактивирует C4b и С3b, фактор Н ускоряет инактивацию С3b фактором I, а аналогичный фактор, С4-связывающий белок (С4-сб), ускоряет расщепление С4b фактором I. Три конституциональных белка клеточных мембран - РК1, мембранный кофакторный белок и фактор, ускоряющий распад (ФУР) - разрушают С3- и С5-конвертазные комплексы, формирующиеся на этих мембранах.
Другие компоненты клеточных мембран - ассоциированные белки (среди которых наиболее изучен CD59) - могут связывать С8 или С8 и С9, что препятствует встраиванию мембраноатакующего комплекса (С5b6789). Некоторые белки сыворотки крови (среди которых наиболее изучены протеин S и кластерин) блокируют присоединение к клеточной мембране комплекса С5b67, связывание им С8 или С9 (т. е. образование полноценного мембраноатакующего комплекса) или как-то иначе препятствуют образованию и встраиванию этого комплекса.
Защитная роль комплемента
Нейтрализация вирусов антителами усиливается С1 и С4 и еще больше возрастает при фиксации С3b, образующегося по ходу классического или альтернативного пути. Таким образом, комплемент приобретает особую важность на ранних стадиях вирусной инфекции, когда количество антител еще невелико. Антитела и комплемент ограничивают инфектив-ность по крайней мере некоторых вирусов и за счет образования типичных комплементных «дыр», видимых при электронной микроскопии. Взаимодействие Clq с его рецептором опсонизирует мишень, т. е. облегчает ее фагоцитоз.
С4а, С3а и С5а фиксируются тучными клетками, которые начинают секретировать гистамин и другие медиаторы, приводя к расширению сосудов и характерным для воспаления отеку и гиперемии. Под влиянием С5а моноциты выделяют ФНО и ИЛ-1, усиливающие воспалительную реакцию. С5а - основной хемотактический фактор для нейтрофилов, моноцитов и эозинофилов, способных фагоцитировать микроорганизмы, опсонизированные С3b или продуктом его расщепления iC3b. Дальнейшая инактивация связанного с клеткой С3b, приводящая к появлению C3d, лишает его опсонизирующей активности, но способность его связывания с В-лимфоцитами сохраняется. Фиксация С3b на клетке-мишени облегчает ее лизис NK-клетками или макрофагами.
Связывание С3b с нерастворимыми иммунными комплексами солюбилизирует их, так как С3b, по-видимому, разрушает решетчатую структуру комплекса антиген-антитело. Одновременно появляется возможность взаимодействия этого комплекса с рецептором С3b (РК1) на эритроцитах, которые переносят комплекс в печень или селезенку, где он поглощается макрофагами. Этот феномен частично объясняет развитие сывороточной болезни (болезни иммунных комплексов) у лиц с недостаточностью С1, С4, С2 или С3.
СЛАЙД 1
Лекция №4. Гуморальные факторы врожденного иммунитета
1. Система комплемента
2. Белки острой фазы воспаления
3. Биогенные амимны
4. Липидные медиаторы
5. Цитокины
6. Интерфероны
СЛАЙД 2
Гуморальная составляющая врожденного иммунитета представлена несколькими взаимосвязанными системами - системой комплемента, цитокиновой сетью, бактерицидными пептидами, а также гуморальными системами, связанными с воспалением.
Действие большинства этих систем подчиняется одному из двух принципов - каскада и сети. По каскадному принципу функционирует система комплемента, при активации которой происходит последовательное вовлечение факторов. При этом эффекты каскадных реакций проявляются не только в конце активационного пути, но и на промежуточных стадиях.
Принцип сети характерен для системы цитокинов и предполагает возможность одновременного функционирования различных компонентов системы. Основа функционирования такой системы - тесная взаимосвязь, взаимное влияние и значительная степень взаимозаменяемости компонентов сети.
СЛАЙД 3
Комплемент – сложный белковый комплекс сыворотки крови.
Система комплемента состоит из 30 белков (компонентов, или фракций , системы комплемента).
Активируется система комплемента за счет каскадного процесса: продукт предыдущей реакции исполняет роль катализатора последующей реакции. Причем при активации фракции компонента происходит, у первых пяти компонентов, ее расщепление. Продукты этого расщепления и обозначаются как активные фракции системы комплемента .
1. Больший из фрагментов (обозначаемый буквой b), образовавшихся при расщеплении неактивной фракции, остается на поверхности клетки – активация комплемента всегда происходит на поверхности микробной клетки, но не собственных эукариотических клеток. Этот фрагмент приобретает свойства фермента и способность воздействовать на последующий компонент, активируя его
2. Меньший фрагмент (обозначается буквой a) является растворимым и «уходит» в жидкую фазу, т.е. в сыворотку крови.
Фракции системы комплемента обозначаются по-разному.
1. Девять – открытых первыми – белков системы комплемента обозначаются буквой С (от английского слова complement) с соответствующей цифрой.
2. Остальные фракции системы комплемента обозначаются другими латинскими буквами или их сочетаниями.
СЛАЙД 4
Пути активации комплемента
Существуют три пути активации комплемента: классический, лектиновый и альтернативный.
СЛАЙД 5
1. Классический путь активации комплемента является основным. Участие в этом пути активации комплемента – главная функция антител.

Активацию комплемента по классическому пути запускает иммунный комплекс : комплекс антигена с иммуноглобулином (класса G или М). Место антитела может «занять» С-реактивный белок – такой комплекс также активирует комплемент по классическому пути.
Классический путь активации комплемента осуществляется следующим образом.
а. Сначала активируется фракция С1 : она собирается из трех субфракций (C1q, C1r, C1s) и превращается в фермент С1-эстеразу (С1qrs).
б. С1-эстераза расщепляет фракцию С4 .
в. Активная фракция С4b ковалентно связывается с поверхностью микробных клеток - здесь присоединяет к себе фракцию С2 .
г. Фракция С2 в комплексе с фракцией С4b расщепляется С1-эстеразой с образованием активной фракции С2b .
д. Активные фракции С4b и С2b в один комплекс – С4bС2b – обладающий ферментативной активностью. Это так называемая С3-конвертаза классического пути .
е. С3-конвертаза расщепляет фракцию С3 , нарабатываю большие количества активной фракции С3b.
ж. Активная фракция С3b присоединяется к комплексу С4bС2b и превращает его в С5-конвертазу (С4bС2bС3b ).
з. С5-конвертаза расщепляет фракцию С5 .
и. Появившаяся в результате этого активная фракция С5b присоединяет фракцию С6 .
к. Комплекс С5bС6 присоединяет фракцию С7 .
л. Комплекс С5bС6С7 встраивается в фосфолипидный бислой мембраны микробной клетки .
м. К этому комплексу присоединяется белок С8 и белок С9 . Данный полимер формирует в мембране микробной клетки пору диаметром около 10 нм, что приводит к лизису микроба (так как на его поверхности образуется множество таких пор – «деятельность» одной единицы С3-конвертазы приводит к появлению около 1000 пор). Комплекс С5bС6С7С8С9, образующийся в результате активации комплемента, называется мемранатакующим комплексом (МАК).
СЛАЙД 6
2. Лектиновый путь активации комплемента запускается комплексом нормального белка сыворотки крови – маннансвязывающего лектина (МСЛ) – с углеводами поверхностных структур микробных клеток (с остатками маннозы).

СЛАЙД 7
3. Альтернативный путь активации комплемента начинается с ковалентного связывания активной фракции С3b – которая всегда присутствует в сыворотке крови в результате постоянно протекающего здесь спонтанного расщепления фракции С3 – с поверхностными молекулами не всех, но некоторых микроорганизмов.

1. Дальнейшие события развиваются следующим образом.
а. С3b связывает фактор В , образуя комплекс С3bВ.
б. В связанном с С3b виде фактор В выступает в качестве субстрата для фактора D (сывороточной сериновой протеазы), которая расщепляет его с образованием активного комплекса С3bВb . Этот комплекс обладает ферментативной активностью, структурно и функционально гомологичен С3-конвертазе классического пути (С4bС2b) и называется С3-конвертазой альтернативного пути .
в. Сама по себе С3-конвертаза альтернативного пути нестабильна. Чтобы альтернативный путь активации комплемента успешно продолжался этот фермент стабилизируется фактором Р (пропердином).
2. Основное функциональное отличие альтернативного пути активации комплемента, по сравнению с классическим, заключается в быстроте ответа на патоген: так как не требуется время для накопления специфических антител и образования иммунных комплексов.
Важно понимать, что и классический и альтернативный пути активации комплемента действуют параллельно , еще и амплифицируя (т.е. усиливая) друг друга. Другими словами комплемент активируется не «или по классическому или по альтернативному», а «и по классическому и по альтернативному» путям активации. Это, еще и с добавлением лектинового пути активации, – единый процесс, разные составляющие которого могут просто проявляться в разной степени.
СЛАЙД 8
Функции системы комплемента
Система комплемента играет очень важную роль в защите макроорганизма от патогенов.
1. Система комплемента участвует в инактивации микроорганизмов , в т.ч. опосредует действие на микробы антител.
2. Активные фракции системы комплемента активируют фагоцитоз (опсонины - С3b и C5b) .
3. Активные фракции системы комплемента принимают участие в формировании воспалительной реакции .
СЛАЙД 9
Активные фракции комплемента С3а и С5а называются анафилотоксинами , так как участвуют, помимо прочего, в аллергической реакции, называемой анафилаксия. Наиболее сильным анафилотоксином является С5а. Анафилотоксины действуют на разные клетки и ткани макроорганизма.
1. Действие их на тучные клетки вызывает дегрануляцию последних.
2. Анафилотоксины действуют также на гладкие мышцы , вызывая их сокращение.
3. Действуют они и на стенку сосуда : вызывают активацию эндотелия и повышение его проницаемости, что создает условия для экстравазации (выхода) из сосудистого русла жидкости и клеток крови в ходе развития воспалительной реакции.
Корме того, анафилотоксины являются иммуномодуляторами , т.е. они выступают в роли регуляторов иммунного ответа.
1. С3а выступает в роли иммуносупрессора (т.е. подавляет иммунный ответ).
2. С5а является иммуностимулятором (т.е. усиливает иммунный ответ).
СЛАЙД 10
Белки острой фазы
Некоторые гуморальные реакции врожденного иммунитета по своему назначению аналогичны реакциям адаптивного иммунитета и могут рассматриваться как их эволюционные предшественники. Такие реакции врожденного иммунитета имеют преимущество перед адаптивным иммунитетом в быстроте развития, однако недостаток их заключается в отсутствии специфичности в отношении антигенов. Пару сходных по результатам реакций врожденного и адаптивного иммунитета мы рассмотрели выше в разделе, посвященном комплементу (альтернативная и классическая активация комплемента). Другой пример будет рассмотрен в данном разделе: белки острой фазы в ускоренном и упрощенном варианте воспроизводят некоторые эффекты антител.
Белки (реактанты) острой фазы представляют группу протеинов, секретируемых гепатоцитами. При воспалении продукция белков острой фазы изменяется. При усилении синтеза белки называют положительными, а при понижении синтеза - отрицательными реактантнами острой фазы воспаления.
Динамика и выраженность изменений сывороточной концентрации различных белков острой фазы при развитии воспаления неодинакова: концентарция С-реактивного белка и сывороточного амилоида Р возрастает очень сильно (в десятки тысяч раз) - быстро и кратковременно (практически нормализуется к концу 1-й недели); уровни гаптоглобина и фибриногена возрастают слабее (в сотни раз) соответственно на 2-й и 3-й неделях воспалительной реакции. В данной презентации будут рассмотрены только положительные реактанты, участвующие в иммунных процессах.

СЛАЙД 11
Согласно выполняемым функциям выделяют несколько групп белков острой фазы.
К транспортным белкам относят преальбумин, альбумин, орозомукоид, липокалины, гаптоглобин, трансферрин, маннозасвязывающий и ретинолсвязывающий белки и т.д. Они играют роль переносчиков метаболитов, ионов металлов, физиологически активных факторов. Роль факторов этой группы существенно возрастает и качественно изменяется при воспалении.
Другую группу образуют протеазы (трипсиноген, эластаза, катепсины, гранзимы, триптазы, химазы, металлопротеиназы), активация которых необходима для формирования многих медиаторов воспаления, а также для осуществления эффекторных функций, в частности киллерной. Активация протеаз (трипсина, химотрипсина, эластазы, металлопротеиназ) уравновешивается накоплением их ингибиторов. α2-Макроглобулин участвует в подавлении активности протеаз разных групп.
Помимо перечисленных, к белкам острой фазы относят факторы коагуляции и фибринолиза, а также белки межклеточного матрикса (например, коллагены, эластины, фибронектин) и даже белки системы комплемента.
СЛАЙД 12
Пентраксины. Наиболее полно проявляют свойства реактантов острой фазы белки семейства пентраксинов: в первые 2-3 сут развития воспаления их концентрация в крови повышается на 4 порядка.
С-реактивный белок и сывороточный амилоид Р образуются и секретируются гепатоцитами. Основной индуктор их синтеза - IL-6. Белок PTX3 вырабатывают миелоидные (макрофаги, дендритные клетки), эпителиальные клетки и фибробласты в ответ на стимуляцию через TLR, а также под действием провоспалительных цитокинов (например, IL-1β, TNFα).
Концентрация пентраксинов в сыворотке резко возрастает при воспалении: С-реактивного белка и сывороточного амилоида Р - с 1 мкг/мл до 1–2 мг/мл (т.е. в 1000 раз), РТХ3 - с 25 до 200–800 нг/мл. Пик концентрации достигается через 6–8 ч после индукции воспаления. Для пентраксинов характерна способность связываться с самыми разнообразными молекулами.
С-реактивный белок был впервые идентифицирован благодаря его способности связывать полисахарид С (Streptococcus рneumoniae ), что и определило его название. Пентраксины взаимодействуют и с множеством других молекул: C1q, бактериальными полисахаридами, фосфорилхолином, гистонами, ДНК, полиэлектролитами, цитокинами, белками межклеточного матрикса, сывороточными липопротеинами, компонентами комплемента, друг с другом, а также с ионами Са 2+ и других металлов.
Для всех рассматриваемых пентраксинов существуют высокоаффинные рецепторы на миелоидных, лимфоидных, эпителиальных и других клетках. Кроме того, эта группа белков острой фазы обладает достаточно высоким сродством к таким рецепторам, как FcγRI и FcγRII. Многочисленность молекул, с которыми взаимодействуют пентраксины, определяет широкое разнообразие их функций.
Распознавание и связывание пентраксинами PAMP дает основание рассматривать их как вариант растворимых патогенраспознающих рецепторов.
К наиболее важным функциям пентраксинов относят их участие в реакциях врожденного иммунитета в качестве факторов, запускающих активацию комплемента через C1q и участвующих в опсонизации микроорганизмов.
Комплементактивирующая и опсонизирующая способность пентраксинов делает их своеобразными «протоантителами», частично выполняющими функции антител на начальном этапе иммунного ответа, когда истинные адаптивные антитела еще не успели выработаться.
Роль пентраксинов во врожденном иммунитете заключается также в активации нейтрофилов и моноцитов/макрофагов, регуляции синтеза цитокинов и проявлении хемотаксической активности по отношению к нейтрофилам. Помимо участия в реакциях врожденного иммунитета пентраксины регулируют функции межклеточного матрикса при воспалении, контроле апоптоза и элиминации апоптотических клеток.
СЛАЙД 13
Биогенные амины
К этой группе медиаторов относят гистамин и серотонин, содержащиеся в гранулах тучных клеток. Освобождаясь при дегрануляции, эти амины вызывают разнообразные эффекты, играющие ключевую роль в развитии ранних проявлений гиперчувствительности немедленного типа.
Гистамин (5-β-имидазолилэтиламин) - главный медиатор аллергии. Он образуется из гистидина под влиянием фермента гистидиндекарбоксилазы.
Поскольку гистамин содержится в гранулах тучных клеток в готовом виде, а процесс дегрануляции происходит быстро, гистамин очень рано появляется в очаге аллергического поражения, причем сразу в большой концентрации, что определяет проявления немедленной гиперчувствительности. Гистамин быстро метаболизируется (95% за 1 мин) с участием 2 ферментов - гистамин-N-метилтрансферазы и диаминооксидазы (гистаминазы); при этом образуется (в соотношении примерно 2:1) соответственно N-метилгистамин и имидазолацетат.
Известно 4 разновидности рецепторов для гистамина Н 1 -Н 4 . При аллергических процессах гистамин действует преимущественно на гладкие мыщцы и эндотелий сосудов, связываясь с их Н 1 -рецепторами. Эти рецепторы поставляют активационный сигнал, опосредованный превращениями фосфоинозитидов с образованием диацилглицерола и мобилизацией Са 2+ .
Указанные эффекты частично обусловлены образованием в клетках (мишенях гистамина) оксида азота и простациклина. Действуя на нервные окончания, гистамин вызывает ощущение зуда, характерного для аллергических проявлений в коже.
У человека гистамин играет важную роль в развитии кожной гиперемии и аллергического ринита. Менее очевидно его участие в развитии общих аллергических реакций и бронхиальной астмы. В то же время через Н 2 -рецепторы гистамин и родственные вещества оказывают регуляторное действие, иногда уменьшающее проявления воспаления, ослабляя хемотаксис нейтрофилов и выброс ими лизосомных ферментов, а также высвобождение самого гистамина.
Через Н 2 -рецепторы гистамин действует на сердце, секреторные клетки желудка, подавляет пролиферацию и цитотоксическую активность лимфоцитов, а также секрецию ими цитокинов. Большинство этих эффектов опосредовано активацией аденилатциклазы и повышением внутриклеточного уровня цАМФ.
Данные об относительной роли различных рецепторов гистамина в реализации его действия очень важны, поскольку многие антиаллергические препараты представляют собой блокаторы Н 1 (но не Н 2 и других) рецепторов гистамина.
СЛАЙД 14
Липидные медиаторы.
Важную роль в регуляции иммунных процессов, а также в развитии аллергических реакций играют гуморальные факторы липидной природы. Наиболее многочислены и важны из них эйкозаноиды.
Эйкозаноиды - продукты метаболизма арахидоновой кислоты - жирной полиненасыщенной кислоты, молекула которой содержит 20 атомов углерода и 4 ненасыщенные связи. Арахидоновая кислота образуется из мембранных фосфолипидов как прямой продукт действия фосфолипазы А (PLA) или косвенный продукт превращений, опосредованных PLC.
Образование арахидоновой кислоты или эйкозаноидов происходит при активации различных типов клеток, особенно участвующих в развитии воспаления, в частности аллергического: эндотелиальных и тучных клеток, базофилов, моноцитов и макрофагов.
Метаболизм арахидоновой кислоты может проходить по 2 путям - катализироваться циклооксигеназой или 5’-липоксигеназой. Циклооксигеназный путь приводит к образованию простагландинов и тромбоксанов из нестабильных промежуточных продуктов - эндоперекисных простагландинов G2 и H2, а липоксигеназный - к образованию лейкотриенов и 5-гидроксиэйкозатетраеноата через промежуточные продукты (5-гидроперокси-6,8,11,14-эйкозатетраеновую кислоту и лейкотриен А4), а также липоксинов - продуктов двойной липоксигенации (под действием двух липоксигеназ - см. далее).
Простагландины и лейкотриены во многих отношениях проявляют альтернативные физиологические эффекты, несмотря на то, что внутри этих групп существуют значительные различия в активности.
Общее свойство этих групп факторов - преобладающее действие на стенку сосудов и гладкие мышцы, а также хемотаксический эффект. Эти эффекты реализуются при взаимодействии эйкозаноидов со специфическими рецепторами на поверхности клеток. Некоторые представители семейства эйкозаноидов усиливают действие других вазоактивных и хемотаксических факторов, например, анафилатоксинов (С3а, С5а).
СЛАЙД 15
Лейкотриены (LT) - С 20 -жирные кислоты, молекула которых в положении 5 содержит ОН-группу, а в положении 6 - боковые серосодержащие цепи, например глутатион.
Выделяют 2 группы лейкотриенов:
Одна из них включает лейкотриены С4, D4 и Е4, называемые цистеиниллей-котриенами (Cys-LT),
Во вторую входит один фактор - лейкотриен B4.
Лейкотриены образуются и секретируются в течение 5–10 мин после активации тучных клеток или базофилов.
Лейкотриен C4 присутствует в жидкой фазе в течение 3–5 мин, при этом он превращается в лейкотриен D4. Лейкотриен D4 существует в последующие 15 мин, медленно превращаясь в лейкотриен E4.
Лейкотриены оказывают свое действие через рецепторы, относящиеся к группе пуриновых рецепторов семейства родопсиноподобных рецепторов, 7-кратно пронизывающих мембрану и связанных с протеином G.
Рецепторы лейкотриенов экспрессируются на клетках селезен-ки, лейкоцитах крови, кроме того, CysLT-R1 представлен на макрофагах, клетках кишечника, воздухоносного эпителия, а CysLT-R2 - на клетках надпочечников и головного мозга.
Цистеиниловые лейкотриены (особенно лейкотриен D4) вызывают спазм гладкой мускулатуры и регулируют локальный кровоток, снижая артериальное давление. Цистеиниловые лейкотриены - медиаторы аллергических реакций, в частности, медленной фазы бронхоспазма при бронхиальной астме.
Кроме того, они подавляют пролиферацию лимфоцитов и способствуют их дифференцировке.
Ранее комплекс этих факторов (лейкотриены C4, D4 и E4) называли медленнореагирующей субстанцией А. Лейкотриен B4 (дигидроксиэйкозатетраеновая кислота) проявляет хемотаксическое и активирующее действие преимущественно в отношении моноцитов, макрофагов, нейтрофилов, эозинофилов и даже Т-клеток.
Еще один продукт липоксигеназного пути - 5-гидроксиэйкозатетраеноат - менее активен, чем лейкотриены, но может служить хемоаттрактантом и активатором нейтрофилов и тучных клеток.
СЛАЙД 16
Простагландины (PG ) - С 20 -жирные кислоты, молекула которых содержит циклопентановое кольцо.
Варианты простагландинов, отличающиеся по типу и положению замещающих групп (окси-, гидрокси-), обозначаются различными буквами; цифры в названии означают число ненасыщенных связей в молекуле.
Простагландины накапливаются в очаге воспаления позже кининов и гистамина, несколько позже лейкотриенов, но одновременно с монокинами (через 6–24 ч после запуска воспаления).
Помимо вазоактивного и хемотаксического эффекта, достигаемого в кооперации с другими факторами, простагландины (особенно простагландин E2) оказывают регулирующее действие при воспалительных и иммунных процессах.
Экзогенный простагландин E2 вызывает некоторые проявления воспалительной реакции, но подавляет иммунный ответ и аллергические реакции.
Так, простагландин E2 снижает цитотоксическую активность макрофагов, нейтрофилов и лимфоцитов, пролиферацию лимфоцитов, выработку этими клетками цитокинов.
Он способствует дифференцировке незрелых лимфоцитов и клеток других кроветворных рядов.
Некоторые эффекты простагландина Е2 связаны с повышением уровня внутриклеточного цАМФ.
Простагландины E2 и D2 подавляют агрегацию тромбоцитов; простагландины F2 и D2 вызывают сокращение гладкой мускулатуры бронхов, тогда как простагландин E2 расслабляет ее.
СЛАЙД 17
Тромбоксан А2 (ТХА2 ) - С 20 -жирная кислота; в его молекуле есть 6-членное кислородсодержащее кольцо.
Это очень нестабильная молекула (время полужизни - 30 с), превращающаяся в неактивный тромбоксан В2.
Тромбоксан А2 вызывает сужение сосудов и бронхов, агрегацию тромбоцитов с высвобождением из них ферментов и других активных факторов, способствующих митогенезу лимфоцитов.
Другой продукт циклоксигеназного пути - простагландин I2 (простациклин) - тоже нестабилен. Он проявляет свое действие через цАМФ, сильно расширяет сосуды, увеличивает их проницаемость, ингибирует агрегацию тромбоцитов.
Наряду с пептидным фактором брадикинином простациклин вызывает ощущение боли при воспалении.
СЛАЙД 18
Цитокины
Похожая информация.
Комплемент представляет собой одну из важнейших полифункцио- нальных систем организма. С одной стороны, его можно расценить как принципиальный эффектор антителозависимых реакций. Он участвует не только в литических и бактерицидных реакциях, но и в других антителозависимых эффектах, среди которых повышение фагоцитоза является одной из его важнейших функций in vivo. С другой стороны, комплемент выступает как основная система - амплифика- тор воспалительных реакций. Возможно, что в эволюционном аспекте это его главная (первичная) функция, и совсем не обязательно связывать ее с антителами и другими иммунологическими механизмами.
Центральным событием в процессе активации комплемента является расщепление СЗ-компонента по классическому (названному так только потому, что он был открыт первым, а не в силу его исключительной значимости) и альтернативному пути. Вторым принципиальным моментом является возможная глубина процесса: останавливается
ли он на стадии расщепления СЗ, обеспечивая при этом ряд биологических эффектов, или углубляется далее (от С5 до С9). Последний этап активации часто называют терминальным, заключительным (мембраноатакующим), он является общим, идентичным для классического и альтернативного пути и с ним связана литическая функция комплемента.
В настоящее время насчитывают не менее 20 протеинов плазмы, объединяемых в систему комплемента. Принципиально они делятся на 3 группы. Компоненты, участвующие в классическом пути активации и в заключительном (мембраноатакующем) этапе, обозначены как Clq, Clr, С1„ С4, С2, СЗ, С5, С6, С7, С8 и С9. Белки, участвующие в альтернативном пути активации, называются факторами и обозначены как В, Д, Р. Наконец, выделяется группа белков, регулирующих интенсивность реакции, или группа белков-контролеров: к ним относятся С1-ингибитор (C1INH), СЗЬ-инактиватор (C3bINa), pIH-фактор - С4 - ВР, ингибитор анафилотоксина. Фрагменты, получающиеся при энзиматическом расщеплении основных компонентов, обозначаются малыми буквами (например, СЗа, СЗь, C3d, С5а и т. д.). Для обозначения компонентов или фрагментов, обладающих энзиматической активностью, над их символами ставится черта, например Cl, С42, СЗьВь.
Ниже приводится содержание отдельных компонентов комплемента в сыворотке крови :
Компонент Концентрация, мкг/мл
Классический путь
С1 70
С1 34
С1 31
С4 600
С2 25
СЗ 1200
Альтернативный путь
Пропердин 25
Фактор В 200
Фактор Д 1
Мембраноатакующий комплекс
С5 85
С6 75
С7 55
С8 55
С9 60
Регуляторные белки
С1-ингибитор 180
Фактор Н 500
Фактор I 34
Система комплемента относится к числу «триггерных» энзимати
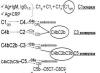
ческих систем, как и система свертывания крови, фибринолиз, образование кининов. Она характеризуется быстрым и стремительно усиливающимся ответом на стимуляцию. Эта амплификация (усиление) вызывается каскадным феноменом, для которого характерно, что продукты одной реакции являются катализаторами для следующей. Такой каскад может быть линейным, однонаправленным (например, классический путь активации комплемента), или вовлекает петли обратной связи (альтернативный путь). Таким образом, в системе комплемента имеют место оба варианта (схема 1).
Классический путь активируется иммунными комплексами
антиген - антитело, в состав которых в качестве антигенов входят IgM, IgG (субклассов 3, 1, 2; они расположены по убывающей активности). Кроме того, классический путь могут активировать агрегаты IgG, СРБ, ДНК, плазмин. Процесс начинается с активации С1, который состоит из 3 компонентов Clq, Clr, Cls. Clq (относительная молекулярная масса 400), имеет своеобразную структуру: 6 субъединиц с коллагеновым стержнем и неколлагеновой головкой, 6 стержней объединены на конце молекулы, противоположном головке. На головках находятся участки для присоединения к молекулам антител, участки же для присоединения С1Г и Cls расположены на коллагеновых стержнях. После присоединения Clq к АТ С1г путем конформативных преобразований становится С1г, активной протеазой. расщепляет Cls, превращая весь комплекс в серинэстеразу С1. Последняя расщепляет С4 на 2 фрагмента - С4а и С4ь и С2 на С2а и С2ь. Образующийся комплекс С4Ь2Ь(а) представляет собой активный фермент, расщепляющий СЗ-компонент (СЗ-конвертаза классического пути); иногда он обозначается С42.
Регулятором классического пути является С1-ингибитор (C1INH), подавляющий активность С1г и Cls путем необратимого связывания с этими ферментами. Установлено, что C1INH также уменьшает активность калликреина, плазмина и фактора Хагемана. Врожденный дефицит этого ингибитора приводит к неконтролируемой активации С4 и С2, проявляющейся в виде врожденного антиоотека.
Альтернативный (пропердиновый) путь состоит из ряда последовательных реакций, не включающих Cl, С4 и С2-компо- ненты и тем не менее приводящих к активации СЗ. К тому же эти реакции приводят к активации заключительного мембраноатакующего механизма. Активация этого пути инициируется эндотоксином грам- отрицательных бактерий, некоторыми полисахаридами типа инулина и зимозана, иммунными комплексами (ИК), содержащими IgA или IgG, и некоторыми бактериями и грибками (например, Staf. epidermis, Candida albicans). В реакции участвуют 4 компонента: факторы Д и В, СЗ и пропер дин (Р). При этом фактор Д (фермент) подобен Cls классического пути, СЗ и фактор В соответственно аналогичны С4- и С2-компонентам. В результате образуется конвертаза альтернативного пути СЗьВь. Образовавшийся комплекс крайне нестойкий, и для выполнения своей функции он стабилизируется пропердином, образуя более сложный комплекс СЗьВьР. Регуляторными белками альтернативного пути являются piH и СЗь-инактиватор (C3JNA). Первый связывается с СЗь и формирует участок связывания для инактиватора (C3bINA). Искусственное удаление этих факторов или их генетический дефицит, существование которого недавно установлено у людей, приводит к безудержной активации альтернативного пути, которая потенциально может завершиться полным истощением СЗ или фактора В.
Терминальный мембраноатакующий механизм. Как уже было сказано, оба пути сходятся на СЗ-компоненте, который активируется любой из образовавшихся конвертаз С42 или СЗьВь. Для
формирования С5-конвертазы необходимо расщепление дополнительного количества СЗ. СЗь, связанный на поверхности клетки, и свободные В, Р или р1Н формируют участок для связывания С5 и придают последнему чувствительность к протеолизу любой из конвертаз СЗ. При этом от С5 отщепляется небольшой пептид С5а, а остающийся крупный С5ь присоединяется к клеточной мембране и имеет участок для прикрепления Сб. Далее последовательно присоединяются компоненты С7, С8, С9. В результате формируется стабильный трансмембранный канал, обеспечивающий через билипидный слой клетки двустороннее движение ионов и воды. Мембрана повреждается, и клетка гибнет. Так, в частности, осуществляется киллинг чужеродных микроорганизмов.
В ходе активации комплемента образуется ряд фрагментов, пептидов, играющих важную роль в процессах воспаления, фагоцитоза и аллергических реакциях.
Так, расщепление С4 и С2 с помощью Cls ведет к повышению проницаемости сосудов и лежит в основе патогенеза врожденного антиоотека, связанного с дефицитом С1-ингибитора. Пептиды СЗа и С5а обладают свойствами анафилотоксина. Присоединяясь к тучным клеткам и базофилам, они индуцируют выделение гистамина. Связываясь с тромбоцитами, СЗа вызывает секрецию серотонина. Анафило- токсическая активность СЗа и С5а легко разрушается под воздействием карбоксипептидазы В, которая отщепляет от этих пептидов аргинин. Образующиеся продукты приобретают свойства хемоаттрактантов в отношении полиморфно-ядерных клеток, эозинофилов и моноцитов. Комплекс C5i67, не обладающий гемолитическими свойствами, и Вь- фрагмент вызывают хемотаксис только у полиморфно-ядерных лейкоцитов. В нормальной человеческой сыворотке имеется фактор CFi, который подавляет активность С5а в отношении полиморфно-ядерных клеток, устраняя способность его стимулировать освобождение лизо- сомальных ферментов. У больных саркоидозом и болезнью Ходжкина имеется избыток CFi. Этим можно объяснить дефект функционирования указанных клеток. Другой пептид СЗь является сильным опсонином для полиморфно-ядерных клеток (ПМЯ) и макрофагов. Рецепторы к этому пептиду обнаружены и на других клетках (моноцитах и В-лим- фоцитах), однако их значение для функционирования этих клеток пока неясно. Связывание лимфоцитами комплемента, находящегося в составе иммунного комплекса, может играть роль в формировании первичного иммунного ответа.
Исследование системы комплемента в клинической практике может быть использовано для диагноза заболевания, определения активности процесса и оценки эффективности терапии. Уровень сывороточного комплемента в каждый данный момент зависит от баланса синтеза, катаболизма и потребления его компонентов.
Низкие значения гемолитической активности комплемента могут отражать недостаточность отдельных компонентов или нахождение продуктов его расщепления в циркуляции. Следует также иметь в виду,
что интенсивное локальное потребление комплемента в таких участках, как плевра, полости суставов, может не сочетаться с изменением уровня комплемента й сыворотке крови. Например, у некоторых больных ревматоидным артритом уровень сывороточного комплемента может быть нормальным, тогда как в синовиальной жидкости он может быть резко понижен из-за активного его потребления. Определение комплемента в синовиальной жидкости очень важно для диагностики.
Врожденные дефициты комплемента. Наследование дефицитов комплемента - аутосомное рецессивное или кодоминант- ное, поэтому гетерозиготы имеют около 50% нормального уровня компонентов комплемента. В большинстве случаев врожденные дефициты ранних инициирующих компонентов (С1, С4, С2) ассоциированы с системной красной волчанкой. Лица с дефицитом С-компонента подвержены возвратным пиогенным инфекциям. Дефициты терминальных компонентов сопровождаются повышением восприимчивости к гонококковой и менингококковой инфекциям. При этих дефицитах комплемента также встречается системная красная волчанка, но реже. Наиболее часто наблюдается врожденный дефицит С2. Гомозиготный дефицит по этому признаку обнаруживается при некоторых аутоиммунных нарушениях, включающих волчаночноподобные заболевания, болезнь Шенлейна - Геноха, при гломерулонефритах и дерматомиозитах. Гомозиготные по этому признаку индивидуумы не обнаруживают повышенной чувствительности к инфекции, если альтернативный путь активации функционирует нормально. Гомозиготы, имеющие дефицит С2, обнаружены среди практически здоровых людей.
Гетерозиготный дефицит С2 может быть ассоциирован с ювенильным ревматоидным артритом и системной красной волчанкой. Семейные исследования позволили обнаружить, что дефицит С2 и С4 ассоциируется с определенными HLA-гаплотипами.
Дефицит регуляторных протеинов системы комплемента также может иметь клинические проявления. Так, при врожденном дефиците C3INA наблюдается клиническая картина, аналогичная таковой при дефиците СЗ, потому что потребление последнего по альтернативному пути становится неконтролируемым.
Эффекторные механизмы иммунитета направлены на связывание и элиминацию патогенов.
Существует 2 типа антигенсвязывающих рецепторов. В связи с этим выделяют 2 типа эффекторных механизмов.
. Антителозависимый, или гуморальный иммунитет. Осуществляется за счёт гуморальных (растворимых) факторов - антител, связывающих антиген и удаляющих его с использованием ряда механизмов: преципитации, агглютинации, нейтрализации, лизиса, блокады и опсонизации.
. Опосредованный клетками (антителонезависимый), или клеточный иммунитет. Клеточный иммунитет реализуется за счёт клеток иммунной системы, в первую очередь Т-лимфоцитов, а также активированных макрофагов и NK-клеток, непосредственно разрушающих генетически чужеродные клетки или инфицированные вирусами и другими внутриклеточными патогенами, и опухолевые клетки.
АНТИТЕЛОЗАВИСИМЫЕ МЕХАНИЗМЫ ЗАЩИТЫ
Опсонизация и запуск системы комплемента
Само по себе связывание антител с антигеном является защитным, по крайней мере, в двух случаях:
. если антиген - сильный яд, антитело при связывании нейтрализует его токсичность;
. если антиген представлен на поверхности патогена (вирус, прион, бактерия), антитело, связав его, препятствует распространению патогена в организме.
Однако в этих случаях защитная реакция не заканчивается на образовании макромолекулярных комплексов антиген-антитело. Эти комплексы необходимо расщепить до мелких метаболитов. Это происходит
при связывании образовавшихся иммунных комплексов с компонентами комплемента. Способность связывать комплемент у иммуноглобулинов разных классов различается (IgM > IgG3 > IgG1). Комплексы антиген-антитело-компоненты комплемента транспортируются эритроцитами, имеющими рецепторы для компонентов комплемента, в синусоиды селезёнки и печени, где их фагоцитируют и расщепят макрофаги.
Fc-рецепторы
Fc-рецепторы (FcR) - семейство мембранных рецепторов клеток иммунной системы, главной функцией которой является распознавание и связывание Fc-фрагмента иммуноглобулинов, находящихся в свободном состоянии и в составе иммунного комплекса. FcR, наряду с TCR и BCR, можно отнести к иммунорецепторам, поскольку клетка-носитель FcR способна связать антиген (пусть и посредством антител) и отвечать на него. FcR выявлены не только на лимфоцитах, но и на всех известных лейкоцитах.
Типы и разновидности FcR. По изотипу связываемых тяжёлых цепей иммуноглобулинов выделяют 4 разновидности FcR: γ, ε, α, μ; а по аффинности связывания с лигандом - 3 типа FcR: I, II и III. FcR типа I способны связывать свободные молекулы антител (это особенно характерно для IgE), FcR типов II и III - только комплексы антиген- антитело.
Fcγ-рецепторы (FcγR) различаются по строению и сродству к Fcчасти IgG, а также специфичности к различным подклассам IgG (рис. 8-1). FcγRI содержит в своём составе 2 полипептидные цепи, из которых α-цепь отвечает за связывание IgG, а γ-цепь - за передачу сигнала (эту функцию осуществляет внутриклеточный γ-домен). Рецепторы типа Fcy RII образованы единственной цепью. В зависимости от структуры их внутриклеточной части различают две разновидности этих рецепторов - FcγRIIA и FcγRIIB. В первом случае во внутриклеточной части содержится γ-домен, во второй - последовательность ITIM (Immunoreceptor-Tyrosin-based Inhibitory Motif - тирозинсодержащие ингибирующие последовательности аминокислот в иммунорецепторах). Эти особенности определяют функцию рецепторов: FcγRIIA передаёт стимулирующий, а FcγRIIB - ингибирующий сигнал. FcγRIII тоже существует в двух вариантах. Вариант FcγRIIIA, подобно FcγRI, содержит IgG-связывающую α- и сигнальную γ- (или ζ-) цепи. FcγRIIIB не
Рис. 8-1. Строение и свойства основных разновидностей Fcγ-рецепторов. Овальными символами обозначены домены, принадлежащие к суперсемейству иммуноглобулинов; ITIM - ингибирующая последовательность иммунорецепторов, содержащая тирозин. В нижней части рисунка в строке «Лиганды» в скобках представлены подклассы IgG, расположенные по убыванию их сродства к данному типу FcγR. Клетки, на которых локализуются Fcγ-рецепторы: Н - нейтрофил, аН - активированный нейтрофил, М - моноцит, МФ - макрофаг, Эо - эозинофил, NK - NK-клетка, В - В-лимфоцит, ФДК - фолликулярная дендритная клетка
обладает сигнальной функцией: его единственная a-цепь заякорена в фосфолипидный слой мембраны и лишена цитоплазматической части. Внеклеточные домены a-цепей рецепторов и единственных цепей FcγRII относятся к суперсемейству иммуноглобулинов.
Известны две разновидности Fcε-рецепторов, отличающиеся по структуре, сродству к Fc-части IgE и по биологической роли (рис. 8-2). FcεI-рецептор построен аналогично FcγRIIIA, но имеет дополнительную β-цепь, четырёхкратно пронизывающую мембрану. Этому рецептору принадлежит основная роль в запуске дегрануляции тучных клеток (ТК) - ключевого события в развитии реакций гиперчувствительности немедленного типа. FcεII-рецептор структурно не имеет сродства к FcεI-рецептору. Он играет роль в регуляции синтеза IgE, а также в регу-

Рис. 8-2. Строение и свойства Fcε-рецепторов. Овальными символами обозначены домены, принадлежащие к суперсемейству иммуноглобулинов; ITAM - активационная последовательность иммунорецепторов, содержащая тирозин. Клетки, на которых локализуются Fcε-рецепторы: ТК - тучная клетка; Б - базофил, М - моноцит, Эо - эозинофил, В и Т - В- и Т-лимфоциты соответственно, ФДК - фолликулярная дендритная клетка. Буква «а» обозначает активированные клетки
ляции роста и дифференцировки В-лимфоцитов. FcεII-рецептор также существует в виде секретируемой формы, играя роль цитокина с широким спектром действия.
Fcα-рецептор структурно сходен с рецепторами FcγRIIIA и FcεIR, его α-цепь принадлежит к суперсемейству иммуноглобулинов (рис. 8-3). Функция этого рецептора практически не изучена.
Рецептор Poly-IgR предназначен для транспорта полимерных иммуноглобулинов (IgA, IgM) через стенку слизистых оболочек. Его фрагмент, связанный с этими молекулами, обозначают как секреторный компонент (SC).
Неонатальный рецептор FcγRn (n - neonatal) отвечает за транспорт IgG, поступающего в кишечник ребёнка с молозивом или молоком, а затем - через кишечную стенку в кровоток ребёнка. Он также отвечает за трансплацентарный транспорт IgG. По структуре он аналогичен молекулам МНС-I (см. рис. 5-1) и содержит в своем составе β2-микроглобулин,

Рис. 8-3. Fcα-рецептор и Fс-рецепторы, ответственные за транспорт иммуноглобулинов. Клетки, на которых локализуются Fcγ-рецепторы: Н - нейтрофил, М - моноцит, МФ - макрофаг, Эо - эозинофил. Буква «а» обозначает активированные клетки
нековалентно связанный с α -цепью. Кроме того, FcγRn повышает срок жизни IgG в организме, защищая его от деградации в эндосомах.
На рис. 8-4 схематично представлены основные пути передачи сигналов с FcR. При перекрестном связывании FcR с лигандом (например, опсонизированным микроорганизмом) ITAM-мотив γ-цепи или α -цепи FcγRIIA фосфорилируется Src-киназами. Это приводит к взаимодействию SH2-доменов Syk-киназы с ITAM-мотивом FcR, его активации и фосфорилированию Scr-киназами. Активированная Syk-киназа фосфорилирует адапторный белок SLP-76, вовлекая в сигнальный процесс белок Vav из семейства GEF (Guanine nucleotide Exchange Factor). Он активирует ГТФазу Rac и адапторный белок ADAP, что вызывает реорганизацию актина, необходимую для образования фагоцитарной чаши и поглощения микроорганизма. С помощью адаптора SLP-76 фосфо-

Рис. 8-4. Сигнальные пути, идущие от Fc-рецептора. Пояснения см. в тексте
рилируется фосфолипаза С (PLCγ), расщепляющая фосфатидилинозитол на инозитолтрифосфат (IP 3 ; активатор Са 2+) и диацилглицерол (DAG) - активатор протеинкиназы С (PKC). Эти события определяют развитие процессов поглощения антигена, дегрануляции и кислородного взрыва. Src-киназы через адапторный белок Gab1 фосфорилируют фосфоинозитид-3-киназу (PI3K), активируя белок Akt, киназу МАР и поддерживают выживание клеток - ингибирование апоптоза. Srcкиназы также могут инициировать ингибиторный путь. В покоящейся клетке фосфатазы SHP-1 или SHIP-1 ассоциированы с ITIM-мотивом. Фосфорилирование ITIM-мотива приводит к активации фосфатаз. Последние дефосфорилируют активированные ферменты и адапторные белки и прерывают развитие сигнального пути.
Антителозависимая клеточная цитотоксичность
Феномен АнтителоЗависимой Клеточной ЦитоТоксичности (АЗКЦТ) проявляется, когда антитело связывает антиген на поверхности какой-либо клетки-мишени и через Fc-фрагмент привлекает для ее разрушения эффекторные клетки (NK-клетки, макрофаги, эозинофилы и др.).
.Естественные киллеры. NK-клетки имеют рецептор (FcγRIII) для
Fc-фрагментов IgG. Механизм собственно киллерного действия NK-лимфоцитов на клетку-мишень такой же, как и киллерный механизм ЦТЛ - перфорин-гранзимовый (см. рис. 1-4 и рис. 6-4).
.Эозинофилы. Механизм санации от гельминтов - вариант антителозависимой клеточной цитотоксичности, где в качестве эффекторных клеток выступают эозинофилы, имеющие низкоаффинные рецепторы для IgE - FcεRII и для IgA - FcαRII. Связывание этих рецепторов с лигандами в сочетании с сигналом от цитокина ИЛ-5 стимулирует синтез и секрецию эозинофилом высокотоксичных белков, направленных на уничтожение гельминтов. Другими словами, активированный эозинофил секретирует ряд биологически активных веществ, действие которых объясняют симптоматику так называемых эозинофильных воспалительных процессов (табл. 8-1).


Гиперчувствительность немедленного типа
Сосудистые и миоконстрикторные реакции, опосредованные медиаторами тучных клеток и базофилов, приводят к развитию гиперчувствительности немедленного типа (ГНТ). Цитокины тучных клеток и базофилов поддерживают иммунный сдвиг в дифференцировке субпопуляций CD4 + T-лимфоцитов в сторону Th2 (ИЛ-4, ИЛ-13), а также поддерживают дифференцировку и активацию эозинофилов (ИЛ-5, ИЛ-3, GM-CSF). В случае патологии именно эти клетки (Th2, тучные клетки, базофилы, эозинофилы) и IgE составляют самоподдерживающийся ансамбль, ответственный за реакции ГНТ. Мишени для цитокинов - клетки гладкой мускулатуры и эндотелия (следовательно, сосуды, бронхи, органы пищеварения). Системная реакция ГНТ - анафилактический шок.
Базофильные лейкоциты и тучные клетки. В этих реакциях антитела вовлекают в ответ базофилы и тучные клетки. Существенные функциональные признаки этих клеток схожи: наличие на мембране высокоаффинного рецептора для IgE (FcεRI) и одинаковый набор биологически активных медиаторов.
. Тучные клетки локализованы в соединительной ткани собственного слоя слизистых оболочек (laminapropria mucosae), в подкожной соединительной ткани и соединительной ткани, расположенной по ходу всех кровеносных сосудов. Выделяют, по крайней мере, 2 тканевые разновидности тучных клеток.
- Тучные клетки слизистых оболочек из сериновых протеаз экспрессируют триптазу и химазу, секретируют минимум гистамина; из протеогликанов в них преобладает хондроитинсульфат; из метаболитов арахидоновой кислоты - лейкотриен C4 (LTC4). По-видимому, дифференцировка этих клеток зависит от T-лимфоцитов, а именно от местной стимуляции клеток-предшественников цитокином ИЛ-3.
- Тучные клетки соединительной ткани локализованы в серозных оболочках полостей тела и в лёгких. Из сериновых протеаз экспрессируют преимущественно триптазу, из протеогликанов - гепарин, секретируют много гистамина, из метаболитов арахидоновой кислоты в них преобладает простагландин D2. Дифференцировку этих тучных клеток стимулируют фибробласты.
.Базофилы циркулируют в крови и мигрируют в ткани только в очаг воспаления (как нейтрофилы). На базофилах экспрессированы молекулы адгезии, важные для хоминга в очаг: LFA-1 (CD11a/CD18), Mac-1 (CD11b/CD18), CD44.
Активация. Сигналы, активирующие как тучные клетки, так и базофилы.
.Гомотипная агрегация Fc eRI. Клетки активируются комплексом IgE с антигеном или антителами к рецептору. FceRI способен связывать свободные IgE-антитела - до того, как они свяжут свой антиген. Клетки с комплексом IgE-FceRI на мембране тучных клеток находятся в состоянии готовности в считанные секунды и минуты осуществить дегрануляцию в ответ на распознавание поступившего антигена (рис. 8-5). Ход событий: антиген взаимодействует с Fabфрагментами IgE и активированная этим сигналом тучная клетка подвергается дегрануляции.
.Анафилатоксины - фрагменты компонентов системы комплемента, образующиеся при развитии каскада.
.Медиаторы из активированных нейтрофилов.
.Нейромедиаторы (норадреналин, вещество Р).
Медиаторы тучных клеток и базофилов различны по биохимическим свойствам, по предназначению и по срокам выброса из активированной клетки. Медиаторы, депонируемые в гранулах, первыми выбрасываются из клетки в ответ на активирующий сигнал. Другие медиаторы синтезируются de novo и вступают в процесс позже.

Рис. 8-5. Дегрануляция тучных клеток
. Гистамин. На разных клетках есть разные рецепторы для гистамина - Н 1 , Н 2 и Н 3 . Гистамин проявляет вазоактивные эффекты: вызывает констрикцию эндотелиальных клеток, контакты между эндотелиоцитами становятся менее плотными, и сыворотка выходит из сосуда в ткани; стимулирует синтез в клетках эндотелия простациклина и радикала оксида азота (NO"), вызывающих расслабление гладких мышц сосудистой стенки и, следовательно, вазодилатацию.
- Если процесс происходит в коже, клинически он проявляется в виде волдырей и покраснения (крапивница). В случае аллергической патологии снять симптомы помогают лекарственные средства - блокаторы Н 1 -рецепторов гистамина.
- При выделении достаточно большого количества гистамина он вызывает клинически значимые сокращения гладких мышц кишечника (перистальтику) и бронхов (бронхоспазм), однако этот эффект непродолжителен, поскольку гистамин быстро распадается во внеклеточной среде.
. Липидные медиаторы. При стимуляции тучных клеток в них активируются ферменты метаболизма липидов, а именно фосфолипаза А2. Этот фермент участвует в образовании биологически активных медиаторов, используя в качестве субстратов фосфолипиды клеточных мембран и липиды (в первую очередь арахидоновую кислоту).
- Простагландин D 2 - действует как вазодилататор и бронхоконстриктор. В биосинтезе простагландина D2 из арахидоновой кислоты участвует циклооксигеназа. Фармакологическим ингибитором этого фермента является ацетилсалициловая кислота.
- Лейкотриены (LTC 4 , LTD 4 , LTE 4) - альтернативные продукты метаболизма арахидоновой кислоты, образуемые под воздей-
ствием 5-липооксигеназы. Комплекс лейкотриенов - медленно реагирующий компонент анафилаксии. Именно он в наибольшей мере ответственен за бронхоконстрикцию при бронхиальной астме. Это объясняет усугубление астматических приступов ацетилсалициловой кислотой: блокируя синтез простагландина D2, ацетилсалициловая кислота высвобождает метаболический шунт арахидоновой кислоты в пользу лейкотриенов.
- Фактор активации тромбоцитов (ФАТ) вызывает бронхоконстрикцию, а также релаксацию гладких мышц сосудов и ретракцию эндотелия. ФАТ продуцируют не только (а может быть, и не столько) тучные клетки, но и клетки эндотелия, стимулированные гистамином и лейкотриенами.
- Ферменты тучных клеток и базофилов [сериновые протеазы (триптаза и химаза), катепсин G, карбоксипептидаза] способствуют перестройке матрикса соединительной ткани.
- Цитокины тучных клеток и базофилов. К ним относят интерлейкины, GM-CSF и др.
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ, ОПОСРЕДОВАННЫЕ КЛЕТКАМИ
Антителонезависимые эффекторные механизмы иммунитета в первую очередь реализуют ЦТЛ. К ним относят CD8 + Tαβ-лимфоциты и NKT-клетки - лимфоциты, одновременно экспрессирующие рецепторы NK- и Т-клеток. Есть T-киллеры и среди Tγδ-лимфоцитов.
Главное назначение ЦТЛ - санация организма от внутриклеточных патогенов, опухолевых и других изменённых клеток, реализуемая киллерной функцией ЦТЛ и цитокинами.
. Киллерная функция. ЦТЛ осуществляют киллерную функцию (см. рис. 1-5 и рис. 6-7) с помощью особых белков - цитотоксинов, к которым относят перфорин, гранзимы и недостаточно изученный цитолизин.
- Синтез цитотоксинов происходит de novo после вовлечения ЦТЛ в иммунный ответ и распознавания ими специфичного антигена.
- Накопление цитотоксинов. В виде функционально неактивных молекул-предшественников цитотоксины накапливаются в гранулах, сконцентрированных в клетке вблизи TCR.
- Дегрануляция ЦТЛ происходит в области межклеточного контакта, образующегося при связывании TCR с антигеном на по-
верхности клетки-мишени. Этот процесс облигатно зависит от
Ca 2+ .
- Перфорин накапливается в гранулах в виде растворимого предшественника. При высвобождении из гранул и в присутствии Ca 2+ перфорин быстро полимеризуется в мембране клетки-мишени, образуя цилиндрическую структуру. При этом липофильные участки молекул перфорина ориентируются в сторону клеточной мембраны, а гидрофильные - в сторону канала внутрь клетки. В результате образуется пора диаметром около 16 нм.
- Гранзимы и апоптоз. Через пору, образованную перфорином, внутрь клетки-мишени попадают выделенные ЦТЛ-гранзимы. Охарактеризовано 3 гранзима ЦТЛ - А, В и С. Это специализированные сериновые протеазы, субстратами которых служат ферменты, инициирующие в клетке-мишени программу апоптоза. При этом происходит разрушение ДНК и белков клетки, а в случае, если она поражена вирусом, то и инфицировавшего её патогена.
- Лизис мишени. Если механизмы апоптоза клетки-мишени по какой-либо причине нарушаются, ЦТЛ всё равно разрушает клетку путём осмотического лизиса через сформированные перфорином поры. Однако в этом случае неповреждённые вирусные частицы и нуклеиновые кислоты могут инфицировать другие клетки, что и происходит в случае некоторых инфекционных заболеваний.
. Цитокины. CD8 + ЦТЛ продуцируют цитокины - ИФНγ , ФНОα и ФНОβ (лимфотоксин). Эффекты ИФН γ перечислены ниже:
- непосредственно подавляет репликацию вирусов;
- индуцирует в клетках-мишенях повышенную экспрессию молекул MHC-I и MHC-II, способствуя более эффективной презентации вирусных антигенов T-лимфоцитам: и для распознавания, и для киллинга;
- активирует макрофаги и NK-клетки;
- служит кофактором при индукции дифференцировки наивных CD4 + T-лимфоцитов в Th1-клетки. Это означает, что CD8 + ЦТЛ вносят вклад в развитие других эффекторных механизмов иммунного ответа - с участием Th1-лимфоцитов.
ГИПЕРЧУВСТВИТЕЛЬНОСТЬ ЗАМЕДЛЕННОГО ТИПА
Гиперчувствительность замедленного типа (ГЗТ) - воспаление тканей, «организуемое» CD4 + T-лимфоцитами субпопуляции Th1 - продуцентами ИФНу. Клетками-исполнителями служат активированные макрофаги. Если в очаге инфекции происходит активация макрофага CD4 + Th1-лимфоцитом, микробицидные возможности макрофага существенно увеличиваются, и он более эффективно разрушает поглощённые патогены. К сожалению, в макрофаге погибают не все патогены, особенно жизнеспособны вирусы, например ВИЧ, а также микобактерии.
Активация макрофага. Для активации макрофага необходимы 2 типа воздействия со стороны лимфоцитов:
.контактное - молекула CD40L на Thl-лимфоците связывается с молекулой CD40 на макрофаге;
.цитокиновое - ИФНγ , продуцируемый Th1-клеткой, CD8 + ЦТЛ или NK-клеткой, связывается с рецептором на макрофаге;
.инфицированный макрофаг имеет больше шансов вступить во взаимодействие с Th1-клеткой, что обусловлено распознаванием Т-клеткой антигена на поверхности макрофага. В результате именно этот макрофаг получит активирующие сигналы от Т-клетки через интерферон и CD40L.
Ингибитор активации макрофагов - ИЛ-10.
Характеристики активированного макрофага. Макрофаг, активированный взаимодействием с Th1-клеткой, приобретает следующие признаки и функциональные способности.
.Увеличивается число рецепторов FcγR, при помощи которых макрофаг связывает комплексы антиген-антитело и фагоцитирует их.
.ИФН у в макрофагах индуцирует биосинтез ферментов, образующих радикалы активных форм кислорода, которые окисляют фагоцитированный антиген.
.В макрофагах под действием ИФНγ , ФНОα и, возможно, ИЛ-1 индуцируется экспрессия NO-синтазы, продуцирующей радикал NO*, который тоже окисляет фагоцитированный материал.
.В макрофагах индуцируется синтез липидных медиаторов воспаления - ФАТ, простагландинов и лейкотриенов (LTE4).
.Макрофаг синтезирует тканевой фактор коагуляции. В начавшемся процессе коагуляции активируется сывороточный тромбин - протеаза, стимулирующая клетки эндотелия сосудов, а также
нейтрофилы к синтезу ФАТ, что ещё больше способствует прогрессированию воспалительного процесса.
.ИФНγ служит самым сильным из известных индукторов синтеза и экспрессии молекул MHC-II. Кроме того, на активированных макрофагах, в отличие от неактивированных, индуцируется экспрессия костимуляторной молекулы B7, что делает активированные макрофаги более эффективными АПК. А также на активированных макрофагах возрастает экспрессия молекул адгезии ICAM-1 и LFA-3.
.Активированные макрофаги продуцируют ИЛ-12, способствующий дифференцировке Th1-лимфоцитов.
Очаг воспаления. Цитокины активированных макрофагов - ФНОа, ИЛ-1 и хемокины - создают очаг воспаления в виде плотных на ощупь узелков разного размера (симптом индурации). Плотность очага обусловлена выпотом из сосудов фибриногена и полимеризацией его в фибрин. Среди клеток, присутствующих в очаге, в первые 6-8 ч преобладают нейтрофилы, затем макрофаги и Th1-лимфоциты. Плотность клеток в свежем очаге ГЗТ невелика.
Сроки развития реакции. ГЗТ получила такое название, поскольку между моментом проникновения антигена в ткань и развитием характерного очага плотного воспаления проходит не менее 24-48 ч. После связывания антигена Th1-клетке требуется примерно 1 ч для индукции биосинтеза цитокинов, а также для синтеза и экспрессии на мембране молекулы CD40L.
Эффекты факторов роста. Среди цитокинов, продуцируемых активированными макрофагами, присутствуют факторы роста, что может значительно изменить состояние прилегающих к очагу тканей. Стандартная защитная реакция - развитие очага воспаления по типу ГЗТ, однако в патологических случаях цитокины, выделяемые активированными макрофагами, вызывают фиброзное перерождение тканей: тромбоцитарный фактор роста PDGF (Platelet-Derived Growth Factor) стимулирует пролиферацию фибробластов, а вырабатываемый CD4 + T-лимфоцитами и макрофагами ТФР- βстимулирует синтез коллагена. Кроме того, факторы роста, вырабатываемые макрофагами, вызывают образование дополнительных кровеносных сосудов - ангиогенез.
, Эстетическая, биологическая и культурная роль коллоидных систем , 1. Место и роль безопасности в профессиональной деятельности..do , НИР Деньги и их роль в экономике.docx , Какую роль в становлении личности играет семья.docx , Гальперин П.Я. Поэтапное формирование умствен. действий.docx , ПР 01 Определение идеи проекта. Формирование целей проекта в рам , Место и роль философии в культуре ХХ века..docx .
Эффекторная роль комплемента. Формирование мембраноатакующего комплекса и его роль в лизисе клетки.
а) участвует в лизисе микробных и других клеток (цитотоксическое действие);
б) обладает хемотаксической активностью ;
в) принимает участие в анафилаксии;
г) участвует в фагоцитозе.
Основные полезные эффекты комплемента:
содействие в уничтожении микроорганизмов;
интенсивное удаление иммунных комплексов;
индукция и усиление гуморального иммунного ответа.
Система комплемента может вызывать повреждение клеток и тканей собственного организма в следующих случаях:
если происходит ее генерализованная массированная активация , например при септицемии, вызванной грамотрицательными бактериями;
если ее активация происходит в очаге тканевого некроза, в частности при инфаркте миокарда ;
если активация происходит при аутоиммунной реакции в тканях.
Первая фаза: прикрепление С6 к С5b на поверхности клетки. Затем С7 связывается с С5b и С6 и проникает в наружную мембрану клетки. Последующее связывание С8 с С5b67 приводит к образованию комплекса, глубже проникающего в мембрану клетки. На мембране клетки C5b-С8 действует как рецептор для С9 - молекулы типа перфорина, который связывается с С8. Дополнительные молекулы С9 взаимодействуют в комплексе с молекулой С9, образуя полимеризованные С9 (поли-С9). Они формируют трансмембранный канал, нарушающий осмотическое равновесие в клетке: через него проникают ионы и поступает вода. Клетка набухает, мембрана становится проницаемой для макромолекул, которые затем покидают клетку. В результате происходит лизиc клетки.

Система комплимента - комплекс сложных белков, постоянно присутствующих в крови. Это каскадная система протеолитическихферментов, предназначенная для гуморальнойзащиты организма от действия чужеродных агентов , она участвует в реализации иммунного ответаорганизма. Является важным компонентом как врождённого, так и приобретённого иммунитета.

По классическому пути комплемент активируется комплексом антиген-антитело. Для этого достаточно участия в связывании антигена одной молекулы IgM или двух молекул IgG. Процесс начинается с присоединения к комплексу АГ+АТ компонента С1 , который распадается на субъединицы C1q, C1r и С1s. Далее в реакции участвуют последовательно активированные «ранние» компоненты комплемента в последовательности: С4 , С2, СЗ. «Ранний» компонент комплемента С3 активирует компонент С5, который обладает свойством прикрепляться к мембране клетки. На компоненте С5 путем последовательного присоединения «поздних» компонентов С6, С7, С8, С9 образуется литический или мембраноатакующий комплекс который нарушает целостность мембраны (образует в ней отверстие), и клетка погибает в результате осмотического лизиса.
Альтернативный путь активации комплемента проходит без участия антител. Этот путь характерен для защиты от грамотрицательных микробов. Каскадная цепная реакция при альтернативном пути начинается с взаимодействия антигена с протеинами В , D и пропердином (Р) с последующей активацией компонента СЗ. Далее реакция идет так же, как и при классическом пути - образуется мембраноатакующий комплекс.
Лектиновый пут ь активации комплемента также происходит без участия антител. Он инициируется особым маннозосвязывающим белком сыворотки крови, который после взаимодействия с остатками маннозы на поверхности микробных клеток катализирует С4. Дальнейший каскад реакций сходен с классическим путем.
В процессе активации комплемента образуются продукты протеолиза его компонентов - субъединицы СЗа и СЗb, С5а и С5b и другие, которые обладают высокой биологической активностью. Например, СЗа и С5а принимают участие в анафилактических реакциях , являются хемоаттрактантами, СЗb - играет роль в опсонизации объектов фагоцитоза, и т. д. Сложная каскадная реакция комплемента происходит с участием ионов Са 2 + и Mg 2+ .