“Seorang ahli matematika, seperti halnya seniman atau penyair, menciptakan pola. Dan jika polanya lebih stabil, itu hanya karena pola tersebut tersusun dari gagasan... Pola seorang ahli matematika, seperti halnya pola seorang seniman atau penyair, pasti indah; Ide, seperti halnya warna atau kata, harus sesuai satu sama lain. Kecantikan adalah syarat pertama: tidak ada tempat di dunia ini untuk matematika jelek».
G.H.Hardy
Pada bab pertama disebutkan bahwa ada yang cukup primitif fungsi sederhana, yang tidak lagi dapat diungkapkan melalui fungsi dasar. Dalam hal ini, kelas-kelas fungsi yang secara akurat dapat kita katakan bahwa antiturunannya adalah fungsi dasar, memperoleh kepentingan praktis yang sangat besar. Kelas fungsi ini mencakup fungsi rasional, mewakili rasio dua polinomial aljabar. Banyak permasalahan yang mengarah pada integrasi pecahan rasional. Oleh karena itu, sangat penting untuk dapat mengintegrasikan fungsi-fungsi tersebut.
2.1.1. Fungsi rasional pecahan
Pecahan rasional(atau fungsi rasional pecahan) adalah relasi dua polinomial aljabar:
di mana dan adalah polinomial.
Mari kita ingat hal itu polinomial (polinomial, utuh fungsi rasional ) Ngelar ke-th disebut fungsi formulir
Di mana ![]() – bilangan real. Misalnya,
– bilangan real. Misalnya,
![]()
– polinomial derajat pertama;
– polinomial derajat keempat, dst.
Pecahan rasional (2.1.1) disebut benar, jika derajatnya lebih rendah dari derajatnya , mis. N<M, jika tidak, pecahan disebut salah.
Pecahan biasa apa pun dapat direpresentasikan sebagai jumlah dari polinomial (bagian bilangan bulat) dan pecahan biasa (bagian pecahan). Pemisahan bagian bilangan bulat dan pecahan dari pecahan biasa dapat dilakukan sesuai dengan aturan pembagian polinomial dengan “sudut”.
Contoh 2.1.1. Tentukan bilangan bulat dan bagian pecahan dari pecahan rasional tak wajar berikut ini:
A)  , B)
, B)  .
.
Larutan . a) Dengan menggunakan algoritma pembagian “sudut”, kita peroleh

Jadi, kita dapatkan
 .
.
b) Di sini kami juga menggunakan algoritma pembagian “sudut”:

Hasilnya, kami mendapatkan
 .
.
Mari kita rangkum. Secara umum, integral tak tentu suatu pecahan rasional dapat direpresentasikan sebagai jumlah integral polinomial dan pecahan rasional sejati. Menemukan antiturunan dari polinomial tidaklah sulit. Oleh karena itu, berikut ini kita terutama akan membahas pecahan rasional wajar.
2.1.2. Pecahan rasional paling sederhana dan integrasinya
Di antara pecahan rasional sejati, ada empat jenis yang diklasifikasikan menjadi pecahan rasional (dasar) yang paling sederhana:
|
3) |
4) |
di mana bilangan bulat, ![]() , yaitu. trinomial kuadrat
, yaitu. trinomial kuadrat ![]() tidak memiliki akar nyata.
tidak memiliki akar nyata.
Mengintegrasikan pecahan sederhana tipe 1 dan tipe 2 tidak menimbulkan banyak kesulitan:
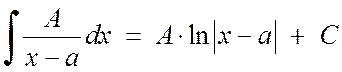 , (2.1.3)
, (2.1.3)
 . (2.1.4)
. (2.1.4)
Sekarang mari kita perhatikan integrasi pecahan sederhana tipe ke-3, tetapi kita tidak akan membahas pecahan tipe ke-4.
Mari kita mulai dengan integral bentuk
 .
.
Integral ini biasanya dihitung dengan mengisolasi kuadrat sempurna penyebutnya. Hasilnya adalah integral tabel dengan bentuk berikut
 atau
atau  .
.
Contoh 2.1.2. Temukan integralnya:
A)  , B)
, B) 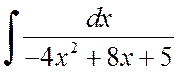 .
.
Larutan . a) Pilih persegi lengkap dari trinomial kuadrat:
Dari sini kita temukan
b) Dengan mengisolasi persegi lengkap dari trinomial kuadrat, kita memperoleh:
Dengan demikian,
 .
.
Untuk mencari integralnya
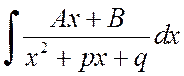
anda dapat mengisolasi turunan penyebut dalam pembilangnya dan memperluas integral menjadi jumlah dua integral: yang pertama dengan substitusi ![]() turun ke penampilan
turun ke penampilan
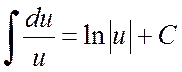 ,
,
dan yang kedua - yang dibahas di atas.
Contoh 2.1.3. Temukan integralnya:
 .
.
Larutan
. Perhatikan itu 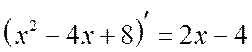 . Mari kita pisahkan turunan dari penyebutnya pada pembilangnya:
. Mari kita pisahkan turunan dari penyebutnya pada pembilangnya:
Integral pertama dihitung dengan menggunakan substitusi ![]() :
:
Pada integral kedua, kita memilih kuadrat sempurna pada penyebutnya
Akhirnya, kita mendapatkan
2.1.3. Ekspansi pecahan rasional yang tepat
untuk jumlah pecahan sederhana
Pecahan rasional apa pun yang tepat ![]() dapat direpresentasikan dengan cara yang unik sebagai jumlah pecahan sederhana. Untuk melakukan ini, penyebutnya harus difaktorkan. Dari aljabar yang lebih tinggi diketahui bahwa setiap polinomial mempunyai koefisien real
dapat direpresentasikan dengan cara yang unik sebagai jumlah pecahan sederhana. Untuk melakukan ini, penyebutnya harus difaktorkan. Dari aljabar yang lebih tinggi diketahui bahwa setiap polinomial mempunyai koefisien real
Jelas bahwa kita tidak akan dapat mengukur secara langsung partikel sekecil itu. Kita akan melakukan percobaan yang melalui perhitungan sederhana kita dapat menentukan ukuran molekul. Anda tentu pernah melihat lapisan tipis berwarna yang terbentuk dari produk minyak bumi (minyak pelumas, solar, dll) di permukaan air. Warna film tipis terjadi karena tumpang tindih sinar cahaya yang dipantulkan dari permukaan atas dan bawah film, suatu fenomena yang disebut interferensi cahaya. Untuk alasan yang sama, gelembung sabun berkilau dengan semua warna pelangi.
Anda akan mempelajari fenomena interferensi dalam pelajaran fisika. Dan sekarang kami tertarik dengan ketebalan filmnya - pernahkah Anda bertanya-tanya seberapa tebal film tersebut? Menentukan ketebalan film sangat sederhana: Anda perlu membagi volumenya dengan luas permukaan. Bahkan para pelaut zaman dahulu memperhatikan bahwa jika minyak nabati dituangkan ke permukaan air, maka akan menyebar di tempat yang sangat luas (pada saat itu muncul pendapat yang agak aneh bahwa dengan cara ini laut dapat “menenangkan” saat terjadi badai). Mungkin orang pertama yang mengukur luas noda minyak di air adalah ilmuwan dan diplomat Amerika terkemuka Benjamin Franklin (1706-1790), yang gambarnya muncul pada uang kertas seratus dolar. Penemuannya yang paling terkenal adalah penangkal petir (atau lebih tepatnya, penangkal petir). Pada tahun 1774, Franklin melakukan perjalanan ke Eropa untuk menyelesaikan konflik lain antara Inggris dan Amerika Serikat. Di waktu luangnya dari negosiasi, ia bereksperimen dengan lapisan minyak di permukaan air. Yang mengejutkan, satu sendok minyak sayur tersebar ke seluruh permukaan kolam kecil. Jika Anda menuangkan bukan minyak sayur ke dalam air, tetapi minyak mesin yang tidak kental, noda darinya tidak akan terlalu besar: satu tetes menghasilkan lingkaran dengan diameter sekitar 20 cm kira-kira 300 cm3, volume satu tetesnya kira-kira 0,03 cm3. Jadi ketebalan filmnya adalah 0,03 cm1 / 300 cm3 = 0,0001 cm = 0,001 mm - 1 mikron. Seperseribu milimeter adalah nilai yang sangat kecil; tidak semua mikroskop dapat melihat partikel sebesar ini.
Namun apakah kita mempunyai jaminan bahwa molekul oli mesin tersebar di air dalam satu lapisan? Memang, hanya dalam kasus ini ketebalan film akan sesuai dengan ukuran molekul. Kami tidak memiliki jaminan seperti itu, dan inilah alasannya. Molekul yang menyusun oli mesin disebut hidrofobik (diterjemahkan dari bahasa Yunani “hidrofobik” - “takut air”). Mereka “menempel” dengan cukup baik satu sama lain, tetapi sangat enggan dengan molekul air. Jika suatu zat yang mirip dengan oli mesin dituangkan ke permukaan air, maka akan terbentuk lapisan yang agak tebal (menurut standar molekuler), terdiri dari ratusan bahkan ribuan lapisan molekul. Selain fakta bahwa perhitungan seperti itu menarik, perhitungan tersebut juga memiliki kepentingan praktis yang besar. Misalnya, hingga saat ini tidak mungkin menghindari kecelakaan kapal tanker besar yang mengangkut minyak ribuan kilometer dari tempat produksinya. Akibat kecelakaan tersebut, sejumlah besar minyak dapat tumpah ke laut, yang akan berdampak buruk bagi organisme hidup. Oli lebih kental dibandingkan oli mesin, sehingga lapisan pada permukaan air mungkin lebih tebal. Jadi, dalam salah satu kecelakaan, 120.000 ton minyak tumpah seluas 500 km3. Seperti yang ditunjukkan oleh perhitungan sederhana, ketebalan rata-rata film tersebut adalah 200 mikron. Ketebalan lapisan film bergantung pada jenis minyak dan suhu air: di laut dingin, saat minyak menjadi lebih kental, lapisan filmnya lebih tebal, di laut hangat, saat minyak menjadi kurang kental, lapisan filmnya lebih tipis. Namun bagaimanapun juga, kecelakaan sebuah kapal tanker besar, ketika puluhan ribu ton minyak jatuh ke laut, adalah sebuah bencana. Lagi pula, jika semua minyak yang tumpah menyebar dalam lapisan tipis, maka akan terbentuk noda yang sangat luas, dan sangat sulit untuk menghilangkan lapisan tersebut.
Mungkinkah suatu zat tersebar di atas air sehingga hanya terbentuk satu lapisan molekul (lapisan seperti itu disebut monomolekuler)? Ternyata hal ini mungkin terjadi, tetapi alih-alih oli mesin atau minyak bumi, Anda perlu mengonsumsi zat lain. Molekul zat tersebut harus memiliki gugus atom yang disebut hidrofilik (yaitu “menyukai air”) di satu ujung, dan gugus hidrofobik di ujung lainnya. Apa jadinya jika suatu zat yang terdiri dari molekul-molekul tersebut diletakkan di atas permukaan air? Bagian molekul yang hidrofilik, yang berusaha larut dalam air, akan menarik molekul tersebut ke dalam air, sedangkan bagian hidrofobik yang “takut” terhadap air akan dengan keras kepala menghindari kontak dengan air. Sebagai hasil dari “kesalahpahaman” timbal balik tersebut, molekul-molekul (jika mereka “ditekan” sedikit dari samping menggunakan papan) akan berbaris di permukaan air seperti yang ditunjukkan pada Gambar. 3.1: ujung hidrofiliknya tenggelam ke dalam air, dan ujung hidrofobiknya menonjol.
\6666666666ы/
Beras. 3.1. Beginilah cara molekul surfaktan berorientasi pada batas air-udara, membentuk “benteng Langmuir” - dinamai menurut ahli kimia dan fisikawan Amerika Irving Langmuir (1881-1957), yang pada tahun 1916 menciptakan teori struktur lapisan tersebut pada permukaan cairan
Zat yang berperilaku seperti ini disebut surfaktan. Ini termasuk, misalnya, sabun dan deterjen lainnya; asam oleat, yang merupakan bagian dari minyak bunga matahari; alkohol palmitat, yang merupakan bagian dari minyak sawit dan minyak ikan paus. Penyebaran zat-zat tersebut di atas permukaan air menghasilkan lapisan film yang jauh lebih tipis dibandingkan oli mesin. Fenomena ini telah diketahui sejak lama; eksperimen serupa dilakukan pada abad ke-18. Namun baru pada akhir abad ke-19 – awal abad ke-20, sebagai hasil eksperimen yang dilakukan oleh fisikawan Inggris John William Rayleigh (1842-1919), fisikawan Jerman Wilhelm Conrad Roentgen (1845-1923) dan sejumlah ilmuwan lain telah menunjukkan bahwa ketebalan film dapat mencapai ukuran sekecil itu sehingga sebanding dengan ukuran masing-masing molekul.
Dalam salah satu eksperimen ini, ahli kimia Inggris Neil Kensington Adam. Sebagian besar molekul dan ion zat yang kita kenal memiliki ukuran orde 1 nm. Jadi, diameter molekul hidrogen kira-kira 0,2 nm, yodium - 0,5 nm, etil alkohol - 0,4 nm; jari-jari ion aluminium adalah 0,06 nm, natrium - 0,10 nm, klorida - 0,13 nm, klorin - 0,18 nm, yodium - 0,22 nm. Namun di antara molekul-molekul juga terdapat raksasa, yang ukurannya, menurut standar molekuler, benar-benar sangat besar. Jadi, di dalam inti sel hewan dan tumbuhan tingkat tinggi terdapat molekul keturunan - asam deoksiribonukleat (DNA). Panjangnya bisa melebihi 2.000.000 nm, yaitu 2 mm!
Sebagai penutup bagian ini, berikut adalah cerita pendek tentang metode cerdik (meskipun bukan yang paling akurat) yang digunakan pada tahun 1908 oleh ilmuwan Perancis Jean Perrin untuk “menimbang” molekul. Seperti yang Anda ketahui, kepadatan udara berkurang seiring dengan ketinggian. Pada awal abad ke-19, ilmuwan Perancis Pierre Laplace mengembangkan rumus yang memungkinkan seseorang menghitung tekanan pada ketinggian berbeda. Menurut rumus ini, tekanan atmosfer turun setengahnya untuk setiap kenaikan 6 km. Nilai ini tentu saja bergantung pada gaya gravitasi, serta massa molekul udara. Jika udara tidak terdiri dari nitrogen dan oksigen, tetapi dari molekul hidrogen yang sangat ringan (16 kali lebih ringan dari molekul oksigen), maka penurunan tekanan atmosfer hingga setengahnya akan diamati pada ketinggian bukan 6 km, tetapi sekitar 16 kali lipat. lebih, yaitu sekitar 100 km. Sebaliknya, jika molekulnya sangat berat, atmosfer akan “ditekan” ke permukaan bumi dan tekanannya akan turun dengan cepat seiring dengan ketinggian.
Beralasan seperti ini. Alih-alih menggunakan molekul, Perrin memutuskan untuk menggunakan bola-bola kecil pewarna gummigut yang tersuspensi dalam air. Ia mencoba membuat suspensi (emulsi) dengan bola-bola dengan ukuran yang sama - diameter sekitar 1 mikron. Kemudian dia meletakkan setetes emulsi di bawah mikroskop dan, dengan menggerakkan sekrup mikroskop secara vertikal, menghitung jumlah bola karet pada ketinggian yang berbeda. Ternyata rumus Laplace cukup dapat diterapkan pada emulsi: untuk setiap kenaikan 6 mikron, jumlah bola dalam bidang pandang berkurang setengahnya. Karena 6 km persisnya satu miliar kali lebih besar dari 6 mikron, Perrin menyimpulkan bahwa molekul oksigen dan nitrogen juga berkali-kali lebih ringan daripada bola karet (dan massanya sudah dapat ditentukan secara eksperimental).
Dan subbagian yang membahas metode filtrasi modern berdasarkan prinsip saringan secara umum. Dan mereka mengisyaratkan bahwa pemurni membran memurnikan air dengan kualitas berbeda, yang bergantung pada ukuran “sel”, yang disebut pori-pori, dalam saringan membran tersebut. Masing-masing, mikrofiltrasi air- Ini adalah teknologi sistem pemurnian air membran pertama yang akan kami pertimbangkan.
Mikrofiltrasi air adalah pemurnian air pada tingkat molekul besar (makromolekul), seperti partikel asbes, cat, debu batubara, kista protozoa, bakteri, karat. Sedangkan makrofiltrasi (air) mempengaruhi pasir, partikel besar lanau, partikel besar karat, dll.
Secara kasar kita dapat mengatakan bahwa ukuran partikel yang disaring makrofiltrasi adalah partikel yang lebih besar dari 1 mikrometer (jika menggunakan kartrid khusus satu mikron). Sedangkan ukuran partikel yang dihilangkan mikrofiltrasi adalah partikel dari 1 mikron hingga 0,1 mikron.
Anda mungkin bertanya, "Tetapi jika partikel hingga 0,1 mikron dihilangkan, bukankah partikel 100 mikron akan ditangkap oleh mikrofiltrasi? Mengapa menulis '1 mikron hingga 0,1 mikron' - itu merupakan kontradiksi?"
Faktanya, tidak ada kontradiksi khusus. Memang, mikrofiltrasi air akan menghilangkan bakteri dan bongkahan besar pasir. Namun tujuan mikrofiltrasi bukanlah untuk menghilangkan potongan pasir yang besar. Tujuan mikrofiltrasi adalah untuk “menghilangkan partikel dalam kisaran ukuran tertentu.” Lalu bagaimana caranya HAI Partikel yang lebih besar hanya akan menyumbat alat pembersih dan menimbulkan biaya tambahan.
Jadi mari kita beralih ke karakteristik mikrofiltrasi air.
Karena mikrofiltrasi menghilangkan partikel berukuran 0,1-1 mikron, kita dapat mengatakan demikian mikrofiltrasi adalah teknologi membran untuk pemurnian air, yang terjadi pada saringan membran dengan diameter sel pori 0,1-1 mikron. Artinya, pada membran tersebut semua zat yang lebih besar dari 0,5-1 mikron dihilangkan:
Seberapa lengkap bakteri tersebut hilang bergantung pada diameter pori-pori dan ukuran sebenarnya, misalnya bakteri. Jadi, jika bakterinya panjang tetapi tipis, maka akan mudah masuk melalui pori-pori membran mikrofiltrasi. Dan bakteri berbentuk bola yang lebih tebal akan tetap berada di permukaan “ayakan”.
Penggunaan mikrofiltrasi yang paling umum adalah dalam industri makanan(untuk susu skim, konsentrat jus) dan dalam kedokteran(untuk penyiapan utama bahan baku obat). Mikrofiltrasi juga digunakan dalam pengolahan air minum industri- terutama di negara-negara Barat (misalnya, di Paris). Meski beredar rumor bahwa salah satu instalasi pengolahan air di Moskow juga menggunakan teknologi mikrofiltrasi. Mungkin ini benar :)
Namun ada juga filter rumah tangga yang berbasis mikrofiltrasi.
Contoh paling umum adalah melacak membran mikrofiltrasi. Track dari kata "track", yaitu jejak, dan nama ini dikaitkan dengan cara pembuatan membran jenis ini. Prosedurnya sangat sederhana:
- Film polimer dibombardir oleh partikel-partikel, yang, karena energinya yang tinggi, membakar jejak-jejak di dalam film - cekungan dengan ukuran yang kira-kira sama, karena partikel-partikel yang dibombardir permukaannya berukuran sama.
- Kemudian film polimer ini digores dalam larutan, misalnya asam, sehingga bekas tumbukan partikel dapat tembus.
- Nah, selanjutnya prosedur sederhana untuk mengeringkan dan memasang film polimer pada substrat - dan selesai, membran mikrofiltrasi lintasan sudah siap!
Hasilnya, membran ini memiliki diameter pori yang tetap dan porositas yang rendah dibandingkan dengan sistem pengolahan air membran lainnya. Dan kesimpulannya: membran ini hanya akan menghilangkan partikel dengan ukuran tertentu.

Ada juga versi membran rumah tangga mikrofiltrasi yang lebih canggih - membran mikrofiltrasi dilapisi dengan karbon aktif. Artinya, langkah-langkah yang tercantum di atas mencakup satu langkah lagi - mengaplikasikan lapisan tipis. Membran ini tidak hanya menghilangkan bakteri dan kotoran mekanis, tetapi juga
- bau,
- bahan organik,
- dll.
Perlu diingat bahwa untuk membran mikrofiltrasi ada bahaya. Dengan demikian, bakteri itu tidak melewati membran mulai hidup di membran ini dan masalah produk hidup Anda ke dalam air murni. Artinya, hal itu muncul keracunan air sekunder. Untuk menghindari hal ini, perlu mengikuti instruksi pabrik untuk desinfeksi membran secara teratur.
Bahaya kedua adalah itu bakteri akan mulai memakan membran ini sendiri. Dan mereka akan membuat lubang besar di dalamnya, yang memungkinkan zat-zat yang seharusnya tertahan oleh membran dapat melewatinya. Untuk mencegah hal ini terjadi, Anda harus membeli filter yang berbahan dasar bahan tahan bakteri (misalnya membran mikrofiltrasi keramik) atau bersiaplah untuk sering mengganti membran mikrofiltrasi.
Penggantian membran mikrofiltrasi yang sering juga didorong oleh fakta bahwa membran tersebut tidak dilengkapi dengan mekanisme pembilasan. Dan pori-pori membran tersumbat oleh kotoran. Membran gagal.
Pada prinsipnya, semuanya tentang mikrofiltrasi. Mikrofiltrasi adalah metode pemurnian air yang cukup berkualitas tinggi. Namun,
Tujuan mikrofiltrasi sebenarnya bukan untuk menyiapkan air untuk diminum (karena bahaya kontaminasi bakteri), tetapi untuk melakukan pengolahan awal air sebelum tahap selanjutnya.
Tahap mikrofiltrasi menghilangkan sebagian besar beban tahap pengolahan air berikutnya.

Berdasarkan bahan Cara memilih filter air: http://voda.blox.ua/2008/07/Kak-vybrat-filtr-dlya-vody-22.html
« Fisika - kelas 10"
Objek fisik (sistem) apa yang dipelajari fisika molekuler?
Bagaimana membedakan fenomena mekanik dan termal?
Teori kinetik molekuler tentang struktur materi didasarkan pada tiga pernyataan:
1) materi terdiri dari partikel-partikel;
2) partikel-partikel ini bergerak secara acak;
3) partikel berinteraksi satu sama lain.
Setiap pernyataan dibuktikan secara ketat melalui eksperimen.
Sifat dan perilaku semua benda, tanpa kecuali, ditentukan oleh pergerakan partikel yang berinteraksi satu sama lain: molekul, atom, atau bahkan formasi yang lebih kecil - partikel elementer.
Estimasi ukuran molekul. Untuk benar-benar yakin akan keberadaan molekul, ukurannya harus ditentukan. Cara termudah untuk melakukannya adalah dengan melihat setetes minyak, seperti minyak zaitun, tersebar di permukaan air. Minyak tidak akan pernah memenuhi seluruh permukaan jika kita mengambil bejana yang cukup lebar (Gbr. 8.1). Tidak mungkin memaksa tetesan yang bervolume 1 mm 2 menyebar sehingga menempati luas permukaan lebih dari 0,6 m 2. Mari kita asumsikan bahwa ketika minyak menyebar ke area maksimumnya, ia membentuk lapisan yang hanya setebal satu molekul - “lapisan monomolekul”. Ketebalan lapisan ini mudah ditentukan dan dengan demikian memperkirakan ukuran molekul minyak zaitun.
Volume V lapisan minyak sama dengan hasil kali luas permukaan S dan ketebalan lapisan d, yaitu V = Sd. Oleh karena itu, ukuran linier molekul minyak zaitun adalah:

Instrumen modern memungkinkan untuk melihat dan bahkan mengukur atom dan molekul individu. Gambar 8.2 menunjukkan mikrograf permukaan wafer silikon, yang tonjolannya merupakan atom silikon individual. Gambar tersebut pertama kali diperoleh pada tahun 1981 menggunakan mikroskop terowongan yang kompleks.
Ukuran molekul, termasuk minyak zaitun, lebih besar dibandingkan ukuran atom. Diameter suatu atom kira-kira 10 -8 cm. Dimensi ini sangat kecil sehingga sulit untuk dibayangkan. Dalam kasus seperti itu, mereka menggunakan perbandingan.
Ini salah satunya. Jika Anda mengepalkan jari-jari Anda dan memperbesarnya hingga seukuran bola bumi, maka atom dengan perbesaran yang sama akan menjadi seukuran kepalan tangan.
Jumlah molekul.
Dengan ukuran molekul yang sangat kecil, jumlah mereka dalam benda makroskopis sangatlah besar. Mari kita hitung perkiraan jumlah molekul dalam setetes air dengan massa 1 g dan volume 1 cm 3.
Diameter molekul air kira-kira 3 · 10 -8 cm. Mengingat setiap molekul air, dengan kumpulan molekul yang padat, menempati volume (3 · 10 -8 cm) 3, maka jumlah molekul dalam setetes dapat dicari sebesar . membagi volume tetesan (1 cm 3) dengan volume per molekul:
Massa molekul.
Massa molekul dan atom individu sangat kecil. Kami menghitung bahwa 1 g air mengandung 3,7 · 10 22 molekul. Oleh karena itu, massa satu molekul air (H 2 0) sama dengan:
Molekul zat lain memiliki massa dengan urutan yang sama, tidak termasuk molekul zat organik yang sangat besar; misalnya, protein memiliki massa ratusan ribu kali lebih besar daripada massa atom individu. Namun tetap saja, massanya pada skala makroskopis (gram dan kilogram) sangatlah kecil.
Berat molekul relatif.
Karena massa molekul sangat kecil, akan lebih mudah untuk menggunakan nilai massa relatif daripada nilai massa absolut dalam perhitungan.
Berdasarkan kesepakatan internasional, massa semua atom dan molekul dibandingkan dengan massa atom karbon (yang disebut skala massa atom karbon).
Massa molekul relatif (atau atom) M r suatu zat adalah perbandingan massa m 0 suatu molekul (atau atom) suatu zat dengan massa atom karbon:
Massa atom relatif semua unsur kimia telah diukur secara akurat. Dengan menjumlahkan massa atom relatif unsur-unsur penyusun molekul suatu zat, kita dapat menghitung massa molekul relatif zat tersebut. Misalnya, massa molekul relatif karbon dioksida CO 2 kira-kira sama dengan 44, karena massa atom relatif karbon hampir sama dengan 12, dan oksigen kira-kira 16:12 + 2 16 = 44.
Perbandingan atom dan molekul dengan massa atom karbon dilakukan pada tahun 1961. Alasan utama pilihan ini adalah karena karbon ditemukan dalam sejumlah besar senyawa kimia yang berbeda. Pengganda diperkenalkan sehingga massa relatif atom mendekati bilangan bulat.
Massa molar air:
Jika molekul-molekul dalam suatu cairan tersusun rapat dan masing-masing molekul tersebut masuk ke dalam kubus yang bervolume V 1 dengan tulang rusuk D, Itu .
Volume satu molekul: ,dimana: Vm satu doa, tidak ada- Nomor Avogadro.
Volume satu mol cairan: , dimana: M- massa molarnya adalah kepadatannya.
Diameter Molekul:
Menghitung, kita punya: 
Berat molekul relatif aluminium Mr=27. Tentukan karakteristik molekul utamanya.
1. Massa molar aluminium: M=Mr. 10 -3 M = 27 . 10 -3
Temukan konsentrasi molekul helium (M = 4,10 -3 kg/mol) dalam kondisi normal (p = 10 5 Pa, T = 273 K), kecepatan akar rata-rata kuadratnya, dan kepadatan gas.Dari kedalaman berapa gelembung udara muncul di badan air jika volumenya menjadi dua kali lipat? Kita tidak tahu apakah suhu udara di dalam gelembung tetap sama. Jika sama, maka proses pendakian dijelaskan dengan persamaan pV=konstan . Jika berubah, maka persamaannya.
pV/T=konstan
Mari kita evaluasi apakah kita melakukan kesalahan besar jika mengabaikan perubahan suhu. Misalkan kita mendapatkan hasil yang paling tidak menguntungkan. Misalkan cuaca sangat panas dan suhu air di permukaan waduk mencapai +25 0 C (298 K). Di bagian bawah, suhu tidak boleh lebih rendah dari +4 0 C (277 K), karena suhu ini sesuai dengan kepadatan maksimum air. Jadi, perbedaan suhunya adalah 21K. Sehubungan dengan suhu awal, nilai ini adalah %%. Kecil kemungkinan kita akan menemukan perairan seperti itu, yang perbedaan suhu antara permukaan dan dasarnya sama dengan nilai yang disebutkan. Selain itu, gelembung tersebut mengapung cukup cepat dan kecil kemungkinannya akan memiliki waktu untuk melakukan pemanasan penuh selama pendakian. Dengan demikian, kesalahan sebenarnya akan jauh lebih kecil dan kita dapat mengabaikan perubahan suhu udara di dalam gelembung dan menggunakan hukum Boyle-Mariotte untuk menjelaskan prosesnya:, hal 1 V 1 =p 2 V 2 Di mana: hal 1 - tekanan udara dalam gelembung pada kedalaman h (p 1 = p atm. + rgh), hal 2 - tekanan udara dalam gelembung dekat permukaan.
 |
p 2 = p atm.
|
Gelas yang terbalik dicelupkan ke dalam kolam. Pada kedalaman berapa kaca akan mulai tenggelam?
Udara tersumbat di dalam gelas yang terbalik. Masalahnya menyatakan bahwa kaca mulai tenggelam hanya pada kedalaman tertentu. Rupanya, jika dilepaskan pada kedalaman kurang dari kedalaman kritis tertentu, ia akan mengapung (dengan asumsi kaca diposisikan vertikal dan tidak terbalik).
Tingkat di mana kaca mengapung dan di bawahnya tenggelam, dicirikan oleh kesetaraan gaya yang diterapkan pada kaca dari sisi yang berbeda.
Gaya-gaya yang bekerja pada kaca dalam arah vertikal adalah gaya gravitasi ke bawah dan gaya apung ke atas.
Gaya gravitasi yang bekerja pada kaca berbanding lurus dengan massanya.
Berdasarkan konteks soal, ketika kaca tenggelam, gaya ke atas berkurang. Penurunan gaya apung hanya dapat terjadi karena penurunan volume zat cair yang dipindahkan, karena zat cair praktis tidak dapat dimampatkan dan massa jenis air di permukaan dan pada kedalaman tertentu adalah sama.
Penurunan volume cairan yang dipindahkan dapat terjadi karena adanya kompresi udara di dalam kaca, yang selanjutnya dapat terjadi karena peningkatan tekanan. Perubahan suhu saat kaca direndam dapat diabaikan jika kita tidak tertarik pada keakuratan hasil yang terlalu tinggi. Pembenaran terkait diberikan pada contoh sebelumnya.
Hubungan antara tekanan gas dan volumenya pada suhu konstan dinyatakan dengan hukum Boyle-Mariotte.
Tekanan fluida sebenarnya meningkat seiring dengan kedalaman dan diteruskan ke segala arah, termasuk ke atas, secara merata.
Tekanan hidrostatis berbanding lurus dengan massa jenis zat cair dan tingginya (kedalaman perendaman).
Setelah menuliskan persamaan awal yang mencirikan keadaan kesetimbangan kaca, secara berurutan mensubstitusikan ke dalamnya ekspresi yang ditemukan selama analisis masalah dan menyelesaikan persamaan yang dihasilkan untuk kedalaman yang diinginkan, kami sampai pada kesimpulan bahwa untuk untuk mendapatkan jawaban numerik kita perlu mengetahui nilai massa jenis air, tekanan atmosfer, massa kaca, volumenya dan percepatan jatuh bebas.
Seluruh argumentasi yang dikemukakan dapat ditampilkan sebagai berikut:
![]()
![]()

Karena tidak ada data di teks soal, kami akan mengaturnya sendiri.
Diberikan:
Massa jenis air r=10 3 kg/m 3.
Tekanan atmosfer 10 5 Pa.
Volume gelas 200 ml = 2 00. 10 -3 aku = 2. 10 -4 m3.
Massa gelas tersebut adalah 50 g = 5. 10 -2kg.
Percepatan gravitasi g = 10 m/s 2.
Solusi numerik:

|
Masalah naiknya balon, seperti halnya masalah kaca yang tenggelam, dapat digolongkan sebagai masalah statis.
Bola akan mulai naik dengan cara yang sama seperti kaca tenggelam, segera setelah kesetaraan gaya yang diterapkan pada benda-benda ini dan diarahkan ke atas dan ke bawah terganggu. Bola, seperti halnya kaca, dipengaruhi oleh gaya gravitasi yang diarahkan ke bawah dan gaya apung yang diarahkan ke atas.
Gaya apung berhubungan dengan kepadatan udara dingin yang mengelilingi bola. Massa jenis ini dapat dicari dari persamaan Mendeleev-Clapeyron.
Gaya gravitasi berbanding lurus dengan massa bola. Massa bola, pada gilirannya, terdiri dari massa cangkang dan massa udara panas di dalamnya. Massa udara panas juga dapat dicari dari persamaan Mendeleev-Clapeyron.
Secara skematis, alasannya dapat ditampilkan sebagai berikut:
![]()

Dari persamaan tersebut, Anda dapat menyatakan besaran yang diinginkan, memperkirakan kemungkinan nilai besaran yang diperlukan untuk memperoleh solusi numerik dari masalah tersebut, mensubstitusikan besaran tersebut ke dalam persamaan yang dihasilkan dan menemukan jawabannya dalam bentuk numerik.
Sebuah bejana tertutup berisi 200 g helium. Gas mengalami proses yang kompleks. Perubahan parameternya tercermin dalam grafik ketergantungan volume pada suhu absolut.1. Nyatakan massa gas dalam SI.
2. Berapa massa molekul relatif gas ini?
3. Berapa massa molar gas tersebut (dalam SI)?
4. Berapa jumlah zat yang terkandung dalam bejana tersebut?
5. Berapa jumlah molekul gas yang ada di dalam bejana?
6. Berapa massa satu molekul gas tersebut?
7. Sebutkan proses pada bagian 1-2, 2-3, 3-1.
8. Tentukan volume gas di titik 1,2, 3, 4 dalam ml, l, m 3.
9. Tentukan suhu gas di titik 1,2, 3, 4 pada 0 C, K.
10. Tentukan tekanan gas pada titik 1, 2, 3, 4 in mm. rt. Seni. , atm, Pa.
11. Gambarkan proses ini pada grafik tekanan versus suhu absolut.
12. Gambarkan proses ini pada grafik tekanan versus volume.
Petunjuk untuk solusi:
1. Lihat kondisinya.
2. Berat molekul relatif suatu unsur ditentukan dengan menggunakan tabel periodik.
3. M = Tuan·10 -3kg/mol.
7. P=const - isobarik; V=const-isokhorik; T=const - isotermal.
8. 1 m 3 = 10 3 liter; 1 liter = 10 3 ml. 9. T=t+ 273. 10. 1 atm. = 10 5 Pa = 760 mm Hg. Seni.
8-10. Anda dapat menggunakan persamaan Mendeleev-Clapeyron, atau hukum gas Boyle-Mariotte, Gay-Lussac, Charles.
Jawaban atas masalahnya
| m = 0,2kg | |||||||
| Tuan = 4 | |||||||
| M = 4 · 10 -3 kg/mol | |||||||
| n = 50 mol | |||||||
| N = 3 10 25 | |||||||
| m =6,7 · 10 -27 kg | |||||||
| 1 - 2 - isobarik | |||||||
| 2 - 3 - isokhorik | |||||||
| 3 - 1 - isotermal | |||||||
| № | ml | aku | m 3 | ||||
| 2 10 5 | 0,2 | ||||||
| 7 10 5 | 0,7 | ||||||
| 7 10 5 | 0,7 | ||||||
| 4 10 5 | 0,4 | ||||||
| № | 0 C | KE | |||||
| № | mmHg | ATM | Pa | ||||
| 7.6 10 3 | 10 6 | ||||||
| 7.6 10 3 | 10 6 | ||||||
| 2.28 10 3 | 0,3 10 6 | ||||||
| 3,8 10 3 | 0,5 10 6 | ||||||
 |
 |
||||||

 ,
, ,
,






