Radyoaktivite olgusu, 1896 yılında uranyum tuzlarından bilinmeyen radyasyonun kendiliğinden yayılmasını gözlemleyen A. Becquerel tarafından keşfedildi. Kısa süre sonra E. Rutherford ve Curies, radyoaktif bozunma sırasında He çekirdeklerinin (α-parçacıkları), elektronların (β-parçacıkları) ve sert elektromanyetik radyasyonun (γ-ışınları) yayıldığını tespit etti.
1934'te pozitron emisyonuyla bozunma (β + -bozunma) keşfedildi ve 1940'ta yeni bir tür radyoaktivite keşfedildi - çekirdeğin kendiliğinden bölünmesi: bölünen bir çekirdek, eşzamanlı emisyonla karşılaştırılabilir kütlenin iki parçasına ayrılır nötronlardan oluşan ve γ -kuanta. Çekirdeklerin proton radyoaktivitesi 1982'de gözlemlendi. Dolayısıyla aşağıdaki radyoaktif bozunma türleri vardır: α-bozunması; -çürümek; - çürümek; e - yakalama.
Radyoaktivite- bazı atom çekirdeklerinin parçacıkların emisyonu ile kendiliğinden (kendiliğinden) başka çekirdeklere dönüşme yeteneği.
Atom çekirdeği şunlardan oluşur: protonlar ve nötronlar genel bir adı olan - nükleonlar.Çekirdekteki protonların sayısı atomun kimyasal özelliklerini belirler ve belirlenir. Z(ürün seri numarası). Nükleon sayısıçekirdekte denir kütle numarası ve belirtmek A. Aynı seri numarasına sahip çekirdekler ve farklı kütle sayıları denir izotoplar. Bir kimyasal elementin tüm izotopları aynı kimyasal özelliklere sahiptir, ancak fiziksel özellikler büyük ölçüde değişebilir. İzotopları belirtmek için iki indeksli bir kimyasal elementin sembolünü kullanın: A'dan Z'ye. Alt indeks seri numarası, üst indeks ise kütle numarasıdır. Genellikle alt simge, öğenin sembolünün kendisi tarafından belirtildiği için atlanır.
Mesela 14 6 C yerine 14 C yazıyorlar.
Bir çekirdeğin bozunma yeteneği onun bileşimine bağlıdır. Aynı element hem kararlı hem de radyoaktif izotoplara sahip olabilir.
Örneğin, karbon izotopu 12C stabildir, ancak izotop 14C radyoaktiftir.
Radyoaktif bozunma istatistiksel bir olgudur. Bir izotopun bozunma yeteneği, bozunma sabiti ile karakterize edilir. λ.
Bozunma sabiti λ, belirli bir izotopun çekirdeğinin birim zamanda bozunma olasılığıdır.
t zamanındaki radyoaktif bozunum çekirdeklerinin sayısını N, dN 1 - dt zamanında bozunan çekirdeklerin sayısını gösterelim. Maddedeki çekirdek sayısı çok fazla olduğundan büyük sayılar kanunu karşılanmıştır. Kısa sürede nükleer bozunma olasılığı dP = λdt formülüyle bulunur. Frekans, olasılığa eşittir: d N 1 / N = dP = λdt. d N 1 / N = λdt- çürüyen çekirdeklerin sayısını belirleyen bir formül.
Denklemin çözümü: , - formüle radyoaktif bozunma yasası denir: Üstel yasaya göre radyoaktif çekirdeklerin sayısı zamanla azalır.
Burada N, t zamanındaki bozulmamış çekirdeklerin sayısıdır; Hayır - çürümemiş çekirdeklerin başlangıç sayısı; λ radyoaktif bozunma sabitidir.
Pratikte kullanılan bozunum sabiti değildir. λ ve çağrılan miktar yarı ömür T.
Yarı ömür (T), radyoaktif çekirdeklerin yarısının bozunduğu süredir.
Dönem boyunca radyoaktif bozunma yasası yarılanma ömrü (T) şu şekildedir:
![]()
Yarı ömür ile bozunma sabiti arasındaki ilişki şu formülle verilir: T = ln(2/λ) = 0,69/λ
Yarılanma ömrü çok uzun ya da çok kısa olabilir.
Radyoaktif bir izotopun aktivite derecesini değerlendirmek için aktivite adı verilen bir miktar kullanılır.
Birim zamanda bozunan radyoaktif ilacın çekirdeklerinin aktivite sayısı: A = dN bozunum /dt
SI aktivite birimi 1 bekerel (Bq) = 1 parçalanma/s'dir - 1 saniyede 1 parçalanmanın meydana geldiği bir ilacın aktivitesi. Daha büyük bir aktivite birimi 1 rutherford (Rd) = Bq'dur. Genellikle sistem dışı bir aktivite birimi kullanılır - 1 g radyumun aktivitesine eşit olan curie (Ci): 1 Ci = 3,7 Bq.
Zamanla aktivite, radyonüklidin kendisinin bozunmasına göre aynı üstel yasaya göre azalır:
![]() =
.
=
.
Pratikte, aktiviteyi hesaplamak için formül kullanılır:
bir = = λN = 0,693 N/T.
Atom sayısını kütle ve kütle cinsinden ifade edersek aktivite hesaplama formülü şu şekilde olacaktır: A = = 0,693 (μT)
Avogadro sayısı nerede; μ - molar kütle.
Çekirdeklerin radyoaktif bozunma yasaları
Çekirdeklerin kendiliğinden bozunma ve parçacık yayma yeteneğine radyoaktivite denir. Radyoaktif bozunma istatistiksel bir süreçtir. Her radyoaktif çekirdek herhangi bir anda bozunabilir ve desen, yeterince fazla sayıda çekirdeğin bozunması durumunda yalnızca ortalama olarak gözlemlenir.
Çürüme sabitiλ birim zaman başına nükleer bozunma olasılığıdır.
Eğer örnekte t zamanında N radyoaktif çekirdek varsa, o zaman dt zamanında bozunan dN çekirdeklerinin sayısı N ile orantılıdır.
dN = -λNdt. (13.1)
(1)’i entegre ederek radyoaktif bozunma yasasını elde ederiz
N(t) = N 0 e -λt . (13.2)
N 0, t = 0 anındaki radyoaktif çekirdeklerin sayısıdır.
Ortalama yaşam süresi τ –
. (13.3)
Yarı ömür T 1/2 - başlangıçtaki radyoaktif çekirdek sayısının yarı yarıya azalacağı süre
T 1/2 = ln2/λ=0,693/λ = τln2. (13.4)
Etkinlik A - birim zamanda bozunan ortalama çekirdek sayısı
A(t) = λN(t). (13.5)
Aktivite, curies (Ci) ve becquerels (Bq) cinsinden ölçülür.
1 Ki = 3,7*10 10 bozunum/s, 1 Bq = 1 bozunum/s.
Orijinal çekirdeğin (1) çekirdeğe (2) bozunması ve ardından çekirdeğe (3) bozunması, bir diferansiyel denklem sistemi ile tanımlanır.
 (13.6)
(13.6)
burada N 1 (t) ve N 2 (t) çekirdek sayısıdır ve λ 1 ve λ 2 sırasıyla çekirdek 1 ve 2'nin bozunum sabitleridir. Başlangıç koşulları N1(0) = N10 olan sistem (6)'nın çözümü; N 2(0) = 0 olacak
![]() , (13.7a)
, (13.7a)
![]() . (13.7b)
. (13.7b)

| Şekil 13.1 |
Çekirdek sayısı 2 maksimum değere ulaşıyor
Eğer λ2< λ 1 (), суммарная активностьN 1 (t)λ 1 + N 2 (t)λ 2 будет монотонно уменьшаться.
Eğer λ 2 >λ 1 () ise, çekirdek 2'nin birikmesi nedeniyle başlangıçta toplam aktivite artar.
Eğer λ 2 >> λ 1 ise, yeterince uzun zamanlarda (7b)'deki ikinci üstelin katkısı, birincinin katkısı ve ikinci A 2 = λ 2 N 2 ve birinci izotop A 1'in aktiviteleriyle karşılaştırıldığında ihmal edilebilir hale gelir. = λ 1 N 1 neredeyse eşittir. Gelecekte hem birinci hem de ikinci izotopların aktiviteleri zamanla aynı şekilde değişecektir.
bir 1 (t) = N 10 λ 1 = N 1 (t)λ 1 = A 2 (t) = N 2 (t)λ 2 .(13.8)
Yani sözde asırlık denge bozunma zincirindeki izotop çekirdeklerinin sayısı, basit bir ilişkiyle bozunma sabitleri (yarı ömürler) ile ilişkilidir.
 . (13.9)
. (13.9)
Bu nedenle doğal durumda radyoaktif serilerde genetik olarak ilişkili tüm izotoplar genellikle yarı ömürlerine bağlı olarak belirli niceliksel oranlarda bulunur.
Genel durumda, 1→2→...n bozunma zinciri olduğunda, süreç bir diferansiyel denklem sistemiyle tanımlanır.
dN i /dt = -λ ben N ben +λ i-1 N ben-1 .(13.10)
Başlangıç koşulları N1(0) = N10 olan aktiviteler için sistem (10)'un çözümü; N ben (0) = 0 olacak
![]() (13.12)
(13.12)
Asal, paydadaki çarpımda i = m olan faktörün atlandığı anlamına gelir.
İzotoplar
İZOTOPLAR– aynı kimyasal elementin fizikokimyasal özellikleri benzer ancak farklı atom kütlelerine sahip çeşitleri. "İzotoplar" adı, 1912'de İngiliz radyokimyacı Frederick Soddy tarafından iki Yunanca kelimeden oluşturuldu: isos - özdeş ve topos - yer. İzotoplar, Mendeleev'in periyodik element tablosu hücresinde aynı yeri işgal eder.
Herhangi bir kimyasal elementin atomu, pozitif yüklü bir çekirdek ve onu çevreleyen negatif yüklü elektronlardan oluşan bir buluttan oluşur ( santimetre.Ayrıca ATOM ÇEKİRDEĞİ). Mendeleev'in periyodik tablosundaki bir kimyasal elementin konumu (atom numarası), atom çekirdeğinin yükü ile belirlenir. Bu nedenle izotoplara, atomları aynı nükleer yüke (ve dolayısıyla pratik olarak aynı elektron kabuklarına) sahip olan, ancak nükleer kütle değerleri farklı olan aynı kimyasal elementin çeşitleri denir. F. Soddy'nin mecazi ifadesine göre izotopların atomları "dışarıda" aynı, "içeride" farklıdır.
Nötron 1932'de keşfedildi – kütlesi hidrojen atomunun çekirdeğinin (proton) kütlesine yakın olan, yüksüz bir parçacık , ve çekirdeğin proton-nötron modeli oluşturuldu. Sonuç olarak bilim, izotop kavramının son modern tanımını oluşturdu: izotoplar, atom çekirdekleri aynı sayıda protondan oluşan ve yalnızca nötron sayısında farklılık gösteren maddelerdir. çekirdek . Her izotop genellikle bir dizi sembolle gösterilir; burada X, kimyasal elementin sembolüdür, Z, atom çekirdeğinin yüküdür (proton sayısı), A, izotopun kütle numarasıdır (toplam nükleon sayısı). - çekirdekteki protonlar ve nötronlar, A = Z + N). Çekirdeğin yükü, kimyasal elementin sembolüyle benzersiz bir şekilde ilişkili göründüğünden, kısaltma için genellikle AX gösterimi kullanılır.
Bildiğimiz tüm izotoplardan yalnızca hidrojen izotoplarının kendi isimleri vardır. Bu nedenle, 2H ve 3H izotoplarına döteryum ve trityum adı verilir ve sırasıyla D ve T olarak gösterilir (1H izotopuna bazen protium da denir).
Doğada kararlı izotoplar halinde bulunur , ve kararsız - radyoaktif, atom çekirdekleri, çeşitli parçacıkların emisyonu (veya radyoaktif bozunma adı verilen süreçler) ile kendiliğinden diğer çekirdeklere dönüşmeye maruz kalır. Şu anda yaklaşık 270 kararlı izotop bilinmektedir ve kararlı izotoplar yalnızca atom numarası ZЈ 83 olan elementlerde bulunur. Kararsız izotopların sayısı 2000'i aşıyor, bunların büyük çoğunluğu çeşitli nükleer reaksiyonların bir sonucu olarak yapay olarak elde edildi. Birçok elementin radyoaktif izotoplarının sayısı çok fazladır ve iki düzineyi aşabilir. Kararlı izotopların sayısı önemli ölçüde daha azdır. Bazı kimyasal elementler yalnızca bir kararlı izotoptan oluşur (berilyum, flor, sodyum, alüminyum, fosfor, manganez, altın ve bir dizi başka element). En fazla kararlı izotop sayısı - 10 - kalayda bulundu, örneğin demirde 4 ve cıvada - 7 var.
İzotopların keşfi, tarihsel arka plan. 1808'de İngiliz bilim adamı doğa bilimci John Dalton, kimyasal elementin tanımını ilk kez aynı türden atomlardan oluşan bir madde olarak tanıttı. 1869'da kimyager D.I. Mendeleev kimyasal elementlerin periyodik yasasını keşfetti. Periyodik tablonun bir hücresinde belirli bir yeri işgal eden bir madde olarak element kavramını doğrulamanın zorluklarından biri, elementlerin deneysel olarak gözlemlenen tamsayı olmayan atom ağırlıklarıydı. 1866'da İngiliz fizikçi ve kimyager Sir William Crookes, her doğal kimyasal elementin özellikleri bakımından aynı olan ancak farklı atom kütlelerine sahip maddelerin belirli bir karışımı olduğu hipotezini öne sürdü, ancak o zamanlar böyle bir varsayım henüz yoktu. deneysel onay ve bu nedenle uzun süre fark edilmedi.
İzotopların keşfine yönelik önemli bir adım, radyoaktivite olgusunun ve Ernst Rutherford ve Frederick Soddy tarafından formüle edilen radyoaktif bozunma hipotezinin keşfiydi: radyoaktivite, bir atomun yüklü bir parçacığa ve başka bir elementin atomuna bozunmasından başka bir şey değildir. kimyasal özellikleri bakımından orijinalinden farklıdır. Sonuç olarak radyoaktif seriler veya radyoaktif aileler fikri ortaya çıktı. , başında radyoaktif olan ilk ana element ve sonunda son kararlı element bulunur. Dönüşüm zincirlerinin analizi, seyirleri sırasında, yalnızca atom kütleleri farklı olan aynı radyoaktif elementlerin periyodik sistemin bir hücresinde görünebileceğini gösterdi. Aslında bu, izotop kavramının ortaya çıkışı anlamına geliyordu.
Kimyasal elementlerin kararlı izotoplarının varlığının bağımsız olarak doğrulanması, J. J. Thomson ve Aston'un 1912-1920'de pozitif yüklü parçacık ışınları (veya kanal ışınları olarak adlandırılan) ile yaptığı deneylerde elde edildi. ) boşaltma borusundan çıkıyor.
1919'da Aston, kütle spektrografı (veya kütle spektrometresi) adı verilen bir alet tasarladı. . İyon kaynağı hala bir deşarj tüpü kullanıyordu, ancak Aston, bir parçacık ışınının elektrik ve manyetik alanlarda art arda saptırılmasının, aynı yük-kütle oranına sahip parçacıkların (hızlarından bağımsız olarak) odaklanmasına yol açtığı bir yol buldu. ekranda aynı nokta. Aston'la birlikte, aynı yıllarda Amerikan Dempster tarafından biraz farklı bir tasarıma sahip bir kütle spektrometresi yaratıldı. Daha sonra kütle spektrometrelerinin birçok araştırmacının çabalarıyla kullanılması ve geliştirilmesinin bir sonucu olarak, 1935 yılına kadar o zamana kadar bilinen tüm kimyasal elementlerin izotopik bileşimlerinin neredeyse eksiksiz bir tablosu derlendi.
İzotop ayırma yöntemleri.İzotopların özelliklerini incelemek ve özellikle bilimsel ve uygulamalı amaçlarla kullanımlarını sağlamak için, bunların az çok fark edilebilir miktarlarda elde edilmesi gerekir. Geleneksel kütle spektrometrelerinde izotopların neredeyse tamamen ayrılması sağlanır, ancak bunların miktarı ihmal edilebilecek kadar küçüktür. Bu nedenle bilim adamlarının ve mühendislerin çabaları, izotopları ayırmaya yönelik diğer olası yöntemleri araştırmayı amaçlıyordu. Her şeyden önce, aynı elementin izotoplarının buharlaşma oranları, denge sabitleri, kimyasal reaksiyon hızları vb. gibi özelliklerindeki farklılıklara dayanarak fizikokimyasal ayırma yöntemleri konusunda uzmanlaştı. Bunlar arasında en etkili olanı, hafif elementlerin izotoplarının endüstriyel üretiminde yaygın olarak kullanılan düzeltme ve izotop değişimi yöntemleriydi: hidrojen, lityum, bor, karbon, oksijen ve nitrojen.
Başka bir yöntem grubu, sözde moleküler kinetik yöntemlerden oluşur: gaz difüzyonu, termal difüzyon, kütle difüzyonu (buhar akışında difüzyon), santrifüjleme. Yüksek oranda dağılmış gözenekli ortamda izotopik bileşenlerin farklı difüzyon hızlarına dayanan gaz difüzyon yöntemleri, İkinci Dünya Savaşı sırasında Manhattan Projesi olarak adlandırılan Manhattan Projesi'nin bir parçası olarak Amerika Birleşik Devletleri'nde uranyum izotop ayrıştırmasının endüstriyel üretimini organize etmek için kullanıldı. atom bombası. Atom bombasının ana “yanıcı” bileşeni olan hafif izotop 235 U ile% 90'a kadar zenginleştirilmiş gerekli miktarda uranyum elde etmek için yaklaşık dört bin hektarlık bir alanı kaplayan tesisler inşa edildi. Zenginleştirilmiş uranyum üretimi için tesislerin bulunduğu bir atom merkezinin oluşturulması için 2 milyar dolardan fazla para ayrıldı. Savaştan sonra, yine difüzyon ayırma yöntemine dayalı olarak askeri amaçlarla zenginleştirilmiş uranyum üretimine yönelik tesisler geliştirildi ve SSCB'de inşa edildi. Son yıllarda bu yöntem yerini daha verimli ve daha ucuz olan santrifüjleme yöntemine bırakmıştır. Bu yöntemde, bir izotop karışımını ayırma etkisi, merkezkaç kuvvetlerinin, üstten ve alttan sınırlı ince duvarlı bir silindir olan ve belirli bir açıda dönen santrifüj rotorunu dolduran izotop karışımının bileşenleri üzerindeki farklı etkileri nedeniyle elde edilir. vakum odasında çok yüksek hız. Her birinin rotoru saniyede binden fazla devir yapan, kaskadlar halinde bağlanan yüzbinlerce santrifüj, günümüzde hem Rusya'da hem de dünyanın diğer gelişmiş ülkelerinde modern ayırma tesislerinde kullanılmaktadır. Santrifüjler yalnızca nükleer santrallerin nükleer reaktörlerine güç sağlamak için gerekli olan zenginleştirilmiş uranyumu üretmek için değil, aynı zamanda periyodik tablonun orta kısmında yer alan yaklaşık otuz kimyasal elementin izotoplarını üretmek için de kullanılır. Çeşitli izotopların ayrılmasında güçlü iyon kaynaklarına sahip elektromanyetik ayırma üniteleri de kullanılmakta olup, son yıllarda lazer ayırma yöntemleri de yaygınlaşmaktadır.
İzotopların uygulanması. Kimyasal elementlerin çeşitli izotopları bilimsel araştırmalarda, sanayi ve tarımın çeşitli alanlarında, nükleer enerjide, modern biyoloji ve tıpta, çevre çalışmalarında ve diğer alanlarda yaygın olarak kullanılmaktadır. Bilimsel araştırmalarda (örneğin, kimyasal analizde), kural olarak, yılda gram ve hatta miligram cinsinden hesaplanan, çeşitli elementlerin az miktarda nadir izotoplarına ihtiyaç vardır. Aynı zamanda nükleer enerji, tıp ve diğer endüstrilerde yaygın olarak kullanılan bir dizi izotop için bunların üretimine duyulan ihtiyaç kilogramlara ve hatta tonlara ulaşabilmektedir. Bu nedenle, nükleer reaktörlerde ağır su D2O kullanılması nedeniyle, geçen yüzyılın 1990'lı yıllarının başlarında küresel üretimi yılda yaklaşık 5000 tondu. Bilim adamlarına göre, termonükleer enerji yakıtının ana bileşeni olan, ağır suyun bir parçası olan hidrojen izotop döteryum, doğal hidrojen karışımındaki konsantrasyonu trityum ile birlikte yalnızca% 0,015'tir. nükleer füzyon reaksiyonları temelinde çalışan reaktörler. Bu durumda hidrojen izotoplarının üretimine olan ihtiyaç çok büyük olacaktır.
Bilimsel araştırmalarda, doğada meydana gelen çok çeşitli süreçlerin incelenmesinde kararlı ve radyoaktif izotoplar izotop göstergeleri (etiketler) olarak yaygın şekilde kullanılmaktadır.
Tarımda izotoplar (“etiketli” atomlar) örneğin fotosentez süreçlerini, gübrelerin sindirilebilirliğini incelemek ve bitkilerin nitrojen, fosfor, potasyum, eser elementler ve diğer maddeleri kullanma verimliliğini belirlemek için kullanılır. .
İzotop teknolojileri tıpta yaygın olarak kullanılmaktadır. Böylece ABD'de istatistiklere göre günde 36 binden fazla tıbbi işlem yapılıyor ve izotoplar kullanılarak yaklaşık 100 milyon laboratuvar testi yapılıyor. En yaygın prosedürler bilgisayarlı tomografiyi içerir. %99'a kadar zenginleştirilmiş (doğal içerik yaklaşık %1) karbon izotop C13, "diagnostik solunum kontrolü" olarak adlandırılan yöntemde aktif olarak kullanılmaktadır. Testin özü çok basittir. Zenginleştirilmiş izotop hastanın yemeğine verilir ve vücudun çeşitli organlarındaki metabolik sürece katıldıktan sonra, hasta tarafından solunan ve bir spektrometre kullanılarak toplanan ve analiz edilen karbondioksit (CO2) şeklinde salınır. C 13 izotopu ile işaretlenmiş farklı miktarlarda karbondioksitin salınımıyla ilişkili süreçlerin oranlarındaki farklılıklar, hastanın çeşitli organlarının durumunu değerlendirmeyi mümkün kılar. ABD'de bu testi yaptıracak hasta sayısının yılda 5 milyon olduğu tahmin ediliyor. Artık endüstriyel ölçekte oldukça zenginleştirilmiş C13 izotopu üretmek için lazer ayırma yöntemleri kullanılıyor.
İlgili bilgiler.
Ders 2. Radyoaktif bozunmanın temel yasası ve radyonüklidlerin aktivitesi
Radyonüklidlerin bozunma hızı farklıdır; bazıları daha hızlı bozunur, diğerleri daha yavaş. Radyoaktif bozunma hızının bir göstergesi radyoaktif bozunma sabiti, λ [saniye-1], bir atomun bir saniyede bozunma olasılığını karakterize eder. Her radyonüklit için bozunma sabitinin kendi değeri vardır; ne kadar büyük olursa maddenin çekirdeği o kadar hızlı bozunur.
Bir radyoaktif örnekte birim zamanda kaydedilen bozunma sayısına ne ad verilir? aktivite (A ) veya numunenin radyoaktivitesi. Aktivite değeri atom sayısıyla doğru orantılıdır N radyoaktif madde:
A =λ· N , (3.2.1)
Nerede λ – radyoaktif bozunma sabiti, [sn-1].
Şu anda, mevcut Uluslararası Birimler Sistemi SI'ya göre, radyoaktivite ölçüm birimi Bequerel [Bk] Bu birim, adını 1856 yılında uranyumun doğal radyoaktivitesi olgusunu keşfeden Fransız bilim adamı Henri Becquerel'in onuruna almıştır. Bir becquerel saniyede bir bozunmaya eşittir 1 Bk = 1 .
Bununla birlikte, sistem dışı faaliyet birimi hala sıklıkla kullanılmaktadır. – Curie [Ki], Curie'ler tarafından bir gram radyumun bozunma oranının bir ölçüsü olarak tanıtıldı (saniyede ~3,7 1010 bozunum meydana gelir), bu nedenle
1 Ki= 3,7·1010 Bk.
Bu ünite büyük miktarlarda radyonüklitlerin aktivitesinin değerlendirilmesi için uygundur.
Bozunmanın bir sonucu olarak zamanla radyonüklid konsantrasyonundaki azalma, üstel bir ilişkiye uyar:
 , (3.2.2)
, (3.2.2)
Nerede N T– radyoaktif bir elementin belirli bir süre sonunda kalan atom sayısı T gözlemin başlamasından sonra; N 0 – zamanın ilk anındaki atom sayısı ( T =0 ); λ – radyoaktif bozunma sabiti.
Açıklanan bağımlılığa denir radyoaktif bozunmanın temel yasası .
Radyonüklitlerin toplam miktarının yarısının bozunduğu süreye ne ad verilir? yarı ömür T½ . Bir yarılanma ömründen sonra 100 radyonüklid atomundan yalnızca 50'si kalır (Şekil 2.1). Bir sonraki benzer dönemde bu 50 atomdan yalnızca 25'i kalır ve bu böyle devam eder.
Yarı ömür ile bozunma sabiti arasındaki ilişki, radyoaktif bozunmanın temel yasasının denkleminden türetilir:
en T=T½ Ve
alıyoruz https://pandia.ru/text/80/150/images/image006_47.gif" width = "67" height = "41 src = "> Ş ;
https://pandia.ru/text/80/150/images/image009_37.gif" width="76" height="21">;
yani.e..gif" width="81" height="41 src=">.
Bu nedenle radyoaktif bozunma yasası şu şekilde yazılabilir:
https://pandia.ru/text/80/150/images/image013_21.gif" width = "89" height = "39 src = ">, (3.2.4)
Nerede en – zamanla ilaç aktivitesi T ; A0 - ilk gözlem anında ilacın aktivitesi.
Herhangi bir radyoaktif maddenin belirli bir miktarının aktivitesinin belirlenmesi sıklıkla gereklidir.
Bir maddenin miktar biriminin mol olduğunu unutmayın. Bir mol, 0,012 kg = 12 g karbon izotopu 12C'de bulunan atom sayısıyla aynı sayıda atom içeren madde miktarıdır.
Herhangi bir maddenin bir molü Avogadro sayısını içerir N.A. atomlar:
N.A. = 6,02·1023 atom.
Basit maddeler (elementler) için bir molün kütlesi sayısal olarak atom kütlesine karşılık gelir. A eleman
1mol = A G.
Örneğin: Magnezyum için: 1 mol 24Mg = 24 g.
226Ra için: 1 mol 226Ra = 226 g, vb.
Söylenenleri dikkate alarak M maddenin gramı olacak N atomlar:
https://pandia.ru/text/80/150/images/image015_20.gif" width = "156" height = "43 src = "> (3.2.6)
Örnek: 1 gram 226Ra'nın aktivitesini hesaplayalım. λ = 1,38·10-11 sn-1.
A= 1,38·10-11·1/226·6,02·1023 = 3,66·1010 Bq.
Radyoaktif bir element kimyasal bir bileşiğin parçasıysa, ilacın aktivitesini belirlerken formülünü dikkate almak gerekir. Maddenin bileşimi dikkate alınarak kütle fraksiyonu belirlenir χ bir maddedeki radyonüklid, şu oranla belirlenir:
https://pandia.ru/text/80/150/images/image017_17.gif" genişlik = "118" yükseklik = "41 src = ">
Sorun çözümü örneği
Durum:
Etkinlik A0 gözlem günü başına radyoaktif element 32P 1000'dir Bk. Bir hafta sonra bu elementin aktivitesini ve atom sayısını belirleyin. Yarı ömür T½ 32P = 14,3 gün.
Çözüm:
a) Fosfor-32'nin 7 gün sonraki aktivitesini bulalım:
https://pandia.ru/text/80/150/images/image019_16.gif" genişlik = "57" yükseklik = "41 src = ">
Cevap: bir hafta sonra 32P ilacının aktivitesi 712 olacak Bk, ve radyoaktif izotop 32P'nin atom sayısı 127,14·106 atomdur.
Güvenlik soruları
1) Bir radyonüklidin aktivitesi nedir?
2) Radyoaktivite birimlerini ve aralarındaki ilişkiyi adlandırın.
3) Radyoaktif bozunma sabiti nedir?
4) Radyoaktif bozunmanın temel yasasını tanımlar.
5) Yarı ömür nedir?
6) Bir radyonüklidin aktivitesi ile kütlesi arasındaki ilişki nedir? Formülü yazın.
Görevler
1. Etkinlik 1'i hesaplayın G 226Ra. T½ = 1602 yıl.
2. Etkinlik 1'i hesaplayın G 60Co. T½ = 5,3 yıl.
3. Bir M-47 tank mermisi 4,3 içerir kilogram 238U. Т½ = 2,5·109 yıl. Merminin aktivitesini belirleyin.
4. İlk gözlem anında 1000'e eşitse, 137C'lerin 10 yıl sonraki aktivitesini hesaplayın. Bk. T½ = 30 yıl.
5. Şu anda 500'e eşitse, 90Sr'nin bir yıl önceki aktivitesini hesaplayın Bk. T½ = 29 yıl.
6. Ne tür bir etkinlik yaratacağım? kilogram radyoizotop 131I, T½ = 8,1 gün?
7. Referans verilerini kullanarak aktivite 1'i belirleyin G 238U. Т½ = 2,5·109 yıl.
Referans verilerini kullanarak aktivite 1'i belirleyin G 232Th, Т½ = 1,4·1010 yıl.
8. 239Pu316O8 bileşiğinin aktivitesini hesaplayın.
9. Aktivitesi 1 olan bir radyonüklidin kütlesini hesaplayın Ki:
9.1. 131I, T1/2=8,1 gün;
9.2. 90Sr, T1/2=29 yıl;
9.3. 137Cs, Т1/2=30 yıl;
9.4. 239Pu, Т1/2=2,4·104 yıl.
10. Kütle 1'i belirleyin mCi radyoaktif karbon izotopu 14C, T½ = 5560 yıl.
11. Radyoaktif bir fosfor 32P preparatı hazırlamak gereklidir. İlacın %3'ü ne kadar süre sonra kalacaktır? Т½ = 14,29 gün.
12. Doğal potasyum karışımı, 40K radyoaktif izotopun %0,012'sini içerir.
1) 1 içeren doğal potasyumun kütlesini belirleyin. Ki 40 bin. Т½ = 1,39·109 yıl = 4,4·1018 sn.
2) Toprak örneğindeki potasyum içeriğinin 14 olduğu biliniyorsa, toprağın radyoaktivitesini 40K kullanarak hesaplayın. kg/ton.
13. Bir radyoizotopun başlangıç aktivitesinin %0,001'e düşmesi için kaç yarılanma ömrü gerekir?
14. 238U'nun bitkiler üzerindeki etkisini belirlemek için tohumlar 100 ml radyoaktif tuzun kütlesinin 6 olduğu UO2(NO3)2 6H2O çözeltisi G. Çözeltideki 238U'nun aktivitesini ve spesifik aktivitesini belirleyin. Т½ = 4,5·109 yıllar.
15. Faaliyet 1'i tanımlayın gram 232Th, Т½ = 1,4·1010 yıl.
16. Kütle 1'i belirleyin Ki 137Cs, Т1/2=30 yıl.
17. Doğadaki kararlı ve radyoaktif potasyum izotoplarının içeriği arasındaki oran sabit bir değerdir. 40K içeriği %0,01'dir. Toprak örneğindeki potasyum içeriğinin 14 olduğu biliniyorsa, toprağın radyoaktivitesini 40K kullanarak hesaplayın. kg/ton.
18. Çevrenin litojenik radyoaktivitesi esas olarak üç ana doğal radyonüklid nedeniyle oluşur: 40K, 238U, 232Th. Radyoaktif izotopların doğal izotop toplamı içindeki oranı sırasıyla 0,01, 99,3, ~100'dür. Radyoaktiviteyi hesaplayın 1 T Toprak örneğindeki göreceli potasyum içeriğinin 13600 olduğu biliniyorsa g/t, uranyum – 1·10-4 g/t, toryum – 6·10-4 g/t.
19. Çift kabuklu yumuşakçaların kabuklarında 23.200 adet bulundu Bq/kg 90Sr. Numunelerin aktivitesini 10, 30, 50, 100 yıl sonra belirleyin.
20. Çernobil bölgesindeki kapalı rezervuarların ana kirliliği, nükleer santraldeki kazadan sonraki ilk yılda meydana geldi. Gölün alt çökeltilerinde. Azbuchin 1999 yılında 1.1.10 Bq/m2 spesifik aktiviteye sahip 137C'leri keşfetti. 1986-1987 yılları arasında dip çökeltilerinin m2'si başına düşen 137C'lerin konsantrasyonunu (aktivitesini) belirleyin. (12 yıl önce).
21. 241Am (T½ = 4,32·102 yıl) 241Pu'dan (T½ = 14,4 yıl) oluşmuştur ve aktif bir jeokimyasal göçmendir. Referans malzemeleri kullanarak, plütonyum-241'in aktivitesinde zaman içinde meydana gelen azalmayı %1 doğrulukla hesaplayın; Çernobil felaketinden sonraki yıl ortamda 241Am oluşumunun maksimum olacağı yıl.
22. Nisan ayı itibarıyla Çernobil reaktörünün emisyonlarındaki 241Am aktivitesini hesaplayın
2015, Nisan 1986'da 241Am'in aktivitesinin 3,82 1012 olması şartıyla Bk,Т½ = 4,32·102 yıl.
Toprak örneklerinde 23. 390 adet bulundu nCi/kg 137C. Numunelerin 10, 30, 50, 100 yıl sonraki aktivitesini hesaplayın.
24. Göl yatağı kirliliğinin ortalama konsantrasyonu. Çernobil hariç tutma bölgesinde yer alan Glubokoye 6,3 104 Bk 1 m2 başına 241Am ve 7,4·104 238+239+240Pu. Bu verilerin hangi yılda elde edildiğini hesaplayın.
§ 15-g. Radyoaktif Bozunma Yasası
Parçacık sayımlarının otomatikleştirilmesine yardımcı olan "manuel" sintilasyon sayaçlarının ve esas olarak Geiger-Muller sayaçlarının ortaya çıkışı (bkz. § 15), fizikçileri önemli bir sonuca götürdü. Herhangi bir radyoaktif izotop, birim zaman başına bozunan çekirdek sayısındaki azalmayla ifade edilen, radyoaktivitenin kendiliğinden zayıflaması ile karakterize edilir.
Çeşitli radyoaktif izotopların aktivite grafiklerinin çizilmesi, bilim adamlarını aynı bağımlılığa yöneltti. üstel fonksiyon(tabloya bakınız). Yatay eksen gözlem süresini, dikey eksen ise bozulmamış çekirdek sayısını gösterir. Çizgilerin eğriliği farklı olabilir ancak grafiklerle açıklanan bağımlılıkları ifade eden fonksiyonun kendisi aynı kaldı:
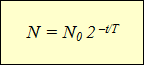
Bu formül ifade eder radyoaktif bozunma yasası: Zamanla bozulmayan çekirdeklerin sayısı, başlangıçtaki çekirdek sayısının 2 çarpı gözlem süresinin negatif işaretle alınan yarı ömre oranına eşit kuvvetin çarpımı olarak belirlenir.
Deneyler sırasında ortaya çıktığı gibi, çeşitli radyoaktif maddeler farklı özelliklerle karakterize edilebilir. yarı ömür– Henüz bozulmamış çekirdeklerin sayısının yarıya indiği süre(tabloya bakınız).
Bazı kimyasal elementlerin bazı izotoplarının yarı ömürleri. Hem doğal hem de yapay izotoplar için değerler verilmiştir.
| İyot-129 | 15 Ma | Karbon-14 | 5,7 bin yıl | |
| İyot-131 | 8 gün | Uran-235 | 0,7 Ga | |
| İyot-135 | saat 7 | Uran-238 | 4,5 milyar yıl |
Yarı ömür, radyoaktif bozunma oranını karakterize eden, genel olarak kabul edilen bir fiziksel miktardır. Çok sayıda deney şunu gösteriyor radyoaktif bir maddenin çok uzun süre gözlemlenmesi durumunda bile yarı ömrü sabittir, yani halihazırda bozunmuş olan atom sayısına bağlı değildir. Bu nedenle radyoaktif bozunma yasası, arkeolojik ve jeolojik buluntuların yaşını belirleme yönteminde uygulama alanı bulmuştur.
Radyokarbon tarihleme yöntemi. Karbon, Dünya'da çok yaygın bir kimyasal elementtir ve yarı ömrü 5,7 bin yıl olan kararlı izotoplar karbon-12, karbon-13 ve radyoaktif izotop karbon-14'ü içerir (tabloya bakınız). Yiyecek tüketen canlı organizmalar, her üç izotopu da dokularında biriktirir. Organizmanın ömrünün sona ermesinden sonra karbon arzı durur ve radyoaktif bozunma nedeniyle zamanla içeriği doğal olarak azalır. Yalnızca karbon-14 bozunması nedeniyle, canlı organizmaların fosil kalıntılarındaki karbon izotoplarının oranı yüzyıllar ve bin yıllar boyunca değişmektedir. Bu "karbon oranını" ölçerek arkeolojik bir buluntunun yaşını tahmin edebiliriz.
Radyokarbon analizi yöntemi, jeolojik kayaların yanı sıra fosil insan nesneleri için de geçerlidir, ancak numunedeki izotop oranının, örneğin bir yangın veya güçlü bir kaynağın etkisi nedeniyle varlığı sırasında bozulmaması şartıyla radyasyon. Bu yöntemin keşfinden hemen sonra bu tür nedenlerin dikkate alınmaması, birkaç yüzyıl ve binlerce yıl boyunca hatalara yol açtı. Günümüzde, karbon-14 izotopu için, uzun ömürlü ağaçlardaki (örneğin, Amerikan milenyum sekoyası) dağılımına dayalı olarak “seküler kalibrasyon ölçekleri” kullanılmaktadır. Yaşları, yıllık ağaç halkaları kullanılarak çok doğru bir şekilde hesaplanabilir.
Radyokarbon tarihleme yönteminin 21. yüzyılın başında uygulama sınırı 60.000 yıldı. Kayalar veya meteorlar gibi daha eski numunelerin yaşını ölçmek için benzer bir yöntem kullanılır, ancak incelenen numunenin kökenine bağlı olarak karbon yerine uranyum veya diğer elementlerin izotoplarına bakılır.
Tarayıcınızda Javascript devre dışı.Hesaplamaları gerçekleştirmek için ActiveX kontrollerini etkinleştirmelisiniz!
>> Radyoaktif bozunma yasası. Yarı ömür
§ 101 RADYOAKTİF BOZUNMA YASASI. YARI ÖMÜR
Radyoaktif bozunma istatistiksel bir yasaya uyar. Radyoaktif maddelerin dönüşümlerini inceleyen Rutherford, deneysel olarak etkinliklerinin zamanla azaldığını tespit etti. Bu, önceki paragrafta tartışılmıştı. Böylece radon aktivitesi 1 dakika sonra 2 kat azalır. Uranyum, toryum ve radyum gibi elementlerin aktiviteleri de zamanla azalır ama çok daha yavaş olur. Her radyoaktif madde için aktivitenin 2 kat azaldığı belli bir zaman aralığı vardır. Bu aralığa yarı ömür denir. Yarı ömür T, başlangıçtaki radyoaktif atom sayısının yarısının bozunduğu süredir.
Radyoaktif ilaçlardan birinin zamana bağlı olarak aktivitedeki düşüşü, yani saniyedeki bozunma sayısı, Şekil 13.8'de gösterilmektedir. Bu maddenin yarı ömrü 5 gündür.
Şimdi radyoaktif bozunma yasasının matematiksel formunu türetelim. Zamanın ilk anında (t= 0) radyoaktif atomların sayısı N 0'a eşit olsun. Daha sonra yarı ömürden sonra bu sayı şuna eşit olacaktır:
Benzer bir zaman aralığından sonra bu sayı şuna eşit olacaktır:









