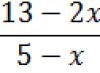Одной из основных единиц в Международной системе единиц (СИ) является единица количества вещества – моль.
Моль – это такое количество вещества, которое содержит столько структурных единиц данного вещества (молекул, атомов, ионов и др.), сколько атомов углерода содержится в 0,012 кг (12 г) изотопа углерода 12 С .
Учитывая, что значение абсолютной атомной массы для углерода равно m (C) = 1,99 · 10 26 кг, можно рассчитать число атомов углерода N А , содержащееся в 0,012 кг углерода.
Моль любого вещества содержит одно и то же число частиц этого вещества (структурных единиц). Число структурных единиц, содержащихся в веществе количеством один моль равно 6,02·10 23 и называется числом Авогадро (N А ).
Например, один моль меди содержит 6,02·10 23 атомов меди (Cu), а один моль водорода (H 2) – 6,02·10 23 молекул водорода.
Молярной массой (M) называется масса вещества, взятого в количестве 1 моль.
Молярная масса обозначается буквой М и имеет размерность [г/моль]. В физике пользуются размерностью [кг/кмоль].
В общем случае численное значение молярной массы вещества численно совпадает со значением его относительной молекулярной (относительной атомной) массы.
Например, относительная молекулярная масса воды равна:
Мr(Н 2 О) = 2Аr (Н) + Аr (O) = 2∙1 + 16 = 18 а.е.м.
Молярная масса воды имеет ту же величину, но выражена в г/моль:
М (Н 2 О) = 18 г/моль.
Таким образом, моль воды, содержащий 6,02·10 23 молекул воды (соответственно 2·6,02·10 23 атомов водорода и 6,02·10 23 атомов кислорода), имеет массу 18 граммов. В воде, количеством вещества 1 моль, содержится 2 моль атомов водорода и один моль атомов кислорода.
1.3.4. Связь между массой вещества и его количеством
Зная массу вещества и его химическую формулу, а значит и значение его молярной массы, можно определить количество вещества и, наоборот, зная количество вещества, можно определить его массу. Для подобных расчетов следует пользоваться формулами:
где ν – количество вещества, [моль]; m – масса вещества, [г] или [кг]; М – молярная масса вещества, [г/моль] или [кг/кмоль].
Например, для нахождения массы сульфата натрия (Na 2 SO 4) количеством 5 моль найдем:
1) значение относительной молекулярной массы Na 2 SO 4 , представляющую собой сумму округленных значений относительных атомных масс:
Мr(Na 2 SO 4) = 2Аr(Na) + Аr(S) + 4Аr(O) = 142,
2) численно равное ей значение молярной массы вещества:
М(Na 2 SO 4) = 142 г/моль,
3) и, наконец, массу 5 моль сульфата натрия:
m = ν · M = 5 моль · 142 г/моль = 710 г.
Ответ: 710.
1.3.5. Связь между объемом вещества и его количеством
При нормальных условиях (н.у.), т.е. при давлении р , равном 101325 Па (760 мм. рт. ст.), и температуре Т, равной 273,15 К (0 С), один моль различных газов и паров занимает один и тот же объем, равный 22,4 л.
Объем, занимаемый 1 моль газа или пара при н.у., называется молярным объемом газа и имеет размерность литр на моль.
V мол = 22,4 л/моль.
Зная количество газообразного вещества (ν) и значение молярного объема (V мол) можно рассчитать его объем (V) при нормальных условиях:
V = ν · V мол,
где ν – количество вещества [моль]; V – объем газообразного вещества [л]; V мол = 22,4 л/моль.
И, наоборот, зная объем (V ) газообразного вещества при нормальных условиях, можно рассчитать его количество (ν):
Атомная единица массы. Число Авогадро
Вещество состоит из молекул. Под молекулой мы будем понимать наименьшую частицу данного вещества, сохраняющую химические свойства данного вещества.
Читатель : А в каких единицах измеряется масса молекул?
Автор : Массу молекулы можно измерять в любых единицах массы, например в тоннах, но поскольку массы молекул очень малы: ~10 –23 г, то для удобства ввели специальную единицу – атомную единицу массы (а.е.м.).
Атомной единицей массы называется величина, равная -й массы атома углерода 6 С 12 .
Запись 6 С 12 означает: атом углерода, имеющий массу 12 а.е.м. и заряд ядра – 6 элементарных зарядов. Аналогично, 92 U 235 – атом урана массой 235 а.е.м. и зарядом ядра 92 элементарных заряда, 8 О 16 – атом кислорода массой 16 а.е.м и зарядом ядра 8 элементарных зарядов и т.д.
Читатель : Почему в качестве атомной единицы массывзяли именно (а не или ) часть массы атома и именно углерода, а не кислорода или плутония?
Экспериментально установлено, что 1 г » 6,02×10 23 а.е.м.
Число, показывающее, во сколько раз масса 1 г больше 1 а.е.м, называется числом Авогадро : N A = 6,02×10 23 .
 Отсюда
Отсюда
N А × (1 а.е.м) = 1 г. (5.1)
Пренебрегая массой электронов и различием в массах протона и нейтрона, можно сказать, что число Авогадро приблизительно показывает, сколько надо взять протонов (или, что почти то же самое, атомов водорода), чтобы образовалась масса в 1 г (рис. 5.1).
Моль
Масса молекулы, выраженная в атомных единицах массы, называется относительной молекулярной массой .
Обозначается М r (r – от relative – относительный), например:
12 а.е.м, = 235 а.е.м.
Порция вещества, которая содержит столько же граммов данного вещества, сколько атомных единиц массы содержит молекула данного вещества, называется молем (1 моль) .
Например: 1) относительная молекулярная масса водорода Н 2: , следовательно, 1 моль водорода имеет массу 2 г;
2) относительная молекулярная масса углекислого газа СО 2:
![]() 12 а.е.м. + 2×16 а.е.м. = 44 а.е.м.
12 а.е.м. + 2×16 а.е.м. = 44 а.е.м.
следовательно, 1 моль СО 2 имеет массу 44 г.
Утверждение. Один моль любого вещества содержит одно и то же число молекул: N А = 6,02×10 23 шт.
Доказательство . Пусть относительная молекулярная масса вещества М r (а.е.м.) = М r × (1 а.е.м.). Тогда согласно определению 1 моль данного вещества имеет массу М r (г) = М r ×(1 г). Пусть N – число молекул в одном моле, тогда
N ×(масса одной молекулы) = (масса одного моля),
Моль – основная единица измерения в СИ.
Замечание . Моль можно определить иначе: 1 моль – это N А = = 6,02×10 23 молекул данного вещества. Тогда легко понять, что масса 1 моля равна М r (г). Действительно, одна молекула имеет массу М r (а.е.м.), т.е.
(масса одной молекулы) = М r × (1 а.е.м.),
(масса одного моля) = N А ×(масса одной молекулы) =
= N
А × М r
× (1 а.е.м.) = ![]() .
.
Масса 1 моля называется молярной массой данного вещества.
Читатель : Если взять массу т некоторого вещества, молярная масса которого равна m, то сколько это будет молей?
Запомним:
Читатель : А в каких единицах в системе СИ следует измерять m?
![]() , [m] = кг/моль.
, [m] = кг/моль.
Например, молярная масса водорода
Моль - одно из важнейших понятий в химии, - это, своего рода, звено для перехода из микромира атомов и молекул в обычный макромир граммов и килограммов.
В химии часто приходится считать большие количества атомов и молекул. Для быстрого и эффективного подсчета принято пользоваться методом взвешивания. Но при этом надо знать, вес отдельных атомов и молекул. Для того, чтобы узнать молекулярную массу надо сложить массу всех атомов, входящих в соединение.
Возьмем молекулу воды H 2 O, которая состоит из одного атома кислорода и двух атомов водорода. Из периодической таблицы Менделеева узнаем, что один атом водорода весит 1,0079 а.е.м. ; один атом кислорода - 15,999 а.е.м. Теперь, чтобы вычислить молекулярную массу воды, надо сложить атомные массы компонентов молекулы воды:
H 2 O = 2·1,0079 + 1·15,999 = 18,015 а.е.м.
Например, для сульфата аммония молекулярная масса будет равна:
Al 2 (SO 4) 3 = 2·26,982 + 3·32,066 + 12·15,999 = 315, 168 а.е.м.
Вернемся опять к повседневной жизни, в которой мы привыкли пользоваться такими понятиями, как пара, десяток, дюжина, сотня. Все это своеобразные единицы измерения определенных объектов: пара ботинок, десяток яиц, сотня скрепок. Подобной единицей измерения в химии является МОЛЬ .
Современная наука с высокой точностью определила число структурных единиц (молекулы, атомы, ионы…), которые содержатся в 1 моле вещества - это 6,022·10 23 - постоянная Авогадро , или число Авогадро .
Все вышесказанное о моле относится к микромиру. Теперь надо увязать понятие моля с повседневным макромиром.
Весь нюанс состоит в том, что в 12 граммах изотопа углерода 12 C содержится 6,022·10 23 атомов углерода, или ровно 1 моль. Таким образом, для любого другого элемента моль выражается количеством граммов, равным атомной массе элемента. Для химических соединений моль выражается количеством граммов, равным молекулярной массе соединения.
Чуть ранее мы выяснили, что молекулярная масса воды равна 18,015 а.е.м. С учетом полученных знаний о моле, можно сказать, что масса 1 моля воды = 18,015 г (т.к., моль соединения - это количество граммов, равных его молекулярной массе). Другими словами, можно сказать, что в 18,015 г воды содержится 6,022·10 23 молекул H 2 O, или 1 моль воды = 1 моль кислорода + 2 моля водорода.
Из приведенного примера понятна связь микромира и макромира через моль:
Число Авогадро ↔ МОЛЬ ↔ кол-во граммов, равных атомной (формульной) массе- n - кол-во вещества, моль;
- N - кол-во частиц;
- N A - число Авогадро, моль -1
Приведем несколько практических примеров использования моля:
Задача №1: Сколько молекул воды содержится в 16,5 молях H 2 O?
Решение: 16,5·6,022·10 23 = 9,93·10 24 молекул.
Задача №2: Сколько молей содержится в 100 граммах H 2 O?
Решение: (100 г/1)·(1 моль/18,015 г) = 5,56 моль.
Задача №3: Сколько молекул содержит 5 г диоксида углерода?
Решение:
- Определяем молекулярную массу CO 2: CO 2 = 1·12,011 + 2·15,999 = 44,01 г/моль
- Находим число молекул: (5г/1)·(1моль/44,01г)·(6,022·10 23 /1моль) = 6,84·10 22 молекул CO 2
Понятие моль используют для измерения химических веществ. Выясним особенности этой величины, приведем примеры расчетных заданий с ее участием, определим важность данного термина.
Определение
Моль в химии - это единица вычисления. Она представляет собой количество определенного вещества, в котором находится столько структурных единиц (атомов, молекул), сколько содержится в 12 граммах атома углерода.
Число Авогадро
Количество вещества связано с числом Авогадро, которое составляет 6*10^23 1/моль. Для веществ молекулярного строения считают, что один моль включает именно число Авогадро. Если нужно посчитать число молекул, содержащееся в 2 молях воды, то необходимо умножить 6*10^23 на 2 , получаем 12*10^23 штук. Давайте рассмотрим, какую роль играет моль в химии.
Количество вещества
Вещество, которое состоит из атомов, содержит число Авогадро. Например, для атома натрия это 6*10*23 1/моль. Каково его обозначение? Моль в химии обозначают греческой буквой «ню» или латинской «n». Для проведения математических вычислений, связанных с количеством вещества, используют математическую формулу:
n=N/N(A), где n - количество вещества, N(A) - число Авогадро, N - количество структурных частиц вещества.
При необходимости можно вычислить число атомов (молекул):
Фактическая масса моля называется молярной. Если количество вещества определяют в молях, то величина молярной массы имеет единицы измерения г/моль. В численном выражении она соответствует значению относительной молекулярной массы, которую можно определить путем суммирования относительных атомных масс отдельных элементов.

Например, для того чтобы определить молярную массу молекулы углекислого газа, необходимо провести следующие расчеты:
M (CO2)=Ar(C)+2Ar(O)=12+2*16=44
При вычислении молярной массы оксида натрия получаем:
M (Na2O)=2*Ar(Na)+Ar(O)=2*23+16=62
При определении молярной массы серной кислоты суммируем две относительные атомные массы водорода с одной атомной массой серы и четырьмя относительными атомными массами кислорода. Их значения всегда можно найти в периодической таблице Менделеева. В итоге получаем 98.
Моль в химии позволяет проводить разнообразные расчеты, связанные с химическими уравнениями. Все типовые расчетные задачи в неорганической и органической химии, которые предполагают нахождение массы и объема веществ, решаются именно через моли.
Примеры расчетных задач
Молекулярная формула любого вещества указывает на количество молей каждого элемента, включенного в его состав. Например, один моль фосфорной кислоты содержит три моля атомов водорода, один моль атомов фосфора и четыре моля атомов кислорода. Все достаточно просто. Моль в химии является переходом из микромира молекул и атомов в макросистему с килограммами и граммами.
Задача 1. Определите число молекул воды, содержащихся в 16,5 молях.
Для решения используем связь между числом Авогадро (количество вещества). Получаем:
16,5*6,022*1023 = 9,9*1024 молекул.

Задача 2. Рассчитайте число молекул, содержащихся в 5 г углекислого газа.
Сначала необходимо вычислить молярную массу данного вещества, воспользовавшись ее связью с относительной молекулярной массой. Получаем:
N=5/44*6,023*1023=6,8*1023 молекул.
Алгоритм задач на химическое уравнение
При вычислении массы или продуктов реакции по уравнению используют определенный алгоритм действий. Сначала определяют, какое из исходных веществ в недостатке. Для этого находят их количество в молях. Далее составляют уравнение процесса, обязательно расставляют стереохимические коэффициенты. Над веществами записывают исходные данные, под ними указывают количество вещества, взятое в молях (по коэффициенту). В случае необходимости осуществляют перевод единиц измерения, пользуясь формулами. Далее составляют пропорцию и решают ее математическим способом.

Если предлагается более сложная задача, то предварительно вычисляют массу чистого вещества, убирая примеси, потом уже приступают к определению его количества (в молях). Ни одна задача в химии, связанная с уравнением реакции, не решается без такой величины, как моль. Кроме того с помощью данного термина, легко можно определить количество молекул или атомов, воспользовавшись для таких вычислений постоянным числом Авогадро. Расчетные задания включены в тестовые вопросы по химии для выпускников основной и средней общеобразовательной школы.