Задачи на изотопы
Уровень А
1. Рассчитать изотопный состав (в %) водорода (средняя относительная атомная масса A r = 1,008) и лития (A r = 6,9), предполагая, что каждый элемент состоит только из двух изотопов, относительные атомные массы которых отличаются на единицу.
Ответ . Водород: 1 Н – 99,2% и 2 Н – 0,8%; литий: 6 Li – 10% и 7 Li – 90%.
2. Относительная атомная масса природного водорода составляет 1,00797. Этот водород является смесью изотопов протия (A r = 1,00782) и дейтерия (A r = 2,0141). Какой процент дейтерия в природном водороде?
Ответ . 0,015%.
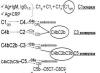
3. Среди приведенных символов элементов укажите изотопы и изобары:
Ответ . У изотопов одинаковые химические символы, у изобаров одинаковые атомные массы.
4. Природный литий (A r = 6,9) состоит из изотопов с массовыми числами 6 и 7. Сколько процентов первого изотопа он содержит?
Ответ . 10%.
5. Масса атома изотопа магния равна 4,15 10 –23 г. Определите число нейтронов, которое содержит ядро этого атома.
Ответ . 13.
6. Медь имеет два изотопа с массовыми числами 63 и 65. Массовая доля их в природной меди составляет соответственно 73% и 27%. На основании этих данных рассчитайте среднюю относительную атомную массу природной меди.
Ответ . 63,54.
7. Средняя относительная атомная масса природного хлора равна 35,45. Вычислите массовые доли двух его изотопов, имеющих массовые числа 35 и 37.
Ответ. 77,5% и 22,5%.
8. Определите относительную атомную массу бора, если известны массовые доли его изотопов ( 10 В) = 19,6% и ( 11 В) = 80,4%.
Ответ. 10,804.
9. Литий состоит из двух природных изотопов с массовыми числами 6 ( 1 = 7,52%) и 7 ( 2 = 92,48%). Рассчитайте относительную атомную массу лития.
Ответ. 6,9248.
10. Рассчитайте относительную атомную массу кобальта, если известно, что в природе существуют два его изотопа: с массовыми числами 57 ( 1 = 0,17%) и 59 ( 2 = 99,83%).
Ответ. 58,9966.
11. Относительная атомная масса бора составляет 10,811. Определите процентное содержание в природном боре изотопов с массовыми числами 10 и 11.
Ответ. 18,9% и 81,1%.
12. Галлий имеет два природных изотопа с массовыми числами 69 и 71. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если относительная атомная масса элемента 69,72.
Ответ. 1,78:1.
13. Природный бром имеет два изотопа с массовыми числами 79 и 81. Относительная атомная масса брома 79,904. Определите массовую долю каждого из изотопов в природном броме.
Ответ. 54,8% и 45,2%.
Уровень Б
1. Кремний имеет три стабильных изотопа – 30 Si (3,05 %(мол.)), 29 Si и 28 Si. Вычислите содержание (в %(мол.)) самого распространенного изотопа кремния. Как будут отличаться молярные массы диоксида кремния, имеющего разный изотопный состав, если учесть, что кислород имеет три стабильных изотопа с массовыми числами 16, 17 и 18?
Ответ. 94,55%; 18 видов молекул диоксида кремния.
2. Образец состоит из смеси двух изотопов одного элемента; 30% составляет изотоп, в ядре атома которого – 18 нейтронов; 70% составляет изотоп, в ядре атома которого – 20 нейтронов. Определите порядковый номер элемента, если средняя относительная атомная масса элемента в смеси изотопов составляет 36,4.
Ответ. 17.
3. Химический элемент состоит из двух изотопов. В ядре атома первого изотопа – 10 протонов и 10 нейтронов. В ядре атома второго изотопа – нейтронов на 2 больше. На 9 атомов более легкого изотопа приходится один атом более тяжелого изотопа. Вычислите среднюю относительную атомную массу элемента.
Ответ. 20,2.
4. Изотоп 137 Cs имеет период полураспада 29,7 лет. 1 г этого изотопа прореагировал со взрывом с избытком воды. Каков период полураспада цезия в образовавшемся соединении? Ответ обоснуйте.
Ответ. T 1/2 = 29,7 лет.
5. Через сколько лет количество радиоактивного стронция-90 (период полураспада 27 лет), выпавшего с радиоактивными осадками в результате ядерного взрыва, станет менее 1,5% от того количества, которое было обнаружено в момент после ядерного взрыва?
Ответ. 163,35 лет.
6. В методе меченых атомов радиоактивные изотопы используют для того, чтобы «проследить маршрут» некоторого элемента в организме. Так, пациенту с больной поджелудочной железой вводят препарат радиоактивного изотопа йода-131 (претерпевает – -распад), что позволяет врачу проследить за прохождением йода по организму больного. Напишите уравнение радиоактивного распада и рассчитайте, через какое время количество радиоактивного йода, введенного в организм, уменьшится в 10 раз (период полураспада 8 сут).
Ответ.
7. Сколько времени потребуется для того, чтобы три четверти никеля превратились в медь в результате – -распада, если период полураспада изотопа 63 28 Ni составляет 120 лет?
Ответ. 240 лет.
8. Найдите массу изотопа 81 Sr (период полураспада 8,5 ч), оставшуюся после 25,5 ч хранения, если первоначальная масса составляла 200 мг.
Ответ. 25 мг.
9. Вычислите процент атомов изотопа 128 I (период полураспада 25 мин), оставшихся нераспавшимися после его хранения в течение 2,5 ч.
Ответ . 1,5625%.
10. Период полураспада – -радиоактивного изотопа 24 Na равен 14,8 ч. Напишите уравнение реакции распада и вычислите, сколько граммов дочернего продукта образуется из 24 г этого изотопа за 29,6 ч.
Ответ .
11. Изотоп 210 Ро, излучающий -частицы, используется в смеси с бериллием в нейтронных источниках. Через какое время интенсивность таких источников уменьшится в 32 раза? Период полураспада изотопа равен 138 дням.
Ответ . 690 сут.
Упражнения на ядерные реакции
1. Сколько - и – -частиц должно было потерять ядро 226 Ra для получения дочернего элемента с массовым числом 206, принадлежащего IV группе периодической системы элементов? Назовите этот элемент.
Ответ. 5, 4 – , 206 82 Pb.
2. Ядро атома изотопа 238 92 U в результате радиоактивного распада превратилось в ядро 226 88 Ra. Сколько - и – -частиц испустило при этом исходное ядро?
1. У какого элемента сильнее выражены неметаллические свойства: а) у кислорода или углерода; б) у фосфора или мышьяка? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
2. Дайте характеристику элемента № 11 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула
3. Как и почему изменяются свойства химических элементов в периодах? Покажите это на примере элементов 3-го периода.
4. Рассчитайте относительную атомную массу бора, если известно, что доля изотопа 10 В составляет 19,6%, а изотопа 11 В - 80,4%. (Ответ: 10,8.)
Решения и ответы:
1. Неметаллические свойства сильнее выражены у а) кислорода (т.к. слева направо в периодах неметаллические свойства усиливаются),
б) фосфора (т.к. в группах снизу вверх усиливаются неметаллические свойства за счет уменьшения радиуса атома).

3. В периодах слева направо усиливаются неметаллические свойства и ослабевают металлические, т.к. за счет увеличения количества электронов на валентной оболочке, электроны начинают сильнее притягиваться к ядру, радиус атома уменьшается.
Из материалов урока вы узнаете, что атомы одних химических элементов отличаются от атомов других химических элементов массой. Учитель расскажет, как химики измеряли массу атомов, которые настолько мало, что их не увидишь даже с помощью электронного микроскопа.
Тема: Первоначальные химические представления
Урок: Относительная атомная масса химических элементов
В начале 19 в. (спустя 150 лет после работ Роберта Бойля) английский ученый Джон Дальтон предложил способ определения массы атомов химических элементов. Рассмотрим суть этого метода.
Дальтон предложил модель, в соответствии с которой в молекулу сложного вещества входит только по одному атому различных химических элементов. Например, он считал, что молекула воды состоит из 1 атома водорода и 1 атома кислорода. В состав простых веществ по Дальтону тоже входит только один атом химического элемента. Т.е. молекула кислорода должна состоять из одного атома кислорода.
И тогда, зная массовые доли элементов в веществе, легко определить во сколько раз масса атома одного элемента отличается от массы атома другого элемента. Таким образом, Дальтон считал, что массовая доля элемента в веществе определяется массой его атома.
Известно, что массовая доля магния в оксиде магния равна 60%, а массовая доля кислорода – 40%. Идя по пути рассуждений Дальтона, можно сказать, что масса атома магния больше массы атома кислорода в 1,5 раза (60/40=1,5):
Ученый заметил, что масса атома водорода самая маленькая, т.к. нет сложного вещества, в котором бы массовая доля водорода была бы больше массовой доли другого элемента. Поэтому он предложил массы атомов элементов сравнивать с массой атома водорода. И таким путем вычислил первые значения относительных (относительно атома водорода) атомных масс химических элементов.
Атомная масса водорода была принята за единицу. А значение относительной массы серы получилось равным 17. Но все полученные значения были либо приблизительными, либо неверными, т.к. техника эксперимента того времени была далека от совершенства и установка Дальтона о составе вещества была неверной.
В 1807 – 1817 гг. шведский химик Йёнс Якоб Берцелиус провел огромное исследование по уточнению относительных атомных масс элементов. Ему удалось получить результаты, близкие к современным.
Значительно позже работ Берцелиуса массы атомов химических элементов стали сравнивать с 1/12 массы атома углерода (Рис. 2).

Рис. 1. Модель расчета относительной атомной массы химического элемента
Относительная атомная масса химического элемента показывает, во сколько раз масса атома химического элемента больше 1/12 массы атома углерода.
Относительная атомная масс обозначается А r , она не имеет единиц измерения, так как показывает отношение масс атомов.
Например: А r (S) = 32, т.е. атом серы в 32 раза тяжелее 1/12 массы атома углерода.
Абсолютная масса 1/12 атома углерода является эталонной единицей, значение которой вычислено с высокой точностью и составляет 1,66 *10 -24 г или 1,66 *10 -27 кг. Эта эталонная масса называется атомной единицей массы (а.е.м.).
Значения относительных атомных масс химических элементов запоминать не надо, они приведены в любом учебнике или справочнике по химии, а также в периодической таблице Д.И. Менделеева.
При расчетах значения относительных атомных масс принято округлять до целых.
Исключение составляет относительная атомная масса хлора – для хлора используют значение 35,5.
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006.
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006. (с.24-25)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§10)
4. Химия: неорг. химия: учеб. для 8 кл. общеобр. учреждений / Г.Е. Рудзитис, ФюГю Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§§8,9)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов ().
2. Электронная версия журнала «Химия и жизнь» ().
Домашнее задание
с.24-25 №№ 1-7 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006.
1. Природный магний состоит из изотопов 24Mg, 25Mg и 26Mg. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в процентах по массе соответственно равно 78,6; 10,1 и 11,3.
2. Природный галлий состоит из изотопов 71Ga и 69Ga. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72.
3. Определите относительную атомную массу бора, если известно, что молярная доля изотопа 10В составляет 19,6%, а изотопа 11B - 80,4%.
4. Медь имеет два изотопа: 63Cu и 65Cu. Молярные доли их в природной меди составляют 73 и 27% соответственно. Определите среднюю относительную атомную массу меди.
5. Определите относительную атомную массу элемента кремния, если он состоит из трёх изотопов: 28Si (молярная доля 92,3%), 29Si (4,7%) и 30Si (3,0%).
6. Природный хлор содержит два изотопа 35Cl и 37Сl. Относительная атомная масса хлора равна 35,45. Определите молярную долю каждого изотопа хлора.
7. Относительная атомная масса неона равна 20,2. Неон состоит из двух изотопов: 20Ne и 22Ne. Рассчитайте молярную долю каждого изотопа в природном неоне.
8. Природный бром содержит два изотопа. Молярная доля изотопа 79Br равна 55%. Какой ещё изотоп входит в состав элемента брома, если его относительная атомная масса равна 79,9.
9. Природный таллий представляет собой смесь изотопов 203Tl и 205Tl. На основании относительной атомной массы природного таллия Ar(Tl) = 204,38 определите изотопный состав таллия в % по массе.
10. Природный иридий представляет собой смесь изотопов 191Ir и 193Ir. На основании относительной атомной массы природного иридия Ar(Ir) = 192,22 определите изотопный состав иридия в % по массе.
11. Природный рений представляет собой смесь изотопов 185Re и 187Re. На основании относительной атомной массы природного рения Ar(Re) = 186,21 определите изотопный состав рения в % по массе.
12. Природный галлий представляет собой смесь изотопов 69Ga и 71Ga. На основании относительной атомной массы природного галлия Ar(Ga) = 69,72 определите изотопный состав галлия в % по массе.
13. Природный хлор состоит из двух стабильных изотопов 35Cl и 37Cl. Исходя из средней относительной атомной массы хлора, равной 35,45, рассчитайте изотопный состав хлора в процентах по массе.
14. Природное серебро состоит из двух стабильных изотопов 107Ag и 109Ag. Исходя из средней относительной атомной массы серебра, равной 107,87, рассчитайте изотопный состав серебра в процентах по массе.
15. Природная медь состоит из двух стабильных изотопов 63Cu и 65Cu. Исходя из средней относительной атомной массы меди, равной 63,55, рассчитайте изотопный состав меди в процентах по массе.
16. Природный бром состоит из двух стабильных изотопов 79Br и 81Br. Исходя из средней относительной атомной массы брома, равной 79,90, рассчитайте изотопный состав брома в процентах по массе.
17. Природный кремний состоит из 3,1% (по молям) изотопа 30Si (с атомной массой 29,9738), а также изотопов 29Si (с атомной массой 28,9765) и 28Si (с атомной массой 27,9770). Рассчитайте содержание в % (по молям) 29Si и 28Si.