મોડ્યુલ 1 પ્રોટીનનું માળખું, ગુણધર્મો અને કાર્યો
મોડ્યુલ 1 પ્રોટીનનું માળખું, ગુણધર્મો અને કાર્યો
મોડ્યુલ માળખું | વિષયો |
મોડ્યુલર યુનિટ 1 | 1.1. પ્રોટીનનું માળખાકીય સંગઠન. મૂળ પ્રોટીન રચનાની રચનાના તબક્કા 1.2. પ્રોટીન કાર્યની મૂળભૂત બાબતો. પ્રોટીન કાર્યને અસર કરતી લિગાન્ડ્સ તરીકે દવાઓ 1.3. પ્રોટીનનું વિકૃતિકરણ અને તેમના સ્વયંસ્ફુરિત પુનર્જીવનની શક્યતા |
મોડ્યુલર યુનિટ 2 | 1.4. હિમોગ્લોબિનના ઉદાહરણનો ઉપયોગ કરીને ઓલિગોમેરિક પ્રોટીનની રચના અને કાર્યની સુવિધાઓ 1.5. સેલ્યુલર પરિસ્થિતિઓ હેઠળ મૂળ પ્રોટીન રચનાની જાળવણી 1.6. પ્રોટીનની વિવિધતા. ઇમ્યુનોગ્લોબ્યુલિનના ઉદાહરણનો ઉપયોગ કરીને પ્રોટીન પરિવારો 1.7. પ્રોટીનના ભૌતિક રાસાયણિક ગુણધર્મો અને તેમના વિભાજન માટેની પદ્ધતિઓ |
મોડ્યુલર યુનિટ 1 મોનોમેરિક પ્રોટીનનું માળખાકીય સંગઠન અને તેમની કામગીરીની મૂળભૂત બાબતો
શીખવાના ઉદ્દેશ્યો આમાં સક્ષમ બનો:
1. વંશપરંપરાગત અને હસ્તગત પ્રોટીનોપેથીના વિકાસની પદ્ધતિઓ સમજવા માટે પ્રોટીનની માળખાકીય વિશેષતાઓ અને તેમની રચના પર પ્રોટીન કાર્યોની અવલંબન વિશેના જ્ઞાનનો ઉપયોગ કરો.
2. પ્રોટીન સાથે ક્રિયાપ્રતિક્રિયા કરતા અને તેમની પ્રવૃત્તિમાં ફેરફાર કરતા લિગાન્ડ્સ તરીકે કેટલીક દવાઓની ઉપચારાત્મક ક્રિયાની પદ્ધતિઓ સમજાવો.
3. બદલાતી પરિસ્થિતિઓમાં તેમની માળખાકીય અને કાર્યાત્મક અસ્થિરતા અને વિકૃતિકરણની વૃત્તિને સમજવા માટે પ્રોટીનની રચના અને રચનાત્મક ક્ષમતા વિશેના જ્ઞાનનો ઉપયોગ કરો.
4. તબીબી સામગ્રી અને સાધનો તેમજ એન્ટિસેપ્ટિક્સને વંધ્યીકૃત કરવાના સાધન તરીકે ડિનેચરિંગ એજન્ટોના ઉપયોગને સમજાવો.
જાણો:
1. પ્રોટીનની માળખાકીય સંસ્થાના સ્તરો.
2. પ્રોટીનની પ્રાથમિક રચનાનું મહત્વ, જે તેમની માળખાકીય અને કાર્યાત્મક વિવિધતા નક્કી કરે છે.
3. પ્રોટીનમાં સક્રિય કેન્દ્રની રચનાની પદ્ધતિ અને લિગાન્ડ સાથે તેની વિશિષ્ટ ક્રિયાપ્રતિક્રિયા, જે પ્રોટીનની કામગીરીને અન્ડરલાઈઝ કરે છે.
4. પ્રોટીનની રચના અને કાર્યાત્મક પ્રવૃત્તિ પર એક્સોજેનસ લિગાન્ડ્સ (દવાઓ, ઝેર, ઝેર) ના પ્રભાવના ઉદાહરણો.
5. પ્રોટીન વિકૃતિકરણના કારણો અને પરિણામો, વિકૃતિકરણનું કારણ બને તેવા પરિબળો.
6. દવામાં એન્ટિસેપ્ટિક્સ અને તબીબી સાધનોને વંધ્યીકૃત કરવા માટેના માધ્યમો તરીકે ડિનેચરિંગ પરિબળોના ઉપયોગના ઉદાહરણો.
વિષય 1.1. પ્રોટીનનું માળખાકીય સંગઠન. મૂળ રચનાના તબક્કાઓ
પ્રોટીન રચનાઓ
પ્રોટીન એ પોલિમર પરમાણુઓ છે જેના મોનોમર્સ માત્ર 20 α-એમિનો એસિડ છે. પ્રોટીનમાં એમિનો એસિડના સંયોજનનો સમૂહ અને ક્રમ વ્યક્તિઓના ડીએનએમાં જનીનોની રચના દ્વારા નક્કી કરવામાં આવે છે. દરેક પ્રોટીન, તેની વિશિષ્ટ રચના અનુસાર, તેનું પોતાનું કાર્ય કરે છે. આપેલ જીવતંત્રના પ્રોટીનનો સમૂહ તેની ફિનોટાઇપિક લાક્ષણિકતાઓ, તેમજ વારસાગત રોગોની હાજરી અથવા તેમના વિકાસની સંભાવના નક્કી કરે છે.
1. એમિનો એસિડ જે પ્રોટીન બનાવે છે. પેપ્ટાઇડ બોન્ડ.પ્રોટીન એ મોનોમર્સમાંથી બનેલા પોલિમર છે - 20 α-એમિનો એસિડ, જેનું સામાન્ય સૂત્ર છે
એમિનો એસિડ α-કાર્બન અણુ સાથે જોડાયેલા રેડિકલના બંધારણ, કદ અને ભૌતિક રાસાયણિક ગુણધર્મોમાં અલગ પડે છે. એમિનો એસિડના કાર્યાત્મક જૂથો વિવિધ α-એમિનો એસિડના ગુણધર્મોની લાક્ષણિકતાઓ નક્કી કરે છે. α-એમિનો એસિડમાં જોવા મળતા રેડિકલને ઘણા જૂથોમાં વિભાજિત કરી શકાય છે:
પ્રોલાઇન,અન્ય 19 પ્રોટીન મોનોમર્સથી વિપરીત, તે એમિનો એસિડ નથી, પરંતુ પ્રોલાઇનમાં રહેલું રેડિકલ α-કાર્બન અણુ અને ઇમિનો જૂથ બંને સાથે સંકળાયેલું છે
 એમિનો એસિડ પાણીમાં દ્રાવ્યતામાં બદલાય છે.આ રેડિકલની પાણી (હાઈડ્રેટ) સાથે ક્રિયાપ્રતિક્રિયા કરવાની ક્ષમતાને કારણે છે.
એમિનો એસિડ પાણીમાં દ્રાવ્યતામાં બદલાય છે.આ રેડિકલની પાણી (હાઈડ્રેટ) સાથે ક્રિયાપ્રતિક્રિયા કરવાની ક્ષમતાને કારણે છે.
TO હાઇડ્રોફિલિકએનિઓનિક, કેશનિક અને ધ્રુવીય અનચાર્જ્ડ ફંક્શનલ જૂથો ધરાવતા રેડિકલનો સમાવેશ થાય છે.
TO હાઇડ્રોફોબિકમિથાઈલ જૂથો, એલિફેટિક સાંકળો અથવા રિંગ્સ ધરાવતા રેડિકલનો સમાવેશ થાય છે.
2. પેપ્ટાઈડ બોન્ડ એમિનો એસિડને પેપ્ટાઈડ્સ બનાવવા માટે જોડે છે.પેપ્ટાઇડ સંશ્લેષણ દરમિયાન, એક એમિનો એસિડનું α-કાર્બોક્સિલ જૂથ બીજા એમિનો એસિડના α-એમિનો જૂથ સાથે ક્રિયાપ્રતિક્રિયા કરે છે. પેપ્ટાઇડ બોન્ડ:
પ્રોટીન પોલીપેપ્ટાઈડ્સ છે, એટલે કે. પેપ્ટાઇડ બોન્ડ દ્વારા જોડાયેલા α-એમિનો એસિડના રેખીય પોલિમર (ફિગ. 1.1.)
 ચોખા. 1.1. પેપ્ટાઈડ્સની રચનાનું વર્ણન કરવા માટે વપરાતા શબ્દો
ચોખા. 1.1. પેપ્ટાઈડ્સની રચનાનું વર્ણન કરવા માટે વપરાતા શબ્દો
એમિનો એસિડના મોનોમર્સ કે જે પોલિપેપ્ટાઇડ્સ બનાવે છે તેને કહેવામાં આવે છે એમિનો એસિડ અવશેષો.પુનરાવર્તિત જૂથોની સાંકળ - NH-CH-CO- સ્વરૂપો પેપ્ટાઇડ બેકબોન.એક એમિનો એસિડ અવશેષો જેમાં મુક્ત α-એમિનો જૂથ હોય તેને N-ટર્મિનલ કહેવાય છે, અને જે મુક્ત α-કાર્બોક્સિલ જૂથ ધરાવે છે તેને C-ટર્મિનલ કહેવાય છે. પેપ્ટાઇડ્સ એન-ટર્મિનસથી સી-ટર્મિનસ સુધી લખવામાં અને વાંચવામાં આવે છે.
પ્રોલાઇનના ઇમિનો જૂથ દ્વારા રચાયેલ પેપ્ટાઇડ બોન્ડ અન્ય પેપ્ટાઇડ બોન્ડથી અલગ છે: પેપ્ટાઇડ જૂથના નાઇટ્રોજન અણુમાં હાઇડ્રોજનનો અભાવ હોય છે,
તેના બદલે, રેડિકલ સાથેનું બંધન છે, જેના પરિણામે રિંગની એક બાજુ પેપ્ટાઇડ બેકબોનમાં શામેલ છે:
 પેપ્ટાઈડ્સ એમિનો એસિડની રચના, એમિનો એસિડની સંખ્યા અને એમિનો એસિડ જોડાણના ક્રમમાં ભિન્ન છે, ઉદાહરણ તરીકે, સેર-આલા-ગ્લુ-ગીસ અને હિઝ-ગ્લુ-આલા-સેર બે અલગ અલગ પેપ્ટાઈડ્સ છે.
પેપ્ટાઈડ્સ એમિનો એસિડની રચના, એમિનો એસિડની સંખ્યા અને એમિનો એસિડ જોડાણના ક્રમમાં ભિન્ન છે, ઉદાહરણ તરીકે, સેર-આલા-ગ્લુ-ગીસ અને હિઝ-ગ્લુ-આલા-સેર બે અલગ અલગ પેપ્ટાઈડ્સ છે.
પેપ્ટાઇડ બોન્ડ્સ ખૂબ જ મજબૂત હોય છે, અને તેમના રાસાયણિક બિન-એન્જાઇમેટિક હાઇડ્રોલિસિસ માટે કઠોર પરિસ્થિતિઓની જરૂર પડે છે: જે પ્રોટીનનું વિશ્લેષણ કરવામાં આવે છે તે 24 કલાક માટે લગભગ 110 ° તાપમાને કેન્દ્રિત હાઇડ્રોક્લોરિક એસિડમાં હાઇડ્રોલાઇઝ્ડ થાય છે. જીવંત કોષમાં, પેપ્ટાઇડ બોન્ડ્સ દ્વારા તોડી શકાય છે પ્રોટીઓલિટીક ઉત્સેચકો,કહેવાય છે પ્રોટીઝઅથવા પેપ્ટાઇડ હાઇડ્રોલેઝ.
3. પ્રોટીનનું પ્રાથમિક માળખું.વિવિધ પ્રોટીનની પેપ્ટાઈડ સાંકળોમાં એમિનો એસિડ અવશેષો એકાંતરે અવ્યવસ્થિત નથી, પરંતુ ચોક્કસ ક્રમમાં ગોઠવાયેલા છે. પોલિપેપ્ટાઇડ સાંકળમાં એમિનો એસિડ અવશેષોનો રેખીય ક્રમ અથવા વૈકલ્પિક ક્રમ કહેવામાં આવે છે પ્રોટીનની પ્રાથમિક રચના.
દરેક વ્યક્તિગત પ્રોટીનનું પ્રાથમિક માળખું ડીએનએ પરમાણુમાં એન્કોડ કરવામાં આવે છે (જેને જનીન કહેવાય છે) અને તે ટ્રાન્સક્રિપ્શન (એમઆરએનએ પર માહિતીની નકલ) અને અનુવાદ (પ્રોટીનની પ્રાથમિક રચનાનું સંશ્લેષણ) દરમિયાન અનુભવાય છે. પરિણામે, વ્યક્તિગત વ્યક્તિના પ્રોટીનનું પ્રાથમિક માળખું માતા-પિતા પાસેથી બાળકોમાં વારસાગત રીતે પ્રસારિત થતી માહિતી છે, જે આપેલ જીવતંત્રના પ્રોટીનની માળખાકીય સુવિધાઓ નક્કી કરે છે, જેના પર હાલના પ્રોટીનનું કાર્ય નિર્ભર છે (ફિગ. 1.2.).
 ચોખા. 1.2. જીનોટાઇપ અને વ્યક્તિના શરીરમાં સંશ્લેષિત પ્રોટીનની રચના વચ્ચેનો સંબંધ
ચોખા. 1.2. જીનોટાઇપ અને વ્યક્તિના શરીરમાં સંશ્લેષિત પ્રોટીનની રચના વચ્ચેનો સંબંધ
માનવ શરીરમાં આશરે 100,000 વ્યક્તિગત પ્રોટીનમાંથી દરેકમાં હોય છે અનન્યપ્રાથમિક માળખું. સમાન પ્રકારના પ્રોટીનના પરમાણુઓ (ઉદાહરણ તરીકે, આલ્બ્યુમિન) એમિનો એસિડ અવશેષોની સમાન ફેરબદલ ધરાવે છે, જે આલ્બ્યુમિનને અન્ય કોઈપણ વ્યક્તિગત પ્રોટીનથી અલગ પાડે છે.
પેપ્ટાઇડ સાંકળમાં એમિનો એસિડ અવશેષોનો ક્રમ રેકોર્ડિંગ માહિતીનું એક સ્વરૂપ ગણી શકાય. આ માહિતી રેખીય પેપ્ટાઈડ સાંકળના અવકાશી ફોલ્ડિંગને વધુ કોમ્પેક્ટ ત્રિ-પરિમાણીય બંધારણમાં નિર્ધારિત કરે છે જેને કહેવાય છે. રચનાખિસકોલી કાર્યાત્મક રીતે સક્રિય પ્રોટીન રચનાની પ્રક્રિયા કહેવામાં આવે છે ફોલ્ડિંગ
4. પ્રોટીન રચના.પેપ્ટાઇડ જૂથના નાઇટ્રોજન અણુ અને પડોશી α-કાર્બન અણુ, તેમજ α-કાર્બન અણુ અને કાર્બોનિલ જૂથના કાર્બન વચ્ચે પેપ્ટાઇડ બેકબોનમાં મુક્ત પરિભ્રમણ શક્ય છે. એમિનો એસિડ અવશેષોના કાર્યાત્મક જૂથોની ક્રિયાપ્રતિક્રિયાને લીધે, પ્રોટીનનું પ્રાથમિક માળખું વધુ જટિલ અવકાશી માળખાં પ્રાપ્ત કરી શકે છે. ગ્લોબ્યુલર પ્રોટીનમાં, પેપ્ટાઇડ સાંકળોની રચનાના ફોલ્ડિંગના બે મુખ્ય સ્તરો છે: ગૌણઅને તૃતીય માળખું.
પ્રોટીનની ગૌણ રચનાપેપ્ટાઇડ બેકબોનના કાર્યાત્મક જૂથો -C=O અને -NH- વચ્ચે હાઇડ્રોજન બોન્ડની રચનાના પરિણામે રચાયેલી અવકાશી રચના છે. આ કિસ્સામાં, પેપ્ટાઇડ સાંકળ બે પ્રકારની નિયમિત રચનાઓ પ્રાપ્ત કરી શકે છે: α-હેલીસીસઅને β-સંરચના.
IN α-હેલીસીસહાઇડ્રોજન બોન્ડ કાર્બોનિલ જૂથના ઓક્સિજન અણુ અને તેમાંથી 4 થી એમિનો એસિડના એમાઇડ નાઇટ્રોજનના હાઇડ્રોજન વચ્ચે રચાય છે; એમિનો એસિડ અવશેષોની બાજુની સાંકળો
ગૌણ બંધારણની રચનામાં ભાગ લીધા વિના, સર્પાકારની પરિઘ સાથે સ્થિત છે (ફિગ. 1.3.).
બલ્ક રેડિકલ અથવા સમાન ચાર્જ વહન કરતા રેડિકલ α-હેલિક્સનું નિર્માણ અટકાવે છે. પ્રોલાઇન અવશેષો, જેમાં રિંગ માળખું હોય છે, તે α-હેલિક્સને અવરોધે છે, કારણ કે પેપ્ટાઇડ સાંકળમાં નાઇટ્રોજન અણુમાં હાઇડ્રોજનની અછતને કારણે હાઇડ્રોજન બોન્ડ બનાવવું અશક્ય છે. નાઇટ્રોજન અને α-કાર્બન અણુ વચ્ચેનું બંધન એ પ્રોલાઇન રિંગનો ભાગ છે, તેથી પેપ્ટાઇડ બેકબોન આ બિંદુએ વળેલું બને છે.
β-માળખુંએક પોલીપેપ્ટાઈડ સાંકળના પેપ્ટાઈડ બેકબોનના રેખીય પ્રદેશો વચ્ચે રચાય છે, ત્યાં ફોલ્ડ સ્ટ્રક્ચર્સ બનાવે છે. પોલીપેપ્ટાઈડ સાંકળો અથવા તેના ભાગો રચી શકે છે સમાંતરઅથવા એન્ટિસમાંતર β-સ્ટ્રક્ચર્સ.પ્રથમ કિસ્સામાં, ક્રિયાપ્રતિક્રિયા કરતી પેપ્ટાઇડ સાંકળોની N- અને C-ટર્મિની એકરૂપ થાય છે, અને બીજામાં તેઓ વિરુદ્ધ દિશા ધરાવે છે (ફિગ. 1.4).
ચોખા. 1.3. પ્રોટીન ગૌણ માળખું - α-હેલિક્સ
 ચોખા. 1.4. સમાંતર અને એન્ટિસમાંતર β-શીટ રચનાઓ
ચોખા. 1.4. સમાંતર અને એન્ટિસમાંતર β-શીટ રચનાઓ
β-સ્ટ્રક્ચર્સ વિશાળ તીરો દ્વારા સૂચવવામાં આવે છે: A - એન્ટિસમાંતર β-સ્ટ્રક્ચર. બી - સમાંતર β-શીટ રચનાઓ
કેટલાક પ્રોટીનમાં, વિવિધ પોલિપેપ્ટાઇડ સાંકળોના પેપ્ટાઇડ બેકબોનના અણુઓ વચ્ચે હાઇડ્રોજન બોન્ડની રચનાને કારણે β-સંરચના બની શકે છે.
પ્રોટીનમાં પણ જોવા મળે છે અનિયમિત ગૌણ સાથેના વિસ્તારોમાળખું, જેમાં પોલીપેપ્ટાઈડ બેકબોનનાં વળાંક, આંટીઓ અને વળાંકનો સમાવેશ થાય છે. તેઓ ઘણીવાર એવા સ્થળોએ સ્થિત હોય છે જ્યાં પેપ્ટાઇડ સાંકળની દિશા બદલાય છે, ઉદાહરણ તરીકે, જ્યારે સમાંતર β-શીટ માળખું રચાય છે.
α-હેલિસિસ અને β-સ્ટ્રક્ચર્સની હાજરીના આધારે, ગ્લોબ્યુલર પ્રોટીનને ચાર શ્રેણીઓમાં વિભાજિત કરી શકાય છે.
ચોખા. 1.5. મ્યોગ્લોબિન (A) અને હિમોગ્લોબિન β-ચેન (B) નું ગૌણ માળખું, જેમાં આઠ α-હેલીસ હોય છે
 ચોખા. 1.6. ટ્રાયઓસેફોસ્ફેટ આઇસોમેરેઝ અને પાયરુવેટ કિનેઝ ડોમેનનું ગૌણ માળખું
ચોખા. 1.6. ટ્રાયઓસેફોસ્ફેટ આઇસોમેરેઝ અને પાયરુવેટ કિનેઝ ડોમેનનું ગૌણ માળખું
 ચોખા. 1.7. ઇમ્યુનોગ્લોબ્યુલિન (A) અને એન્ઝાઇમ સુપરઓક્સાઇડ ડિસમ્યુટેઝ (B) ના સતત ડોમેનનું ગૌણ માળખું
ચોખા. 1.7. ઇમ્યુનોગ્લોબ્યુલિન (A) અને એન્ઝાઇમ સુપરઓક્સાઇડ ડિસમ્યુટેઝ (B) ના સતત ડોમેનનું ગૌણ માળખું
IN ચોથી શ્રેણીપ્રોટીનનો સમાવેશ થાય છે જેમાં નિયમિત ગૌણ રચનાઓની થોડી માત્રા હોય છે. આ પ્રોટીનમાં નાના સિસ્ટીન-સમૃદ્ધ પ્રોટીન અથવા મેટાલોપ્રોટીનનો સમાવેશ થાય છે.
પ્રોટીન તૃતીય માળખું- એમિનો એસિડ રેડિકલ વચ્ચેની ક્રિયાપ્રતિક્રિયાને કારણે રચનાનો એક પ્રકાર, જે પેપ્ટાઇડ સાંકળમાં એકબીજાથી નોંધપાત્ર અંતરે સ્થિત હોઈ શકે છે. મોટાભાગના પ્રોટીન ગ્લોબ્યુલ (ગ્લોબ્યુલર પ્રોટીન) જેવું જ અવકાશી માળખું બનાવે છે.
હાઇડ્રોફોબિક એમિનો એસિડ રેડિકલ કહેવાતા દ્વારા ભેગા થવાનું વલણ ધરાવે છે હાઇડ્રોફોબિક ક્રિયાપ્રતિક્રિયાઓઅને ઇન્ટરમોલેક્યુલર વેન ડેર વાલ્સ ફોર્સ, પ્રોટીન ગ્લોબ્યુલની અંદર એક ગાઢ હાઇડ્રોફોબિક કોર રચાય છે. હાઇડ્રોફિલિક ionized અને બિન-ionized રેડિકલ મુખ્યત્વે પ્રોટીનની સપાટી પર સ્થિત હોય છે અને પાણીમાં તેની દ્રાવ્યતા નક્કી કરે છે.
 ચોખા. 1.8. પ્રોટીનની તૃતીય રચનાની રચના દરમિયાન એમિનો એસિડ રેડિકલ વચ્ચે ઉદ્ભવતા બોન્ડના પ્રકાર
ચોખા. 1.8. પ્રોટીનની તૃતીય રચનાની રચના દરમિયાન એમિનો એસિડ રેડિકલ વચ્ચે ઉદ્ભવતા બોન્ડના પ્રકાર
1 - આયનીય બોન્ડ- સકારાત્મક અને નકારાત્મક ચાર્જ કાર્યાત્મક જૂથો વચ્ચે થાય છે;
2 - હાઇડ્રોજન બોન્ડ- હાઇડ્રોફિલિક અનચાર્જ્ડ જૂથ અને અન્ય કોઈપણ હાઇડ્રોફિલિક જૂથ વચ્ચે થાય છે;
3 - હાઇડ્રોફોબિક ક્રિયાપ્રતિક્રિયાઓ- હાઇડ્રોફોબિક રેડિકલ વચ્ચે ઊભી થાય છે;
4 - ડિસલ્ફાઇડ બોન્ડ- સિસ્ટીન અવશેષોના એસએચ જૂથોના ઓક્સિડેશન અને એકબીજા સાથે તેમની ક્રિયાપ્રતિક્રિયાને કારણે રચાય છે
હાઇડ્રોફોબિક કોરની અંદર જોવા મળતા હાઇડ્રોફિલિક એમિનો એસિડ અવશેષો એકબીજા સાથે સંપર્ક કરી શકે છે આયનીયઅને હાઇડ્રોજન બોન્ડ(ફિગ. 1.8).
આયોનિક અને હાઇડ્રોજન બોન્ડ્સ, તેમજ હાઇડ્રોફોબિક ક્રિયાપ્રતિક્રિયાઓ, નબળા છે: તેમની ઊર્જા ઓરડાના તાપમાને પરમાણુઓની થર્મલ ગતિની ઊર્જા કરતાં ઘણી વધારે નથી. પ્રોટીનની રચના આવા ઘણા નબળા બોન્ડની રચના દ્વારા જાળવવામાં આવે છે. પ્રોટીન બનાવે છે તે અણુઓ સતત ગતિમાં હોવાથી, કેટલાક નબળા બોન્ડ્સ તોડવાનું અને અન્ય બનાવવાનું શક્ય છે, જે પોલિપેપ્ટાઇડ સાંકળના વ્યક્તિગત વિભાગોની સહેજ હલનચલન તરફ દોરી જાય છે. કેટલાક તોડવા અને અન્ય નબળા બોન્ડ બનાવવાના પરિણામે રચના બદલવાની પ્રોટીનની આ મિલકત કહેવાય છે રચનાત્મક ક્ષમતા.
માનવ શરીરમાં એવી સિસ્ટમો છે જે સપોર્ટ કરે છે હોમિયોસ્ટેસિસ- સ્વસ્થ શરીર માટે અમુક સ્વીકાર્ય મર્યાદાઓમાં આંતરિક વાતાવરણની સ્થિરતા. હોમિયોસ્ટેસિસની સ્થિતિમાં, રચનામાં નાના ફેરફારો પ્રોટીનની એકંદર રચના અને કાર્યને વિક્ષેપિત કરતા નથી. પ્રોટીનની કાર્યાત્મક રીતે સક્રિય રચના કહેવામાં આવે છે મૂળ રચના.આંતરિક વાતાવરણમાં ફેરફારો (ઉદાહરણ તરીકે, ગ્લુકોઝ, Ca આયન, પ્રોટોન, વગેરેની સાંદ્રતા) પ્રોટીન કાર્યોની રચના અને વિક્ષેપમાં ફેરફાર તરફ દોરી જાય છે.
કેટલાક પ્રોટીનનું તૃતીય માળખું સ્થિર થાય છે ડિસલ્ફાઇડ બોન્ડ્સ,બે અવશેષોના -SH જૂથોની ક્રિયાપ્રતિક્રિયાને કારણે રચાય છે
 ચોખા. 1.9. પ્રોટીન પરમાણુમાં ડાયસલ્ફાઇડ બોન્ડની રચના
ચોખા. 1.9. પ્રોટીન પરમાણુમાં ડાયસલ્ફાઇડ બોન્ડની રચના
સિસ્ટીન (ફિગ. 1.9). મોટાભાગના અંતઃકોશિક પ્રોટીન તેમની તૃતીય રચનામાં સહસંયોજક ડિસલ્ફાઇડ બોન્ડ ધરાવતા નથી. તેમની હાજરી સેલ દ્વારા સ્ત્રાવિત પ્રોટીનની લાક્ષણિકતા છે, જે બાહ્યકોષીય પરિસ્થિતિઓમાં તેમની વધુ સ્થિરતાને સુનિશ્ચિત કરે છે. આમ, ઇન્સ્યુલિન અને ઇમ્યુનોગ્લોબ્યુલિનના પરમાણુઓમાં ડિસલ્ફાઇડ બોન્ડ હાજર છે.
ઇન્સ્યુલિન- સ્વાદુપિંડના β-સેલ્સમાં સંશ્લેષિત પ્રોટીન હોર્મોન અને લોહીમાં ગ્લુકોઝની સાંદ્રતામાં વધારો થવાના પ્રતિભાવમાં લોહીમાં સ્ત્રાવ થાય છે.
 ઇન્સ્યુલિનની રચનામાં, પોલિપેપ્ટાઇડ A અને B સાંકળોને જોડતા બે ડિસલ્ફાઇડ બોન્ડ છે, અને A સાંકળમાં એક ડિસલ્ફાઇડ બોન્ડ છે (ફિગ. 1.10).
ઇન્સ્યુલિનની રચનામાં, પોલિપેપ્ટાઇડ A અને B સાંકળોને જોડતા બે ડિસલ્ફાઇડ બોન્ડ છે, અને A સાંકળમાં એક ડિસલ્ફાઇડ બોન્ડ છે (ફિગ. 1.10).
ચોખા. 1.10. ઇન્સ્યુલિનની રચનામાં ડિસલ્ફાઇડ બોન્ડ્સ 5. પ્રોટીનનું સુપરસેકન્ડરી માળખું. વિવિધ પ્રાથમિક માળખું અને કાર્યો સાથે પ્રોટીનમાં, તેઓ ક્યારેક શોધી કાઢવામાં આવે છેસમાન સંયોજનો અને ગૌણ બંધારણોની સંબંધિત સ્થિતિ,
જેને સુપરસેકન્ડરી સ્ટ્રક્ચર કહેવામાં આવે છે. તે ગૌણ અને તૃતીય માળખાં વચ્ચે મધ્યવર્તી સ્થાન ધરાવે છે, કારણ કે તે પ્રોટીનની તૃતીય રચનાની રચનામાં ગૌણ માળખાના ઘટકોનું ચોક્કસ સંયોજન છે. સુપરસેકન્ડરી સ્ટ્રક્ચરના ચોક્કસ નામો હોય છે, જેમ કે “α-helix-turn-a-helix,” “leucine Zipper,” “zinc fingers,” વગેરે. આવા સુપરસેકન્ડરી સ્ટ્રક્ચર ડીએનએ-બંધનકર્તા પ્રોટીનની લાક્ષણિકતા છે."લ્યુસીન ઝિપર."
 આ પ્રકારની સુપરસેકન્ડરી સ્ટ્રક્ચરનો ઉપયોગ બે પ્રોટીનને એકસાથે જોડવા માટે થાય છે. ક્રિયાપ્રતિક્રિયા કરતા પ્રોટીનની સપાટી પર ઓછામાં ઓછા ચાર લ્યુસિન અવશેષો ધરાવતા α-હેલિકલ પ્રદેશો છે. α-હેલિક્સમાં લ્યુસિન અવશેષો છ એમિનો એસિડના અંતરે સ્થિત છે. α-હેલિક્સના દરેક વળાંકમાં 3.6 એમિનો એસિડ અવશેષો હોવાથી, લ્યુસિન રેડિકલ દરેક બીજા વળાંકની સપાટી પર સ્થિત છે. એક પ્રોટીનના α-હેલિક્સના લ્યુસિન અવશેષો બીજા પ્રોટીનના લ્યુસિન અવશેષો (હાઇડ્રોફોબિક ક્રિયાપ્રતિક્રિયાઓ) સાથે ક્રિયાપ્રતિક્રિયા કરી શકે છે, તેમને એકબીજા સાથે જોડે છે (ફિગ. 1.11.). ઘણા ડીએનએ બંધનકર્તા પ્રોટીન ઓલિગોમેરિક સંકુલમાં કાર્ય કરે છે જ્યાં વ્યક્તિગત સબ્યુનિટ્સ "લ્યુસીન ઝિપર્સ" દ્વારા એકબીજા સાથે જોડાયેલા હોય છે.
આ પ્રકારની સુપરસેકન્ડરી સ્ટ્રક્ચરનો ઉપયોગ બે પ્રોટીનને એકસાથે જોડવા માટે થાય છે. ક્રિયાપ્રતિક્રિયા કરતા પ્રોટીનની સપાટી પર ઓછામાં ઓછા ચાર લ્યુસિન અવશેષો ધરાવતા α-હેલિકલ પ્રદેશો છે. α-હેલિક્સમાં લ્યુસિન અવશેષો છ એમિનો એસિડના અંતરે સ્થિત છે. α-હેલિક્સના દરેક વળાંકમાં 3.6 એમિનો એસિડ અવશેષો હોવાથી, લ્યુસિન રેડિકલ દરેક બીજા વળાંકની સપાટી પર સ્થિત છે. એક પ્રોટીનના α-હેલિક્સના લ્યુસિન અવશેષો બીજા પ્રોટીનના લ્યુસિન અવશેષો (હાઇડ્રોફોબિક ક્રિયાપ્રતિક્રિયાઓ) સાથે ક્રિયાપ્રતિક્રિયા કરી શકે છે, તેમને એકબીજા સાથે જોડે છે (ફિગ. 1.11.). ઘણા ડીએનએ બંધનકર્તા પ્રોટીન ઓલિગોમેરિક સંકુલમાં કાર્ય કરે છે જ્યાં વ્યક્તિગત સબ્યુનિટ્સ "લ્યુસીન ઝિપર્સ" દ્વારા એકબીજા સાથે જોડાયેલા હોય છે.
આવા પ્રોટીનનું ઉદાહરણ હિસ્ટોન્સ છે. હિસ્ટોન્સ- ન્યુક્લિયર પ્રોટીન, જેમાં મોટી સંખ્યામાં પોઝિટિવ ચાર્જ્ડ એમિનો એસિડ હોય છે - આર્જિનિન અને લાયસિન (80% સુધી). હિસ્ટોન પરમાણુઓ ઓલિગોમેરિક કોમ્પ્લેક્સમાં જોડાય છે જેમાં આઠ મોનોમર્સ હોય છે જેમાં "લ્યુસીન ઝિપર્સ" નો ઉપયોગ કરવામાં આવે છે, આ પરમાણુઓના નોંધપાત્ર સમાન ચાર્જ હોવા છતાં.
"ઝીંક આંગળી"- સુપરસેકન્ડરી સ્ટ્રક્ચરનો એક પ્રકાર, ડીએનએ-બંધનકર્તા પ્રોટીનની લાક્ષણિકતા, પ્રોટીનની સપાટી પર વિસ્તરેલ ટુકડાનું સ્વરૂપ ધરાવે છે અને લગભગ 20 એમિનો એસિડ અવશેષો ધરાવે છે (ફિગ. 1.12). "વિસ્તૃત આંગળી" આકારને ચાર એમિનો એસિડ રેડિકલ - બે સિસ્ટીન અવશેષો અને બે હિસ્ટીડિન અવશેષો સાથે બંધાયેલા ઝીંક અણુ દ્વારા સપોર્ટેડ છે. કેટલાક કિસ્સાઓમાં, હિસ્ટીડાઇન અવશેષોને બદલે, સિસ્ટીન અવશેષો છે. લગભગ 12 એમિનો એસિડ અવશેષોનો સમાવેશ કરતી સિસ સિક્વન્સ દ્વારા બે નજીકથી પડેલા સિસ્ટીન અવશેષોને અન્ય બે જીસીલી અવશેષોથી અલગ કરવામાં આવે છે. પ્રોટીનનો આ પ્રદેશ α-હેલિક્સ બનાવે છે, જેનાં રેડિકલ ખાસ કરીને DNA ના મુખ્ય ગ્રુવના નિયમનકારી પ્રદેશો સાથે જોડાઈ શકે છે. વ્યક્તિગત બંધનકર્તા વિશિષ્ટતા
 ચોખા. 1.12. ડીએનએ-બંધનકર્તા પ્રોટીનના પ્રદેશનું પ્રાથમિક માળખું જે "ઝિંક ફિંગર" માળખું બનાવે છે (અક્ષરો એમિનો એસિડ સૂચવે છે જે આ માળખું બનાવે છે)
ચોખા. 1.12. ડીએનએ-બંધનકર્તા પ્રોટીનના પ્રદેશનું પ્રાથમિક માળખું જે "ઝિંક ફિંગર" માળખું બનાવે છે (અક્ષરો એમિનો એસિડ સૂચવે છે જે આ માળખું બનાવે છે)
નિયમનકારી ડીએનએ બંધનકર્તા પ્રોટીન ઝીંક આંગળીના પ્રદેશમાં સ્થિત એમિનો એસિડ અવશેષોના ક્રમ પર આધાર રાખે છે. આવી રચનાઓમાં, ખાસ કરીને, ટ્રાંસ્ક્રિપ્શનના નિયમનમાં સામેલ સ્ટેરોઇડ હોર્મોન્સ માટેના રીસેપ્ટર્સ (ડીએનએથી આરએનએ સુધીની માહિતી વાંચવી) હોય છે.
વિષય 1.2. પ્રોટીન કાર્યની મૂળભૂત બાબતો. પ્રોટીન કાર્યને અસર કરતી લિગાન્ડ્સ તરીકે દવાઓ
1. પ્રોટીનનું સક્રિય કેન્દ્ર અને લિગાન્ડ સાથે તેની ક્રિયાપ્રતિક્રિયા.તૃતીય માળખાના નિર્માણ દરમિયાન, કાર્યાત્મક રીતે સક્રિય પ્રોટીનની સપાટી પર એક પ્રદેશ રચાય છે, સામાન્ય રીતે વિરામમાં, એમિનો એસિડ રેડિકલ દ્વારા રચાય છે જે પ્રાથમિક બંધારણમાં એકબીજાથી દૂર હોય છે. આ પ્રદેશ, જે આપેલ પ્રોટીન માટે અનન્ય માળખું ધરાવે છે અને ચોક્કસ પરમાણુ અથવા સમાન અણુઓના જૂથ સાથે વિશિષ્ટ રીતે ક્રિયાપ્રતિક્રિયા કરવા સક્ષમ છે, તેને પ્રોટીન-લિગાન્ડ બંધનકર્તા સાઇટ અથવા સક્રિય સાઇટ કહેવામાં આવે છે. લિગાન્ડ્સ એ અણુઓ છે જે પ્રોટીન સાથે ક્રિયાપ્રતિક્રિયા કરે છે.
ઉચ્ચ વિશિષ્ટતાલિગાન્ડ સાથે પ્રોટીનની ક્રિયાપ્રતિક્રિયા લિગાન્ડની રચનામાં સક્રિય કેન્દ્રની રચનાની પૂરકતા દ્વારા સુનિશ્ચિત થાય છે.
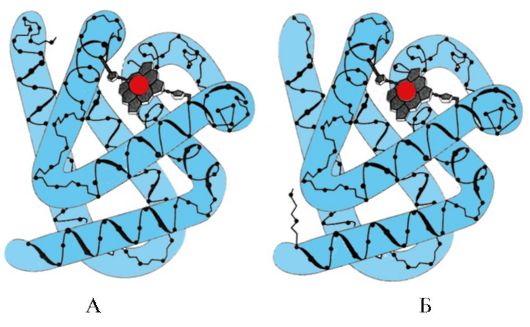
પૂરકતા- આ ક્રિયાપ્રતિક્રિયા કરતી સપાટીઓનો અવકાશી અને રાસાયણિક પત્રવ્યવહાર છે. સક્રિય કેન્દ્ર માત્ર તેમાં સમાવિષ્ટ લિગાન્ડને અવકાશી રૂપે અનુરૂપ હોવું જોઈએ નહીં, પરંતુ સક્રિય કેન્દ્રમાં સમાવિષ્ટ રેડિકલના કાર્યાત્મક જૂથો અને લિગાન્ડ જે લિગાન્ડ ધરાવે છે તે વચ્ચે બોન્ડ્સ (આયનીય, હાઇડ્રોજન અને હાઇડ્રોફોબિક ક્રિયાપ્રતિક્રિયાઓ) પણ રચાયેલા હોવા જોઈએ. સક્રિય કેન્દ્રમાં (ફિગ. 1.13).
 ચોખા. 1.13. લિગાન્ડ સાથે પ્રોટીનની પૂરક ક્રિયાપ્રતિક્રિયા
ચોખા. 1.13. લિગાન્ડ સાથે પ્રોટીનની પૂરક ક્રિયાપ્રતિક્રિયા
કેટલાક લિગાન્ડ્સ, જ્યારે પ્રોટીનના સક્રિય કેન્દ્ર સાથે જોડાયેલા હોય છે, ત્યારે પ્રોટીનની કામગીરીમાં સહાયક ભૂમિકા ભજવે છે. આવા લિગાન્ડ્સને કોફેક્ટર્સ કહેવામાં આવે છે, અને બિન-પ્રોટીન ભાગ ધરાવતા પ્રોટીન કહેવામાં આવે છે જટિલ પ્રોટીન(સાદા પ્રોટીનથી વિપરીત, જેમાં માત્ર પ્રોટીનનો ભાગ હોય છે). પ્રોટીન સાથે નિશ્ચિતપણે જોડાયેલ બિન-પ્રોટીન ભાગ કહેવાય છે કૃત્રિમ જૂથ.ઉદાહરણ તરીકે, મ્યોગ્લોબિન, હિમોગ્લોબિન અને સાયટોક્રોમ્સમાં એક પ્રોસ્થેટિક જૂથ, હેમ હોય છે, જેમાં આયર્ન આયન હોય છે, જે સક્રિય કેન્દ્ર સાથે નિશ્ચિતપણે જોડાયેલ હોય છે. હેમ ધરાવતા જટિલ પ્રોટીનને હિમોપ્રોટીન કહેવામાં આવે છે.
જ્યારે ચોક્કસ લિગાન્ડ્સ પ્રોટીન સાથે જોડાયેલા હોય છે, ત્યારે આ પ્રોટીનનું કાર્ય પ્રગટ થાય છે. આમ, લોહીના પ્લાઝ્મામાં સૌથી મહત્વપૂર્ણ પ્રોટીન એલ્બુમિન, હાઇડ્રોફોબિક લિગાન્ડ્સ, જેમ કે ફેટી એસિડ્સ, બિલીરૂબિન, કેટલીક દવાઓ વગેરેને સક્રિય કેન્દ્ર સાથે જોડીને તેનું પરિવહન કાર્ય દર્શાવે છે (ફિગ. 1.14)
પેપ્ટાઈડ સાંકળની ત્રિ-પરિમાણીય રચના સાથે ક્રિયાપ્રતિક્રિયા કરતા લિગાન્ડ્સ માત્ર ઓછા-પરમાણુ કાર્બનિક અને અકાર્બનિક અણુઓ જ નહીં, પણ મેક્રોમોલેક્યુલ્સ પણ હોઈ શકે છે:
ડીએનએ (ઉપર ચર્ચા કરેલ ડીએનએ-બંધનકર્તા પ્રોટીન સાથેના ઉદાહરણો);
પોલિસેકરાઇડ્સ;
 ચોખા. 1.14. જીનોટાઇપ અને ફેનોટાઇપ વચ્ચેનો સંબંધ
ચોખા. 1.14. જીનોટાઇપ અને ફેનોટાઇપ વચ્ચેનો સંબંધ
માનવ પ્રોટીનનું અનન્ય પ્રાથમિક માળખું, ડીએનએ પરમાણુમાં એન્કોડેડ, એક અનન્ય રચના, સક્રિય કેન્દ્ર માળખું અને પ્રોટીન કાર્યોના સ્વરૂપમાં કોષોમાં અનુભવાય છે.
આ કિસ્સાઓમાં, પ્રોટીન લિગાન્ડના ચોક્કસ પ્રદેશને ઓળખે છે જે બંધનકર્તા સ્થળને અનુરૂપ અને પૂરક છે. આમ, હેપેટોસાયટ્સની સપાટી પર હોર્મોન ઇન્સ્યુલિન માટે રીસેપ્ટર પ્રોટીન હોય છે, જેમાં પ્રોટીન માળખું પણ હોય છે. રીસેપ્ટર સાથે ઇન્સ્યુલિનની ક્રિયાપ્રતિક્રિયા તેની રચના અને સિગ્નલિંગ સિસ્ટમના સક્રિયકરણમાં ફેરફારનું કારણ બને છે, જે ભોજન પછી હેપેટોસાઇટ્સમાં પોષક તત્વોના સંગ્રહ તરફ દોરી જાય છે.
આમ, પ્રોટીનનું કાર્ય લિગાન્ડ સાથે પ્રોટીનના સક્રિય કેન્દ્રની ચોક્કસ ક્રિયાપ્રતિક્રિયા પર આધારિત છે.
2. ડોમેન માળખું અને પ્રોટીનની કામગીરીમાં તેની ભૂમિકા.ગ્લોબ્યુલર પ્રોટીનની લાંબી પોલીપેપ્ટાઈડ સાંકળો ઘણીવાર કેટલાક કોમ્પેક્ટ, પ્રમાણમાં સ્વતંત્ર પ્રદેશોમાં ફોલ્ડ થાય છે. તેમની પાસે સ્વતંત્ર તૃતીય માળખું છે, જે ગ્લોબ્યુલર પ્રોટીનની યાદ અપાવે છે, અને કહેવામાં આવે છે ડોમેન્સપ્રોટીનની ડોમેન સ્ટ્રક્ચરને લીધે, તેમની તૃતીય માળખું રચવામાં સરળ છે.
ડોમેન પ્રોટીનમાં, લિગાન્ડ બંધનકર્તા સાઇટ્સ ઘણીવાર ડોમેન્સ વચ્ચે સ્થિત હોય છે. આમ, ટ્રિપ્સિન એ પ્રોટીઓલિટીક એન્ઝાઇમ છે જે સ્વાદુપિંડના એક્ઝોક્રાઇન ભાગ દ્વારા ઉત્પન્ન થાય છે અને ખોરાક પ્રોટીનના પાચન માટે જરૂરી છે. તે બે-ડોમેન માળખું ધરાવે છે, અને તેના લિગાન્ડ સાથે ટ્રિપ્સિનના બંધનનું કેન્દ્ર - ફૂડ પ્રોટીન - બે ડોમેન્સ વચ્ચેના ખાંચમાં સ્થિત છે. સક્રિય કેન્દ્રમાં, ખાદ્ય પ્રોટીનની ચોક્કસ સાઇટના અસરકારક બંધન અને તેના પેપ્ટાઇડ બોન્ડના હાઇડ્રોલિસિસ માટે જરૂરી શરતો બનાવવામાં આવે છે.
જ્યારે સક્રિય કેન્દ્ર લિગાન્ડ (ફિગ. 1.15) સાથે ક્રિયાપ્રતિક્રિયા કરે છે ત્યારે પ્રોટીનમાંના વિવિધ ડોમેન્સ એકબીજાની સાપેક્ષમાં આગળ વધી શકે છે.
હેક્સોકિનેઝ- એક એન્ઝાઇમ જે ATP નો ઉપયોગ કરીને ગ્લુકોઝના ફોસ્ફોરાયલેશનને ઉત્પ્રેરિત કરે છે. એન્ઝાઇમની સક્રિય સાઇટ બે ડોમેન્સ વચ્ચેના ફાટમાં સ્થિત છે. જ્યારે હેક્સોકિનેઝ ગ્લુકોઝ સાથે જોડાય છે, ત્યારે તેની આસપાસના ડોમેન્સ બંધ થાય છે અને સબસ્ટ્રેટ ફસાઈ જાય છે, જ્યાં ફોસ્ફોરાયલેશન થાય છે (જુઓ. ફિગ. 1.15).
 ચોખા. 1.15. ગ્લુકોઝ માટે હેક્સોકિનેઝ ડોમેન્સનું બંધન
ચોખા. 1.15. ગ્લુકોઝ માટે હેક્સોકિનેઝ ડોમેન્સનું બંધન
કેટલાક પ્રોટીનમાં, ડોમેન્સ વિવિધ લિગાન્ડ્સ સાથે જોડાઈને સ્વતંત્ર કાર્યો કરે છે. આવા પ્રોટીનને મલ્ટિફંક્શનલ કહેવામાં આવે છે.
3. દવાઓ લિગાન્ડ્સ છે જે પ્રોટીનના કાર્યને અસર કરે છે.લિગાન્ડ્સ સાથે પ્રોટીનની ક્રિયાપ્રતિક્રિયા ચોક્કસ છે. જો કે, પ્રોટીન અને તેના સક્રિય કેન્દ્રની રચનાત્મક ક્ષમતાને લીધે, સક્રિય કેન્દ્ર અથવા પરમાણુના અન્ય ભાગમાં પ્રોટીન સાથે ક્રિયાપ્રતિક્રિયા કરી શકે તેવા અન્ય પદાર્થને પસંદ કરવાનું શક્ય છે.
કુદરતી લિગાન્ડ જેવી રચનામાં સમાન પદાર્થ કહેવાય છે લિગાન્ડનું માળખાકીય એનાલોગઅથવા બિન-કુદરતી લિગાન્ડ. તે સક્રિય સાઇટ પર પ્રોટીન સાથે પણ ક્રિયાપ્રતિક્રિયા કરે છે. લિગાન્ડનું માળખાકીય એનાલોગ બંને પ્રોટીન કાર્યને વધારી શકે છે (એગોનિસ્ટ),અને તેને ઘટાડો (વિરોધી).લિગાન્ડ અને તેના માળખાકીય એનાલોગ એક જ સ્થળ પર પ્રોટીન સાથે જોડાવા માટે એકબીજા સાથે સ્પર્ધા કરે છે. આવા પદાર્થો કહેવામાં આવે છે સ્પર્ધાત્મક મોડ્યુલેટર્સપ્રોટીન કાર્યોના (નિયમનકારો). ઘણી દવાઓ પ્રોટીન અવરોધક તરીકે કામ કરે છે. તેમાંના કેટલાક કુદરતી લિગાન્ડ્સના રાસાયણિક ફેરફાર દ્વારા મેળવવામાં આવે છે. પ્રોટીન કાર્યોના અવરોધકો દવાઓ અને ઝેર હોઈ શકે છે.
એટ્રોપિન એ એમ-કોલિનર્જિક રીસેપ્ટર્સનું સ્પર્ધાત્મક અવરોધક છે.એસીટીલ્કોલાઇન એ કોલિનર્જિક સિનેપ્સ દ્વારા ચેતા આવેગના પ્રસારણ માટે ચેતાપ્રેષક છે. ઉત્તેજના હાથ ધરવા માટે, સિનેપ્ટિક ક્લેફ્ટમાં મુક્ત થયેલ એસિટિલકોલાઇનને પોસ્ટસિનેપ્ટિક મેમ્બ્રેનના રીસેપ્ટર પ્રોટીન સાથે ક્રિયાપ્રતિક્રિયા કરવી આવશ્યક છે. બે પ્રકારના જોવા મળે છે કોલિનર્જિક રીસેપ્ટર્સ:
એમ રીસેપ્ટરએસિટિલકોલાઇન ઉપરાંત, તે પસંદગીયુક્ત રીતે મસ્કરીન (ફ્લાય એગેરિક ટોક્સિન) સાથે ક્રિયાપ્રતિક્રિયા કરે છે. એમ - કોલીનર્જિક રીસેપ્ટર્સ સરળ સ્નાયુઓ પર હાજર હોય છે અને, જ્યારે એસિટિલકોલાઇન સાથે ક્રિયાપ્રતિક્રિયા કરે છે, ત્યારે તેમના સંકોચનનું કારણ બને છે;
એચ રીસેપ્ટરખાસ કરીને નિકોટિન માટે બંધનકર્તા. N-cholinergic રીસેપ્ટર્સ સ્ટ્રાઇટેડ હાડપિંજરના સ્નાયુઓના ચેતોપાગમ પર જોવા મળે છે.
ચોક્કસ અવરોધક એમ-કોલિનર્જિક રીસેપ્ટર્સએટ્રોપિન છે. તે બેલાડોના અને હેનબેનના છોડમાં જોવા મળે છે.
 એટ્રોપીનમાં એસીટીલ્કોલાઇન અને તેમની અવકાશી ગોઠવણી જેવી જ રચનામાં કાર્યાત્મક જૂથો છે, તેથી તે એમ-કોલિનર્જિક રીસેપ્ટર્સનું સ્પર્ધાત્મક અવરોધક છે. એમ-કોલિનર્જિક રીસેપ્ટર્સ સાથે એસિટિલકોલાઇનનું બંધન સરળ સ્નાયુઓના સંકોચનનું કારણ બને છે તે ધ્યાનમાં લેતા, એટ્રોપિનનો ઉપયોગ એક દવા તરીકે થાય છે જે તેમના ખેંચાણને દૂર કરે છે. (એન્ટિસ્પેસ્મોડિક).આમ, ફન્ડસને જોતી વખતે આંખના સ્નાયુઓને આરામ આપવા માટે, તેમજ જઠરાંત્રિય કોલિક દરમિયાન ખેંચાણને દૂર કરવા માટે એટ્રોપિનનો ઉપયોગ કરવા માટે જાણીતું છે. સેન્ટ્રલ નર્વસ સિસ્ટમ (CNS) માં એમ-કોલિનર્જિક રીસેપ્ટર્સ પણ હાજર છે, તેથી એટ્રોપીનની મોટી માત્રા સેન્ટ્રલ નર્વસ સિસ્ટમમાંથી અનિચ્છનીય પ્રતિક્રિયા પેદા કરી શકે છે: મોટર અને માનસિક આંદોલન, આભાસ, આંચકી.
એટ્રોપીનમાં એસીટીલ્કોલાઇન અને તેમની અવકાશી ગોઠવણી જેવી જ રચનામાં કાર્યાત્મક જૂથો છે, તેથી તે એમ-કોલિનર્જિક રીસેપ્ટર્સનું સ્પર્ધાત્મક અવરોધક છે. એમ-કોલિનર્જિક રીસેપ્ટર્સ સાથે એસિટિલકોલાઇનનું બંધન સરળ સ્નાયુઓના સંકોચનનું કારણ બને છે તે ધ્યાનમાં લેતા, એટ્રોપિનનો ઉપયોગ એક દવા તરીકે થાય છે જે તેમના ખેંચાણને દૂર કરે છે. (એન્ટિસ્પેસ્મોડિક).આમ, ફન્ડસને જોતી વખતે આંખના સ્નાયુઓને આરામ આપવા માટે, તેમજ જઠરાંત્રિય કોલિક દરમિયાન ખેંચાણને દૂર કરવા માટે એટ્રોપિનનો ઉપયોગ કરવા માટે જાણીતું છે. સેન્ટ્રલ નર્વસ સિસ્ટમ (CNS) માં એમ-કોલિનર્જિક રીસેપ્ટર્સ પણ હાજર છે, તેથી એટ્રોપીનની મોટી માત્રા સેન્ટ્રલ નર્વસ સિસ્ટમમાંથી અનિચ્છનીય પ્રતિક્રિયા પેદા કરી શકે છે: મોટર અને માનસિક આંદોલન, આભાસ, આંચકી.
ડિટિલિન એ એચ-કોલિનર્જિક રીસેપ્ટર્સનું સ્પર્ધાત્મક એગોનિસ્ટ છે, જે ચેતાસ્નાયુ ચેતોપાગમના કાર્યને અવરોધે છે.
 હાડપિંજરના સ્નાયુઓના ન્યુરોમસ્ક્યુલર સિનેપ્સમાં એચ-કોલિનર્જિક રીસેપ્ટર્સ હોય છે. એસિટિલકોલાઇન સાથે તેમની ક્રિયાપ્રતિક્રિયા સ્નાયુ સંકોચન તરફ દોરી જાય છે. કેટલાક સર્જિકલ ઓપરેશન્સ દરમિયાન, તેમજ એન્ડોસ્કોપિક અભ્યાસોમાં, દવાઓનો ઉપયોગ કરવામાં આવે છે જે હાડપિંજરના સ્નાયુઓને આરામ આપે છે. (સ્નાયુ રાહત આપનાર).આમાં ડિથિલિનનો સમાવેશ થાય છે, જે એસિટિલકોલાઇનનું માળખાકીય એનાલોગ છે. તે એચ-કોલિનર્જિક રીસેપ્ટર્સને જોડે છે, પરંતુ એસિટિલકોલિનથી વિપરીત, તે ખૂબ જ ધીરે ધીરે એન્ઝાઇમ એસિટિલકોલિનેસ્ટેરેઝ દ્વારા નાશ પામે છે. આયન ચેનલોના લાંબા સમય સુધી ઉદઘાટન અને પટલના સતત વિધ્રુવીકરણના પરિણામે, ચેતા આવેગનું વહન વિક્ષેપિત થાય છે અને સ્નાયુઓમાં આરામ થાય છે. શરૂઆતમાં, આ ગુણધર્મો ક્યુરે ઝેરમાં મળી આવ્યા હતા, તેથી જ આવી દવાઓ કહેવામાં આવે છે ઉપચાર જેવું.
હાડપિંજરના સ્નાયુઓના ન્યુરોમસ્ક્યુલર સિનેપ્સમાં એચ-કોલિનર્જિક રીસેપ્ટર્સ હોય છે. એસિટિલકોલાઇન સાથે તેમની ક્રિયાપ્રતિક્રિયા સ્નાયુ સંકોચન તરફ દોરી જાય છે. કેટલાક સર્જિકલ ઓપરેશન્સ દરમિયાન, તેમજ એન્ડોસ્કોપિક અભ્યાસોમાં, દવાઓનો ઉપયોગ કરવામાં આવે છે જે હાડપિંજરના સ્નાયુઓને આરામ આપે છે. (સ્નાયુ રાહત આપનાર).આમાં ડિથિલિનનો સમાવેશ થાય છે, જે એસિટિલકોલાઇનનું માળખાકીય એનાલોગ છે. તે એચ-કોલિનર્જિક રીસેપ્ટર્સને જોડે છે, પરંતુ એસિટિલકોલિનથી વિપરીત, તે ખૂબ જ ધીરે ધીરે એન્ઝાઇમ એસિટિલકોલિનેસ્ટેરેઝ દ્વારા નાશ પામે છે. આયન ચેનલોના લાંબા સમય સુધી ઉદઘાટન અને પટલના સતત વિધ્રુવીકરણના પરિણામે, ચેતા આવેગનું વહન વિક્ષેપિત થાય છે અને સ્નાયુઓમાં આરામ થાય છે. શરૂઆતમાં, આ ગુણધર્મો ક્યુરે ઝેરમાં મળી આવ્યા હતા, તેથી જ આવી દવાઓ કહેવામાં આવે છે ઉપચાર જેવું.
વિષય 1.3. પ્રોટીનનું વિકૃતીકરણ અને તેમના સ્વયંસ્ફુરિત પુનર્જીવનની સંભાવના
1. પ્રોટીનની મૂળ રચના નબળા ક્રિયાપ્રતિક્રિયાઓને કારણે જાળવવામાં આવતી હોવાથી, પ્રોટીનની આસપાસના વાતાવરણની રચના અને ગુણધર્મોમાં ફેરફાર, રાસાયણિક રીએજન્ટ્સ અને ભૌતિક પરિબળોના સંપર્કમાં આવવાથી તેમની રચના (કન્ફોર્મેશનલ લેબિલિટીની મિલકત) માં ફેરફાર થાય છે. મોટી સંખ્યામાં બોન્ડ્સ તોડવાથી પ્રોટીનની મૂળ રચના અને વિકૃતિકરણનો વિનાશ થાય છે.
પ્રોટીનનું વિકૃતિકરણ- આ ડિનેચરિંગ એજન્ટોના પ્રભાવ હેઠળ તેમના મૂળ રચનાનો વિનાશ છે, જે નબળા બોન્ડના ભંગાણને કારણે થાય છે જે પ્રોટીનની અવકાશી રચનાને સ્થિર કરે છે. વિકૃતિકરણ એ અનન્ય ત્રિ-પરિમાણીય માળખું અને પ્રોટીનના સક્રિય કેન્દ્રના વિનાશ અને તેની જૈવિક પ્રવૃત્તિ (ફિગ. 1.16) ના નુકશાન સાથે છે.
એક પ્રોટીનના તમામ વિકૃત અણુઓ એક રેન્ડમ કન્ફોર્મેશન મેળવે છે જે સમાન પ્રોટીનના અન્ય પરમાણુઓથી અલગ હોય છે. એમિનો એસિડ રેડિકલ જે સક્રિય કેન્દ્ર બનાવે છે તે એકબીજાથી અવકાશી રીતે દૂર હોય છે, એટલે કે. લિગાન્ડ સાથે પ્રોટીનની ચોક્કસ બંધનકર્તા સ્થળનો નાશ થાય છે. વિકૃતિકરણ દરમિયાન, પ્રોટીનનું પ્રાથમિક માળખું યથાવત રહે છે.
જૈવિક સંશોધન અને દવામાં ડિનેચરિંગ એજન્ટોની અરજી.બાયોકેમિકલ અભ્યાસમાં, જૈવિક સામગ્રીમાં ઓછા પરમાણુ વજનના સંયોજનો નક્કી કરતા પહેલા, પ્રોટીનને સામાન્ય રીતે સૌ પ્રથમ ઉકેલમાંથી દૂર કરવામાં આવે છે. Trichloroacetic acid (TCA) નો ઉપયોગ મોટેભાગે આ હેતુ માટે થાય છે. સોલ્યુશનમાં TCA ઉમેર્યા પછી, વિકૃત પ્રોટીન અવક્ષેપિત થાય છે અને ગાળણ દ્વારા સરળતાથી દૂર થાય છે (કોષ્ટક 1.1.)
દવામાં, ડિનેચરિંગ એજન્ટ્સનો ઉપયોગ ઘણીવાર ઓટોક્લેવ્સમાં તબીબી સાધનો અને સામગ્રીને જંતુરહિત કરવા માટે થાય છે (ડિનેચરિંગ એજન્ટ ઉચ્ચ તાપમાન હોય છે) અને પેથોજેનિક માઇક્રોફ્લોરા ધરાવતી દૂષિત સપાટીઓની સારવાર માટે એન્ટિસેપ્ટિક્સ (આલ્કોહોલ, ફિનોલ, ક્લોરામાઇન) તરીકે.
2. સ્વયંસ્ફુરિત પ્રોટીન પુનઃસક્રિયકરણ- પ્રોટીનની પ્રાથમિક રચના, રચના અને કાર્યના નિર્ધારણનો પુરાવો. વ્યક્તિગત પ્રોટીન એ એક જનીનનાં ઉત્પાદનો છે જે સમાન એમિનો એસિડ ક્રમ ધરાવે છે અને કોષમાં સમાન રચના પ્રાપ્ત કરે છે. મૂળભૂત નિષ્કર્ષ કે પ્રોટીનની પ્રાથમિક રચનામાં તેની રચના અને કાર્ય વિશેની માહિતી પહેલાથી જ છે તે કેટલાક પ્રોટીન (ખાસ કરીને, રિબોન્યુક્લીઝ અને મ્યોગ્લોબિન) ની સ્વયંભૂ પુનર્જીવિત કરવાની ક્ષમતાના આધારે બનાવવામાં આવ્યું હતું - વિકૃતિકરણ પછી તેમના મૂળ સ્વરૂપને પુનઃસ્થાપિત કરો.
અવકાશી પ્રોટીન સ્ટ્રક્ચર્સની રચના સ્વ-એસેમ્બલીની પદ્ધતિ દ્વારા હાથ ધરવામાં આવે છે - એક સ્વયંસ્ફુરિત પ્રક્રિયા જેમાં એક અનન્ય પ્રાથમિક માળખું ધરાવતી પોલિપેપ્ટાઇડ સાંકળ ઉકેલમાં સૌથી ઓછી મુક્ત ઉર્જા સાથેનું સ્વરૂપ અપનાવવાનું વલણ ધરાવે છે. પ્રોટીનને પુનર્જીવિત કરવાની ક્ષમતા કે જે વિકૃતિકરણ પછી તેમનું પ્રાથમિક માળખું જાળવી રાખે છે તેનું વર્ણન એન્ઝાઇમ રિબોન્યુક્લીઝ સાથેના પ્રયોગમાં કરવામાં આવ્યું હતું.
રિબોન્યુક્લીઝ એ એક એન્ઝાઇમ છે જે આરએનએ પરમાણુમાં વ્યક્તિગત ન્યુક્લિયોટાઇડ્સ વચ્ચેના બોન્ડને તોડે છે. આ ગ્લોબ્યુલર પ્રોટીનમાં એક પોલિપેપ્ટાઇડ સાંકળ હોય છે, જેનું તૃતીય માળખું ઘણા નબળા અને ચાર ડિસલ્ફાઇડ બોન્ડ દ્વારા સ્થિર થાય છે.
યુરિયા સાથે રિબોન્યુક્લીઝની સારવાર, જે પરમાણુમાં હાઇડ્રોજન બોન્ડ તોડે છે, અને ઘટાડનાર એજન્ટ, જે ડિસલ્ફાઇડ બોન્ડ તોડે છે, તે એન્ઝાઇમના વિકૃતીકરણ અને તેની પ્રવૃત્તિને ગુમાવવા તરફ દોરી જાય છે.
ડાયાલિસિસ દ્વારા ડિનેચરિંગ એજન્ટોને દૂર કરવાથી પ્રોટીનની રચના અને કાર્ય પુનઃસ્થાપિત થાય છે, એટલે કે. પુનર્જન્મ માટે. (ફિગ. 1.17).
 ચોખા. 1.17. રિબોન્યુક્લીઝનું વિકૃતિકરણ અને પુનરુત્થાન
ચોખા. 1.17. રિબોન્યુક્લીઝનું વિકૃતિકરણ અને પુનરુત્થાન
A - રિબોન્યુક્લીઝનું મૂળ સ્વરૂપ, તૃતીય બંધારણમાં જેમાં ચાર ડિસલ્ફાઇડ બોન્ડ હોય છે; બી - વિકૃત રિબોન્યુક્લીઝ પરમાણુ;
B - પુનઃસ્થાપિત માળખું અને કાર્ય સાથે પુનઃસક્રિય થયેલ રિબોન્યુક્લીઝ પરમાણુ
1. કોષ્ટક 1.2 ભરો.
કોષ્ટક 1.2. રેડિકલની ધ્રુવીયતા અનુસાર એમિનો એસિડનું વર્ગીકરણ
2. ટેટ્રાપેપ્ટાઇડનું સૂત્ર લખો:
એએસપી - પ્રો - ફેન - લિઝ
a) પેપ્ટાઇડમાં પુનરાવર્તિત જૂથોને પ્રકાશિત કરો જે પેપ્ટાઇડ બેકબોન બનાવે છે અને એમિનો એસિડ રેડિકલ દ્વારા રજૂ કરાયેલ ચલ જૂથો;
b) N- અને C- ટર્મિનીને લેબલ કરો;
c) પેપ્ટાઇડ બોન્ડને હાઇલાઇટ કરો;
d) સમાન એમિનો એસિડ ધરાવતા અન્ય પેપ્ટાઇડ લખો;
e) સમાન એમિનો એસિડ રચના સાથે ટેટ્રાપેપ્ટાઇડના સંભવિત ચલોની સંખ્યા ગણો.
3. સ્તન્ય પ્રાણીઓમાં ગર્ભમાં રહેલા બચ્ચાની રક્ષા માટેનું આચ્છાદન - ઓક્સીટોસિન અને વાસોપ્રેસિન (કોષ્ટક 1.3) ના બે માળખાકીય રીતે સમાન અને ઉત્ક્રાંતિની રીતે બંધ પેપ્ટાઈડ હોર્મોન્સના તુલનાત્મક વિશ્લેષણના ઉદાહરણનો ઉપયોગ કરીને પ્રોટીનની પ્રાથમિક રચનાની ભૂમિકા સમજાવો.
કોષ્ટક 1.3. ઓક્સિટોસિન અને વાસોપ્રેસિનનું માળખું અને કાર્યો
 આ કરવા માટે:
આ કરવા માટે:
a) બે પેપ્ટાઈડ્સની રચના અને એમિનો એસિડ ક્રમની તુલના કરો;
b) બે પેપ્ટાઈડ્સની પ્રાથમિક રચનાની સમાનતા અને તેમની જૈવિક ક્રિયાની સમાનતા શોધો;
c) બે પેપ્ટાઇડ્સની રચનામાં તફાવત અને તેમના કાર્યોમાં તફાવત શોધો;
ડી) તેમના કાર્યો પર પેપ્ટાઇડ્સની પ્રાથમિક રચનાના પ્રભાવ વિશે નિષ્કર્ષ દોરો.
4. ગ્લોબ્યુલર પ્રોટીનની રચનાના મુખ્ય તબક્કાઓનું વર્ણન કરો (ગૌણ, તૃતીય માળખાં, સુપરસેકન્ડરી સ્ટ્રક્ચરનો ખ્યાલ). પ્રોટીન સ્ટ્રક્ચરની રચનામાં સામેલ બોન્ડના પ્રકારો સૂચવો. કયા એમિનો એસિડ રેડિકલ હાઇડ્રોફોબિક ક્રિયાપ્રતિક્રિયાઓ, આયનીય, હાઇડ્રોજન બોન્ડની રચનામાં ભાગ લઈ શકે છે.
ઉદાહરણો આપો.
5. "પ્રોટીનની રચનાત્મક ક્ષમતા" ની વિભાવનાને વ્યાખ્યાયિત કરો, તેના અસ્તિત્વ અને મહત્વના કારણો સૂચવો.
6. નીચેના વાક્યનો અર્થ વિસ્તૃત કરો: "પ્રોટીનનું કાર્ય લિગાન્ડ સાથેની તેમની ચોક્કસ ક્રિયાપ્રતિક્રિયા પર આધારિત છે," શબ્દોનો ઉપયોગ કરીને અને તેનો અર્થ સમજાવો: પ્રોટીન રચના, સક્રિય કેન્દ્ર, લિગાન્ડ, પૂરકતા, પ્રોટીન કાર્ય.
7. એક ઉદાહરણનો ઉપયોગ કરીને, સમજાવો કે ડોમેન્સ શું છે અને પ્રોટીનની કામગીરીમાં તેમની ભૂમિકા શું છે.
સ્વ-નિયંત્રણ કાર્યો
1. મેચ.
એમિનો એસિડ રેડિકલમાં કાર્યાત્મક જૂથ:
A. કાર્બોક્સિલ જૂથ B. હાઇડ્રોક્સિલ જૂથ C ગુઆનીડીન જૂથ D. થિયોલ જૂથ E. એમિનો જૂથ
2. સાચા જવાબો પસંદ કરો.
ધ્રુવીય અનચાર્જ્ડ રેડિકલવાળા એમિનો એસિડ છે:
A. Cis B. Asn
B. Glu G. થ્રી
3. સાચા જવાબો પસંદ કરો.
એમિનો એસિડ રેડિકલ:
A. પ્રાથમિક માળખાની વિશિષ્ટતા પ્રદાન કરો B. તૃતીય બંધારણની રચનામાં ભાગ લેવો
B. પ્રોટીનની સપાટી પર સ્થિત, તેઓ તેની દ્રાવ્યતા પર અસર કરે છે D. સક્રિય કેન્દ્ર બનાવે છે
D. પેપ્ટાઈડ બોન્ડની રચનામાં ભાગ લેવો
4. સાચા જવાબો પસંદ કરો.
એમિનો એસિડ રેડિકલ વચ્ચે હાઇડ્રોફોબિક ક્રિયાપ્રતિક્રિયાઓ રચાય છે:
A. ટ્રે લે B. પ્રો થ્રી
B. મેટ ઇલે જી. તીર આલા ડી. વાલ ફેન
5. સાચા જવાબો પસંદ કરો.
એમિનો એસિડ રેડિકલ વચ્ચે આયોનિક બોન્ડ રચી શકે છે:
A. Gln Asp B. એપ્રિલ લિઝ
B. Liz Glu G. Gis Asp D. Asn Apr
6. સાચા જવાબો પસંદ કરો.
એમિનો એસિડ રેડિકલ વચ્ચે હાઇડ્રોજન બોન્ડ રચી શકે છે:
A. Ser Gln B. Cis Tre
B. Asp Liz G. Glu Asp D. Asn Tre
7. મેચ.
પ્રોટીન સ્ટ્રક્ચરની રચનામાં સામેલ બોન્ડનો પ્રકાર:
A. પ્રાથમિક માળખું B. માધ્યમિક માળખું
B. તૃતીય માળખું
D. સુપરસેકન્ડરી સ્ટ્રક્ચર E. કન્ફોર્મેશન.
1. પેપ્ટાઇડ બેકબોનના અણુઓ વચ્ચે હાઇડ્રોજન બોન્ડ
2. એમિનો એસિડ રેડિકલના કાર્યાત્મક જૂથો વચ્ચે નબળા બોન્ડ
3. એમિનો એસિડના α-amino અને α-carboxyl જૂથો વચ્ચેના બોન્ડ
8. સાચા જવાબો પસંદ કરો. ટ્રિપ્સિન:
A. પ્રોટીઓલિટીક એન્ઝાઇમ B. બે ડોમેન્સ ધરાવે છે
B. હાઈડ્રોલાઈઝ સ્ટાર્ચ
D. સક્રિય સાઇટ ડોમેન્સ વચ્ચે સ્થિત છે. D. બે પોલીપેપ્ટાઈડ સાંકળોનો સમાવેશ કરે છે.
9. સાચા જવાબો પસંદ કરો. એટ્રોપિન:
A. ચેતાપ્રેષક
B. એસિટિલકોલાઇનનું માળખાકીય એનાલોગ
B. H-cholinergic રીસેપ્ટર્સ સાથે ક્રિયાપ્રતિક્રિયા કરે છે
D. કોલિનર્જિક સિનેપ્સ દ્વારા ચેતા આવેગના વહનને મજબૂત બનાવે છે
D. M-cholinergic રીસેપ્ટર્સના સ્પર્ધાત્મક અવરોધક
10. યોગ્ય નિવેદનો પસંદ કરો. પ્રોટીનમાં:
A. પ્રાથમિક માળખું તેની સક્રિય સાઇટની રચના વિશેની માહિતી ધરાવે છે
B. સક્રિય કેન્દ્ર પ્રાથમિક રચનાના સ્તરે રચાય છે
B. રચના સહસંયોજક બોન્ડ દ્વારા સખત રીતે નિશ્ચિત છે
D. સક્રિય સાઇટ સમાન લિગાન્ડ્સના જૂથ સાથે ક્રિયાપ્રતિક્રિયા કરી શકે છે
પ્રોટીન ડીની રચનાત્મક ક્ષમતાને કારણે. પર્યાવરણમાં થતા ફેરફારો સક્રિયની સંલગ્નતાને અસર કરી શકે છે
લિગાન્ડનું કેન્દ્ર
1. 1-B, 2-G, 3-B.
3. A, B, C, D.
7. 1-B, 2-D, 3-A.
8. A, B, C, D.
મૂળભૂત શરતો અને ખ્યાલો
1. પ્રોટીન, પોલિપેપ્ટાઇડ, એમિનો એસિડ
2. પ્રાથમિક, ગૌણ, તૃતીય પ્રોટીન માળખાં
3. રચના, મૂળ પ્રોટીન રચના
4. પ્રોટીનમાં સહસંયોજક અને નબળા બોન્ડ
5. રચનાત્મક ક્ષમતા
6. પ્રોટીન સક્રિય સાઇટ
7. લિગાન્ડ્સ
8. પ્રોટીન ફોલ્ડિંગ
9. લિગાન્ડ્સના માળખાકીય એનાલોગ
10. ડોમેન પ્રોટીન
11. સરળ અને જટિલ પ્રોટીન
12. પ્રોટીન ડિનેચરેશન, ડિનેચરિંગ એજન્ટ્સ
13. પ્રોટીનનું પુનઃસક્રિયકરણ
સમસ્યાઓ ઉકેલો
"પ્રોટીનનું માળખાકીય સંગઠન અને તેમની કામગીરીનો આધાર"
1. પ્રોટીનનું મુખ્ય કાર્ય - હિમોગ્લોબિન A (HbA) એ પેશીઓમાં ઓક્સિજનનું પરિવહન છે. માનવ વસ્તીમાં, બદલાયેલ ગુણધર્મો અને કાર્ય સાથે આ પ્રોટીનના બહુવિધ સ્વરૂપો જાણીતા છે - કહેવાતા અસામાન્ય હિમોગ્લોબિન. ઉદાહરણ તરીકે, હિમોગ્લોબિન એસ, સિકલ સેલ રોગ (HbS) ધરાવતા દર્દીઓના લાલ રક્ત કોશિકાઓમાં જોવા મળે છે, તે ઓક્સિજનના ઓછા આંશિક દબાણની સ્થિતિમાં ઓછી દ્રાવ્યતા હોવાનું જણાયું છે (જેમ કે વેનિસ લોહીમાં છે). આ આ પ્રોટીનના એકત્રીકરણની રચના તરફ દોરી જાય છે. પ્રોટીન તેનું કાર્ય ગુમાવે છે, અવક્ષેપ પામે છે, અને લાલ રક્ત કોશિકાઓ અનિયમિત આકારના બને છે (તેમાંથી કેટલાક સિકલ આકાર બનાવે છે) અને બરોળમાં સામાન્ય કરતાં વધુ ઝડપથી નાશ પામે છે. પરિણામે, સિકલ સેલ એનિમિયા વિકસે છે.
HbA ની પ્રાથમિક રચનામાં એકમાત્ર તફાવત હિમોગ્લોબિન β-ચેઈનના N-ટર્મિનલ પ્રદેશમાં જોવા મળ્યો હતો. β-સ્ટ્રૅન્ડના N-ટર્મિનલ પ્રદેશોની સરખામણી કરો અને બતાવો કે પ્રોટીનની પ્રાથમિક રચનામાં થતા ફેરફારો તેના ગુણધર્મો અને કાર્યોને કેવી રીતે અસર કરે છે.
 આ કરવા માટે:
આ કરવા માટે:
a) એમિનો એસિડના સૂત્રો લખો જેના દ્વારા HbA અલગ પડે છે અને આ એમિનો એસિડ (ધ્રુવીયતા, ચાર્જ) ના ગુણધર્મોની તુલના કરો.
b) દ્રાવ્યતામાં ઘટાડો અને પેશીઓમાં ઓક્સિજન પરિવહનના વિક્ષેપના કારણ વિશે નિષ્કર્ષ દોરો.
2. આકૃતિ પ્રોટીનની રચનાનું આકૃતિ દર્શાવે છે જેમાં લિગાન્ડ (સક્રિય કેન્દ્ર) સાથે બંધનકર્તા કેન્દ્ર હોય છે. લિગાન્ડની પસંદગીમાં પ્રોટીન શા માટે પસંદગીયુક્ત છે તે સમજાવો. આ કરવા માટે:
એ) પ્રોટીનનું સક્રિય કેન્દ્ર શું છે તે યાદ રાખો અને આકૃતિમાં બતાવેલ પ્રોટીનના સક્રિય કેન્દ્રની રચનાને ધ્યાનમાં લો;
b) એમિનો એસિડ રેડિકલના સૂત્રો લખો જે સક્રિય કેન્દ્ર બનાવે છે;
c) એક લિગાન્ડ દોરો જે ખાસ કરીને પ્રોટીનની સક્રિય સાઇટ સાથે ક્રિયાપ્રતિક્રિયા કરી શકે. તેના પર કાર્યાત્મક જૂથો સૂચવો જે એમિનો એસિડ રેડિકલ સાથે બોન્ડ બનાવી શકે છે જે સક્રિય કેન્દ્ર બનાવે છે;
d) સક્રિય કેન્દ્રના લિગાન્ડ અને એમિનો એસિડ રેડિકલ વચ્ચે ઉદ્ભવતા બોન્ડના પ્રકારો સૂચવે છે;
e) પ્રોટીન-લિગાન્ડ ક્રિયાપ્રતિક્રિયાની વિશિષ્ટતા શું આધારિત છે તે સમજાવો.
 3.
આકૃતિ પ્રોટીનની સક્રિય સાઇટ અને કેટલાક લિગાન્ડ્સ દર્શાવે છે.
3.
આકૃતિ પ્રોટીનની સક્રિય સાઇટ અને કેટલાક લિગાન્ડ્સ દર્શાવે છે.
પ્રોટીનની સક્રિય સાઇટ સાથે કયા લિગાન્ડની ક્રિયાપ્રતિક્રિયા થવાની સંભાવના છે અને શા માટે તે નક્કી કરો.
 પ્રોટીન-લિગાન્ડ કોમ્પ્લેક્સની રચના દરમિયાન કયા પ્રકારના બોન્ડ્સ ઉત્પન્ન થાય છે?
પ્રોટીન-લિગાન્ડ કોમ્પ્લેક્સની રચના દરમિયાન કયા પ્રકારના બોન્ડ્સ ઉત્પન્ન થાય છે?
4. કુદરતી પ્રોટીન લિગાન્ડ્સના માળખાકીય એનાલોગનો ઉપયોગ પ્રોટીનની પ્રવૃત્તિમાં ફેરફાર કરવા માટે દવાઓ તરીકે થઈ શકે છે.
એસીટીલ્કોલાઇન એ ચેતાસ્નાયુ ચેતોપાગમમાં ઉત્તેજના ટ્રાન્સમિશનનું મધ્યસ્થી છે. જ્યારે એસિટિલકોલાઇન પ્રોટીન સાથે ક્રિયાપ્રતિક્રિયા કરે છે - હાડપિંજરના સ્નાયુઓના પોસ્ટસિનેપ્ટિક પટલના રીસેપ્ટર્સ, આયન ચેનલો ખુલે છે અને સ્નાયુ સંકોચન થાય છે. ડિટિલિન એ સ્નાયુઓને આરામ કરવા માટે કેટલીક કામગીરીમાં વપરાતી દવા છે, કારણ કે તે ચેતાસ્નાયુ ચેતોપાગમ દ્વારા ચેતા આવેગના પ્રસારણને અવરોધે છે. ડિટિલિનની ક્રિયા કરવાની પદ્ધતિને સ્નાયુઓમાં રાહત આપનાર તરીકે સમજાવો. આ કરવા માટે:
એ) એસિટિલકોલાઇન અને ડિથિલિનના સૂત્રો લખો અને તેમની રચનાઓની તુલના કરો;
b) ડીટીલિનની હળવા અસરની પદ્ધતિનું વર્ણન કરો.
5. કેટલાક રોગોમાં, દર્દીના શરીરનું તાપમાન વધે છે, જે શરીરની રક્ષણાત્મક પ્રતિક્રિયા તરીકે ગણવામાં આવે છે. જો કે, ઉચ્ચ તાપમાન શરીરના પ્રોટીન માટે હાનિકારક છે. 40 ડિગ્રી સેલ્સિયસથી ઉપરના તાપમાને શા માટે પ્રોટીનનું કાર્ય ખોરવાય છે અને માનવ જીવન માટે જોખમ ઊભું થાય છે તે સમજાવો. આ કરવા માટે, યાદ રાખો:
1) પ્રોટીનનું માળખું અને બોન્ડ કે જે તેની રચનાને મૂળ સ્વરૂપમાં ધરાવે છે;
2) વધતા તાપમાન સાથે પ્રોટીનની રચના અને કાર્ય કેવી રીતે બદલાય છે?;
3) હોમિયોસ્ટેસિસ શું છે અને માનવ સ્વાસ્થ્ય જાળવવા માટે તે શા માટે મહત્વપૂર્ણ છે.
નિયમનકારી પ્રભાવોના લક્ષ્યો તરીકે મોડ્યુલર યુનિટ 2 ઓલિગોમેરિક પ્રોટીન. પ્રોટીનની માળખાકીય અને કાર્યાત્મક વિવિધતા. પ્રોટીનને અલગ કરવા અને શુદ્ધિકરણ માટેની પદ્ધતિઓ
શીખવાના ઉદ્દેશ્યો આમાં સક્ષમ બનો:
1. ઓલિગોમેરિક પ્રોટીનની રચના અને કાર્યોના લક્ષણો વિશેના જ્ઞાનનો ઉપયોગ તેમના કાર્યોના નિયમનની અનુકૂલનશીલ પદ્ધતિઓને સમજવા માટે કરો.
2. સેલ્યુલર પરિસ્થિતિઓમાં પ્રોટીન કન્ફોર્મેશનના સંશ્લેષણ અને જાળવણીમાં ચેપરોન્સની ભૂમિકા સમજાવો.
3. શરીરમાં સંશ્લેષિત પ્રોટીનની વિવિધ રચનાઓ અને કાર્યો દ્વારા જીવનના અભિવ્યક્તિઓની વિવિધતા સમજાવો.
4. સંબંધિત હિમોપ્રોટીન - મ્યોગ્લોબિન અને હિમોગ્લોબિન, તેમજ ઇમ્યુનોગ્લોબ્યુલિન પરિવારના પ્રોટીનના પાંચ વર્ગોના પ્રતિનિધિઓની તુલનાના ઉદાહરણોનો ઉપયોગ કરીને પ્રોટીનની રચના અને તેમના કાર્ય વચ્ચેના સંબંધનું વિશ્લેષણ કરો.
5. અન્ય પ્રોટીન અને અશુદ્ધિઓમાંથી તેમના શુદ્ધિકરણ માટેની પદ્ધતિઓ પસંદ કરવા માટે પ્રોટીનના ભૌતિક અને રાસાયણિક ગુણધર્મોની વિશિષ્ટતાઓ વિશેના જ્ઞાનનો ઉપયોગ કરો.
6. ક્લિનિકલ નિદાનની પુષ્ટિ કરવા અથવા સ્પષ્ટ કરવા માટે રક્ત પ્લાઝ્મા પ્રોટીનની માત્રાત્મક અને ગુણાત્મક રચનાના પરિણામોનું અર્થઘટન કરો.
જાણો:
1. હિમોગ્લોબિનના ઉદાહરણનો ઉપયોગ કરીને તેમના કાર્યોને નિયંત્રિત કરવા માટે ઓલિગોમેરિક પ્રોટીન અને અનુકૂલનશીલ મિકેનિઝમ્સની રચનાની સુવિધાઓ.
2. ચેપરોન્સની રચના અને કાર્યો અને સેલ્યુલર પરિસ્થિતિઓમાં પ્રોટીનની મૂળ રચના જાળવવા માટે તેમનું મહત્વ.
3. ઇમ્યુનોગ્લોબ્યુલિનના ઉદાહરણનો ઉપયોગ કરીને તેમની રચના અને કાર્યોની સમાનતાના આધારે પરિવારોમાં પ્રોટીનને જોડવાના સિદ્ધાંતો.
4. તેમના ભૌતિક રાસાયણિક ગુણધર્મોની લાક્ષણિકતાઓના આધારે પ્રોટીનને અલગ કરવાની પદ્ધતિઓ.
5. પ્રોટીનની ગુણાત્મક અને માત્રાત્મક રચનાનું મૂલ્યાંકન કરવાની પદ્ધતિ તરીકે રક્ત પ્લાઝ્માના ઇલેક્ટ્રોફોરેસિસ.
વિષય 1.4. હિમોગ્લોબીનના ઉદાહરણનો ઉપયોગ કરીને ઓલિગોમેરિક પ્રોટીનની રચના અને કાર્યની વિશેષતાઓ
1. ઘણા પ્રોટીનમાં ઘણી પોલિપેપ્ટાઈડ સાંકળો હોય છે. આવા પ્રોટીન કહેવામાં આવે છે ઓલિગોમેરિકઅને વ્યક્તિગત સાંકળો - પ્રોટોમર્સઓલિગોમેરિક પ્રોટીનમાં પ્રોટોમર્સ ઘણા નબળા બિન-સહસંયોજક બોન્ડ્સ (હાઇડ્રોફોબિક, આયનીય, હાઇડ્રોજન) દ્વારા જોડાયેલા હોય છે. ક્રિયાપ્રતિક્રિયા
protomers માટે આભાર હાથ ધરવામાં આવે છે પૂરકતાતેમની સંપર્ક સપાટીઓ.
ઓલિગોમેરિક પ્રોટીનમાં પ્રોટોમર્સની સંખ્યા મોટા પ્રમાણમાં બદલાઈ શકે છે: હિમોગ્લોબિનમાં 4 પ્રોટોમર હોય છે, એન્ઝાઇમ એસ્પાર્ટેટ એમિનોટ્રાન્સફેરેઝમાં 12 પ્રોટોમર્સ હોય છે, અને તમાકુ મોઝેક વાયરસ પ્રોટીનમાં 2120 પ્રોટોમર્સ હોય છે જે બિન-સહસંયોજક બોન્ડ દ્વારા જોડાયેલા હોય છે. પરિણામે, ઓલિગોમેરિક પ્રોટીન ખૂબ ઊંચા મોલેક્યુલર વજન ધરાવી શકે છે.
એક પ્રોટોમરની અન્યો સાથેની ક્રિયાપ્રતિક્રિયાને પ્રોટીન-લિગાન્ડની ક્રિયાપ્રતિક્રિયાનો વિશેષ કેસ ગણી શકાય, કારણ કે દરેક પ્રોટોમર અન્ય પ્રોટોમર માટે લિગાન્ડ તરીકે કામ કરે છે. પ્રોટીનમાં પ્રોટોમર્સને જોડવાની સંખ્યા અને પદ્ધતિ કહેવામાં આવે છે ચતુર્થાંશ પ્રોટીન માળખું.
પ્રોટીનમાં સમાન અથવા અલગ બંધારણના પ્રોટોમર્સ હોઈ શકે છે, ઉદાહરણ તરીકે, હોમોડાઈમર બે સરખા પ્રોટોમર્સ ધરાવતા પ્રોટીન છે, અને હેટરોડાઈમર બે અલગ અલગ પ્રોટોમર્સ ધરાવતા પ્રોટીન છે.
જો પ્રોટીનમાં અલગ-અલગ પ્રોટોમર્સ હોય, તો તેમના પર અલગ-અલગ લિગાન્ડ્સ સાથે બંધનકર્તા કેન્દ્રો રચી શકાય છે. જ્યારે લિગાન્ડ સક્રિય સાઇટ સાથે જોડાય છે, ત્યારે આ પ્રોટીનનું કાર્ય પ્રગટ થાય છે. અલગ પ્રોટોમર પર સ્થિત કેન્દ્રને એલોસ્ટેરિક (સક્રિય કરતા અલગ) કહેવામાં આવે છે. સંપર્ક કરી રહ્યા છેએલોસ્ટેરિક લિગાન્ડ અથવા અસરકર્તા, તે એક નિયમનકારી કાર્ય કરે છે (ફિગ. 1.18). અસરકર્તા સાથે એલોસ્ટેરિક કેન્દ્રની ક્રિયાપ્રતિક્રિયા તેની રચનાત્મક ક્ષમતાને કારણે સમગ્ર ઓલિગોમેરિક પ્રોટીનની રચનામાં રચનાત્મક ફેરફારોનું કારણ બને છે. આ ચોક્કસ લિગાન્ડ માટે સક્રિય સાઇટના જોડાણને અસર કરે છે અને તે પ્રોટીનના કાર્યને નિયંત્રિત કરે છે. ઓછામાં ઓછા એક લિગાન્ડ સાથે ઓલિગોમેરિક પ્રોટીનની ક્રિયાપ્રતિક્રિયા દરમિયાન તમામ પ્રોટોમર્સની રચના અને કાર્યમાં ફેરફારને સહકારી રચનાત્મક ફેરફારો કહેવામાં આવે છે. પ્રોટીન કાર્યને વધારે છે તેવા પ્રભાવોને કહેવામાં આવે છેસક્રિયકર્તાઓ, અને પ્રભાવકો જે તેના કાર્યને અવરોધે છે -
અવરોધકો.
 આમ, ઓલિગોમેરિક પ્રોટીન, તેમજ ડોમેન માળખું ધરાવતા પ્રોટીન, મોનોમેરિક પ્રોટીનની સરખામણીમાં એક નવી મિલકત ધરાવે છે - એલોસ્ટેરીલી રીતે કાર્યોને નિયંત્રિત કરવાની ક્ષમતા (પ્રોટીન સાથે વિવિધ લિગાન્ડ્સને જોડીને નિયમન). આને બે નજીકથી સંબંધિત જટિલ પ્રોટીન, મ્યોગ્લોબિન અને હિમોગ્લોબિનનાં બંધારણ અને કાર્યોની સરખામણી કરીને જોઈ શકાય છે.
આમ, ઓલિગોમેરિક પ્રોટીન, તેમજ ડોમેન માળખું ધરાવતા પ્રોટીન, મોનોમેરિક પ્રોટીનની સરખામણીમાં એક નવી મિલકત ધરાવે છે - એલોસ્ટેરીલી રીતે કાર્યોને નિયંત્રિત કરવાની ક્ષમતા (પ્રોટીન સાથે વિવિધ લિગાન્ડ્સને જોડીને નિયમન). આને બે નજીકથી સંબંધિત જટિલ પ્રોટીન, મ્યોગ્લોબિન અને હિમોગ્લોબિનનાં બંધારણ અને કાર્યોની સરખામણી કરીને જોઈ શકાય છે.
ચોખા. 1.18. ડાયમેરિક પ્રોટીનની રચનાની યોજના
2. અવકાશી રચનાઓનું નિર્માણ અને મ્યોગ્લોબિનની કામગીરી.
માયોગ્લોબિન (Mb) એ લાલ સ્નાયુઓમાં જોવા મળતું પ્રોટીન છે, જેનું મુખ્ય કાર્ય સ્નાયુઓના તીવ્ર કાર્ય માટે જરૂરી O 2 અનામત બનાવવાનું છે. Mb એ એક જટિલ પ્રોટીન છે જેમાં પ્રોટીન ભાગ - apoMb અને બિન-પ્રોટીન ભાગ - હેમ હોય છે. એપોએમબીનું પ્રાથમિક માળખું તેની કોમ્પેક્ટ ગ્લોબ્યુલર રચના અને સક્રિય કેન્દ્રનું માળખું નક્કી કરે છે, જેમાં માયોગ્લોબિનનો બિન-પ્રોટીન ભાગ, હેમ જોડાયેલ છે. રક્તમાંથી સ્નાયુઓમાં આવતો ઓક્સિજન મ્યોગ્લોબિનમાં Fe+2 હેમ્સ સાથે જોડાય છે. Mb એ એક મોનોમેરિક પ્રોટીન છે જે O 2 માટે ખૂબ જ ઉચ્ચ આકર્ષણ ધરાવે છે, તેથી મ્યોગ્લોબિન દ્વારા ઓક્સિજનનું પ્રકાશન માત્ર તીવ્ર સ્નાયુબદ્ધ કાર્ય દરમિયાન થાય છે, જ્યારે O 2 નું આંશિક દબાણ તીવ્રપણે ઘટે છે.લાલ સ્નાયુઓમાં, MV નું પ્રાથમિક માળખું, જે 153 એમિનો એસિડ અવશેષોના ચોક્કસ ક્રમ દ્વારા રજૂ થાય છે, તે અનુવાદ દરમિયાન રિબોઝોમ્સ પર સંશ્લેષણ કરવામાં આવે છે. Mb ની ગૌણ રચનામાં આઠ α-હેલીસ હોય છે, જેને A થી H સુધીના લેટિન અક્ષરોમાં કહેવાય છે, જેની વચ્ચે બિન-હેલિકલ પ્રદેશો હોય છે. Mb નું તૃતીય માળખું કોમ્પેક્ટ ગ્લોબ્યુલનું સ્વરૂપ ધરાવે છે, જેનું સક્રિય કેન્દ્ર F અને E α-હેલિસિસ (ફિગ. 1.19) વચ્ચે સ્થિત છે.
 ચોખા. 1.19. મ્યોગ્લોબિન માળખું
ચોખા. 1.19. મ્યોગ્લોબિન માળખું
3. એમવીના સક્રિય કેન્દ્રની રચના અને કામગીરીની સુવિધાઓ. Mb નું સક્રિય કેન્દ્ર મુખ્યત્વે હાઇડ્રોફોબિક એમિનો એસિડ રેડિકલ દ્વારા રચાય છે, જે પ્રાથમિક માળખામાં એકબીજાથી વ્યાપકપણે અંતરે છે (ઉદાહરણ તરીકે, ટ્રાઇ 3 9 અને ફેન 138) પાણીના લિગાન્ડ્સમાં નબળી રીતે દ્રાવ્ય - હેમ અને ઓ 2 - સક્રિય કેન્દ્ર સાથે જોડાય છે. હેમ એ એપોએમબી (ફિગ. 1.20) નો ચોક્કસ લિગાન્ડ છે, જેનો આધાર મિથેનાઇલ બ્રિજ દ્વારા જોડાયેલા ચાર પાયરોલ રિંગ્સનો બનેલો છે;કેન્દ્રમાં એક Fe+2 અણુ છે જે ચાર સંકલન બોન્ડ દ્વારા પિરોલ રિંગ્સના નાઇટ્રોજન અણુ સાથે જોડાયેલ છે. Mb ના સક્રિય કેન્દ્રમાં, હાઇડ્રોફોબિક એમિનો એસિડ રેડિકલ ઉપરાંત, હાઇડ્રોફિલિક રેડિકલવાળા બે એમિનો એસિડના અવશેષો પણ છે - જીસ ઇ 7(Gis 64) અને
 GIS F 8
GIS F 8
 (તેના 93) (ફિગ. 1.21).
(તેના 93) (ફિગ. 1.21).
ચોખા. 1.20. હેમનું માળખું - મ્યોગ્લોબિન અને હિમોગ્લોબિનનો બિન-પ્રોટીન ભાગ
જીસ ઇ 7ચોખા. 1.21. એપોમીયોગ્લોબિન અને હિમોગ્લોબિન પ્રોટોમર્સની સક્રિય સાઇટમાં હેમ અને O 2 નું સ્થાન હેમ એ એપોએમબી (ફિગ. 1.20) નો ચોક્કસ લિગાન્ડ છે, જેનો આધાર મિથેનાઇલ બ્રિજ દ્વારા જોડાયેલા ચાર પાયરોલ રિંગ્સનો બનેલો છે;હેમ લોખંડના અણુ દ્વારા તેમના F8 સાથે સહસંયોજક રીતે બંધાયેલ છે. O 2 હેમ પ્લેનની બીજી બાજુના લોખંડને જોડે છે. તેનું E 7 O 2 ની સાચી દિશા માટે જરૂરી છે અને Fe + 2 હેમમાં ઓક્સિજન ઉમેરવાની સુવિધા આપે છે.
Fe+ 2 સાથે સંકલન બોન્ડ બનાવે છે અને સક્રિય કેન્દ્રમાં હિમને નિશ્ચિતપણે ઠીક કરે છે.
Fe + 2 હેમ સાથેની ક્રિયાપ્રતિક્રિયા દરમિયાન અન્ય લિગાન્ડ - O 2 ના સક્રિય કેન્દ્રમાં યોગ્ય અભિગમ માટે જરૂરી. હેમ માઇક્રોએનવાયરમેન્ટ O 2 થી Fe + 2 ના મજબૂત પરંતુ ઉલટાવી શકાય તેવા બંધન માટે શરતો બનાવે છે અને પાણીને હાઇડ્રોફોબિક સક્રિય સાઇટમાં પ્રવેશતા અટકાવે છે, જે તેના ઓક્સિડેશનને Fe + 3 તરફ દોરી શકે છે.- પ્રોટીનનું કુટુંબ, જેમ કે મ્યોગ્લોબિન, જટિલ પ્રોટીન (હિમોપ્રોટીન) થી સંબંધિત. તેમની પાસે ટેટ્રામેરિક માળખું છે અને તેમાં બે α-સાંકળો છે, પરંતુ અન્ય બે પોલિપેપ્ટાઇડ સાંકળો (2α-, 2x-ચેન) ની રચનામાં અલગ છે. બીજી પોલિપેપ્ટાઇડ સાંકળનું માળખું Hb ના આ સ્વરૂપોની કામગીરીની લાક્ષણિકતાઓ નક્કી કરે છે. પુખ્ત વ્યક્તિના લાલ રક્તકણોમાં લગભગ 98% હિમોગ્લોબિન હોય છે હિમોગ્લોબિન એ(2α-, 2p-ચેઇન્સ).
ગર્ભના વિકાસ દરમિયાન, બે મુખ્ય પ્રકારના હિમોગ્લોબિન કાર્ય કરે છે: ગર્ભ Hb(2α, 2ε), જે ગર્ભ વિકાસના પ્રારંભિક તબક્કામાં જોવા મળે છે, અને હિમોગ્લોબિન એફ (ગર્ભ)- (2α, 2γ), જે ગર્ભાશયના વિકાસના છઠ્ઠા મહિનામાં પ્રારંભિક ગર્ભ હિમોગ્લોબિનને બદલે છે અને જન્મ પછી જ Hb A દ્વારા બદલવામાં આવે છે.
Hb A એ પુખ્ત લાલ રક્ત કોશિકાઓમાં જોવા મળતા માયોગ્લોબિન (Mb) થી સંબંધિત પ્રોટીન છે. તેના વ્યક્તિગત પ્રોટોમર્સની રચના મ્યોગ્લોબિન જેવી જ છે. મ્યોગ્લોબિન અને હિમોગ્લોબિન પ્રોટોમર્સની ગૌણ અને તૃતીય રચનાઓ ખૂબ સમાન છે, હકીકત એ છે કે તેમની પોલિપેપ્ટાઇડ સાંકળોની પ્રાથમિક રચનામાં માત્ર 24 એમિનો એસિડ અવશેષો સમાન છે (હિમોગ્લોબિન પ્રોટોમર્સની ગૌણ રચના, મ્યોગ્લોબિન જેવી, આઠ α-હેલિસિસ ધરાવે છે, A થી H સુધીના લેટિન અક્ષરો દ્વારા નિયુક્ત, અને તૃતીય માળખું કોમ્પેક્ટ ગ્લોબ્યુલનું સ્વરૂપ ધરાવે છે). પરંતુ મ્યોગ્લોબિનથી વિપરીત, હિમોગ્લોબિન એક ઓલિગોમેરિક માળખું ધરાવે છે, જેમાં બિન-સહસંયોજક બોન્ડ્સ (આકૃતિ 1.22) દ્વારા જોડાયેલ ચાર પોલિપેપ્ટાઇડ સાંકળોનો સમાવેશ થાય છે.
દરેક Hb પ્રોટોમર બિન-પ્રોટીન ભાગ - હેમ અને પડોશી પ્રોટોમર્સ સાથે સંકળાયેલું છે. હેમ સાથે Hb ના પ્રોટીન ભાગનું જોડાણ મ્યોગ્લોબિન જેવું જ છે: પ્રોટીનના સક્રિય કેન્દ્રમાં, હિમના હાઇડ્રોફોબિક ભાગો હાઇડ્રોફોબિક એમિનો એસિડ રેડિકલથી ઘેરાયેલા હોય છે, તેમના F 8 અને તેમના E 7 સિવાય, જે હેમ પ્લેનની બંને બાજુઓ પર સ્થિત છે અને પ્રોટીનની કામગીરી અને ઓક્સિજન સાથે તેના બંધનમાં સમાન ભૂમિકા ભજવે છે (મ્યોગ્લોબિનનું માળખું જુઓ).
 ચોખા. 1.22. હિમોગ્લોબિનનું ઓલિગોમેરિક માળખું
ચોખા. 1.22. હિમોગ્લોબિનનું ઓલિગોમેરિક માળખું
ઉપરાંત, હેમ એ એપોએમબી (ફિગ. 1.20) નો ચોક્કસ લિગાન્ડ છે, જેનો આધાર મિથેનાઇલ બ્રિજ દ્વારા જોડાયેલા ચાર પાયરોલ રિંગ્સનો બનેલો છે;મહત્વપૂર્ણ કાર્ય કરે છે વધારાની ભૂમિકા Nv ની કામગીરીમાં. ફ્રી હેમમાં O2 કરતાં CO માટે 25,000 ગણી વધારે એફિનિટી છે.
5. HB નું મુખ્ય કાર્ય ફેફસાંમાંથી પેશીઓમાં O2 નું પરિવહન છે.મોનોમેરિક મ્યોગ્લોબિનથી વિપરીત, જે O2 માટે ખૂબ જ વધારે આકર્ષણ ધરાવે છે અને લાલ સ્નાયુઓમાં ઓક્સિજન સંગ્રહિત કરવાનું કાર્ય કરે છે, હિમોગ્લોબિનનું ઓલિગોમેરિક માળખું પ્રદાન કરે છે:
1) ફેફસામાં ઓક્સિજન સાથે HB ની ઝડપી સંતૃપ્તિ;
2) O 2 (20-40 mm Hg) ના પ્રમાણમાં ઊંચા આંશિક દબાણે પેશીઓમાં ઓક્સિજન છોડવાની HBની ક્ષમતા;
3) Hb થી O 2 ના જોડાણને નિયંત્રિત કરવાની સંભાવના.
6. હિમોગ્લોબિન પ્રોટોમર્સની રચનામાં સહકારી ફેરફારો ફેફસામાં O 2 ના બંધનને વેગ આપે છે અને પેશીઓમાં તેના પ્રકાશનને વેગ આપે છે. ફેફસાંમાં, O 2 નું ઉચ્ચ આંશિક દબાણ ચાર પ્રોટોમર (2α અને 2β) ની સક્રિય સાઇટ પર Hb સાથે તેના બંધનને પ્રોત્સાહન આપે છે. દરેક પ્રોટોમરનું સક્રિય કેન્દ્ર, માયોગ્લોબિનની જેમ, હાઇડ્રોફોબિક ખિસ્સામાં બે α-હેલિસિસ (F અને E) વચ્ચે સ્થિત છે. તેમાં બિન-પ્રોટીન ભાગ છે - હીમ, જે પ્રોટીન ભાગ સાથે ઘણા નબળા હાઇડ્રોફોબિક ક્રિયાપ્રતિક્રિયાઓ દ્વારા જોડાયેલ છે અને Fe 2 + heme અને હિઝ F 8 વચ્ચે એક મજબૂત બંધન (જુઓ. ફિગ. 1.21).
ડીઓક્સીહેમોગ્લોબિનમાં, તેના F 8 સાથેના આ જોડાણને કારણે, Fe 2 + અણુ હિમ પ્લેનમાંથી હિસ્ટિડિન તરફ આગળ વધે છે. O 2 થી Fe 2 + નું બંધન હિઝ E 7 પ્રદેશમાં હેમની બીજી બાજુએ સિંગલ ફ્રી કોઓર્ડિનેશન બોન્ડનો ઉપયોગ કરીને થાય છે. તેનું E 7 O 2 ને હેમ આયર્ન સાથે જોડવા માટે શ્રેષ્ઠ પરિસ્થિતિઓ પ્રદાન કરે છે.
એક પ્રોટોમરના Fe + 2 અણુમાં O 2 ના ઉમેરાથી તેની હિમ પ્લેનમાં હિલચાલ થાય છે, ત્યારબાદ તેની સાથે સંકળાયેલ હિસ્ટીડિન અવશેષો
 ચોખા. 1.23. જ્યારે O 2 સાથે જોડવામાં આવે ત્યારે હિમોગ્લોબિન પ્રોટોમરની રચનામાં ફેરફાર
ચોખા. 1.23. જ્યારે O 2 સાથે જોડવામાં આવે ત્યારે હિમોગ્લોબિન પ્રોટોમરની રચનામાં ફેરફાર
આ તેમની રચનાત્મક ક્ષમતાને કારણે તમામ પોલિપેપ્ટાઇડ સાંકળોની રચનામાં ફેરફાર તરફ દોરી જાય છે. અન્ય સાંકળોની રચના બદલવાથી અનુગામી O 2 પરમાણુઓ સાથે તેમની ક્રિયાપ્રતિક્રિયાને સરળ બનાવે છે.
ચોથો O 2 પરમાણુ પ્રથમ કરતા 300 ગણું સરળ હિમોગ્લોબિન સાથે જોડાય છે (ફિગ. 1.24).
 ચોખા. 1.24. O2 સાથે તેની ક્રિયાપ્રતિક્રિયા દરમિયાન હિમોગ્લોબિન પ્રોટોમર્સની રચનામાં સહકારી ફેરફારો
ચોખા. 1.24. O2 સાથે તેની ક્રિયાપ્રતિક્રિયા દરમિયાન હિમોગ્લોબિન પ્રોટોમર્સની રચનામાં સહકારી ફેરફારો
પેશીઓમાં, દરેક અનુગામી O 2 પરમાણુ અગાઉના એક કરતાં વધુ સરળતાથી છૂટા પડે છે, પ્રોટોમર્સની રચનામાં સહકારી ફેરફારોને કારણે પણ.
7. કાર્બનિક પદાર્થોના અપચય દરમિયાન રચાયેલી CO 2 અને H+, તેમની સાંદ્રતાના પ્રમાણમાં O 2 માટે હિમોગ્લોબિનનું આકર્ષણ ઘટાડે છે. હિમોગ્લોબિન દ્વારા ફેફસાંમાંથી વિતરિત O 2 નો ઉપયોગ કરીને કાર્બનિક પદાર્થોના ઓક્સિડેશન દરમિયાન કોષની કામગીરી માટે જરૂરી ઊર્જા મુખ્યત્વે મિટોકોન્ડ્રિયામાં ઉત્પન્ન થાય છે. કાર્બનિક પદાર્થોના ઓક્સિડેશનના પરિણામે, તેમના વિઘટનના અંતિમ ઉત્પાદનો રચાય છે: CO 2 અને K 2 O, જેનું પ્રમાણ ચાલુ ઓક્સિડેશન પ્રક્રિયાઓની તીવ્રતાના પ્રમાણસર છે.
CO 2 કોષોમાંથી લોહીમાં ફેલાય છે અને લાલ રક્ત કોશિકાઓમાં પ્રવેશ કરે છે, જ્યાં એન્ઝાઇમ કાર્બનહાઇડ્રેઝની ક્રિયા હેઠળ, તે કાર્બોનિક એસિડમાં રૂપાંતરિત થાય છે. આ નબળા એસિડ પ્રોટોન અને બાયકાર્બોનેટ આયનમાં અલગ પડે છે.
H+ તેના રેડિકલ્સમાં જોડાવા માટે સક્ષમ છે 14 6 હિમોગ્લોબિનની α- અને β- સાંકળોમાં, એટલે કે. હેમથી દૂરના વિસ્તારોમાં. હિમોગ્લોબિનનું પ્રોટોનેશન O 2 માટે તેની આકર્ષણ ઘટાડે છે, oxyHb માંથી O 2 ને દૂર કરવા, deoxyHb ની રચનાને પ્રોત્સાહન આપે છે, અને રચાયેલા પ્રોટોનની સંખ્યાના પ્રમાણમાં પેશીઓને ઓક્સિજનનો પુરવઠો વધારે છે (ફિગ. 1.25).
લાલ રક્ત કોશિકાઓમાં H+ સાંદ્રતાના વધારાને આધારે પ્રકાશિત ઓક્સિજનના જથ્થામાં વધારો બોહર અસર કહેવાય છે (ડેનિશ ફિઝિયોલોજિસ્ટ ક્રિશ્ચિયન બોહરના નામ પરથી નામ આપવામાં આવ્યું છે, જેમણે આ અસરની પ્રથમ શોધ કરી હતી).
ફેફસાંમાં, ઓક્સિજનનું ઊંચું આંશિક દબાણ તેના ડીઓક્સીએચબી સાથે બંધનને પ્રોત્સાહન આપે છે, જે H+ માટે પ્રોટીનનું આકર્ષણ ઘટાડે છે. કાર્બોનિક એસિડની ક્રિયા હેઠળ મુક્ત થયેલા પ્રોટોન બાયકાર્બોનેટ સાથે પ્રતિક્રિયા કરીને CO 2 અને H 2 O બનાવે છે

 ચોખા. 1.25. CO 2 અને પ્રોટોન (બોહર અસર) ની સાંદ્રતા પર O 2 માટે Hb ના આકર્ષણનું અવલંબન:
ચોખા. 1.25. CO 2 અને પ્રોટોન (બોહર અસર) ની સાંદ્રતા પર O 2 માટે Hb ના આકર્ષણનું અવલંબન:
એ- HB (બોહર અસર) સાથેના સંકુલમાંથી O 2 ના પ્રકાશન પર CO 2 અને H+ સાંદ્રતાનો પ્રભાવ; બી- ફેફસામાં ડીઓક્સીહેમોગ્લોબિનનું ઓક્સિજનેશન, CO 2 નું નિર્માણ અને પ્રકાશન.
પરિણામી CO 2 મૂર્ધન્ય અવકાશમાં પ્રવેશ કરે છે અને બહાર નીકળેલી હવા સાથે દૂર કરવામાં આવે છે. આમ, પેશીઓમાં હિમોગ્લોબિન દ્વારા પ્રકાશિત ઓક્સિજનની માત્રા કાર્બનિક પદાર્થોના અપચયના ઉત્પાદનો દ્વારા નિયંત્રિત થાય છે: પદાર્થોનું વધુ તીવ્ર વિભાજન, ઉદાહરણ તરીકે શારીરિક કસરત દરમિયાન, CO 2 અને H + ની સાંદ્રતા વધુ અને વધુ ઓક્સિજન. O 2 માટે Hb ના આકર્ષણમાં ઘટાડો થવાના પરિણામે પેશીઓ પ્રાપ્ત થાય છે.
8. લિગાન્ડ - 2,3-બિસ્ફોસ્ફોગ્લિસેરેટ દ્વારા O2 માટે Hb ની એફિનિટીનું એલોસ્ટેરિક નિયમન.એરિથ્રોસાઇટ્સમાં, હિમોગ્લોબિનના એલોસ્ટેરિક લિગાન્ડ, 2,3-બિસ્ફોસ્ફોગ્લિસેરેટ (2,3-BPG), ગ્લુકોઝ ઓક્સિડેશનના ઉત્પાદનમાંથી સંશ્લેષણ કરવામાં આવે છે - 1,3-બિસ્ફોસ્ફોગ્લિસેરેટ. સામાન્ય સ્થિતિમાં, 2,3-BPG ની સાંદ્રતા ઊંચી હોય છે અને Hb ની સાંદ્રતા સાથે તુલનાત્મક હોય છે. 2,3-BPG પાસે -5 નો મજબૂત નકારાત્મક ચાર્જ છે.
 પેશી રુધિરકેશિકાઓમાં બિસ્ફોસ્ફોગ્લિસેરેટ, ડીઓક્સીહેમોગ્લોબિન સાથે બંધનકર્તા, પેશીઓમાં ઓક્સિજનના પ્રકાશનમાં વધારો કરે છે, O 2 માટે Hb નું આકર્ષણ ઘટાડે છે.
પેશી રુધિરકેશિકાઓમાં બિસ્ફોસ્ફોગ્લિસેરેટ, ડીઓક્સીહેમોગ્લોબિન સાથે બંધનકર્તા, પેશીઓમાં ઓક્સિજનના પ્રકાશનમાં વધારો કરે છે, O 2 માટે Hb નું આકર્ષણ ઘટાડે છે.
ટેટ્રામેરિક હિમોગ્લોબિન પરમાણુના કેન્દ્રમાં એક પોલાણ છે. તે ચારેય પ્રોટોમર્સના એમિનો એસિડ અવશેષો દ્વારા રચાય છે (જુઓ. ફિગ. 1.22). પેશી રુધિરકેશિકાઓમાં, Hb (બોહર અસર) નું પ્રોટોનેશન હેમ આયર્ન અને O2 વચ્ચેના બોન્ડના ભંગાણ તરફ દોરી જાય છે. એક પરમાણુમાં
ડીઓક્સીહેમોગ્લોબિન, ઓક્સિહેમોગ્લોબિનની તુલનામાં, વધારાના આયનીય બોન્ડ્સ ઉત્પન્ન થાય છે જે પ્રોટોમર્સને જોડે છે, પરિણામે ઓક્સિહેમોગ્લોબિનની તુલનામાં કેન્દ્રીય પોલાણના પરિમાણો વધે છે. કેન્દ્રીય પોલાણ એ હિમોગ્લોબિન સાથે 2,3-BPG ના જોડાણનું સ્થળ છે. કેન્દ્રીય પોલાણના કદમાં તફાવતને લીધે, 2,3-BPG માત્ર ડીઓક્સીહેમોગ્લોબિન સાથે જોડી શકે છે.
2,3-BPG પ્રોટીનના સક્રિય કેન્દ્રોથી દૂરસ્થ સાઇટમાં હિમોગ્લોબિન સાથે ક્રિયાપ્રતિક્રિયા કરે છે અને તેની સાથે સંબંધિત છે એલોસ્ટેરિક(નિયમનકારી) લિગાન્ડ્સ, અને Hb નું કેન્દ્રિય પોલાણ છે એલોસ્ટેરિક કેન્દ્ર. 2,3-BPG મજબૂત નકારાત્મક ચાર્જ ધરાવે છે અને Hb ની બે β-સાંકળોના પાંચ હકારાત્મક ચાર્જ જૂથો સાથે ક્રિયાપ્રતિક્રિયા કરે છે: Valનું N-ટર્મિનલ α-amino જૂથ અને Lys 82 હિઝ 143 રેડિકલ (ફિગ. 1.26).
 ચોખા. 1.26. ડીઓક્સીહેમોગ્લોબિનના કેન્દ્રિય પોલાણમાં BPG
ચોખા. 1.26. ડીઓક્સીહેમોગ્લોબિનના કેન્દ્રિય પોલાણમાં BPG
BPG દરેક β-સ્ટ્રેન્ડ પર ત્રણ હકારાત્મક ચાર્જવાળા જૂથો સાથે જોડાય છે.
પેશી રુધિરકેશિકાઓમાં, પરિણામી ડીઓક્સીહેમોગ્લોબિન 2,3-BPG સાથે ક્રિયાપ્રતિક્રિયા કરે છે અને β-ચેઈન્સના સકારાત્મક ચાર્જ રેડિકલ અને નકારાત્મક રીતે ચાર્જ કરાયેલ લિગાન્ડ વચ્ચે આયનીય બોન્ડ રચાય છે, જે પ્રોટીનની રચનામાં ફેરફાર કરે છે અને O2 માટે Hb નું જોડાણ ઘટાડે છે. . O 2 માટે Hb ના જોડાણમાં ઘટાડો પેશીઓમાં O 2 ના વધુ કાર્યક્ષમ પ્રકાશનમાં ફાળો આપે છે.
ફેફસાંમાં, ઉચ્ચ આંશિક દબાણ પર, ઓક્સિજન Hb સાથે ક્રિયાપ્રતિક્રિયા કરે છે, હેમ આયર્નમાં જોડાય છે; આ કિસ્સામાં, પ્રોટીનની રચના બદલાય છે, કેન્દ્રિય પોલાણ ઘટે છે અને 2,3-BPG એલોસ્ટેરિક કેન્દ્રમાંથી વિસ્થાપિત થાય છે.
આમ, મોનોમેરિક પ્રોટીનની તુલનામાં ઓલિગોમેરિક પ્રોટીનમાં નવા ગુણધર્મો છે. સાઇટ્સ પર લિગાન્ડ્સનું જોડાણ
એકબીજાથી અવકાશી રીતે દૂર (એલોસ્ટેરિક), સમગ્ર પ્રોટીન પરમાણુમાં રચનાત્મક ફેરફારોનું કારણ બની શકે છે. નિયમનકારી લિગાન્ડ્સ સાથેની ક્રિયાપ્રતિક્રિયાને લીધે, પર્યાવરણીય ફેરફારો માટે પ્રોટીન પરમાણુના કાર્યની રચના અને અનુકૂલનમાં ફેરફાર થાય છે.
વિષય 1.5. કોષની શરતો હેઠળ પ્રોટીનની મૂળ રચનાની જાળવણી
કોષોમાં, પોલીપેપ્ટાઈડ સાંકળોના સંશ્લેષણ દરમિયાન, કોષના અનુરૂપ ભાગોમાં પટલ દ્વારા તેમનું પરિવહન, ફોલ્ડિંગ (મૂળ રચનાની રચના) પ્રક્રિયા દરમિયાન અને ઓલિગોમેરિક પ્રોટીનની એસેમ્બલી દરમિયાન, તેમજ તેમની કામગીરી દરમિયાન, મધ્યવર્તી પ્રોટીન સ્ટ્રક્ચરમાં એકત્રીકરણ-પ્રોન, અસ્થિર રચનાઓ ઊભી થાય છે. હાઇડ્રોફોબિક રેડિકલ, સામાન્ય રીતે મૂળ રચનામાં પ્રોટીન પરમાણુની અંદર છુપાયેલા હોય છે, તે અસ્થિર સ્વરૂપમાં સપાટી પર દેખાય છે અને અન્ય પ્રોટીનના જૂથો સાથે જોડવાનું વલણ ધરાવે છે જે પાણીમાં નબળી રીતે દ્રાવ્ય હોય છે. તમામ જાણીતા સજીવોના કોષોમાં, ખાસ પ્રોટીન મળી આવ્યા છે જે સેલ પ્રોટીનના શ્રેષ્ઠ ફોલ્ડિંગને સુનિશ્ચિત કરે છે, કાર્ય દરમિયાન તેમની મૂળ રચનાને સ્થિર કરે છે અને, સૌથી અગત્યનું, જ્યારે હોમિયોસ્ટેસિસ ખલેલ પહોંચે છે ત્યારે અંતઃકોશિક પ્રોટીનની રચના અને કાર્યોને જાળવી રાખે છે. આ પ્રોટીન કહેવામાં આવે છે "ચેપરોન્સ"જેનો ફ્રેન્ચમાં અર્થ થાય છે “આયા”.
1. મોલેક્યુલર ચેપરોન્સ અને પ્રોટીન ડિનેચરેશનને રોકવામાં તેમની ભૂમિકા.
ચેપરોન્સ (CH) ને તેમના સબ્યુનિટ્સના સમૂહ અનુસાર વર્ગીકૃત કરવામાં આવે છે. ઉચ્ચ પરમાણુ વજનના ચેપરોનનું દળ 60 થી 110 kDa છે. તેમાંથી, ત્રણ વર્ગોનો સૌથી વધુ અભ્યાસ કરવામાં આવ્યો છે: Sh-60, Sh-70 અને Sh-90. દરેક વર્ગમાં સંબંધિત પ્રોટીનનું કુટુંબ શામેલ છે. આમ, Sh-70 માં 66 થી 78 kDa સુધીના પરમાણુ વજનવાળા પ્રોટીનનો સમાવેશ થાય છે. ઓછા પરમાણુ વજનના ચેપરોન્સનું પરમાણુ વજન 40 થી 15 kDa સુધીનું હોય છે.
ચેપરોન્સ વચ્ચે છે રચનાત્મકપ્રોટીન, જેનું ઉચ્ચ મૂળભૂત સંશ્લેષણ શરીરના કોષો પર તાણની અસરો પર આધારિત નથી, અને પ્રેરકજેનું સંશ્લેષણ સામાન્ય સ્થિતિમાં નબળું હોય છે, પરંતુ તાણ હેઠળ ઝડપથી વધે છે. ઇન્ડ્યુસિબલ ચેપરોન્સને "હીટ શોક પ્રોટીન" પણ કહેવામાં આવે છે કારણ કે તેઓ પ્રથમ વખત ઉચ્ચ તાપમાનના સંપર્કમાં આવેલા કોષોમાં મળી આવ્યા હતા. કોષોમાં, પ્રોટીનની ઊંચી સાંદ્રતાને લીધે, આંશિક રીતે વિકૃત પ્રોટીનનું સ્વયંભૂ પુનઃસક્રિયકરણ મુશ્કેલ છે. Sh-70 વિકૃતિકરણની શરૂઆતને અટકાવી શકે છે અને પ્રોટીનની મૂળ રચનાને પુનઃસ્થાપિત કરવામાં મદદ કરી શકે છે. મોલેક્યુલર ચેપરોન્સ -70- કોષના તમામ ભાગોમાં જોવા મળતા પ્રોટીનનો અત્યંત સંરક્ષિત વર્ગ: સાયટોપ્લાઝમ, ન્યુક્લિયસ, એન્ડોપ્લાઝમિક રેટિક્યુલમ, મિટોકોન્ડ્રિયા. સિંગલ પોલીપેપ્ટાઈડ સાંકળ Ш-70 ના કાર્બોક્સિલ છેડે એક ક્ષેત્ર છે જે લંબાઈના પેપ્ટાઈડ્સ સાથે ક્રિયાપ્રતિક્રિયા કરવા સક્ષમ ખાંચો છે.
હાઇડ્રોફોબિક રેડિકલથી સમૃદ્ધ 7 થી 9 એમિનો એસિડ અવશેષો. ગ્લોબ્યુલર પ્રોટીનમાં આવા પ્રદેશો લગભગ દર 16 એમિનો એસિડમાં જોવા મળે છે. Sh-70 પ્રોટીનને તાપમાન નિષ્ક્રિયતાથી બચાવવા અને આંશિક રીતે વિકૃત પ્રોટીનની રચના અને પ્રવૃત્તિને પુનઃસ્થાપિત કરવામાં સક્ષમ છે.
2. પ્રોટીન ફોલ્ડિંગમાં ચેપરોન્સની ભૂમિકા.રાઇબોઝોમ પર પ્રોટીન સંશ્લેષણ દરમિયાન, પોલિપેપ્ટાઇડના એન-ટર્મિનલ પ્રદેશને સી-ટર્મિનલ પહેલા સંશ્લેષણ કરવામાં આવે છે. મૂળ રચના બનાવવા માટે, પ્રોટીનનો સંપૂર્ણ એમિનો એસિડ ક્રમ જરૂરી છે. પ્રોટીન સંશ્લેષણની પ્રક્રિયામાં, ચેપરોન્સ-70, તેમના સક્રિય કેન્દ્રની રચનાને કારણે, સંશ્લેષણ પૂર્ણ ન થાય ત્યાં સુધી હાઇડ્રોફોબિક એમિનો એસિડ રેડિકલમાં સમૃદ્ધ એવા પોલીપેપ્ટાઈડના વિસ્તારોને બંધ કરવામાં સક્ષમ હોય છે (આકૃતિ 1.27, A. ).
 ચોખા. 1.27. પ્રોટીન ફોલ્ડિંગમાં ચેપરોન્સની ભાગીદારી
ચોખા. 1.27. પ્રોટીન ફોલ્ડિંગમાં ચેપરોન્સની ભાગીદારી
A - સંશ્લેષિત પોલિપેપ્ટાઇડના વિભાગો વચ્ચે હાઇડ્રોફોબિક ક્રિયાપ્રતિક્રિયાના નિવારણમાં ચેપરોન્સ -70 ની ભાગીદારી; બી - ચેપરોન સંકુલમાં પ્રોટીનની મૂળ રચનાની રચના
ઘણા ઉચ્ચ-પરમાણુ-વજન પ્રોટીન કે જેનું જટિલ સ્વરૂપ છે, જેમ કે ડોમેન માળખું, Sh-60 દ્વારા રચાયેલી વિશિષ્ટ જગ્યામાં ફોલ્ડ થાય છે. Ш-60ઓલિગોમેરિક સંકુલ તરીકે કાર્ય કરે છે જેમાં 14 સબ્યુનિટ્સનો સમાવેશ થાય છે. તેઓ બે હોલો રિંગ્સ બનાવે છે, જેમાંના દરેકમાં સાત સબ્યુનિટ્સ હોય છે, આ રિંગ્સ એકબીજા સાથે જોડાયેલા હોય છે. દરેક Sh-60 સબ્યુનિટમાં ત્રણ ડોમેન્સ હોય છે: apical (apical), રિંગની પોલાણની સામે હાઇડ્રોફોબિક રેડિકલથી સમૃદ્ધ, મધ્યવર્તી અને વિષુવવૃત્તીય (ફિગ. 1.28).
 ચોખા. 1.28. ચેપરોનિન સંકુલનું માળખું જેમાં 14 Ш-60 નો સમાવેશ થાય છે
ચોખા. 1.28. ચેપરોનિન સંકુલનું માળખું જેમાં 14 Ш-60 નો સમાવેશ થાય છે
એ - બાજુ દૃશ્ય; બી - ટોચનું દૃશ્ય
સંશ્લેષિત પ્રોટીન, જે સપાટી પરના તત્ત્વો ધરાવે છે જે અનફોલ્ડ અણુઓની લાક્ષણિકતા ધરાવે છે, ખાસ કરીને હાઇડ્રોફોબિક રેડિકલ, ચેપરોન રિંગ્સના પોલાણમાં પ્રવેશ કરે છે. આ પોલાણના વિશિષ્ટ વાતાવરણમાં, જ્યાં સુધી ઊર્જાસભર રીતે સૌથી સાનુકૂળ હોય તેવી માત્ર એક જ ન મળે ત્યાં સુધી સંભવિત રચનાઓની ગણતરી કરવામાં આવે છે (ફિગ. 1.27, B). વિષુવવૃત્તીય પ્રદેશમાં એટીપી હાઇડ્રોલિસિસ સાથે કન્ફોર્મેશન્સ અને પ્રોટીન પ્રકાશનનું નિર્માણ થાય છે. સામાન્ય રીતે, આવા ચેપરોન-આશ્રિત ફોલ્ડિંગ માટે નોંધપાત્ર પ્રમાણમાં ઊર્જાની જરૂર પડે છે.
પ્રોટીનની ત્રિ-પરિમાણીય રચનાની રચના અને આંશિક રીતે વિકૃત પ્રોટીનના પુનર્જીવનમાં ભાગ લેવા ઉપરાંત, ઓલિગોમેરિક પ્રોટીનની એસેમ્બલી, વિકૃત પ્રોટીનની ઓળખ અને લિસોસોમમાં પરિવહન જેવી મૂળભૂત પ્રક્રિયાઓની ઘટના માટે ચેપરોન્સ પણ જરૂરી છે. સમગ્ર પટલમાં પ્રોટીનનું પરિવહન, અને પ્રોટીન સંકુલની પ્રવૃત્તિના નિયમનમાં ભાગીદારી.
વિષય 1.6. પ્રોટીનની વિવિધતા. પ્રોટીન પરિવારો: ઇમ્યુનોગ્લોબ્યુલિનનું ઉદાહરણ
1. પ્રોટીન વ્યક્તિગત કોષો અને સમગ્ર મલ્ટિસેલ્યુલર સજીવના જીવનમાં નિર્ણાયક ભૂમિકા ભજવે છે, અને તેમના કાર્યો આશ્ચર્યજનક રીતે વૈવિધ્યસભર છે. આ પ્રાથમિક માળખું અને પ્રોટીનની રચનાની લાક્ષણિકતાઓ, સક્રિય કેન્દ્રની અનન્ય રચના અને ચોક્કસ લિગાન્ડ્સને બાંધવાની ક્ષમતા દ્વારા નક્કી કરવામાં આવે છે.
પેપ્ટાઇડ સાંકળોના તમામ સંભવિત પ્રકારોનો માત્ર એક ખૂબ જ નાનો અંશ સ્થિર અવકાશી માળખું અપનાવી શકે છે; બહુમતી
તેમાંથી લગભગ સમાન ગિબ્સ ઊર્જા સાથે ઘણી રચનાઓ લઈ શકે છે, પરંતુ વિવિધ ગુણધર્મો સાથે. જૈવિક ઉત્ક્રાંતિ દ્વારા પસંદ કરાયેલ મોટા ભાગના જાણીતા પ્રોટીનનું પ્રાથમિક માળખું એક રચનાની અસાધારણ સ્થિરતાને સુનિશ્ચિત કરે છે, જે આ પ્રોટીનની કામગીરીની લાક્ષણિકતાઓ નક્કી કરે છે.
2. પ્રોટીન પરિવારો.સમાન જૈવિક પ્રજાતિઓમાં, એમિનો એસિડ અવશેષોના અવેજીકરણથી વિવિધ પ્રોટીનના ઉદ્ભવ થઈ શકે છે જે સંબંધિત કાર્યો કરે છે અને હોમોલોગસ એમિનો એસિડ સિક્વન્સ ધરાવે છે. આવા સંબંધિત પ્રોટીનમાં આશ્ચર્યજનક રીતે સમાન રચનાઓ હોય છે: α-હેલિસિસ અને/અથવા β-સ્ટ્રક્ચર્સની સંખ્યા અને સંબંધિત સ્થિતિ, પોલિપેપ્ટાઇડ સાંકળોના મોટાભાગના વળાંક અને વળાંક સમાન અથવા સમાન હોય છે. પોલીપેપ્ટાઈડ સાંકળના હોમોલોગસ પ્રદેશો સાથેના પ્રોટીન, સમાન રચના અને સંબંધિત કાર્યોને પ્રોટીન પરિવારોમાં વર્ગીકૃત કરવામાં આવે છે. પ્રોટીન પરિવારોના ઉદાહરણો: સેરીન પ્રોટીનેસ, ઇમ્યુનોગ્લોબ્યુલિન ફેમિલી, મ્યોગ્લોબિન ફેમિલી.
સેરીન પ્રોટીનસેસ- પ્રોટીનનું કુટુંબ જે પ્રોટીઓલિટીક ઉત્સેચકોનું કાર્ય કરે છે. આમાં પાચન ઉત્સેચકોનો સમાવેશ થાય છે - chymotrypsin, trypsin, elastase અને લોહી ગંઠાઈ જવાના ઘણા પરિબળો. આ પ્રોટીનમાં તેમની 40% સ્થિતિમાં સમાન એમિનો એસિડ હોય છે અને ખૂબ સમાન રચના (ફિગ. 1.29).

ચોખા. 1.29. ઇલાસ્ટેઝ (A) અને કીમોટ્રીપ્સિન (B) ની અવકાશી રચનાઓ
કેટલાક એમિનો એસિડ અવેજી આ પ્રોટીનની સબસ્ટ્રેટ વિશિષ્ટતામાં ફેરફાર અને પરિવારમાં કાર્યાત્મક વિવિધતાના ઉદભવ તરફ દોરી જાય છે.
3. ઇમ્યુનોગ્લોબ્યુલિન પરિવાર.રોગપ્રતિકારક તંત્રની કામગીરીમાં, ઇમ્યુનોગ્લોબ્યુલિનના પ્રોટીન સુપરફેમિલીમાં મોટી ભૂમિકા ભજવે છે, જેમાં પ્રોટીનના ત્રણ પરિવારોનો સમાવેશ થાય છે:
એન્ટિબોડીઝ (ઇમ્યુનોગ્લોબ્યુલિન);
ટી-લિમ્ફોસાઇટ રીસેપ્ટર્સ;
મુખ્ય હિસ્ટોકોમ્પેટિબિલિટી કોમ્પ્લેક્સના પ્રોટીન્સ - MHC વર્ગો 1 અને 2 (મુખ્ય હિસ્ટોકોમ્પેટિબિલિટી કોમ્પ્લેક્સ).
આ બધા પ્રોટીનમાં ડોમેન માળખું હોય છે, જેમાં હોમોલોગસ રોગપ્રતિકારક ડોમેન્સ હોય છે અને સમાન કાર્યો કરે છે: તેઓ વિદેશી રચનાઓ સાથે ક્રિયાપ્રતિક્રિયા કરે છે, કાં તો લોહીમાં ઓગળી જાય છે, લસિકા અથવા ઇન્ટરસેલ્યુલર પ્રવાહી (એન્ટિબોડીઝ), અથવા કોષોની સપાટી પર સ્થિત હોય છે (પોતાના અથવા વિદેશી).
4. એન્ટિબોડીઝ- શરીરમાં વિદેશી બંધારણના પ્રવેશના પ્રતિભાવમાં બી લિમ્ફોસાઇટ્સ દ્વારા ઉત્પાદિત ચોક્કસ પ્રોટીન, જેને કહેવાય છે. એન્ટિજેન
એન્ટિબોડીઝની રચનાની સુવિધાઓ
સૌથી સરળ એન્ટિબોડી પરમાણુઓમાં ચાર પોલિપેપ્ટાઇડ સાંકળો હોય છે: બે સરખા પ્રકાશવાળા - L, જેમાં લગભગ 220 એમિનો એસિડ હોય છે, અને બે સમાન ભારે હોય છે - H, જેમાં 440-700 એમિનો એસિડ હોય છે. એન્ટિબોડી પરમાણુની તમામ ચાર સાંકળો ઘણા બિન-સહસંયોજક બોન્ડ્સ અને ચાર ડિસલ્ફાઇડ બોન્ડ્સ (ફિગ. 1.30) દ્વારા જોડાયેલી છે.
એન્ટિબોડી લાઇટ ચેઇન્સમાં બે ડોમેન્સ હોય છે: એક વેરિયેબલ ડોમેન (VL), જે પોલીપેપ્ટાઇડ ચેઇનના N-ટર્મિનલ પ્રદેશમાં સ્થિત છે, અને સતત ડોમેન (CL), જે C-ટર્મિનસ પર સ્થિત છે. હેવી ચેઇન્સમાં સામાન્ય રીતે ચાર ડોમેન્સ હોય છે: એક ચલ (VH), N-ટર્મિનસ પર સ્થિત હોય છે, અને ત્રણ સતત ડોમેન્સ (CH1, CH2, CH3) (જુઓ ફિગ. 1.30). પ્રત્યેક ઇમ્યુનોગ્લોબ્યુલિન ડોમેનમાં β-શીટ સુપરસ્ટ્રક્ચર હોય છે જેમાં બે સિસ્ટીન અવશેષો ડિસલ્ફાઇડ બોન્ડ દ્વારા જોડાયેલા હોય છે.
બે સ્થિર ડોમેન્સ CH1 અને CH2 વચ્ચે એક એવો પ્રદેશ છે જેમાં મોટી સંખ્યામાં પ્રોલાઇન અવશેષો છે, જે ગૌણ બંધારણની રચના અને આ સેગમેન્ટમાં પડોશી એચ-ચેઇન્સની ક્રિયાપ્રતિક્રિયાને અટકાવે છે. આ મિજાગરું ક્ષેત્ર એન્ટિબોડી પરમાણુને સુગમતા આપે છે. ભારે અને હળવા સાંકળોના ચલ ડોમેન્સ વચ્ચે બે સમાન એન્ટિજેન-બંધનકર્તા સાઇટ્સ છે (એન્ટિજેન્સને બાંધવા માટે સક્રિય સાઇટ્સ), તેથી આવા એન્ટિબોડીઝને ઘણીવાર કહેવામાં આવે છે. દ્વિભાષીબંને સાંકળોના ચલ પ્રદેશોનો સંપૂર્ણ એમિનો એસિડ ક્રમ એન્ટિજેનને એન્ટિબોડી સાથે જોડવામાં સામેલ નથી, પરંતુ દરેક સાંકળના હાયપરવેરિયેબલ પ્રદેશોમાં સ્થિત માત્ર 20-30 એમિનો એસિડ્સ છે. તે આ પ્રદેશો છે જે અનુરૂપ પૂરક એન્ટિજેન સાથે ક્રિયાપ્રતિક્રિયા કરવા માટે દરેક પ્રકારના એન્ટિબોડીની અનન્ય ક્ષમતા નક્કી કરે છે.
એન્ટિબોડીઝ એ વિદેશી જીવો પર આક્રમણ કરવા સામે શરીરની સંરક્ષણ રેખાઓમાંની એક છે. તેમની કામગીરીને બે તબક્કામાં વિભાજિત કરી શકાય છે: પ્રથમ તબક્કો વિદેશી સજીવોની સપાટી પર એન્ટિજેનની ઓળખ અને બંધન છે, જે એન્ટિબોડી બંધારણમાં એન્ટિજેન-બંધનકર્તા સ્થળોની હાજરીને કારણે શક્ય છે; બીજો તબક્કો એ એન્ટિજેનના નિષ્ક્રિયકરણ અને વિનાશની પ્રક્રિયાની શરૂઆત છે. બીજા તબક્કાની વિશિષ્ટતા એન્ટિબોડીઝના વર્ગ પર આધારિત છે. ભારે સાંકળોના પાંચ વર્ગો છે જે સતત ડોમેનની રચનામાં એકબીજાથી અલગ છે: α, δ, ε, γ અને μ, જે મુજબ ઇમ્યુનોગ્લોબ્યુલિનના પાંચ વર્ગો અલગ પડે છે: A, D, E, G અને M.
ભારે સાંકળોના માળખાકીય લક્ષણો હિન્જ વિસ્તારો અને ભારે સાંકળોના સી-ટર્મિનલ પ્રદેશોને દરેક વર્ગની રચનાની લાક્ષણિકતા આપે છે. એકવાર એન્ટિજેન એન્ટિબોડી સાથે જોડાય છે, સતત ડોમેન્સમાં રચનાત્મક ફેરફારો એન્ટિજેન દૂર કરવાનો માર્ગ નક્કી કરે છે.
 ચોખા. 1. 30. IgG નું ડોમેન માળખું
ચોખા. 1. 30. IgG નું ડોમેન માળખું
ઇમ્યુનોગ્લોબ્યુલિન એમ
ઇમ્યુનોગ્લોબ્યુલિન એમ બે સ્વરૂપો ધરાવે છે.
મોનોમેરિક સ્વરૂપ- બી લિમ્ફોસાઇટ્સના વિકાસ દ્વારા ઉત્પાદિત એન્ટિબોડીઝનો પ્રથમ વર્ગ. ત્યારબાદ, ઘણા બી કોષો એન્ટિબોડીઝના અન્ય વર્ગો ઉત્પન્ન કરવા માટે સ્વિચ કરે છે, પરંતુ તે જ એન્ટિજેન-બંધનકર્તા સાઇટ સાથે. IgM પટલમાં એમ્બેડેડ છે અને એન્ટિજેન ઓળખ રીસેપ્ટર તરીકે કાર્ય કરે છે. પૂંછડીના પ્રદેશમાં 25 હાઇડ્રોફોબિક એમિનો એસિડ અવશેષોની હાજરીને કારણે કોષ પટલમાં IgM નું એકીકરણ શક્ય છે.
આઇજીએમનું સેક્રેટરી ફોર્મપાંચ મોનોમેરિક સબયુનિટ્સનો સમાવેશ થાય છે જે એકબીજા સાથે ડાયસલ્ફાઇડ બોન્ડ દ્વારા જોડાયેલા હોય છે અને વધારાની પોલિપેપ્ટાઇડ J ચેઇન (ફિગ. 1.31) ધરાવે છે. આ સ્વરૂપના મોનોમર્સની ભારે સાંકળોમાં હાઇડ્રોફોબિક પૂંછડી હોતી નથી. પેન્ટામરમાં 10 એન્ટિજેન બંધનકર્તા સ્થળો છે અને તેથી તે એન્ટિજેનને ઓળખવામાં અને દૂર કરવામાં અસરકારક છે જે શરીરમાં પ્રથમ પ્રવેશે છે. IgM નું ગુપ્ત સ્વરૂપ એ પ્રાથમિક રોગપ્રતિકારક પ્રતિભાવ દરમિયાન લોહીમાં સ્ત્રાવ કરાયેલ એન્ટિબોડીઝનો મુખ્ય વર્ગ છે. એન્ટિજેન સાથે IgM નું બંધન IgM ની રચનામાં ફેરફાર કરે છે અને પૂરક સિસ્ટમના પ્રથમ પ્રોટીન ઘટક (પૂરક સિસ્ટમ એ એન્ટિજેનના વિનાશમાં સામેલ પ્રોટીનનો સમૂહ છે) અને આ સિસ્ટમના સક્રિયકરણ સાથે તેના બંધનને પ્રેરિત કરે છે. જો એન્ટિજેન સુક્ષ્મસજીવોની સપાટી પર સ્થિત હોય, તો પૂરક સિસ્ટમ કોષ પટલની અખંડિતતા અને બેક્ટેરિયલ કોષના મૃત્યુનું કારણ બને છે.
ઇમ્યુનોગ્લોબ્યુલિન જી
માત્રાત્મક રીતે, ઇમ્યુનોગ્લોબ્યુલિનનો આ વર્ગ લોહીમાં પ્રબળ છે (તમામ Igs ના 75%). IgG - મોનોમર્સ, ગૌણ રોગપ્રતિકારક પ્રતિભાવ દરમિયાન રક્તમાં સ્ત્રાવિત એન્ટિબોડીઝનો મુખ્ય વર્ગ. IgG સુક્ષ્મસજીવોના સપાટીના એન્ટિજેન્સ સાથે ક્રિયાપ્રતિક્રિયા કર્યા પછી, એન્ટિજેન-એન્ટિબોડી સંકુલ પૂરક સિસ્ટમના પ્રોટીનને બાંધવા અને સક્રિય કરવામાં સક્ષમ છે અથવા મેક્રોફેજ અને ન્યુટ્રોફિલ્સના ચોક્કસ રીસેપ્ટર્સ સાથે ક્રિયાપ્રતિક્રિયા કરી શકે છે. ફેગોસાઇટ્સ સાથેની ક્રિયાપ્રતિક્રિયા તરફ દોરી જાય છે
 ચોખા. 1.31. IgM ના ગુપ્ત સ્વરૂપનું માળખું
ચોખા. 1.31. IgM ના ગુપ્ત સ્વરૂપનું માળખું
એન્ટિજેન-એન્ટિબોડી સંકુલના શોષણ અને સેલ ફેગોસોમમાં તેમના વિનાશ માટે. IgG એ એન્ટિબોડીઝનો એકમાત્ર વર્ગ છે જે પ્લેસેન્ટલ અવરોધને ભેદવામાં સક્ષમ છે અને ગર્ભને ચેપથી ઇન્ટ્રાઉટેરિન રક્ષણ પૂરું પાડે છે.
ઇમ્યુનોગ્લોબ્યુલિન એ
સ્ત્રાવમાં હાજર એન્ટિબોડીઝનો મુખ્ય વર્ગ (દૂધ, લાળ, શ્વસન માર્ગ અને આંતરડાના માર્ગના સ્ત્રાવ). IgA મુખ્યત્વે ડાયમેરિક સ્વરૂપમાં સ્ત્રાવ થાય છે, જ્યાં મોનોમર્સ વધારાની J સાંકળ (ફિગ. 1.32) દ્વારા એકબીજા સાથે જોડાયેલા હોય છે.
IgA પૂરક પ્રણાલી અને ફેગોસાયટીક કોષો સાથે ક્રિયાપ્રતિક્રિયા કરતું નથી, પરંતુ સુક્ષ્મસજીવો સાથે જોડાઈને, એન્ટિબોડીઝ તેમના ઉપકલા કોષો સાથેના જોડાણ અને શરીરમાં પ્રવેશને અટકાવે છે.
ઇમ્યુનોગ્લોબ્યુલિન ઇ
ઇમ્યુનોગ્લોબ્યુલિન E એ મોનોમર્સ દ્વારા દર્શાવવામાં આવે છે જેમાં ભારે ε-ચેઇન્સ હોય છે, જેમ કે ઇમ્યુનોગ્લોબ્યુલિન Mની μ-ચેઇન્સ, એક ચલ અને ચાર સતત ડોમેન્સ. સ્ત્રાવ પછી, IgE તેની સાથે જોડાય છે
 ચોખા. 1.32. IgA નું માળખું
ચોખા. 1.32. IgA નું માળખું
માસ્ટ કોશિકાઓ અને બેસોફિલ્સની સપાટી પર અનુરૂપ રીસેપ્ટર્સ સાથે સી-ટર્મિનલ પ્રદેશો. પરિણામે, તેઓ આ કોશિકાઓની સપાટી પર એન્ટિજેન્સ માટે રીસેપ્ટર્સ બની જાય છે (ફિગ. 1.33).
 ચોખા. 1.33. માસ્ટ સેલની સપાટી પર એન્ટિજેન સાથે IgE ની ક્રિયાપ્રતિક્રિયા
ચોખા. 1.33. માસ્ટ સેલની સપાટી પર એન્ટિજેન સાથે IgE ની ક્રિયાપ્રતિક્રિયા
એન્ટિજેન IgE ના અનુરૂપ એન્ટિજેન-બંધનકર્તા સ્થળો સાથે જોડાય પછી, કોષો જૈવિક રીતે સક્રિય પદાર્થો (હિસ્ટામાઇન, સેરોટોનિન) સ્ત્રાવ કરવા માટે સંકેત મેળવે છે, જે બળતરા પ્રતિક્રિયાના વિકાસ માટે અને એલર્જીક પ્રતિક્રિયાઓના અભિવ્યક્તિ માટે મોટે ભાગે જવાબદાર હોય છે. અસ્થમા, અિટકૅરીયા, પરાગરજ તાવ.
ઇમ્યુનોગ્લોબ્યુલિન ડી
ઇમ્યુનોગ્લોબ્યુલિન ડી સીરમમાં ખૂબ જ ઓછી માત્રામાં જોવા મળે છે તે મોનોમર છે. હેવી δ સાંકળોમાં એક ચલ અને ત્રણ સ્થિર ડોમેન્સ હોય છે. IgDs B લિમ્ફોસાઇટ્સ માટે રીસેપ્ટર તરીકે કામ કરે છે, અન્ય કાર્યો હજુ અજ્ઞાત છે. B-lymphocytes (IgD) ની સપાટી પરના રીસેપ્ટર્સ સાથે ચોક્કસ એન્ટિજેન્સની ક્રિયાપ્રતિક્રિયા આ સંકેતોના કોષમાં પ્રસારણ અને મિકેનિઝમ્સના સક્રિયકરણ તરફ દોરી જાય છે જે આપેલ લિમ્ફોસાઇટ ક્લોનના પ્રસારને સુનિશ્ચિત કરે છે.
વિષય 1.7. પ્રોટીનના ભૌતિક અને રાસાયણિક ગુણો અને તેમને અલગ કરવા માટેની પદ્ધતિઓ
1. વ્યક્તિગત પ્રોટીન ભૌતિક અને રાસાયણિક ગુણધર્મોમાં અલગ પડે છે:
પરમાણુઓનો આકાર;
મોલેક્યુલર વજન;
કુલ ચાર્જ, જેની તીવ્રતા એમિનો એસિડના anionic અને cationic જૂથોના ગુણોત્તર પર આધારિત છે;
પરમાણુઓની સપાટી પર ધ્રુવીય અને બિન-ધ્રુવીય એમિનો એસિડ રેડિકલનો ગુણોત્તર;
વિવિધ ડિનેચરિંગ એજન્ટો સામે પ્રતિકારની ડિગ્રી.
2. પ્રોટીનની દ્રાવ્યતા આધાર રાખે છેઉપર સૂચિબદ્ધ પ્રોટીનના ગુણધર્મો પર, તેમજ તે માધ્યમની રચના પર કે જેમાં પ્રોટીન ઓગળવામાં આવે છે (pH મૂલ્યો, મીઠાની રચના, તાપમાન, પ્રોટીન સાથે ક્રિયાપ્રતિક્રિયા કરી શકે તેવા અન્ય કાર્બનિક પદાર્થોની હાજરી). પ્રોટીન પરમાણુઓના ચાર્જનું પ્રમાણ તેમની દ્રાવ્યતાને અસર કરતા પરિબળોમાંનું એક છે. જ્યારે આઇસોઇલેક્ટ્રિક પોઇન્ટ પરનો ચાર્જ ખોવાઈ જાય છે, ત્યારે પ્રોટીન વધુ સરળતાથી એકત્ર થાય છે અને અવક્ષેપ કરે છે. આ ખાસ કરીને વિકૃત પ્રોટીન માટે લાક્ષણિક છે, જેમાં હાઇડ્રોફોબિક એમિનો એસિડ રેડિકલ સપાટી પર દેખાય છે.
પ્રોટીન પરમાણુની સપાટી પર હકારાત્મક અને નકારાત્મક એમીનો એસિડ રેડિકલ બંને હોય છે. આ જૂથોની સંખ્યા, અને તેથી પ્રોટીનનો કુલ ચાર્જ, માધ્યમના pH પર આધાર રાખે છે, એટલે કે. H+ - અને OH - જૂથોની સાંદ્રતાનો ગુણોત્તર. એસિડિક વાતાવરણમાં H+ સાંદ્રતામાં વધારો કાર્બોક્સિલ જૂથો -COO - + H+ > - COOH અને પ્રોટીનના નકારાત્મક ચાર્જમાં ઘટાડોના વિયોજનના દમન તરફ દોરી જાય છે. આલ્કલાઇન વાતાવરણમાં, અધિક OH નું બંધન - એમિનો જૂથો - NH 3 + + OH - - NH 2 + H 2 O ના વિયોજન દરમિયાન રચાયેલા પ્રોટોન દ્વારા, પાણીની રચના સાથે, પ્રોટીનના હકારાત્મક ચાર્જમાં ઘટાડો તરફ દોરી જાય છે. . pH મૂલ્ય કે જેના પર પ્રોટીનનો ચોખ્ખો શૂન્ય ચાર્જ હોય છે તેને કહેવામાં આવે છે આઇસોઇલેક્ટ્રિક પોઇન્ટ (IEP). IET માં, હકારાત્મક અને નકારાત્મક રીતે ચાર્જ કરેલા જૂથોની સંખ્યા સમાન છે, એટલે કે. પ્રોટીન આઇસોઇલેક્ટ્રિક સ્થિતિમાં છે.
3. વ્યક્તિગત પ્રોટીનનું વિભાજન.શરીરની રચના અને કાર્યની લાક્ષણિકતાઓ તેમાં સંશ્લેષિત પ્રોટીનના સમૂહ પર આધારિત છે. પ્રોટીનની રચના અને ગુણધર્મોનો અભ્યાસ તેમને કોષમાંથી અલગ કર્યા વિના અને અન્ય પ્રોટીન અને કાર્બનિક અણુઓથી શુદ્ધ કર્યા વિના અશક્ય છે. વ્યક્તિગત પ્રોટીનના અલગતા અને શુદ્ધિકરણના તબક્કા:
કોષનો વિનાશપેશીનો અભ્યાસ કરવામાં આવે છે અને હોમોજેનેટ મેળવે છે.
અપૂર્ણાંકમાં હોમોજેનેટનું વિભાજનસેન્ટ્રીફ્યુગેશન દ્વારા, ન્યુક્લિયર, મિટોકોન્ડ્રીયલ, સાયટોસોલિક અથવા ઇચ્છિત પ્રોટીન ધરાવતા અન્ય અપૂર્ણાંક મેળવવા.
પસંદગીયુક્ત થર્મલ ડિનેચરેશન- પ્રોટીન સોલ્યુશનની ટૂંકા ગાળાની ગરમી, જે દરમિયાન કેટલીક વિકૃત પ્રોટીન અશુદ્ધિઓ દૂર કરી શકાય છે (જો પ્રોટીન પ્રમાણમાં ગરમી-સ્થિર હોય તો).
મીઠું ચડાવવું.વિવિધ પ્રોટીન સોલ્યુશનમાં વિવિધ મીઠાની સાંદ્રતા પર અવક્ષેપ કરે છે. ધીમે ધીમે મીઠાની સાંદ્રતામાં વધારો કરીને, તેમાંથી એકમાં અલગ પ્રોટીનની મુખ્ય સામગ્રી સાથે સંખ્યાબંધ અલગ અપૂર્ણાંક મેળવવાનું શક્ય છે.
એમોનિયમ સલ્ફેટનો ઉપયોગ મોટાભાગે પ્રોટીન અપૂર્ણાંક માટે થાય છે. ઓછામાં ઓછી દ્રાવ્યતા ધરાવતા પ્રોટીન ઓછા મીઠાની સાંદ્રતામાં અવક્ષેપ કરે છે.જેલ ગાળણ
- સોજાવાળા સેફેડેક્સ ગ્રાન્યુલ્સ (છિદ્રો ધરાવતા ડેક્સ્ટ્રાનની ત્રિ-પરિમાણીય પોલિસેકરાઇડ સાંકળો) દ્વારા પરમાણુઓને ચાળવાની પદ્ધતિ. સેફાડેક્સથી ભરેલા સ્તંભમાંથી પ્રોટીન જે ઝડપે પસાર થાય છે તે તેમના પરમાણુ વજન પર આધારિત છે: પ્રોટીન પરમાણુઓનો સમૂહ જેટલો ઓછો હોય છે, તે ગ્રાન્યુલ્સમાં જેટલો સહેલાઈથી પ્રવેશ કરે છે અને ત્યાં લાંબો સમય રહે છે, તેટલી ઝડપથી તેમાંથી નીકળે છે; કૉલમઅલ્ટ્રાસેન્ટ્રીફ્યુગેશન
- એક પદ્ધતિ જેમાં અલ્ટ્રાસેન્ટ્રીફ્યુજના રોટરમાં સેન્ટ્રીફ્યુજ ટ્યુબમાં પ્રોટીન મૂકવાનો સમાવેશ થાય છે. જ્યારે રોટર ફરે છે, ત્યારે પ્રોટીનનો સેડિમેન્ટેશન દર તેમના પરમાણુ વજનના પ્રમાણમાં હોય છે: ભારે પ્રોટીનના અપૂર્ણાંક ટેસ્ટ ટ્યુબના તળિયે નજીક સ્થિત હોય છે, હળવા - સપાટીની નજીક.ઇલેક્ટ્રોફોરેસીસ
- ઇલેક્ટ્રિક ફિલ્ડમાં પ્રોટીનની ગતિમાં તફાવત પર આધારિત પદ્ધતિ. આ મૂલ્ય પ્રોટીનના ચાર્જના પ્રમાણસર છે. પ્રોટીનનું ઇલેક્ટ્રોફોરેસીસ કાગળ પર હાથ ધરવામાં આવે છે (આ કિસ્સામાં, પ્રોટીન ચળવળની ગતિ ફક્ત તેમના ચાર્જના પ્રમાણસર હોય છે) અથવા ચોક્કસ છિદ્ર કદ સાથે પોલિએક્રિલામાઇડ જેલમાં (પ્રોટીનની હિલચાલની ગતિ તેમના ચાર્જ અને પરમાણુ વજનના પ્રમાણસર હોય છે) .- આયન વિનિમય રેઝિન (અદ્રાવ્ય પોલિમેરિક સામગ્રી) ના વિરોધી ચાર્જ જૂથો સાથે પ્રોટીનના આયનાઇઝ્ડ જૂથોના બંધન પર આધારિત અપૂર્ણાંક પદ્ધતિ. પ્રોટીનને રેઝિન સાથે જોડવાની શક્તિ પ્રોટીનના ચાર્જના પ્રમાણસર છે. આયન-વિનિમય પોલિમરમાં શોષાયેલ પ્રોટીન NaCl ઉકેલોની વધતી સાંદ્રતા સાથે ધોવાઇ શકાય છે; પ્રોટીનનો ચાર્જ જેટલો ઓછો હશે, તેટલી ઓછી NaCl ની સાંદ્રતા રેઝિનના આયનીય જૂથો સાથે બંધાયેલ પ્રોટીનને ધોવા માટે જરૂરી છે.
એફિનિટી ક્રોમેટોગ્રાફી- વ્યક્તિગત પ્રોટીનને અલગ કરવા માટેની સૌથી વિશિષ્ટ પદ્ધતિ પ્રોટીનનો લિગાન્ડ નિષ્ક્રિય પોલિમર સાથે જોડાયેલ છે. જ્યારે પ્રોટીન સોલ્યુશન પોલિમર સાથેના સ્તંભમાંથી પસાર થાય છે, ત્યારે લિગાન્ડ સાથે પ્રોટીનના પૂરક બંધનને કારણે, આપેલ લિગાન્ડ માટે વિશિષ્ટ પ્રોટીન જ સ્તંભ પર શોષાય છે.
ડાયાલિસિસ- અલગ પ્રોટીનના દ્રાવણમાંથી ઓછા પરમાણુ વજનના સંયોજનોને દૂર કરવા માટે વપરાતી પદ્ધતિ. આ પદ્ધતિ પ્રોટીનની અર્ધ-પારગમ્ય પટલમાંથી પસાર થવાની અસમર્થતા પર આધારિત છે, ઓછા પરમાણુ વજનવાળા પદાર્થોથી વિપરીત. તેનો ઉપયોગ લો-મોલેક્યુલર અશુદ્ધિઓમાંથી પ્રોટીનને શુદ્ધ કરવા માટે થાય છે, ઉદાહરણ તરીકે, મીઠું બહાર કાઢ્યા પછી ક્ષાર.
વધારાના કામ માટે સોંપણીઓ
1. ટેબલ ભરો. 1.4.
કોષ્ટક 1.4. સંબંધિત પ્રોટીનની રચના અને કાર્યોનું તુલનાત્મક વિશ્લેષણ - મ્યોગ્લોબિન અને હિમોગ્લોબિન
a) Mb અને Hb ના સક્રિય કેન્દ્રની રચના યાદ રાખો. આ પ્રોટીનના સક્રિય કેન્દ્રોની રચનામાં હાઇડ્રોફોબિક એમિનો એસિડ રેડિકલ શું ભૂમિકા ભજવે છે? Mb અને Hb ના સક્રિય કેન્દ્રની રચના અને તેની સાથે લિગાન્ડ્સના જોડાણની પદ્ધતિઓનું વર્ણન કરો. Mb અને Hb ના સક્રિય કેન્દ્રની કામગીરીમાં તેમના F 8 અને તેમના E 7 અવશેષો શું ભૂમિકા ભજવે છે?
b) મોનોમેરિક માયોગ્લોબિનની તુલનામાં નજીકથી સંબંધિત ઓલિગોમેરિક પ્રોટીન, હિમોગ્લોબિન પાસે કઈ નવી ગુણધર્મો છે? હિમોગ્લોબિન પરમાણુમાં પ્રોટોમર્સની રચનામાં સહકારી ફેરફારોની ભૂમિકા, ઓક્સિજન માટે હિમોગ્લોબિનના આકર્ષણ પર CO 2 અને પ્રોટોન સાંદ્રતાની અસર, તેમજ Hb કાર્યના એલોસ્ટેરિક નિયમનમાં 2,3-BPG ની ભૂમિકા સમજાવો. .
2. તેમની રચના અને કાર્ય વચ્ચેના સંબંધ પર ધ્યાન આપીને, મોલેક્યુલર ચેપરોન્સનું લક્ષણ બનાવો.
3. કુટુંબોમાં કયા પ્રોટીનનું જૂથ થયેલ છે? ઇમ્યુનોગ્લોબ્યુલિન પરિવારના ઉદાહરણનો ઉપયોગ કરીને, આ પરિવારના પ્રોટીનના સમાન માળખાકીય લક્ષણો અને સંબંધિત કાર્યોને ઓળખો.
4. બાયોકેમિકલ અને ઔષધીય હેતુઓ માટે ઘણીવાર શુદ્ધ વ્યક્તિગત પ્રોટીનની જરૂર પડે છે. પ્રોટીનના કયા ભૌતિક રાસાયણિક ગુણધર્મોને અલગ કરવા અને શુદ્ધિકરણ માટે વપરાતી પદ્ધતિઓ પર આધારિત છે તે સમજાવો.
સ્વ-નિયંત્રણ કાર્યો
1. સાચા જવાબો પસંદ કરો.
હિમોગ્લોબિનના કાર્યો:
A. O 2 નું ફેફસામાંથી પેશીમાં પરિવહન B. H+ નું પેશીઓમાંથી ફેફસામાં પરિવહન
B. લોહીનું સતત pH જાળવવું D. ફેફસાંમાંથી પેશીઓમાં CO 2નું પરિવહન
D. પેશીઓમાંથી ફેફસામાં CO 2નું પરિવહન
2. સાચા જવાબો પસંદ કરો. લિગાન્ડα -પ્રોટોમર એચબી છે: A. હેમ
B. ઓક્સિજન
B. CO G. 2,3-BPG
ડી. β-પ્રોટોમર
3. સાચા જવાબો પસંદ કરો.
હિમોગ્લોબિન મ્યોગ્લોબિનથી વિપરીત:
A. ચતુર્થાંશ માળખું ધરાવે છે
B. ગૌણ માળખું માત્ર α-helices દ્વારા દર્શાવવામાં આવે છે
B. જટિલ પ્રોટીનનું છે
D. એલોસ્ટેરિક લિગાન્ડ સાથે ક્રિયાપ્રતિક્રિયા કરે છે D. સહસંયોજક રીતે હેમ સાથે બંધાયેલ છે
4. સાચા જવાબો પસંદ કરો.
O2 માટે Hb નું આકર્ષણ ઘટે છે:
A. જ્યારે એક O 2 પરમાણુ ઉમેરવામાં આવે છે B. જ્યારે એક O 2 પરમાણુ દૂર કરવામાં આવે છે
B. 2,3-BPG સાથે વાતચીત કરતી વખતે
D. પ્રોટોમર્સ H + D સાથે જોડાયેલ હોય ત્યારે. જ્યારે 2,3-BPG ની સાંદ્રતા ઘટે છે
5. મેચ.
HB ના પ્રકારો દ્વારા વર્ગીકૃત કરવામાં આવે છે:
A. ડીઓક્સી સ્વરૂપમાં તે ફાઈબ્રિલર એગ્રીગેટ્સ બનાવે છે B. બે α- અને બે δ- સાંકળો ધરાવે છે
B. પુખ્ત એરિથ્રોસાઇટ્સમાં Hb નું મુખ્ય સ્વરૂપ D. સક્રિય કેન્દ્રમાં Fe+ 3 સાથે હેમ ધરાવે છે
D. બે α- અને બે γ- સાંકળો ધરાવે છે 1. HbA 2.
6. મેચ.
Hb લિગાન્ડ્સ:
A. એલોસ્ટેરિક કેન્દ્રમાં Hb સાથે જોડાય છે
B. Hb ની સક્રિય સાઇટ માટે ખૂબ જ ઉચ્ચ આકર્ષણ ધરાવે છે
B. જોડાવાથી, તે O 2 G માટે Hb નું આકર્ષણ વધારે છે. Fe+ 2 થી Fe+ 3 ને ઓક્સિડાઇઝ કરે છે.
D. તેનાF8 સાથે સહસંયોજક બોન્ડ બનાવે છે
7. સાચા જવાબો પસંદ કરો.
ચેપરોન્સ:
A. કોષના તમામ ભાગોમાં હાજર પ્રોટીન
B. તાણ હેઠળ સંશ્લેષણ વધે છે
B. વિકૃત પ્રોટીનના હાઇડ્રોલિસિસમાં ભાગ લેવો
D. પ્રોટીનની મૂળ રચના જાળવવામાં ભાગ લેવો
D. તેઓ ઓર્ગેનેલ્સ બનાવે છે જેમાં પ્રોટીનની રચના થાય છે.
8. મેચ. ઇમ્યુનોગ્લોબ્યુલિન:
A. સ્ત્રાવનું સ્વરૂપ પેન્ટામેરિક છે.
B. વર્ગ Ig કે જે પ્લેસેન્ટલ અવરોધમાં પ્રવેશ કરે છે
B. Ig - માસ્ટ સેલ રીસેપ્ટર
D. ઉપકલા કોષોના સ્ત્રાવમાં હાજર Ig નો મુખ્ય વર્ગ. ડી. બી-લિમ્ફોસાઇટ રીસેપ્ટર, જેનું સક્રિયકરણ કોષોના પ્રસારને સુનિશ્ચિત કરે છે
9. સાચા જવાબો પસંદ કરો.
ઇમ્યુનોગ્લોબ્યુલિન ઇ:
A. મેક્રોફેજ દ્વારા ઉત્પાદિત B. તેમની પાસે ભારે ε સાંકળો છે.
B. ટી-લિમ્ફોસાઇટ્સના પટલમાં જડિત
D. માસ્ટ કોશિકાઓ અને બેસોફિલ્સ પર મેમ્બ્રેન એન્ટિજેન રીસેપ્ટર્સ તરીકે કાર્ય કરે છે
D. એલર્જીક પ્રતિક્રિયાઓ માટે જવાબદાર
10. સાચા જવાબો પસંદ કરો.
પ્રોટીનને અલગ કરવાની પદ્ધતિ તેમના પરમાણુ વજનમાં તફાવત પર આધારિત છે:
A. જેલ ગાળણ
B. અલ્ટ્રાસેન્ટ્રીફ્યુગેશન
B. પોલિએક્રાયલામાઇડ જેલ ઇલેક્ટ્રોફોરેસીસ D. આયન વિનિમય ક્રોમેટોગ્રાફી
D. એફિનિટી ક્રોમેટોગ્રાફી
11. સાચો જવાબ પસંદ કરો.
પ્રોટીનને અલગ કરવાની પદ્ધતિ પાણીમાં તેમની દ્રાવ્યતામાં તફાવત પર આધારિત છે:
A. જેલ ફિલ્ટરેશન B. મીઠું ચડાવવું
B. આયન વિનિમય ક્રોમેટોગ્રાફી D. એફિનિટી ક્રોમેટોગ્રાફી
ડી. પોલિએક્રિલામાઇડ જેલમાં ઇલેક્ટ્રોફોરેસીસ
"સ્વ-નિયંત્રણ કાર્યો" ના જવાબોના ધોરણો
1. A, B, C, D
2. A, B, C, D
5. 1-B, 2-A, 3-G
6. 1-B, 2-B, 3-A
7. A, B, D, D
8. 1-જી; 2-B, 3-B
મૂળભૂત શરતો અને ખ્યાલો
1. ઓલિગોમેરિક પ્રોટીન, પ્રોટોમર, પ્રોટીનનું ચતુર્થાંશ માળખું
2. પ્રોટોમર કન્ફોર્મેશનમાં સહકારી ફેરફારો
3. બોહર અસર
4. પ્રોટીન કાર્યોનું એલોસ્ટેરિક નિયમન, એલોસ્ટેરિક કેન્દ્ર અને એલોસ્ટેરિક અસરકર્તા
5. મોલેક્યુલર ચેપરોન્સ, હીટ શોક પ્રોટીન
6. પ્રોટીન પરિવારો (સેરીન પ્રોટીઝ, ઇમ્યુનોગ્લોબ્યુલિન)
7. IgM-, G-, E-, A-સ્ટ્રક્ચર-ફંક્શન સંબંધ
8. પ્રોટીનનો કુલ ચાર્જ, પ્રોટીનનું આઇસોઇલેક્ટ્રિક બિંદુ
9. ઇલેક્ટ્રોફોરેસિસ
10. મીઠું ચડાવવું
11. જેલ ગાળણ
12. આયન વિનિમય ક્રોમેટોગ્રાફી
13. અલ્ટ્રાસેન્ટ્રીફ્યુગેશન
14. એફિનિટી ક્રોમેટોગ્રાફી
15. રક્ત પ્લાઝ્મા પ્રોટીનનું ઇલેક્ટ્રોફોરેસિસ
વર્ગખંડના કાર્ય માટેના કાર્યો
1. પેશીઓમાં તેના આંશિક દબાણ પર ઓક્સિજન સાથે હિમોગ્લોબિન (Hb) અને મ્યોગ્લોબિન (Mb) ની સંતૃપ્તિની ડિગ્રીની અવલંબનની તુલના કરો.
 ચોખા. 1.34. સંતૃપ્તિની અવલંબન Mv અનેNHતેના આંશિક દબાણમાંથી ઓક્સિજન
ચોખા. 1.34. સંતૃપ્તિની અવલંબન Mv અનેNHતેના આંશિક દબાણમાંથી ઓક્સિજન
મહેરબાની કરીને નોંધ કરો કે પ્રોટીન ઓક્સિજન સંતૃપ્તિ વણાંકોનો આકાર અલગ છે: મ્યોગ્લોબિન માટે - એક હાયપરબોલા, હિમોગ્લોબિન માટે - સિગ્મોઇડ આકાર.
1. ઓક્સિજનના આંશિક દબાણના મૂલ્યોની તુલના કરો કે જેના પર Mb અને Hb O 2 સાથે 50% દ્વારા સંતૃપ્ત થાય છે. આમાંથી કયું પ્રોટીન O 2 માટે વધુ આકર્ષણ ધરાવે છે?
2. Mb ની કઈ માળખાકીય વિશેષતાઓ O 2 માટે તેની ઉચ્ચ લાગણી નક્કી કરે છે?
3. HB ની કઈ માળખાકીય વિશેષતાઓ તેને આરામ કરતી પેશીઓની રુધિરકેશિકાઓમાં O2 મુક્ત કરવાની મંજૂરી આપે છે (O2 ના પ્રમાણમાં ઊંચા આંશિક દબાણ પર) અને કાર્યકારી સ્નાયુઓમાં આ પ્રકાશનને તીવ્રપણે વધારો કરે છે? ઓલિગોમેરિક પ્રોટીનની કઈ મિલકત આ અસર પૂરી પાડે છે?
4. ગણતરી કરો કે O 2 (% માં) ઓક્સિજનયુક્ત હિમોગ્લોબિન આરામ અને કામ કરતા સ્નાયુઓને કેટલી માત્રામાં આપે છે?
5. પ્રોટીનની રચના અને તેના કાર્ય વચ્ચેના સંબંધ વિશે તારણો કાઢો.
2. રુધિરકેશિકાઓમાં હિમોગ્લોબિન દ્વારા પ્રકાશિત ઓક્સિજનની માત્રા પેશીઓમાં કેટબોલિક પ્રક્રિયાઓની તીવ્રતા (બોહર અસર) પર આધારિત છે. ટીશ્યુ મેટાબોલિઝમમાં થતા ફેરફારો O2 માટે Hb ની આનુષંગિકતાને કેવી રીતે નિયંત્રિત કરે છે? O 2 માટે Hb ના આકર્ષણ પર CO 2 અને H+ ની અસર
 1. બોહર અસરનું વર્ણન કરો.
1. બોહર અસરનું વર્ણન કરો.
2. રેખાકૃતિમાં દર્શાવેલ પ્રક્રિયા કઈ દિશામાં આગળ વધે છે:
એ) ફેફસાંની રુધિરકેશિકાઓમાં;
b) પેશી રુધિરકેશિકાઓમાં?
3. બોહર અસરનું શારીરિક મહત્વ શું છે?
4. હેમથી રિમોટ સાઇટ્સ પર H+ સાથે Hb ની ક્રિયાપ્રતિક્રિયા શા માટે O 2 માટે પ્રોટીનની સંલગ્નતાને બદલે છે?
3. O2 માટે Hb ની એફિનિટી તેના લિગાન્ડ - 2,3-બિસ્ફોસ્ફોગ્લિસેરેટની સાંદ્રતા પર આધારિત છે, જે O2 માટે Hb ની એફિનિટીનું એલોસ્ટેરિક રેગ્યુલેટર છે.
સક્રિય સાઇટથી દૂરની સાઇટ પર લિગાન્ડની ક્રિયાપ્રતિક્રિયા શા માટે પ્રોટીન કાર્યને અસર કરે છે? 2,3-BPG કેવી રીતે O2 માટે Hb ના આકર્ષણને નિયંત્રિત કરે છે? સમસ્યા હલ કરવા માટે, નીચેના પ્રશ્નોના જવાબ આપો:
1. 2.3-બિસ્ફોસ્ફોગ્લિસેરેટ (2,3-BPG) ક્યાં અને શેમાંથી સંશ્લેષણ કરવામાં આવે છે? તેનું સૂત્ર લખો, આ પરમાણુનો ચાર્જ સૂચવો.
2. હિમોગ્લોબિન (ઓક્સી અથવા ડીઓક્સી) ના કયા સ્વરૂપ સાથે BPG ક્રિયાપ્રતિક્રિયા કરે છે અને શા માટે? Hb પરમાણુના કયા ભાગમાં ક્રિયાપ્રતિક્રિયા થાય છે?
3. રેખાકૃતિમાં દર્શાવેલ પ્રક્રિયા કઈ દિશામાં આગળ વધે છે?
એ) પેશી રુધિરકેશિકાઓમાં;
b) ફેફસાંની રુધિરકેશિકાઓમાં?
4. જ્યાં સંકુલની સાંદ્રતા વધારે હોવી જોઈએ
Nv-2,3-BFG:
એ) આરામમાં સ્નાયુઓની રુધિરકેશિકાઓમાં,
b) કાર્યશીલ સ્નાયુઓની રુધિરકેશિકાઓમાં (એરિથ્રોસાઇટ્સમાં BPG ની સમાન સાંદ્રતા પ્રદાન કરે છે)?
4. 5. જ્યારે એરિથ્રોસાઇટ્સમાં BPG ની સાંદ્રતા વધે તો વ્યક્તિ જ્યારે ઉચ્ચ-ઉંચાઈની પરિસ્થિતિઓને અનુકૂલન કરે છે ત્યારે ઓક્સિજન માટે HB ની લાગણી કેવી રીતે બદલાશે? આ ઘટનાનું શારીરિક મહત્વ શું છે?
5. સાચવેલ રક્તના સંગ્રહ દરમિયાન 2,3-BPG નો નાશ HB ના કાર્યોને નબળી પાડે છે. જો એરિથ્રોસાઇટ્સમાં 2,3-BPG ની સાંદ્રતા 8 થી 0.5 mmol/l સુધી ઘટી શકે તો સાચવેલ રક્તમાં O 2 માટે HB નું આકર્ષણ કેવી રીતે બદલાશે. જો 2,3-BPG ની સાંદ્રતા ત્રણ દિવસ પછી પુનઃસ્થાપિત ન થાય તો શું ગંભીર રીતે બીમાર દર્દીઓને આવા રક્તનું પરિવહન કરવું શક્ય છે? શું લોહીમાં 2,3-BPG ઉમેરીને લાલ રક્ત કોશિકાઓના કાર્યોને પુનઃસ્થાપિત કરવું શક્ય છે?
સૌથી સરળ ઇમ્યુનોગ્લોબ્યુલિન પરમાણુઓની રચના યાદ રાખો. રોગપ્રતિકારક તંત્રમાં ઇમ્યુનોગ્લોબ્યુલિન શું ભૂમિકા ભજવે છે? શા માટે Igs ને ઘણી વાર બાયવેલેન્ટ કહેવામાં આવે છે? Igs ની રચના તેમના કાર્ય સાથે કેવી રીતે સંબંધિત છે? (ઇમ્યુનોગ્લોબ્યુલિનના વર્ગના ઉદાહરણનો ઉપયોગ કરીને વર્ણન કરો.)
6. પ્રોટીનના ભૌતિક રાસાયણિક ગુણધર્મો અને તેમના વિભાજન માટેની પદ્ધતિઓ.
પ્રોટીનનો ચોખ્ખો ચાર્જ તેની દ્રાવ્યતાને કેવી રીતે અસર કરે છે?
a) pH 7 પર પેપ્ટાઈડનો કુલ ચાર્જ નક્કી કરો
Ala-Glu-Tre-Pro-Asp-Liz-Cis<7, рН <<7?
b) આ પેપ્ટાઈડનો ચાર્જ pH >7, pH પર કેવી રીતે બદલાશે
c) પ્રોટીન (IEP) નો આઇસોઇલેક્ટ્રિક પોઇન્ટ શું છે અને તે કયા વાતાવરણમાં રહે છે?
આ પેપ્ટાઈડનું IET?
7. d) કયા pH મૂલ્ય પર આ પેપ્ટાઈડની ઓછામાં ઓછી દ્રાવ્યતા જોવામાં આવશે.
8. જેલ ફિલ્ટરેશનનો ઉપયોગ વ્યક્તિગત પ્રોટીનને અલગ કરવા માટે થાય છે. જેલ ફિલ્ટરેશન (ફિગ. 1.35) દ્વારા અનુક્રમે 160,000, 80,000 અને 60,000 જેટલા મોલેક્યુલર વજન સાથે પ્રોટીન A, B, C ધરાવતા મિશ્રણનું વિશ્લેષણ કરવામાં આવ્યું હતું. 70,000 થી ઓછા મોલેક્યુલર વજનવાળા પ્રોટીન માટે સોજો જેલ ગ્રાન્યુલ્સ અભેદ્ય છે? કયો ગ્રાફ અપૂર્ણાંકના પરિણામોને યોગ્ય રીતે પ્રતિબિંબિત કરે છે? સ્તંભમાંથી પ્રોટીન A, B અને C છોડવામાં આવે છે તે ક્રમ સૂચવો.
 ચોખા. 1.35. પ્રોટીનને અલગ કરવા માટે જેલ ફિલ્ટરેશનનો ઉપયોગ કરવો
ચોખા. 1.35. પ્રોટીનને અલગ કરવા માટે જેલ ફિલ્ટરેશનનો ઉપયોગ કરવો
9. ફિગ માં. 1.36, A તંદુરસ્ત વ્યક્તિના લોહીના સીરમ પ્રોટીનના કાગળ પર ઇલેક્ટ્રોફોરેસીસનું આકૃતિ દર્શાવે છે. આ પદ્ધતિનો ઉપયોગ કરીને મેળવેલ પ્રોટીન અપૂર્ણાંકની સંબંધિત માત્રા છે: આલ્બ્યુમિન્સ 54-58%, α 1 -ગ્લોબ્યુલિન 6-7%, α 2 -ગ્લોબ્યુલિન 8-9%, β-ગ્લોબ્યુલિન 13%, γ-ગ્લોબ્યુલિન 11-12% .
 ચોખા. 1.36 તંદુરસ્ત વ્યક્તિ (A) અને દર્દી (B) ના રક્ત પ્લાઝ્મા પ્રોટીનના કાગળ પર ઇલેક્ટ્રોફોરેસિસ
ચોખા. 1.36 તંદુરસ્ત વ્યક્તિ (A) અને દર્દી (B) ના રક્ત પ્લાઝ્મા પ્રોટીનના કાગળ પર ઇલેક્ટ્રોફોરેસિસ
હું - γ-ગ્લોબ્યુલિન; II - β-ગ્લોબ્યુલિન; III -α 2 -ગ્લોબ્યુલિન; IV -α 2 -ગ્લોબ્યુલિન; વી - આલ્બ્યુમિન્સ
ઘણા રોગો સીરમ પ્રોટીન (ડિસપ્રોટીનેમિયા) ની રચનામાં જથ્થાત્મક ફેરફારો સાથે છે. નિદાન કરતી વખતે અને રોગની ગંભીરતા અને તબક્કાનું મૂલ્યાંકન કરતી વખતે આ ફેરફારોની પ્રકૃતિને ધ્યાનમાં લેવામાં આવે છે.
કોષ્ટકમાં આપેલ ડેટાનો ઉપયોગ કરવો. 1.5, રોગ વિશે અનુમાન લગાવો, જે ફિગમાં પ્રસ્તુત ઇલેક્ટ્રોફોરેટિક પ્રોફાઇલ દ્વારા વર્ગીકૃત થયેલ છે. 1.36.
કોષ્ટક 1.5. પેથોલોજીમાં સીરમ પ્રોટીનની સાંદ્રતામાં ફેરફાર
પી ઉર્વિચનાય માળખુંબેલ્કોવ
પ્રોટીનનું પ્રાથમિક માળખું તેના વિશેની માહિતી ધરાવે છે તેની અવકાશી રચના.
1. પ્રોટીનની પેપ્ટાઈડ શૃંખલામાં એમિનો એસિડ અવશેષો અવ્યવસ્થિત રીતે બદલાતા નથી, પરંતુ ચોક્કસ ક્રમમાં ગોઠવાયેલા હોય છે. પોલિપેપ્ટાઇડ સાંકળમાં એમિનો એસિડ અવશેષોનો રેખીય ક્રમ કહેવામાં આવે છે પ્રોટીનની પ્રાથમિક રચના.
2. દરેક વ્યક્તિગત પ્રોટીનનું પ્રાથમિક માળખું ડીએનએ પરમાણુ (જેને જનીન કહેવાય છે) માં એન્કોડ કરવામાં આવે છે અને તે ટ્રાન્સક્રિપ્શન (એમઆરએનએ પર માહિતીની નકલ) અને અનુવાદ (પેપ્ટાઇડ સાંકળનું સંશ્લેષણ) દરમિયાન અનુભવાય છે.
3. માનવ શરીરમાં દરેક 50,000 વ્યક્તિગત પ્રોટીન હોય છે અનન્યઆપેલ વ્યક્તિગત પ્રોટીન માટે, પ્રાથમિક માળખું. વ્યક્તિગત પ્રોટીનના તમામ પરમાણુઓ (ઉદાહરણ તરીકે, આલ્બ્યુમિન) એમિનો એસિડ અવશેષોની સમાન ફેરબદલ ધરાવે છે, જે અન્ય કોઈપણ વ્યક્તિગત પ્રોટીનથી આલ્બ્યુમિનને અલગ પાડે છે.
4. પેપ્ટાઈડ સાંકળમાં એમિનો એસિડ અવશેષોનો ક્રમ ગણી શકાય
પ્રવેશ ફોર્મ
કેટલીક માહિતી સાથે.
આ માહિતી લાંબી રેખીય પેપ્ટાઇડ સાંકળના અવકાશી ફોલ્ડિંગને વધુ કોમ્પેક્ટ ત્રિ-પરિમાણીય બંધારણમાં સૂચવે છે.
રચનાબેલ્કોવ
1. વ્યક્તિગત પ્રોટીનની રેખીય પોલિપેપ્ટાઇડ સાંકળો, એમિનો એસિડના કાર્યાત્મક જૂથોની ક્રિયાપ્રતિક્રિયાને કારણે, ચોક્કસ અવકાશી ત્રિ-પરિમાણીય માળખું અથવા રચના પ્રાપ્ત કરે છે. ગ્લોબ્યુલર પ્રોટીનમાં છે
બે મુખ્ય પ્રકારો રચનાપેપ્ટાઇડ સાંકળો: ગૌણ અને તૃતીય માળખું.
સેકન્ડરીમાળખુંબેલ્કોવ
2. પ્રોટીનની ગૌણ રચનાપેપ્ટાઇડ બેકબોનના કાર્યાત્મક જૂથો વચ્ચેની ક્રિયાપ્રતિક્રિયાના પરિણામે રચાયેલી અવકાશી રચના છે. આ કિસ્સામાં, પેપ્ટાઇડ સાંકળ નિયમિત રચનાઓ મેળવી શકે છે બે પ્રકાર:ઓએસ-સર્પાકારઅને p-સ્ટ્રક્ચર્સ.
ચોખા. 1.2. પ્રોટીનનું ગૌણ માળખું એ-હેલિક્સ છે.
ઓએસ-સર્પાકારમાંકાર્બોક્સિલ જૂથના ઓક્સિજન અણુ અને પાણી વચ્ચે હાઇડ્રોજન બોન્ડ રચાય છે 4 એમિનો એસિડ દ્વારા પેપ્ટાઇડ બેકબોનના એમાઇડ નાઇટ્રોજનની જીનસ; એમિનો એસિડ અવશેષોની બાજુની સાંકળો હેલિક્સની પરિઘ સાથે સ્થિત છે, જે હાઇડ્રોજન બોન્ડની રચનામાં ભાગ લેતા નથી જે ગૌણ માળખું બનાવે છે (ફિગ. 1.2).
મોટા વોલ્યુમેટ્રિક અવશેષો અથવા સમાન રિપેલિંગ ચાર્જ સાથેના અવશેષો અટકાવે છેα-હેલિક્સની રચનાને પ્રોત્સાહન આપો.
પ્રોલાઇન અવશેષો α-હેલિક્સને તેની રિંગ રચના અને પેપ્ટાઇડ સાંકળમાં નાઇટ્રોજન અણુમાં હાઇડ્રોજનની અછતને કારણે હાઇડ્રોજન બોન્ડ બનાવવાની અસમર્થતાને કારણે વિક્ષેપિત કરે છે.
બી- માળખુંએક પોલીપેપ્ટાઈડ સાંકળના રેખીય પ્રદેશો વચ્ચે રચાય છે, ફોલ્ડ બનાવે છે અથવા વિવિધ પોલીપેપ્ટાઈડ સાંકળોની વચ્ચે બને છે. પોલીપેપ્ટાઈડ સાંકળો અથવા તેના ભાગો રચી શકે છે સમાંતર(પ્રતિક્રિયા કરતી પેપ્ટાઇડ સાંકળોની એન- અને સી-ટર્મિની સમાન છે) અથવા સમાંતર વિરોધી(પરસ્પર ક્રિયાપ્રતિક્રિયા કરતી પેપ્ટાઇડ સાંકળોની એન- અને સી-ટર્મિની વિરુદ્ધ દિશામાં આવેલા છે) p-સ્ટ્રક્ચર્સ(ફિગ. 1.3).
INપ્રોટીનમાં અનિયમિત ગૌણ બંધારણવાળા વિસ્તારો પણ હોય છે, જેને કહેવામાં આવે છે રેન્ડમ ગૂંચમાં,જો કે આ રચનાઓ એક પ્રોટીન પરમાણુથી બીજામાં એટલી બધી બદલાતી નથી.
તૃતીયમાળખુંબેલ્કોવ
3. પ્રોટીનની તૃતીય રચનાએમિનો એસિડ રેડિકલ વચ્ચેની ક્રિયાપ્રતિક્રિયાને કારણે રચાયેલ ત્રિ-પરિમાણીય અવકાશી માળખું છે, જે પેપ્ટાઇડ સાંકળમાં એકબીજાથી નોંધપાત્ર અંતરે સ્થિત હોઈ શકે છે.
ચોખા. 1.3. એન્ટિસમાંતર (બીટા માળખું.)
.jpg)
હાઇડ્રોફોબિક એમિનો એસિડ રેડિકલ પ્રોટીનની ગ્લોબ્યુલર સ્ટ્રક્ચરમાં કહેવાતા દ્વારા ભેગા થવાનું વલણ ધરાવે છે. માર્ગદર્શક-રોફોબિક ક્રિયાપ્રતિક્રિયાઓઅને આંતરપરમાણુ વાન ડેર વાલ્સ દળો, ગાઢ હાઇડ્રોફોબિક કોર બનાવે છે. હાઇડ્રોફિલિક આયનાઇઝ્ડ અને નોન-આયોનાઇઝ્ડ એમિનો એસિડ રેડિકલ મુખ્યત્વે પ્રોટીનની સપાટી પર સ્થિત છે અને પાણીમાં તેની દ્રાવ્યતા નક્કી કરે છે.
હાઇડ્રોફોબિક કોરની અંદર જોવા મળતા હાઇડ્રોફિલિક એમિનો એસિડનો ઉપયોગ કરીને એકબીજા સાથે ક્રિયાપ્રતિક્રિયા કરી શકે છે આયનીયઅને હાઇડ્રોજન બોન્ડ(ચોખા. 1.4).
.jpg)
ચોખા. 1.4. પ્રોટીનની તૃતીય રચનાની રચના દરમિયાન એમિનો એસિડ રેડિકલ વચ્ચે ઉદ્ભવતા બોન્ડના પ્રકાર. 1 - આયનીય બોન્ડ; 2 - હાઇડ્રોજન બોન્ડ; 3 - હાઇડ્રોફોબિક ક્રિયાપ્રતિક્રિયાઓ; 4 - ડિસલ્ફાઇડ બોન્ડ.
|
|
ચોખા. 1.5. માનવ ઇન્સ્યુલિનની રચનામાં ડિસલ્ફાઇડ બોન્ડ્સ.
આયોનિક, હાઇડ્રોજન અને હાઇડ્રોફોબિક બોન્ડ નબળા છે: તેમની ઊર્જા ઓરડાના તાપમાને પરમાણુઓની થર્મલ ગતિની ઊર્જા કરતાં ઘણી વધારે નથી.
આવા ઘણા નબળા બોન્ડના દેખાવને કારણે પ્રોટીનની રચના જાળવવામાં આવે છે.
પ્રોટીનની રચનાત્મક ક્ષમતાકેટલાક તૂટવા અને અન્ય નબળા બોન્ડની રચનાને કારણે રચનામાં નાના ફેરફારોને પસાર કરવાની પ્રોટીનની ક્ષમતા છે.
કેટલાક પ્રોટીનનું તૃતીય માળખું સ્થિર થાય છે ડિસલ્ફાઇડ બોન્ડ્સ,બે સિસ્ટીન અવશેષોના એસએચ જૂથોની ક્રિયાપ્રતિક્રિયાને કારણે રચાય છે.
મોટાભાગના અંતઃકોશિક પ્રોટીનમાં સહસંયોજક ડિસલ્ફાઇડ બોન્ડ હોતા નથી. તેમની હાજરી કોષ દ્વારા સ્ત્રાવિત પ્રોટીનની લાક્ષણિકતા છે, ઉદાહરણ તરીકે, ઇન્સ્યુલિન અને ઇમ્યુનોગ્લોબ્યુલિનના પરમાણુઓમાં ડિસલ્ફાઇડ બોન્ડ હાજર છે.
ઇન્સ્યુલિન- સ્વાદુપિંડના બીટા કોષોમાં સંશ્લેષિત પ્રોટીન હોર્મોન. રક્તમાં ગ્લુકોઝની સાંદ્રતામાં વધારો થવાના પ્રતિભાવમાં કોષો દ્વારા સ્ત્રાવ થાય છે. ઇન્સ્યુલિનની રચનામાં 2 ડાયસલ્ફાઇડ બોન્ડ છે જે 2 પોલિપેપ્ટાઇડ A- અને B- સાંકળોને જોડે છે, અને A- સાંકળની અંદર 1 ડિસલ્ફાઇડ બોન્ડ છે (ફિગ. 1.5).
પ્રોટીનની ગૌણ રચનાની વિશેષતાઓ ઇન્ટરરેડિકલ ક્રિયાપ્રતિક્રિયાઓ અને તૃતીય બંધારણની પ્રકૃતિને પ્રભાવિત કરે છે.
4. વિવિધ બંધારણો અને કાર્યો સાથે ઘણા પ્રોટીનમાં ગૌણ બંધારણોના ફેરબદલનો ચોક્કસ ચોક્કસ ક્રમ જોવા મળે છે અને તેને સુપરસેકન્ડરી સ્ટ્રક્ચર કહેવામાં આવે છે.
આવા ઓર્ડર્ડ સ્ટ્રક્ચર્સને ઘણીવાર માળખાકીય પ્રધાનતત્ત્વ તરીકે ઓળખવામાં આવે છે,જેના ચોક્કસ નામો છે: “a-helix-turn-a-helix”, “leucine Zipper”, “zinc fingers”, “P-barrel structure”, વગેરે.
α-હેલિસિસ અને β-સ્ટ્રક્ચર્સની હાજરીના આધારે, ગ્લોબ્યુલર પ્રોટીનને 4 શ્રેણીઓમાં વિભાજિત કરી શકાય છે:
1. પ્રથમ શ્રેણીમાં પ્રોટીનનો સમાવેશ થાય છે જેમાં માત્ર α-helices હોય છે, ઉદાહરણ તરીકે મ્યોગ્લોબિન અને હિમોગ્લોબિન (ફિગ. 1.6).
2. બીજી શ્રેણીમાં પ્રોટીનનો સમાવેશ થાય છે જેમાં એ-હેલિસિસ અને (3-સ્ટ્રક્ચર્સ હોય છે. આ કિસ્સામાં, a- અને (3-સ્ટ્રક્ચર) ઘણીવાર વિવિધ વ્યક્તિગત પ્રોટીનમાં જોવા મળતા સમાન પ્રકારના સંયોજનો બનાવે છે.
ઉદાહરણ. પી-બેરલ પ્રકારનું સુપરસેકન્ડરી માળખું.
એન્ઝાઇમ ટ્રાઇઓસેફોસ્ફેટ આઇસોમેરેઝ પી-બેરલ પ્રકારનું સુપર-સેકન્ડરી માળખું ધરાવે છે, જ્યાં દરેક (3-સંરચના પી-બેરલની અંદર સ્થિત છે અને પોલિપેપ્ટાઇડના α-હેલિકલ પ્રદેશ સાથે સંકળાયેલ છે.પરમાણુની સપાટી પર સ્થિત સાંકળો (ફિગ. 1.7, એ).
ચોખા. 1.7. પી-બેરલ પ્રકારનું સુપરસેકન્ડરી માળખું.
a - triosephosphate isomerase; b - પીરુ વાટકા નાઝીનું ડોમેન.
.jpg)
સમાન સુપરસેકન્ડરી માળખું પાયરુવેટ કિનેઝ એન્ઝાઇમ પરમાણુ (ફિગ. 1.7, બી) ના એક ડોમેનમાં જોવા મળ્યું હતું. ડોમેન એ પરમાણુનો એક ભાગ છે જેની રચના સ્વતંત્ર ગ્લોબ્યુલર પ્રોટીન જેવું હોય છે.
સુપરસેકન્ડરી સ્ટ્રક્ચરની રચનાનું બીજું ઉદાહરણ જેમાં પી-સ્ટ્રક્ચર્સ અને ઓએસ-હેલિસિસ છે. લેક્ટેટ ડિહાઇડ્રોજેનેઝ (LDH) અને ફોસ્ફોગ્લિસેરેટ કિનેઝના ડોમેન્સમાંના એકમાં, પોલિપેપ્ટાઇડ સાંકળના પી-સ્ટ્રક્ચર્સ મધ્યમાં ટ્વિસ્ટેડ શીટના રૂપમાં સ્થિત છે, અને દરેક પી-સ્ટ્રક્ચર α-હેલિકલ પ્રદેશ સાથે સંકળાયેલું છે. પરમાણુની સપાટી પર (ફિગ. 1.8).
ચોખા. 1.8. ગૌણ માળખું, ઘણા ફેરની લાક્ષણિકતા-પોલીસ
એ-લેક્ટેટ ડિહાઇડ્રોજેનેઝ ડોમેન; b-ફોસ્ફોગ્લિસેરેટ કિનેઝ ડોમેન.
.jpg) 3. ત્રીજી શ્રેણીમાં એવા પ્રોટીનનો સમાવેશ થાય છે કે જેમાં હોય છેજેમાં માત્ર ગૌણ પી-સ્ટ્રક્ચર છે. આવી રચનાઓ ઇમ્યુનોગ્લોબ્યુલિનમાં, એન્ઝાઇમ સુપરઓક્સાઇડ ડિસમ્યુટેઝ (ફિગ. 1.9) માં જોવા મળે છે.
3. ત્રીજી શ્રેણીમાં એવા પ્રોટીનનો સમાવેશ થાય છે કે જેમાં હોય છેજેમાં માત્ર ગૌણ પી-સ્ટ્રક્ચર છે. આવી રચનાઓ ઇમ્યુનોગ્લોબ્યુલિનમાં, એન્ઝાઇમ સુપરઓક્સાઇડ ડિસમ્યુટેઝ (ફિગ. 1.9) માં જોવા મળે છે.
ચોખા. 1.9. ઇમ્યુનોગ્લોબ્યુલિન સતત ડોમેનનું ગૌણ માળખું (A)
અને એન્ઝાઇમ સુપરઓક્સાઇડ ડિસમ્યુટેઝ (b).
.jpg)
4. ચોથી કેટેગરીમાં પ્રોટીનનો સમાવેશ થાય છે જેમાં માત્ર થોડી માત્રામાં નિયમિત ગૌણ રચના હોય છે. આ પ્રોટીનમાં નાના સિસ્ટીન-સમૃદ્ધ પ્રોટીન અથવા મેટાલોપ્રોટીનનો સમાવેશ થાય છે.
ડીએનએ-બંધનકર્તા પ્રોટીનમાં સામાન્ય પ્રકારના સુપરસેકન્ડરી સ્ટ્રક્ચર્સ હોય છે: "os-helix-turn-os-helix", "leucine Zipper", "zinc-તમારી આંગળીઓ."ડીએનએ-બંધનકર્તા પ્રોટીનમાં એક બંધનકર્તા સ્થળ હોય છે જે ચોક્કસ ન્યુક્લિયોટાઇડ ક્રમ સાથે ડીએનએના પ્રદેશને પૂરક હોય છે. આ પ્રોટીન જનીન ક્રિયાના નિયમનમાં સામેલ છે.
« A-
સર્પાકાર-ટર્ન-એ-સર્પાકાર"
ચોખા. 1.10. સુપરસેકંડરીને લિંક કરવું
"એ-હેલિક્સ-ટર્ન-એ-હેલિક્સ" સ્ટ્રક્ચર્સ
મુખ્ય ખાંચ ડી માં
|
|
.jpg) ગરદનની ખાંચ સારીનાના હેલિકલ પ્રદેશો સાથે પ્રોટીનને બંધનકર્તા માટે અનુકૂળ.
ગરદનની ખાંચ સારીનાના હેલિકલ પ્રદેશો સાથે પ્રોટીનને બંધનકર્તા માટે અનુકૂળ.
આ માળખાકીય ઉદ્દેશ્યમાં 2 હેલિકોસનો સમાવેશ થાય છે: એક ટૂંકી, બીજી લાંબી, પોલિપેપ્ટાઇડ સાંકળના વળાંક દ્વારા જોડાયેલ (ફિગ. 1.10).
ટૂંકા α-હેલિક્સ ડીએનએ ગ્રુવમાં સ્થિત છે, અને લાંબો α-હેલિક્સ મુખ્ય ગ્રુવમાં સ્થિત છે, જે ડીએનએ ન્યુક્લિયોટાઇડ્સ સાથે એમિનો એસિડ રેડિકલના બિન-સહસંયોજક વિશિષ્ટ બોન્ડ બનાવે છે.
ઘણી વખત આવી રચના સાથેના પ્રોટીન ડાયમર્સ બનાવે છે પરિણામે, ઓલિગોમેરિક પ્રોટીનમાં 2 સુપરસેકન્ડરી સ્ટ્રક્ચર હોય છે.
તેઓ એકબીજાથી ચોક્કસ અંતરે સ્થિત છે અને પ્રોટીનની સપાટી ઉપર બહાર નીકળે છે (ફિગ. 1.11).આવી બે રચનાઓ મુખ્ય ખાંચોની નજીકના પ્રદેશોમાં ડીએનએને બાંધી શકે છે
વગરપ્રોટીનની રચનામાં નોંધપાત્ર ફેરફારો.
"ઝીંક આંગળી"
“ઝીંક ફિંગર” એ પ્રોટીનનો ટુકડો છે જેમાં લગભગ 20 એમિનો એસિડ અવશેષો (ફિગ. 1.12) છે.
ઝિંક અણુ 4 એમિનો એસિડ રેડિકલ સાથે સંકળાયેલું છે: 2 સિસ્ટીન અવશેષો અને 2 હિસ્ટીડાઇન અવશેષો.
કેટલાક કિસ્સાઓમાં, હિસ્ટીડાઇન અવશેષોને બદલે, સિસ્ટીન અવશેષો છે.
ચોખા. 1.12. ડીએનએ-બંધનકર્તા પ્રદેશનું માળખું"ઝીંક ફિંગર" ના રૂપમાં પ્રોટીન.
.jpg)
પ્રોટીનનો આ પ્રદેશ α-હેલિક્સ બનાવે છે, જે ખાસ કરીને DNA ના મુખ્ય ગ્રુવના નિયમનકારી પ્રદેશો સાથે જોડાઈ શકે છે.
વ્યક્તિગત નિયમનકારી ડીએનએ-બંધનકર્તા પ્રોટીનની બંધનકર્તા વિશિષ્ટતા ઝીંક આંગળીના પ્રદેશમાં સ્થિત એમિનો એસિડ અવશેષોના ક્રમ પર આધારિત છે.
"લ્યુસીન ઝિપર"
ક્રિયાપ્રતિક્રિયા કરતા પ્રોટીનમાં α-હેલિકલ પ્રદેશ હોય છે જેમાં ઓછામાં ઓછા 4 લ્યુસીન અવશેષો હોય છે.
લ્યુસીન અવશેષો એકબીજાથી 6 એમિનો એસિડ સ્થિત છે.
α-હેલિક્સના દરેક વળાંકમાં 3,6-એમિનો એસિડ અવશેષો હોવાથી, લ્યુસિન રેડિકલ દરેક બીજા વળાંકની સપાટી પર સ્થિત છે.
એક પ્રોટીનના α-હેલિક્સના લ્યુસિન અવશેષો બીજા પ્રોટીનના લ્યુસિન અવશેષો (હાઈડ્રોફોબિક ક્રિયાપ્રતિક્રિયાઓ) સાથે ક્રિયાપ્રતિક્રિયા કરી શકે છે, તેમને એકબીજા સાથે જોડે છે (ફિગ. 1.13).
.jpg) ઘણા ડીએનએ-બંધનકર્તા પ્રોટીન ડીએનએ સાથે ઓલિગોમેરિક સ્ટ્રક્ચર્સના સ્વરૂપમાં ક્રિયાપ્રતિક્રિયા કરે છે, જ્યાં સબ્યુનિટ્સ "લ્યુસીન ઝિપર્સ" દ્વારા એકબીજા સાથે જોડાયેલા હોય છે. આવા પ્રોટીનનું ઉદાહરણ હિસ્ટોન્સ છે.
ઘણા ડીએનએ-બંધનકર્તા પ્રોટીન ડીએનએ સાથે ઓલિગોમેરિક સ્ટ્રક્ચર્સના સ્વરૂપમાં ક્રિયાપ્રતિક્રિયા કરે છે, જ્યાં સબ્યુનિટ્સ "લ્યુસીન ઝિપર્સ" દ્વારા એકબીજા સાથે જોડાયેલા હોય છે. આવા પ્રોટીનનું ઉદાહરણ હિસ્ટોન્સ છે.
હિસ્ટોન્સ- ન્યુક્લિયર પ્રોટીન, જેમાં મોટી સંખ્યામાં પોઝિટિવ ચાર્જ્ડ એમિનો એસિડ હોય છે - આર્જિનિન અને લાયસિન (80% સુધી).
હિસ્ટોન પરમાણુઓ આ અણુઓના મજબૂત હકારાત્મક ચાર્જ હોવા છતાં, "લ્યુસીન ઝિપર્સ" નો ઉપયોગ કરીને 8 મોનોમર્સ ધરાવતા ઓલિગોમેરિક સંકુલમાં જોડાય છે.
ફરી શરૂ કરો.વ્યક્તિગત પ્રોટીનના તમામ અણુઓ, સમાન પ્રાથમિક માળખું ધરાવતા, દ્રાવણમાં સમાન રચના પ્રાપ્ત કરે છે.
આમ, પેપ્ટાઇડ સાંકળની અવકાશી ગોઠવણીની પ્રકૃતિ એમિનો એસિડ દ્વારા નક્કી કરવામાં આવે છેમાં એમિનો એસિડ અવશેષોની રચના અને ફેરબદલસાંકળોપરિણામે, રચના એ વ્યક્તિગત પ્રોટીનની પ્રાથમિક રચના જેટલી વિશિષ્ટ લાક્ષણિકતા છે.
ખિસકોલી- ઉચ્ચ પરમાણુ વજન કાર્બનિક સંયોજનો જેમાં α-એમિનો એસિડ અવશેષો હોય છે.
IN પ્રોટીન રચનાકાર્બન, હાઇડ્રોજન, નાઇટ્રોજન, ઓક્સિજન, સલ્ફરનો સમાવેશ થાય છે. કેટલાક પ્રોટીન ફોસ્ફરસ, આયર્ન, જસત અને તાંબુ ધરાવતા અન્ય અણુઓ સાથે સંકુલ બનાવે છે.
પ્રોટીનનું મોલેક્યુલર વજન છે: ઇંડા એલ્બ્યુમિન - 36,000, હિમોગ્લોબિન - 152,000, માયોસિન - 500,000 સરખામણી માટે: આલ્કોહોલનું પરમાણુ વજન 46, એસિટિક એસિડ - 60, બેન્ઝીન - 78 છે.
પ્રોટીનની એમિનો એસિડ રચના
ખિસકોલી- બિન-સામયિક પોલિમર, જેમાંથી મોનોમર્સ છે α-એમિનો એસિડ. સામાન્ય રીતે, 20 પ્રકારના α-એમિનો એસિડને પ્રોટીન મોનોમર્સ કહેવામાં આવે છે, જો કે તેમાંથી 170 થી વધુ કોષો અને પેશીઓમાં જોવા મળે છે.
માનવીઓ અને અન્ય પ્રાણીઓના શરીરમાં એમિનો એસિડનું સંશ્લેષણ કરી શકાય છે કે કેમ તેના આધારે, તેઓને અલગ પાડવામાં આવે છે: બિનજરૂરી એમિનો એસિડ- સંશ્લેષણ કરી શકાય છે; આવશ્યક એમિનો એસિડ- સંશ્લેષણ કરી શકાતું નથી. આવશ્યક એમિનો એસિડ ખોરાક દ્વારા શરીરને પૂરા પાડવામાં આવશ્યક છે. છોડ તમામ પ્રકારના એમિનો એસિડનું સંશ્લેષણ કરે છે.
એમિનો એસિડ રચના પર આધાર રાખીને, પ્રોટીન છે: સંપૂર્ણ- એમિનો એસિડનો સંપૂર્ણ સમૂહ ધરાવે છે; ખામીયુક્ત- કેટલાક એમિનો એસિડ તેમની રચનામાં ખૂટે છે. જો પ્રોટીનમાં માત્ર એમિનો એસિડ હોય, તો તેને કહેવામાં આવે છે સરળ. જો પ્રોટીનમાં એમિનો એસિડ ઉપરાંત, નોન-એમિનો એસિડ ઘટક (કૃત્રિમ જૂથ) હોય, તો તેને કહેવામાં આવે છે. જટિલ. કૃત્રિમ જૂથને ધાતુઓ (મેટલોપ્રોટીન), કાર્બોહાઇડ્રેટ્સ (ગ્લાયકોપ્રોટીન), લિપિડ્સ (લિપોપ્રોટીન), ન્યુક્લીક એસિડ્સ (ન્યુક્લિયોપ્રોટીન) દ્વારા રજૂ કરી શકાય છે.
બધા એમિનો એસિડ સમાવે છે: 1) કાર્બોક્સિલ જૂથ (-COOH), 2) એમિનો જૂથ (-NH 2), 3) આમૂલ અથવા આર-જૂથ (બાકીના પરમાણુ). વિવિધ પ્રકારના એમિનો એસિડ માટે રેડિકલની રચના અલગ છે. એમિનો એસિડની રચનામાં સમાવિષ્ટ એમિનો જૂથો અને કાર્બોક્સિલ જૂથોની સંખ્યાના આધારે, તેઓને અલગ પાડવામાં આવે છે: તટસ્થ એમિનો એસિડએક કાર્બોક્સિલ જૂથ અને એક એમિનો જૂથ ધરાવે છે; મૂળભૂત એમિનો એસિડએક કરતાં વધુ એમિનો જૂથ ધરાવતા; એસિડિક એમિનો એસિડએક કરતાં વધુ કાર્બોક્સિલ જૂથ ધરાવે છે.
એમિનો એસિડ છે એમ્ફોટેરિક સંયોજનો, કારણ કે દ્રાવણમાં તેઓ એસિડ અને બેઝ બંને તરીકે કાર્ય કરી શકે છે. જલીય દ્રાવણમાં, એમિનો એસિડ વિવિધ આયનીય સ્વરૂપોમાં અસ્તિત્વ ધરાવે છે.
પેપ્ટાઇડ બોન્ડ
પેપ્ટાઇડ્સ- પેપ્ટાઇડ બોન્ડ દ્વારા જોડાયેલા એમિનો એસિડ અવશેષો ધરાવતા કાર્બનિક પદાર્થો.
એમિનો એસિડની ઘનીકરણ પ્રતિક્રિયાના પરિણામે પેપ્ટાઇડ્સનું નિર્માણ થાય છે. જ્યારે એક એમિનો એસિડનું એમિનો જૂથ બીજાના કાર્બોક્સિલ જૂથ સાથે ક્રિયાપ્રતિક્રિયા કરે છે, ત્યારે તેમની વચ્ચે સહસંયોજક નાઇટ્રોજન-કાર્બન બોન્ડ ઉત્પન્ન થાય છે, જેને કહેવામાં આવે છે. પેપ્ટાઇડ. પેપ્ટાઇડમાં સમાવિષ્ટ એમિનો એસિડ અવશેષોની સંખ્યાના આધારે, ત્યાં છે ડિપેપ્ટાઇડ્સ, ટ્રિપેપ્ટાઇડ્સ, ટેટ્રાપેપ્ટાઇડ્સવગેરે પેપ્ટાઇડ બોન્ડની રચના ઘણી વખત પુનરાવર્તિત થઈ શકે છે. આ રચના તરફ દોરી જાય છે પોલિપેપ્ટાઇડ્સ. પેપ્ટાઈડના એક છેડે એક મફત એમિનો જૂથ છે (જેને એન-ટર્મિનસ કહેવાય છે), અને બીજી બાજુ એક મફત કાર્બોક્સિલ જૂથ છે (જેને સી-ટર્મિનસ કહેવાય છે).

પ્રોટીન પરમાણુઓનું અવકાશી સંગઠન
પ્રોટીન દ્વારા અમુક ચોક્કસ કાર્યોનું પ્રદર્શન તેમના પરમાણુઓના અવકાશી રૂપરેખાંકન પર આધાર રાખે છે, વધુમાં, સાંકળના રૂપમાં પ્રોટીનને અનફોલ્ડ સ્વરૂપમાં રાખવું તે ઊર્જાસભર રીતે પ્રતિકૂળ છે, તેથી પોલીપેપ્ટાઈડ સાંકળો ફોલ્ડિંગમાંથી પસાર થાય છે, ચોક્કસ ત્રિ-પરિમાણીય માળખું, અથવા રચના. ત્યાં 4 સ્તરો છે પ્રોટીનનું અવકાશી સંગઠન.
પ્રાથમિક પ્રોટીન માળખું- પોલીપેપ્ટાઈડ સાંકળમાં એમિનો એસિડ અવશેષોની ગોઠવણીનો ક્રમ જે પ્રોટીન પરમાણુ બનાવે છે. એમિનો એસિડ વચ્ચેનું બોન્ડ પેપ્ટાઈડ બોન્ડ છે.

જો પ્રોટીન પરમાણુમાં માત્ર 10 એમિનો એસિડ અવશેષો હોય, તો પ્રોટીન પરમાણુઓના સૈદ્ધાંતિક રીતે સંભવિત ચલોની સંખ્યા જે એમિનો એસિડના ફેરબદલના ક્રમમાં ભિન્ન હોય તે 10% છે. 20 એમિનો એસિડ ધરાવતા, તમે તેમાંથી વધુ વિવિધ સંયોજનો બનાવી શકો છો. માનવ શરીરમાં લગભગ દસ હજાર વિવિધ પ્રોટીન મળી આવ્યા છે, જે એકબીજાથી અને અન્ય જીવોના પ્રોટીનથી અલગ છે.
તે પ્રોટીન પરમાણુનું પ્રાથમિક માળખું છે જે પ્રોટીન પરમાણુના ગુણધર્મો અને તેના અવકાશી રૂપરેખાંકનને નિર્ધારિત કરે છે. પોલિપેપ્ટાઇડ સાંકળમાં માત્ર એક એમિનો એસિડને બીજા સાથે બદલવાથી પ્રોટીનના ગુણધર્મો અને કાર્યોમાં ફેરફાર થાય છે. ઉદાહરણ તરીકે, હિમોગ્લોબિનના β-સબ્યુનિટમાં છઠ્ઠા ગ્લુટામાઇન એમિનો એસિડને વેલિન સાથે બદલવાથી એ હકીકત તરફ દોરી જાય છે કે સમગ્ર હિમોગ્લોબિન પરમાણુ તેનું મુખ્ય કાર્ય કરી શકતું નથી - ઓક્સિજન પરિવહન; આવા કિસ્સાઓમાં, વ્યક્તિને સિકલ સેલ એનિમિયા નામનો રોગ થાય છે.
ગૌણ માળખું- પોલિપેપ્ટાઇડ સાંકળને સર્પાકારમાં ફોલ્ડ કરવાનો આદેશ આપ્યો (એક વિસ્તૃત વસંત જેવું લાગે છે). કાર્બોક્સિલ જૂથો અને એમિનો જૂથો વચ્ચે ઉદ્ભવતા હાઇડ્રોજન બોન્ડ દ્વારા હેલિક્સના વળાંકને મજબૂત બનાવવામાં આવે છે. લગભગ તમામ CO અને NH જૂથો હાઇડ્રોજન બોન્ડની રચનામાં ભાગ લે છે. તેઓ પેપ્ટાઈડ કરતા નબળા હોય છે, પરંતુ, ઘણી વખત પુનરાવર્તિત થાય છે, આ ગોઠવણીને સ્થિરતા અને કઠોરતા આપે છે. ગૌણ રચનાના સ્તરે, પ્રોટીન હોય છે: ફાઈબ્રોઈન (રેશમ, સ્પાઈડર વેબ), કેરાટિન (વાળ, નખ), કોલેજન (રજ્જૂ).



તૃતીય માળખું- ગ્લોબ્યુલ્સમાં પોલિપેપ્ટાઇડ સાંકળોનું પેકીંગ, રાસાયણિક બોન્ડ્સ (હાઇડ્રોજન, આયનીય, ડાયસલ્ફાઇડ) ની રચના અને એમિનો એસિડ અવશેષોના રેડિકલ વચ્ચે હાઇડ્રોફોબિક ક્રિયાપ્રતિક્રિયાઓની સ્થાપનાના પરિણામે. તૃતીય માળખાના નિર્માણમાં મુખ્ય ભૂમિકા હાઇડ્રોફિલિક-હાઇડ્રોફોબિક ક્રિયાપ્રતિક્રિયાઓ દ્વારા ભજવવામાં આવે છે. જલીય દ્રાવણમાં, હાઇડ્રોફોબિક રેડિકલ પાણીથી છુપાઇને, ગ્લોબ્યુલની અંદર જૂથબદ્ધ થવાનું વલણ ધરાવે છે, જ્યારે હાઇડ્રોફિલિક રેડિકલ, હાઇડ્રેશન (પાણીના દ્વિધ્રુવો સાથે ક્રિયાપ્રતિક્રિયા) ના પરિણામે, પરમાણુની સપાટી પર દેખાવાનું વલણ ધરાવે છે. કેટલાક પ્રોટીનમાં, તૃતીય માળખું બે સિસ્ટીન અવશેષોના સલ્ફર અણુઓ વચ્ચે રચાયેલા ડાયસલ્ફાઇડ સહસંયોજક બોન્ડ દ્વારા સ્થિર થાય છે. તૃતીય માળખાના સ્તરે ઉત્સેચકો, એન્ટિબોડીઝ અને કેટલાક હોર્મોન્સ હોય છે.

ચતુર્થાંશ માળખુંજટિલ પ્રોટીનની લાક્ષણિકતા જેના પરમાણુઓ બે અથવા વધુ ગ્લોબ્યુલ્સ દ્વારા રચાય છે. સબ્યુનિટ્સ આયનીય, હાઇડ્રોફોબિક અને ઇલેક્ટ્રોસ્ટેટિક ક્રિયાપ્રતિક્રિયાઓ દ્વારા પરમાણુમાં રાખવામાં આવે છે. કેટલીકવાર, ચતુર્થાંશ માળખાના નિર્માણ દરમિયાન, સબ્યુનિટ્સ વચ્ચે ડિસલ્ફાઇડ બોન્ડ્સ થાય છે. ચતુર્થાંશ માળખું સાથે સૌથી વધુ અભ્યાસ કરાયેલ પ્રોટીન છે હિમોગ્લોબિન. તે બે α-સબ્યુનિટ્સ (141 એમિનો એસિડ અવશેષો) અને બે β-સબ્યુનિટ્સ (146 એમિનો એસિડ અવશેષો) દ્વારા રચાય છે. દરેક સબ્યુનિટ સાથે સંકળાયેલ હેમ પરમાણુ હોય છે જેમાં આયર્ન હોય છે.
જો કોઈ કારણોસર પ્રોટીનની અવકાશી રચના સામાન્યથી વિચલિત થાય છે, તો પ્રોટીન તેના કાર્યો કરી શકતું નથી. ઉદાહરણ તરીકે, "મેડ કાઉ ડિસીઝ" (સ્પોન્જિફોર્મ એન્સેફાલોપથી) નું કારણ ચેતા કોષોની સપાટીના પ્રોટીન, પ્રિઓન્સની અસામાન્ય રચના છે.
પ્રોટીનના ગુણધર્મો
પ્રોટીન પરમાણુની એમિનો એસિડ રચના અને માળખું તે નક્કી કરે છે ગુણધર્મો. પ્રોટીન મૂળભૂત અને એસિડિક ગુણધર્મોને જોડે છે, જે એમિનો એસિડ રેડિકલ દ્વારા નિર્ધારિત થાય છે: પ્રોટીનમાં વધુ એસિડિક એમિનો એસિડ, તેના એસિડિક ગુણધર્મો વધુ સ્પષ્ટ થાય છે. દાન કરવાની અને H+ ઉમેરવાની ક્ષમતા નક્કી કરવામાં આવે છે પ્રોટીનના બફરિંગ ગુણધર્મો; સૌથી શક્તિશાળી બફર્સમાંનું એક લાલ રક્ત કોશિકાઓમાં હિમોગ્લોબિન છે, જે સતત સ્તરે રક્ત pH જાળવી રાખે છે. ત્યાં દ્રાવ્ય પ્રોટીન (ફાઈબ્રિનોજન) છે, અને ત્યાં અદ્રાવ્ય પ્રોટીન છે જે યાંત્રિક કાર્યો કરે છે (ફાઈબ્રોઈન, કેરાટિન, કોલેજન). ત્યાં પ્રોટીન છે જે રાસાયણિક રીતે સક્રિય છે (એન્ઝાઇમ્સ), ત્યાં રાસાયણિક રીતે નિષ્ક્રિય પ્રોટીન છે જે વિવિધ પર્યાવરણીય પરિસ્થિતિઓ માટે પ્રતિરોધક છે અને જે અત્યંત અસ્થિર છે.
બાહ્ય પરિબળો (ગરમી, અલ્ટ્રાવાયોલેટ કિરણોત્સર્ગ, ભારે ધાતુઓ અને તેમના ક્ષાર, pH ફેરફારો, કિરણોત્સર્ગ, નિર્જલીકરણ)
પ્રોટીન પરમાણુના માળખાકીય સંગઠનમાં વિક્ષેપ પેદા કરી શકે છે. આપેલ પ્રોટીન પરમાણુમાં સહજ ત્રિ-પરિમાણીય રચનાના નુકશાનની પ્રક્રિયા કહેવામાં આવે છે. વિકૃતિકરણ. વિકૃતિકરણનું કારણ એ બોન્ડનું તૂટવું છે જે ચોક્કસ પ્રોટીન માળખું સ્થિર કરે છે. શરૂઆતમાં, સૌથી નબળા સંબંધો તૂટી જાય છે, અને જેમ જેમ પરિસ્થિતિઓ વધુ કડક બને છે તેમ, મજબૂત સંબંધો પણ તૂટી જાય છે. તેથી, પ્રથમ ચતુર્થાંશ, પછી તૃતીય અને ગૌણ માળખાં ખોવાઈ જાય છે. અવકાશી રૂપરેખાંકનમાં ફેરફાર પ્રોટીનના ગુણધર્મોમાં ફેરફાર તરફ દોરી જાય છે અને પરિણામે, પ્રોટીન તેના અંતર્ગત જૈવિક કાર્યો કરવા માટે તેને અશક્ય બનાવે છે. જો વિકૃતિકરણ પ્રાથમિક માળખાના વિનાશ સાથે ન હોય, તો તે હોઈ શકે છે ઉલટાવી શકાય તેવું, આ કિસ્સામાં, પ્રોટીનની રચના લાક્ષણિકતાની સ્વ-પુનઃપ્રાપ્તિ થાય છે. ઉદાહરણ તરીકે, મેમ્બ્રેન રીસેપ્ટર પ્રોટીન આવા વિકૃતીકરણમાંથી પસાર થાય છે. વિકૃતિકરણ પછી પ્રોટીન માળખું પુનઃસ્થાપિત કરવાની પ્રક્રિયા કહેવામાં આવે છે પુનર્નિર્માણ. જો પ્રોટીનના અવકાશી રૂપરેખાંકનને પુનઃસ્થાપિત કરવું અશક્ય છે, તો પછી વિકૃતિકરણ કહેવામાં આવે છે ઉલટાવી શકાય તેવું.
પ્રોટીનનાં કાર્યો
| કાર્ય | ઉદાહરણો અને સમજૂતીઓ |
|---|---|
| બાંધકામ | પ્રોટીન્સ સેલ્યુલર અને એક્સ્ટ્રા સેલ્યુલર સ્ટ્રક્ચર્સની રચનામાં સામેલ છે: તે કોષ પટલ (લિપોપ્રોટીન, ગ્લાયકોપ્રોટીન), વાળ (કેરાટિન), રજ્જૂ (કોલેજન) વગેરેનો ભાગ છે. |
| પરિવહન | રક્ત પ્રોટીન હિમોગ્લોબિન ઓક્સિજનને જોડે છે અને તેને ફેફસાંમાંથી તમામ પેશીઓ અને અવયવોમાં પરિવહન કરે છે, અને તેમાંથી ફેફસાંમાં કાર્બન ડાયોક્સાઇડનું પરિવહન કરે છે; કોષ પટલની રચનામાં વિશિષ્ટ પ્રોટીનનો સમાવેશ થાય છે જે કોષમાંથી બાહ્ય વાતાવરણ અને પાછળના ભાગમાં ચોક્કસ પદાર્થો અને આયનોના સક્રિય અને સખત પસંદગીયુક્ત સ્થાનાંતરણને સુનિશ્ચિત કરે છે. |
| નિયમનકારી | પ્રોટીન હોર્મોન્સ મેટાબોલિક પ્રક્રિયાઓના નિયમનમાં ભાગ લે છે. ઉદાહરણ તરીકે, હોર્મોન ઇન્સ્યુલિન લોહીમાં શર્કરાના સ્તરને નિયંત્રિત કરે છે, ગ્લાયકોજન સંશ્લેષણને પ્રોત્સાહન આપે છે અને કાર્બોહાઇડ્રેટ્સમાંથી ચરબીની રચનામાં વધારો કરે છે. |
| રક્ષણાત્મક | શરીરમાં વિદેશી પ્રોટીન અથવા સુક્ષ્મસજીવો (એન્ટિજેન્સ) ના ઘૂંસપેંઠના પ્રતિભાવમાં, ખાસ પ્રોટીન રચાય છે - એન્ટિબોડીઝ જે તેમને બાંધી અને તટસ્થ કરી શકે છે. ફાઈબ્રિનોજનમાંથી બનેલું ફાઈબ્રિન રક્તસ્રાવ રોકવામાં મદદ કરે છે. |
| મોટર | સંકોચનીય પ્રોટીન એક્ટિન અને માયોસિન બહુકોષીય પ્રાણીઓમાં સ્નાયુ સંકોચન પૂરું પાડે છે. |
| સિગ્નલ | કોષની સપાટીના પટલમાં બિલ્ટ પ્રોટીન પરમાણુઓ છે જે પર્યાવરણીય પરિબળોના પ્રતિભાવમાં તેમની તૃતીય રચનાને બદલવામાં સક્ષમ છે, આમ બાહ્ય વાતાવરણમાંથી સંકેતો પ્રાપ્ત કરે છે અને કોષને આદેશો પ્રસારિત કરે છે. |
| સંગ્રહ | પ્રાણીઓના શરીરમાં, પ્રોટીન, એક નિયમ તરીકે, ઇંડા આલ્બ્યુમિન અને દૂધ કેસિનના અપવાદ સિવાય સંગ્રહિત નથી. પરંતુ પ્રોટીનનો આભાર, કેટલાક પદાર્થો શરીરમાં સંગ્રહિત થઈ શકે છે, ઉદાહરણ તરીકે, હિમોગ્લોબિનના ભંગાણ દરમિયાન, આયર્ન શરીરમાંથી દૂર કરવામાં આવતું નથી, પરંતુ તે પ્રોટીન ફેરિટિન સાથે સંકુલ બનાવે છે. |
| ઉર્જા | જ્યારે 1 ગ્રામ પ્રોટીન અંતિમ ઉત્પાદનોમાં તૂટી જાય છે, ત્યારે 17.6 kJ મુક્ત થાય છે. પ્રથમ, પ્રોટીન એમિનો એસિડમાં તૂટી જાય છે, અને પછી અંતિમ ઉત્પાદનોમાં - પાણી, કાર્બન ડાયોક્સાઇડ અને એમોનિયા. જો કે, પ્રોટીનનો ઉપયોગ ઊર્જાના સ્ત્રોત તરીકે ત્યારે જ થાય છે જ્યારે અન્ય સ્ત્રોતો (કાર્બોહાઇડ્રેટ્સ અને ચરબી)નો ઉપયોગ થાય છે. |
| ઉત્પ્રેરક | પ્રોટીનના સૌથી મહત્વપૂર્ણ કાર્યોમાંનું એક. પ્રોટીન દ્વારા પ્રદાન કરવામાં આવે છે - ઉત્સેચકો જે કોષોમાં થતી બાયોકેમિકલ પ્રતિક્રિયાઓને વેગ આપે છે. ઉદાહરણ તરીકે, રિબ્યુલોઝ બાયફોસ્ફેટ કાર્બોક્સિલેઝ પ્રકાશસંશ્લેષણ દરમિયાન CO 2 ના ફિક્સેશનને ઉત્પ્રેરિત કરે છે. |
ઉત્સેચકો
ઉત્સેચકો, અથવા ઉત્સેચકો, પ્રોટીનનો એક વિશિષ્ટ વર્ગ છે જે જૈવિક ઉત્પ્રેરક છે. ઉત્સેચકોનો આભાર, બાયોકેમિકલ પ્રતિક્રિયાઓ જબરદસ્ત ઝડપે થાય છે. એન્ઝાઇમેટિક પ્રતિક્રિયાઓની ગતિ અકાર્બનિક ઉત્પ્રેરકની ભાગીદારી સાથે થતી પ્રતિક્રિયાઓની ગતિ કરતા હજારો ગણી (અને કેટલીકવાર લાખો) વધારે છે. જે પદાર્થ પર એન્ઝાઇમ કાર્ય કરે છે તેને કહેવામાં આવે છે સબસ્ટ્રેટ.
ઉત્સેચકો ગ્લોબ્યુલર પ્રોટીન છે, માળખાકીય સુવિધાઓઉત્સેચકોને બે જૂથોમાં વિભાજિત કરી શકાય છે: સરળ અને જટિલ. સરળ ઉત્સેચકોસરળ પ્રોટીન છે, એટલે કે. માત્ર એમિનો એસિડનો સમાવેશ થાય છે. જટિલ ઉત્સેચકોજટિલ પ્રોટીન છે, એટલે કે. પ્રોટીન ભાગ ઉપરાંત, તેમાં બિન-પ્રોટીન પ્રકૃતિનું જૂથ છે - કોફેક્ટર. કેટલાક ઉત્સેચકો કોફેક્ટર્સ તરીકે વિટામિનનો ઉપયોગ કરે છે. એન્ઝાઇમ પરમાણુમાં સક્રિય કેન્દ્ર તરીકે ઓળખાતા વિશેષ ભાગનો સમાવેશ થાય છે. સક્રિય કેન્દ્ર- એન્ઝાઇમનો એક નાનો વિભાગ (ત્રણથી બાર એમિનો એસિડ અવશેષોમાંથી), જ્યાં સબસ્ટ્રેટ અથવા સબસ્ટ્રેટનું બંધન એન્ઝાઇમ-સબસ્ટ્રેટ સંકુલ રચવા માટે થાય છે. પ્રતિક્રિયા પૂર્ણ થયા પછી, એન્ઝાઇમ-સબસ્ટ્રેટ કોમ્પ્લેક્સ એન્ઝાઇમ અને પ્રતિક્રિયા ઉત્પાદન(ઓ)માં તૂટી જાય છે. કેટલાક ઉત્સેચકો હોય છે (સક્રિય સિવાય) એલોસ્ટેરિક કેન્દ્રો- વિસ્તારો કે જેમાં એન્ઝાઇમ સ્પીડ રેગ્યુલેટર જોડાયેલા છે ( એલોસ્ટેરિક ઉત્સેચકો).

એન્ઝાઇમેટિક કેટાલિસિસની પ્રતિક્રિયાઓ દ્વારા વર્ગીકૃત કરવામાં આવે છે: 1) ઉચ્ચ કાર્યક્ષમતા, 2) કડક પસંદગી અને ક્રિયાની દિશા, 3) સબસ્ટ્રેટ વિશિષ્ટતા, 4) દંડ અને ચોક્કસ નિયમન. એન્ઝાઇમેટિક ઉત્પ્રેરક પ્રતિક્રિયાઓની સબસ્ટ્રેટ અને પ્રતિક્રિયા વિશિષ્ટતા ઇ. ફિશર (1890) અને ડી. કોશલેન્ડ (1959) ની પૂર્વધારણાઓ દ્વારા સમજાવવામાં આવી છે.
ઇ. ફિશર (કી-લોક પૂર્વધારણા)સૂચન કર્યું કે એન્ઝાઇમ અને સબસ્ટ્રેટની સક્રિય સાઇટની અવકાશી રૂપરેખાંકનો એકબીજા સાથે બરાબર અનુરૂપ હોવા જોઈએ. સબસ્ટ્રેટને "કી" સાથે સરખાવવામાં આવે છે, એન્ઝાઇમને "લોક" સાથે.
ડી. કોશલેન્ડ (હેન્ડ-ગ્લોવ પૂર્વધારણા)સૂચવે છે કે સબસ્ટ્રેટની રચના અને એન્ઝાઇમના સક્રિય કેન્દ્ર વચ્ચેનો અવકાશી પત્રવ્યવહાર ફક્ત તેમની એકબીજા સાથેની ક્રિયાપ્રતિક્રિયાની ક્ષણે જ બનાવવામાં આવે છે. આ પૂર્વધારણા પણ કહેવાય છે પ્રેરિત પત્રવ્યવહાર પૂર્વધારણા.
એન્ઝાઇમેટિક પ્રતિક્રિયાઓનો દર આના પર આધાર રાખે છે: 1) તાપમાન, 2) એન્ઝાઇમ સાંદ્રતા, 3) સબસ્ટ્રેટ સાંદ્રતા, 4) pH. એ વાત પર ભાર મૂકવો જોઈએ કે ઉત્સેચકો પ્રોટીન હોવાથી, શારીરિક રીતે સામાન્ય સ્થિતિમાં તેમની પ્રવૃત્તિ સૌથી વધુ હોય છે.
મોટાભાગના ઉત્સેચકો માત્ર 0 અને 40 ° સે વચ્ચેના તાપમાને જ કામ કરી શકે છે. આ મર્યાદાઓની અંદર, તાપમાનમાં દર 10 ° સે વધારા સાથે પ્રતિક્રિયા દર આશરે 2 ગણો વધે છે. 40 ડિગ્રી સેલ્સિયસથી ઉપરના તાપમાને, પ્રોટીન ડિનેચરેશનમાંથી પસાર થાય છે અને એન્ઝાઇમની પ્રવૃત્તિમાં ઘટાડો થાય છે. ઠંડકની નજીકના તાપમાને, ઉત્સેચકો નિષ્ક્રિય થાય છે.
જેમ જેમ સબસ્ટ્રેટનું પ્રમાણ વધે છે તેમ, સબસ્ટ્રેટ પરમાણુઓની સંખ્યા એન્ઝાઇમ પરમાણુઓની સંખ્યા જેટલી ન થાય ત્યાં સુધી એન્ઝાઈમેટિક પ્રતિક્રિયાનો દર વધે છે. સબસ્ટ્રેટની માત્રામાં વધુ વધારા સાથે, ગતિ વધશે નહીં, કારણ કે એન્ઝાઇમના સક્રિય કેન્દ્રો સંતૃપ્ત છે. એન્ઝાઇમની સાંદ્રતામાં વધારો ઉત્પ્રેરક પ્રવૃત્તિમાં વધારો તરફ દોરી જાય છે, કારણ કે મોટી સંખ્યામાં સબસ્ટ્રેટ પરમાણુઓ એકમ સમય દીઠ પરિવર્તનમાંથી પસાર થાય છે.

દરેક એન્ઝાઇમ માટે, ત્યાં એક શ્રેષ્ઠ pH મૂલ્ય છે કે જેના પર તે મહત્તમ પ્રવૃત્તિ દર્શાવે છે (પેપ્સિન - 2.0, લાળ એમીલેઝ - 6.8, સ્વાદુપિંડનું લિપેઝ - 9.0). ઉચ્ચ અથવા નીચલા પીએચ મૂલ્યો પર, એન્ઝાઇમ પ્રવૃત્તિ ઘટે છે. પીએચમાં અચાનક ફેરફાર સાથે, એન્ઝાઇમ ડિનેચર થાય છે.
એલોસ્ટેરિક એન્ઝાઇમ્સની ગતિ એલોસ્ટેરિક કેન્દ્રો સાથે જોડાયેલા પદાર્થો દ્વારા નિયંત્રિત થાય છે. જો આ પદાર્થો પ્રતિક્રિયાને વેગ આપે છે, તો તેને કહેવામાં આવે છે સક્રિયકર્તા, જો તેઓ ધીમું કરે છે - અવરોધકો.
ઉત્સેચકોનું વર્ગીકરણ
રાસાયણિક પરિવર્તનના પ્રકારને આધારે તેઓ ઉત્પ્રેરક કરે છે, ઉત્સેચકોને 6 વર્ગોમાં વહેંચવામાં આવે છે:
- oxireductases(હાઈડ્રોજન, ઓક્સિજન અથવા ઈલેક્ટ્રોન અણુઓનું એક પદાર્થમાંથી બીજા પદાર્થમાં ટ્રાન્સફર - ડિહાઈડ્રોજેનેઝ),
- ટ્રાન્સફર(મિથાઈલ, એસિલ, ફોસ્ફેટ અથવા એમિનો જૂથનું એક પદાર્થમાંથી બીજા પદાર્થમાં ટ્રાન્સફર - ટ્રાન્સમિનેઝ),
- હાઇડ્રોલેસ(હાઇડ્રોલિસિસ પ્રતિક્રિયાઓ જેમાં સબસ્ટ્રેટમાંથી બે ઉત્પાદનો રચાય છે - એમીલેઝ, લિપેઝ),
- lyases(સબસ્ટ્રેટમાં બિન-હાઇડ્રોલિટીક ઉમેરણ અથવા તેમાંથી અણુઓના જૂથની ટુકડી, જે કિસ્સામાં C-C, C-N, C-O, C-S બોન્ડ તૂટી શકે છે - ડેકાર્બોક્સિલેઝ),
- આઇસોમેરેસિસ(ઇન્ટ્રામોલેક્યુલર પુનર્ગઠન - આઇસોમેરેઝ),
- લિગાસિસ(C-C, C-N, C-O, C-S બોન્ડ - સિન્થેટેઝની રચનાના પરિણામે બે પરમાણુઓનું જોડાણ).
વર્ગો બદલામાં પેટાવર્ગો અને પેટા વર્ગોમાં વિભાજિત થાય છે. વર્તમાન આંતરરાષ્ટ્રીય વર્ગીકરણમાં, દરેક એન્ઝાઇમમાં એક ચોક્કસ કોડ હોય છે જેમાં બિંદુઓ દ્વારા અલગ કરાયેલ ચાર સંખ્યાઓનો સમાવેશ થાય છે. પ્રથમ નંબર વર્ગ છે, બીજો ઉપવર્ગ છે, ત્રીજો ઉપવર્ગ છે, ચોથો આ પેટા વર્ગમાં એન્ઝાઇમનો સીરીયલ નંબર છે, ઉદાહરણ તરીકે, આર્જીનેઝ કોડ 3.5.3.1 છે.
પર જાઓ પ્રવચનો નંબર 2"કાર્બોહાઇડ્રેટ્સ અને લિપિડ્સનું માળખું અને કાર્યો"
પર જાઓ પ્રવચનો નંબર 4"એટીપી ન્યુક્લિક એસિડનું માળખું અને કાર્યો"
લગભગ દરેક શાળા જીવવિજ્ઞાન પાઠ હવે જાણે છે કે પ્રોટીન શું છે. તેઓ જીવંત પ્રાણીના કોષમાં ઘણા કાર્યો કરે છે.
પ્રોટીન શું છે?
આ જટિલ કાર્બનિક સંયોજનો છે. તેઓ એમિનો એસિડથી બનેલા છે, જેમાંથી કુલ 20 છે, પરંતુ તેમને વિવિધ ક્રમમાં જોડીને, તમે લાખો વિવિધ રસાયણો મેળવી શકો છો.
પ્રોટીન માળખું
એકવાર આપણે પહેલેથી જાણીએ છીએ કે પ્રોટીન શું છે, અમે તેમની રચનાને નજીકથી જોઈ શકીએ છીએ. આ પ્રકારના પદાર્થનું પ્રાથમિક, ગૌણ, તૃતીય અને ચતુર્થાંશ માળખું છે.
પ્રાથમિક માળખું
આ એક સાંકળ છે જેમાં એમિનો એસિડ યોગ્ય ક્રમમાં જોડાયેલા છે. આ ફેરબદલ પ્રોટીનનો પ્રકાર નક્કી કરે છે. આ વર્ગના દરેક પદાર્થ માટે તે વ્યક્તિગત છે. ચોક્કસ પ્રોટીનના ભૌતિક અને રાસાયણિક ગુણધર્મો પણ મોટાભાગે પ્રાથમિક બંધારણ પર આધાર રાખે છે.
ગૌણ માળખું
આ તે અવકાશી આકાર છે જે કાર્બોક્સિલ જૂથો અને ઈમિનો જૂથો વચ્ચે હાઈડ્રોજન બોન્ડની રચનાને કારણે પોલિપેપ્ટાઈડ સાંકળ ધારણ કરે છે. બે સૌથી સામાન્ય પ્રકારો છે: આલ્ફા હેલિક્સ અને બીટા સ્ટ્રક્ચર, જે રિબન જેવો દેખાવ ધરાવે છે. પ્રથમ સમાન પોલિપેપ્ટાઇડ સાંકળના પરમાણુઓ વચ્ચેના બોન્ડની રચનાને કારણે રચાય છે, બીજો - સમાંતર સ્થિત બે અથવા વધુ સાંકળો વચ્ચે. જો કે, બીટા સ્ટ્રક્ચર માટે એક પોલિમરની અંદર દેખાવાનું પણ શક્ય છે, તે કિસ્સામાં જ્યારે તેના અમુક ટુકડાઓ 180 ડિગ્રી ફેરવાય છે.

તૃતીય માળખું
આલ્ફા હેલિક્સના વિભાગો, સાદી પોલિપેપ્ટાઇડ સાંકળો અને બીટા સ્ટ્રક્ચર્સના અવકાશમાં એકબીજાને સંબંધિત આ ફેરબદલ અને ગોઠવણી છે.
ચતુર્થાંશ માળખું
તેના પણ બે પ્રકાર છે: ગ્લોબ્યુલર અને ફાઈબ્રિલર. આ માળખું ઇલેક્ટ્રોસ્ટેટિક ક્રિયાપ્રતિક્રિયાઓ અને હાઇડ્રોજન બોન્ડને કારણે રચાય છે. ગ્લોબ્યુલરમાં નાના બોલનો આકાર હોય છે, અને ફાઈબ્રિલરમાં થ્રેડનો આકાર હોય છે. પ્રથમ પ્રકારની ચતુર્થાંશ રચનાવાળા પ્રોટીનનાં ઉદાહરણો એલ્બુમિન, ઇન્સ્યુલિન, ઇમ્યુનોગ્લોબ્યુલિન વગેરે છે.; ફાઈબ્રિલર - ફાઈબ્રોઈન, કેરાટિન, કોલેજન અને અન્ય. એવા પ્રોટીન પણ છે જે રચનામાં વધુ જટિલ છે, ઉદાહરણ તરીકે, માયોસિન, જે સ્નાયુ પેશીઓમાં જોવા મળે છે, તેમાં ફાઇબરિલર-આકારની લાકડી છે જેના પર બે ગોળાકાર હેડ સ્થિત છે.
પ્રોટીનની રાસાયણિક રચના

પ્રોટીનની એમિનો એસિડ રચનાને વીસ એમિનો એસિડ દ્વારા રજૂ કરી શકાય છે, જે વિવિધ ક્રમમાં અને જથ્થામાં જોડાય છે.
આ ગ્લાયસીન, એલાનિન, વેલિન, લ્યુસીન, આઇસોલ્યુસીન, સેરીન, થ્રેઓનાઇન, સિસ્ટીન, મેથિઓનાઇન, લાયસિન, આર્જીનાઇન, એસ્પાર્ટિક એસિડ, એસ્પેરાજીન, ગ્લુટામિક એસિડ, ગ્લુટામાઇન, ફેનીલાલેનાઇન, ટાયરોસિન, ટ્રિપ્ટોફેન, હિસ્ટીડિન અને પ્રોલાઇન છે. તેમની વચ્ચે બદલી ન શકાય તેવી વસ્તુઓ છે, એટલે કે, જે માનવ શરીર તેના પોતાના પર ઉત્પન્ન કરવામાં સક્ષમ નથી. પુખ્ત વયના લોકો માટે આવા 8 એમિનો એસિડ અને બાળકો માટે 2 વધુ છે: લ્યુસીન, આઇસોલ્યુસીન, વેલિન, મેથિઓનાઇન, લાયસિન, ટ્રિપ્ટોફેન, ફેનીલાલેનાઇન, થ્રેઓનાઇન, તેમજ હિસ્ટીડિન અને આર્જીનાઇન.
વિવિધ બંધારણો સાથે પ્રોટીનનાં ઉદાહરણો
ગ્લોબ્યુલર પ્રોટીનનો અગ્રણી પ્રતિનિધિ એલ્બુમિન છે. તેની તૃતીય રચનામાં આલ્ફા હેલીસનો સમાવેશ થાય છે જે સિંગલ પોલિપેપ્ટાઇડ સાંકળો દ્વારા જોડાયેલ છે.

પ્રાથમિક એમિનો એસિડ દ્વારા રચાય છે જેમ કે એસ્પાર્ટિક એસિડ, એલાનિન, સિસ્ટીન અને ગ્લાયસીન. આ પ્રોટીન રક્ત પ્લાઝ્મામાં જોવા મળે છે અને અમુક પદાર્થોના પરિવહનનું કાર્ય કરે છે. ફાઇબરિલર રાશિઓમાં, ફાઇબ્રોઇન અને કોલેજનને અલગ કરી શકાય છે. પ્રથમનું તૃતીય માળખું એ બીટા સ્ટ્રક્ચરનો પદાર્થ છે જે સિંગલ પોલિપેપ્ટાઇડ સાંકળો દ્વારા જોડાયેલ છે. સાંકળ પોતે એલેનાઇન, ગ્લાયસીન, સિસ્ટીન અને સેરીનનું વૈકલ્પિક છે. આ રાસાયણિક સંયોજન કરોળિયાના જાળા અને રેશમ તેમજ પક્ષીઓના પીછાનો મુખ્ય ઘટક છે.
વિકૃતિકરણ શું છે?
આ પ્રોટીનની પ્રથમ ચતુર્થાંશ, પછી તૃતીય અને ગૌણ રચનાઓના વિનાશની પ્રક્રિયા છે. જે પ્રોટીન સાથે આ બન્યું તે હવે તેના કાર્યો કરી શકતું નથી અને તેના મૂળભૂત ભૌતિક અને રાસાયણિક ગુણધર્મો ગુમાવે છે. આ પ્રક્રિયા મુખ્યત્વે ઉચ્ચ તાપમાન અથવા આક્રમક રસાયણોના સંપર્કમાં આવવાને કારણે થાય છે. ઉદાહરણ તરીકે, ચાલીસ ડિગ્રી સેલ્સિયસથી ઉપરના તાપમાને, હિમોગ્લોબિન, જે સજીવોના રક્ત દ્વારા ઓક્સિજન વહન કરે છે, તે વિકૃત થવાનું શરૂ કરે છે. તેથી જ તાપમાનમાં આટલો તીવ્ર વધારો માનવીઓ માટે જોખમી છે.

પ્રોટીનનાં કાર્યો
પ્રોટીન શું છે તે શીખ્યા પછી, તમે કોષના જીવનમાં અને સમગ્ર જીવતંત્રમાં આ પદાર્થોની ભૂમિકા પર ધ્યાન આપી શકો છો. તેઓ નવ મુખ્ય કાર્યો કરે છે. પ્રથમ પ્લાસ્ટિક છે. તેઓ જીવંત જીવતંત્રની ઘણી રચનાઓના ઘટકો છે અને કોષો માટે નિર્માણ સામગ્રી તરીકે સેવા આપે છે. બીજું પરિવહન છે. પ્રોટીન્સ પદાર્થોના પરિવહન માટે સક્ષમ છે; આ હેતુ માટેના પદાર્થોના ઉદાહરણો એલ્બુમિન, હિમોગ્લોબિન, તેમજ કોષના પ્લાઝ્મા મેમ્બ્રેન પર સ્થિત વિવિધ ટ્રાન્સપોર્ટર પ્રોટીન છે, જેમાંથી દરેક પર્યાવરણમાંથી માત્ર ચોક્કસ પદાર્થને સાયટોપ્લાઝમમાં જવા દે છે. ત્રીજું કાર્ય રક્ષણાત્મક છે. તે ઇમ્યુનોગ્લોબ્યુલિન દ્વારા કરવામાં આવે છે, જે રોગપ્રતિકારક તંત્રનો ભાગ છે, અને કોલેજન, જે ત્વચાનો મુખ્ય ઘટક છે. ઉપરાંત, માનવ શરીર અને અન્ય સજીવોમાં પ્રોટીન નિયમનકારી કાર્ય કરે છે, કારણ કે આવા પદાર્થો દ્વારા રજૂ કરાયેલ સંખ્યાબંધ હોર્મોન્સ છે, ઉદાહરણ તરીકે, ઇન્સ્યુલિન. આ રાસાયણિક સંયોજનો દ્વારા ભજવવામાં આવતી અન્ય ભૂમિકા સિગ્નલિંગ છે. આ પદાર્થો કોષથી કોષમાં વિદ્યુત આવેગ પ્રસારિત કરે છે. છઠ્ઠું કાર્ય મોટર છે. પ્રોટીનના અગ્રણી પ્રતિનિધિઓ જે આ કરે છે તે એક્ટિન અને માયોસિન છે, જે સંકોચન કરવામાં સક્ષમ છે (તેઓ સ્નાયુઓમાં જોવા મળે છે). આવા પદાર્થો અનામત પદાર્થો તરીકે પણ કામ કરી શકે છે, પરંતુ આવા હેતુઓ માટે તે ખૂબ જ ભાગ્યે જ ઉપયોગમાં લેવાય છે તે મુખ્યત્વે દૂધમાં જોવા મળતા પ્રોટીન છે. તેઓ ઉત્પ્રેરક કાર્ય પણ કરે છે - પ્રકૃતિમાં પ્રોટીન ઉત્સેચકો છે. અને છેલ્લું કાર્ય રીસેપ્ટર છે. પ્રોટીનનું એક જૂથ છે જે એક અથવા બીજા પરિબળના પ્રભાવ હેઠળ આંશિક રીતે વિકૃત છે, આમ સમગ્ર કોષને સંકેત આપે છે, જે તેને આગળ પ્રસારિત કરે છે.
એલએમિનો એસિડના કાર્યાત્મક જૂથોની ક્રિયાપ્રતિક્રિયાને લીધે, વ્યક્તિગત પ્રોટીનની રેખીય પોલિપેપ્ટાઇડ સાંકળો ચોક્કસ અવકાશી ત્રિ-પરિમાણીય માળખું મેળવે છે, જેને "રૂપાંતરણ" કહેવાય છે. વ્યક્તિગત પ્રોટીનના તમામ અણુઓ (એટલે કે, સમાન પ્રાથમિક માળખું ધરાવતા) દ્રાવણમાં સમાન રચના બનાવે છે. પરિણામે, અવકાશી બંધારણોની રચના માટે જરૂરી તમામ માહિતી પ્રોટીનની પ્રાથમિક રચનામાં સ્થિત છે.
પ્રોટીનમાં, પોલિપેપ્ટાઇડ સાંકળોના 2 મુખ્ય પ્રકારો છે: ગૌણ અને તૃતીય બંધારણ.
2. પ્રોટીનનું ગૌણ માળખું -પેપ્ટાઇડ બેકબોનના કાર્યાત્મક જૂથો વચ્ચેની ક્રિયાપ્રતિક્રિયાના પરિણામે અવકાશી માળખું.
આ કિસ્સામાં, પેપ્ટાઇડ સાંકળો બે પ્રકારની નિયમિત રચનાઓ પ્રાપ્ત કરી શકે છે: α-હેલીસીસ
β- માળખુંβ-સંરચના દ્વારા અમારો અર્થ એકોર્ડિયનની જેમ ફોલ્ડ કરેલી શીટ જેવી આકૃતિ છે. એક પોલિપેપ્ટાઈડ સાંકળ બનાવતા બેન્ડના રેખીય પ્રદેશોના પેપ્ટાઈડ જૂથોના અણુઓ વચ્ચે અથવા વિવિધ પોલીપેપ્ટાઈડ જૂથો વચ્ચે ઘણા હાઇડ્રોજન બોન્ડની રચનાને કારણે આકૃતિ રચાય છે.

બોન્ડ હાઇડ્રોજન છે,તેઓ મેક્રોમોલેક્યુલ્સના વ્યક્તિગત ટુકડાઓને સ્થિર કરે છે.
3. પ્રોટીનનું તૃતીય માળખું -એમિનો એસિડ રેડિકલ વચ્ચેની ક્રિયાપ્રતિક્રિયાને કારણે રચાયેલી ત્રિ-પરિમાણીય અવકાશી માળખું, જે પોલિપેપ્ટાઇડ સાંકળમાં એકબીજાથી નોંધપાત્ર અંતરે સ્થિત હોઈ શકે છે.
માળખાકીય રીતે ગૌણ રચનાના ઘટકોનો સમાવેશ થાય છે, જે વિવિધ પ્રકારની ક્રિયાપ્રતિક્રિયાઓ દ્વારા સ્થિર થાય છે, જેમાં હાઇડ્રોફોબિક ક્રિયાપ્રતિક્રિયાઓ નિર્ણાયક ભૂમિકા ભજવે છે.
પ્રોટીનની તૃતીય રચનાનું સ્થિરીકરણ ભાગ લે છે:
· સહસંયોજક બોન્ડ્સ (બે સિસ્ટીન અવશેષો વચ્ચે - ડાયસલ્ફાઇડ પુલ);
એમિનો એસિડ અવશેષોના વિરોધી ચાર્જવાળા બાજુ જૂથો વચ્ચે આયનીય બોન્ડ;
હાઇડ્રોજન બોન્ડ્સ;
હાઇડ્રોફિલિક-હાઇડ્રોફોબિક ક્રિયાપ્રતિક્રિયાઓ. આજુબાજુના પાણીના અણુઓ સાથે ક્રિયાપ્રતિક્રિયા કરતી વખતે, પ્રોટીન પરમાણુ ફોલ્ડ થાય છે જેથી એમિનો એસિડના બિનધ્રુવીય બાજુના જૂથો જલીય દ્રાવણમાંથી અલગ થઈ જાય; ધ્રુવીય હાઇડ્રોફિલિક બાજુ જૂથો પરમાણુની સપાટી પર દેખાય છે.
4. ચતુર્થાંશ માળખું એ એક પ્રોટીન સંકુલની અંદર અનેક પોલિપેપ્ટાઇડ સાંકળોની સંબંધિત ગોઠવણી છે. પ્રોટીન પરમાણુઓ કે જે ચતુર્થાંશ માળખું સાથે પ્રોટીન બનાવે છે તે રાઈબોઝોમ પર અલગથી રચાય છે અને સંશ્લેષણ પૂર્ણ થયા પછી જ એક સામાન્ય સુપ્રામોલેક્યુલર માળખું બનાવે છે. ચતુર્થાંશ માળખું ધરાવતા પ્રોટીનમાં સમાન અને અલગ-અલગ પોલીપેપ્ટાઈડ બંને સાંકળો હોઈ શકે છે. ચતુર્થાંશ માળખાના સ્થિરીકરણમાં ભાગ લો તૃતીયના સ્થિરીકરણમાં સમાન પ્રકારની ક્રિયાપ્રતિક્રિયાઓ. સુપરમોલેક્યુલર પ્રોટીન સંકુલમાં ડઝનેક અણુઓ હોઈ શકે છે.
ભૂમિકા.
શરીરમાં પેપ્ટાઇડ્સનું નિર્માણ થોડી મિનિટોમાં થાય છે, જ્યારે પ્રયોગશાળામાં રાસાયણિક સંશ્લેષણ એ એક લાંબી પ્રક્રિયા છે જે ઘણા દિવસો લઈ શકે છે, અને સંશ્લેષણ તકનીકના વિકાસમાં ઘણા વર્ષો લાગી શકે છે. જો કે, આ હોવા છતાં, કુદરતી પેપ્ટાઇડ્સના એનાલોગના સંશ્લેષણ પર કામ કરવાની તરફેણમાં ખૂબ મજબૂત દલીલો છે. પ્રથમ, પેપ્ટાઇડ્સના રાસાયણિક ફેરફાર દ્વારા પ્રાથમિક રચનાની પૂર્વધારણાની પુષ્ટિ કરવી શક્ય છે. કેટલાક હોર્મોન્સના એમિનો એસિડ સિક્વન્સ પ્રયોગશાળામાં તેમના એનાલોગના સંશ્લેષણ દ્વારા ચોક્કસપણે જાણીતા બન્યા.
બીજું, કૃત્રિમ પેપ્ટાઇડ્સ અમને એમિનો એસિડ ક્રમની રચના અને તેની પ્રવૃત્તિ વચ્ચેના સંબંધનો વધુ વિગતવાર અભ્યાસ કરવાની મંજૂરી આપે છે. પેપ્ટાઇડની વિશિષ્ટ રચના અને તેની જૈવિક પ્રવૃત્તિ વચ્ચેના સંબંધને સ્પષ્ટ કરવા માટે, એક હજારથી વધુ એનાલોગના સંશ્લેષણ પર વિશાળ માત્રામાં કાર્ય હાથ ધરવામાં આવ્યું હતું. પરિણામે, એવું જાણવા મળ્યું કે પેપ્ટાઈડની રચનામાં માત્ર એક એમિનો એસિડને બદલવાથી તેની જૈવિક પ્રવૃત્તિ ઘણી વખત વધી શકે છે અથવા તેની દિશા બદલી શકે છે. અને એમિનો એસિડ ક્રમની લંબાઈ બદલવાથી પેપ્ટાઈડના સક્રિય કેન્દ્રોનું સ્થાન અને રીસેપ્ટરની ક્રિયાપ્રતિક્રિયાની જગ્યા નક્કી કરવામાં મદદ મળે છે.
ત્રીજે સ્થાને, મૂળ એમિનો એસિડ ક્રમમાં ફેરફાર કરવા બદલ આભાર, ફાર્માકોલોજિકલ દવાઓ મેળવવાનું શક્ય બન્યું. કુદરતી પેપ્ટાઇડ્સના એનાલોગની રચના એ પરમાણુઓના વધુ "અસરકારક" રૂપરેખાંકનોને ઓળખવાનું શક્ય બનાવે છે જે જૈવિક અસરને વધારે છે અથવા તેને લાંબા સમય સુધી ટકી રહે છે.
ચોથું, પેપ્ટાઈડ્સનું રાસાયણિક સંશ્લેષણ આર્થિક રીતે ફાયદાકારક છે. મોટાભાગની ઉપચારાત્મક દવાઓ જો કુદરતી ઉત્પાદનમાંથી બનાવવામાં આવી હોય તો તેની કિંમત દસ ગણી વધારે હશે.
મોટે ભાગે, સક્રિય પેપ્ટાઇડ્સ માત્ર નેનોગ્રામ જથ્થામાં પ્રકૃતિમાં જોવા મળે છે. ઉપરાંત, પ્રાકૃતિક સ્ત્રોતોમાંથી પેપ્ટાઈડ્સને શુદ્ધ કરવા અને અલગ કરવા માટેની પદ્ધતિઓ વિપરીત અથવા અલગ અસરના પેપ્ટાઈડ્સથી ઇચ્છિત એમિનો એસિડ ક્રમને સંપૂર્ણપણે અલગ કરી શકતી નથી. અને માનવ શરીર દ્વારા સંશ્લેષિત ચોક્કસ પેપ્ટાઇડ્સના કિસ્સામાં, તેઓ માત્ર પ્રયોગશાળા પરિસ્થિતિઓમાં સંશ્લેષણ દ્વારા મેળવી શકાય છે.
57. પ્રોટીનનું વર્ગીકરણ: સરળ અને જટિલ, ગ્લોબ્યુલર અને ફાઈબ્રિલર, મોનોમેરિક અને ઓલિગોમેરિક. શરીરમાં પ્રોટીનનાં કાર્યો.
માળખાના પ્રકાર દ્વારા વર્ગીકરણ
તેમની સામાન્ય પ્રકારની રચનાના આધારે, પ્રોટીનને ત્રણ જૂથોમાં વિભાજિત કરી શકાય છે:
1. ફાઇબરિલર પ્રોટીન - પોલિમર બનાવે છે, તેમની રચના સામાન્ય રીતે અત્યંત નિયમિત હોય છે અને મુખ્યત્વે વિવિધ સાંકળો વચ્ચેની ક્રિયાપ્રતિક્રિયા દ્વારા જાળવવામાં આવે છે. તેઓ માઇક્રોફિલામેન્ટ્સ, માઇક્રોટ્યુબ્યુલ્સ, ફાઇબ્રિલ્સ બનાવે છે અને કોશિકાઓ અને પેશીઓની રચનાને ટેકો આપે છે. ફાઈબ્રિલર પ્રોટીનમાં કેરાટિન અને કોલેજનનો સમાવેશ થાય છે.
2. ગ્લોબ્યુલર પ્રોટીન પાણીમાં દ્રાવ્ય હોય છે, પરમાણુનો સામાન્ય આકાર વધુ કે ઓછા ગોળાકાર હોય છે.
3. મેમ્બ્રેન પ્રોટીન - કોષ પટલને ઓળંગતા ડોમેન્સ ધરાવે છે, પરંતુ તેમાંથી કેટલાક ભાગો આંતરકોષીય વાતાવરણ અને કોષના સાયટોપ્લાઝમમાં પટલમાંથી બહાર નીકળે છે. મેમ્બ્રેન પ્રોટીન રીસેપ્ટર્સ તરીકે કાર્ય કરે છે, એટલે કે, તેઓ સિગ્નલો પ્રસારિત કરે છે અને વિવિધ પદાર્થોનું ટ્રાન્સમેમ્બ્રેન પરિવહન પણ પ્રદાન કરે છે. ટ્રાન્સપોર્ટર પ્રોટીન ચોક્કસ હોય છે; તેમાંના દરેક ચોક્કસ અણુઓ અથવા ચોક્કસ પ્રકારના સિગ્નલને પટલમાંથી પસાર થવા દે છે.
સરળ પ્રોટીન , જટિલ પ્રોટીન
પેપ્ટાઇડ સાંકળો ઉપરાંત, ઘણા પ્રોટીનમાં નોન-એમિનો એસિડ જૂથો પણ હોય છે, અને આ માપદંડ અનુસાર, પ્રોટીનને બે મોટા જૂથોમાં વહેંચવામાં આવે છે - સરળ અને જટિલ પ્રોટીન(પ્રોટીડ્સ). સરળ પ્રોટીનમાં માત્ર પોલીપેપ્ટાઈડ સાંકળો હોય છે;
સરળ.
ગ્લોબ્યુલર પ્રોટીનમાં આપણે તફાવત કરી શકીએ છીએ:
1. આલ્બ્યુમિન - વિશાળ pH રેન્જમાં પાણીમાં દ્રાવ્ય (4 થી 8.5 સુધી), એમોનિયમ સલ્ફેટના 70-100% દ્રાવણ સાથે અવક્ષેપિત;
2. ઉચ્ચ પરમાણુ વજનવાળા પોલીફંક્શનલ ગ્લોબ્યુલિન, પાણીમાં ઓછા દ્રાવ્ય, ખારા દ્રાવણમાં દ્રાવ્ય, ઘણીવાર કાર્બોહાઇડ્રેટ ભાગ ધરાવે છે;
3. હિસ્ટોન્સ એ પરમાણુમાં આર્જીનાઇન અને લાયસિન અવશેષોની ઉચ્ચ સામગ્રી સાથે ઓછા પરમાણુ વજનવાળા પ્રોટીન છે, જે તેમના મૂળભૂત ગુણધર્મોને નિર્ધારિત કરે છે;
4. પ્રોટામાઈન્સ વધુ ઉચ્ચ આર્જીનાઈન સામગ્રી (85% સુધી) દ્વારા અલગ પડે છે, હિસ્ટોન્સની જેમ, તેઓ ન્યુક્લીક એસિડ સાથે સ્થિર સહયોગી બનાવે છે, નિયમનકારી અને દબાવનાર પ્રોટીન તરીકે કામ કરે છે - ન્યુક્લિયોપ્રોટીનનો અભિન્ન ભાગ;
5. પ્રોલામાઈન્સ ગ્લુટામિક એસિડ (30-45%) અને પ્રોલાઈન (15% સુધી), પાણીમાં અદ્રાવ્ય, 50-90% ઇથેનોલમાં દ્રાવ્ય, ઉચ્ચ સામગ્રી દ્વારા વર્ગીકૃત થયેલ છે;
6. ગ્લુટેલિનમાં પ્રોલામિન્સની જેમ લગભગ 45% ગ્લુટામિક એસિડ હોય છે અને તે મોટાભાગે અનાજ પ્રોટીનમાં જોવા મળે છે.
ફાઇબરિલર પ્રોટીન તંતુમય માળખું દ્વારા વર્ગીકૃત થયેલ છે અને તે પાણી અને ખારા ઉકેલોમાં વ્યવહારીક રીતે અદ્રાવ્ય છે. પરમાણુઓમાં પોલિપેપ્ટાઇડ સાંકળો એક બીજાની સમાંતર સ્થિત છે. કનેક્ટિવ પેશી (કોલેજેન્સ, કેરાટિન્સ, ઇલાસ્ટિન્સ) ના માળખાકીય તત્વોની રચનામાં ભાગ લેવો.
જટિલ પ્રોટીન
(પ્રોટીડ્સ, હોલોપ્રોટીન) એ બે ઘટક પ્રોટીન છે જે, પેપ્ટાઇડ સાંકળો (સરળ પ્રોટીન) ઉપરાંત, નોન-એમિનો એસિડ ઘટક ધરાવે છે - એક કૃત્રિમ જૂથ. જ્યારે જટિલ પ્રોટીનને હાઇડ્રોલાઇઝ કરવામાં આવે છે, ત્યારે એમિનો એસિડ ઉપરાંત, બિન-પ્રોટીન ભાગ અથવા તેના ભંગાણ ઉત્પાદનોને મુક્ત કરવામાં આવે છે.
વિવિધ કાર્બનિક (લિપિડ્સ, કાર્બોહાઇડ્રેટ્સ) અને અકાર્બનિક (ધાતુઓ) પદાર્થો કૃત્રિમ જૂથ તરીકે કાર્ય કરી શકે છે.
કૃત્રિમ જૂથોની રાસાયણિક પ્રકૃતિના આધારે, નીચેના વર્ગોને જટિલ પ્રોટીનમાં અલગ પાડવામાં આવે છે:
· ગ્લાયકોપ્રોટીન્સ જેમાં કૃત્રિમ જૂથ તરીકે સહસંયોજક રીતે બંધાયેલા કાર્બોહાઇડ્રેટ અવશેષો અને તેમના પેટા વર્ગ - પ્રોટીઓગ્લાયકેન્સ, મ્યુકોપોલિસેકરાઇડ પ્રોસ્થેટિક જૂથો સાથે. સેરીન અથવા થ્રેઓનાઇનના હાઇડ્રોક્સિલ જૂથો સામાન્ય રીતે કાર્બોહાઇડ્રેટ અવશેષો સાથે બોન્ડની રચનામાં ભાગ લે છે. મોટાભાગના એક્સ્ટ્રા સેલ્યુલર પ્રોટીન, ખાસ કરીને ઇમ્યુનોગ્લોબ્યુલિન, ગ્લાયકોપ્રોટીન છે. પ્રોટીઓગ્લાયકેન્સનો કાર્બોહાઇડ્રેટ ભાગ ~95% છે તે ઇન્ટરસેલ્યુલર મેટ્રિક્સનો મુખ્ય ઘટક છે.
· કૃત્રિમ ભાગ તરીકે બિન-સહસંયોજક બંધાયેલ લિપિડ ધરાવતા લિપોપ્રોટીન. લિપોપ્રોટીન એપોલીપોપ્રોટીન પ્રોટીન દ્વારા રચાય છે જે લિપિડને તેમની સાથે જોડે છે અને લિપિડ પરિવહનનું કાર્ય કરે છે.
· મેટાલોપ્રોટીન જેમાં નોન-હીમ કોઓર્ડિનેટેડ મેટલ આયનો હોય છે. મેટાલોપ્રોટીન્સમાં એવા પ્રોટીન છે જે સંગ્રહ અને પરિવહનના કાર્યો કરે છે (ઉદાહરણ તરીકે, આયર્ન-સમાવતી ફેરીટિન અને ટ્રાન્સફરિન) અને ઉત્સેચકો (ઉદાહરણ તરીકે, ઝિંક-સમાવતી કાર્બોનિક એનહાઇડ્રેઝ અને તાંબુ, મેંગેનીઝ, આયર્ન અને અન્ય ધાતુના આયનો ધરાવતા વિવિધ સુપરઓક્સાઇડ ડિસમ્યુટેઝ સક્રિય કેન્દ્રો તરીકે. )
· બિન-સહસંયોજક DNA અથવા RNA ધરાવતા ન્યુક્લિયોપ્રોટીન, ખાસ કરીને, ક્રોમેટીન, જે રંગસૂત્રો બનાવે છે, તે ન્યુક્લિયોપ્રોટીન છે.
· કૃત્રિમ જૂથ તરીકે સહસંયોજક રીતે બંધાયેલા ફોસ્ફોરિક એસિડ અવશેષો ધરાવતા ફોસ્ફોપ્રોટીન. સેરીન અથવા થ્રેઓનાઇનના હાઇડ્રોક્સિલ જૂથો ફોસ્ફેટ સાથે એસ્ટર બોન્ડની રચનામાં ભાગ લે છે, ખાસ કરીને, ફોસ્ફોપ્રોટીન છે:
· ક્રોમોપ્રોટીન એ વિવિધ રાસાયણિક પ્રકૃતિના રંગીન કૃત્રિમ જૂથો સાથે જટિલ પ્રોટીનનું સામૂહિક નામ છે. આમાં ધાતુ ધરાવતા પોર્ફિરિન પ્રોસ્થેટિક જૂથ સાથેના ઘણા પ્રોટીનનો સમાવેશ થાય છે જે વિવિધ કાર્યો કરે છે - હિમોપ્રોટીન (પ્રોસ્થેટિક જૂથ તરીકે હીમ ધરાવતા પ્રોટીન - હિમોગ્લોબિન, સાયટોક્રોમ્સ, વગેરે), ફ્લેવિન જૂથ સાથે ફ્લેવોપ્રોટીન વગેરે;
1. માળખાકીય કાર્ય
2. રક્ષણાત્મક કાર્ય
3. નિયમનકારી કાર્ય
4. એલાર્મ કાર્ય
5. પરિવહન કાર્ય
6. ફાજલ (બેકઅપ) કાર્ય
7. રીસેપ્ટર કાર્ય
8. મોટર (મોટર) કાર્ય

.jpg)
.jpg)







