કિરણોત્સર્ગીતાની ઘટના 1896 માં એ. બેકરેલ દ્વારા શોધી કાઢવામાં આવી હતી, જેમણે યુરેનિયમ ક્ષારમાંથી અજાણ્યા કિરણોત્સર્ગના સ્વયંસ્ફુરિત ઉત્સર્જનનું અવલોકન કર્યું હતું. ટૂંક સમયમાં જ ઇ. રધરફોર્ડ અને ક્યુરીઝે સ્થાપિત કર્યું કે કિરણોત્સર્ગી સડો દરમિયાન હી ન્યુક્લી (α-કણો), ઇલેક્ટ્રોન (β-કણો) અને સખત ઇલેક્ટ્રોમેગ્નેટિક રેડિયેશન (γ-કિરણો) ઉત્સર્જિત થાય છે.
1934 માં, પોઝિટ્રોન (β + -decay) ના ઉત્સર્જન સાથેનો સડો શોધાયો, અને 1940 માં, એક નવી પ્રકારની રેડિયોએક્ટિવિટી શોધાઈ - ન્યુક્લિયસનું સ્વયંસ્ફુરિત વિભાજન: એક વિભાજન ન્યુક્લિયસ એક સાથેના ઉત્સર્જન સાથે તુલનાત્મક સમૂહના બે ટુકડાઓમાં અલગ પડે છે. ન્યુટ્રોન અને γ -ક્વોન્ટા. ન્યુક્લીની પ્રોટોન રેડિયોએક્ટિવિટી 1982માં જોવા મળી હતી. આમ, કિરણોત્સર્ગી સડોના નીચેના પ્રકારો છે: α-સડો; - સડો; - સડો; e - કેપ્ચર.
રેડિયોએક્ટિવિટી- કણોના ઉત્સર્જન સાથે કેટલાક અણુ ન્યુક્લીની સ્વયંસ્ફુરિત (સ્વયંસ્ફુરિત) અન્ય ન્યુક્લીમાં રૂપાંતરિત થવાની ક્ષમતા.
અણુ મધ્યવર્તી કેન્દ્ર બનેલા છે પ્રોટોન અને ન્યુટ્રોન, જેનું સામાન્ય નામ છે - ન્યુક્લિયોન્સન્યુક્લિયસમાં પ્રોટોનની સંખ્યા અણુના રાસાયણિક ગુણધર્મો નક્કી કરે છે અને નિયુક્ત કરવામાં આવે છે ઝેડ(આઇટમ સીરીયલ નંબર). ન્યુક્લિઅન્સની સંખ્યાકર્નલ માં કહેવાય છે સમૂહ સંખ્યાઅને સૂચવો એ. સમાન સીરીયલ નંબર સાથે ન્યુક્લીઅને વિવિધ સમૂહ નંબરો કહેવામાં આવે છે આઇસોટોપ્સ. એક રાસાયણિક તત્વના તમામ આઇસોટોપ્સ સમાન રાસાયણિક ગુણધર્મો ધરાવે છે, પરંતુ ભૌતિક ગુણધર્મો મોટા પ્રમાણમાં બદલાઈ શકે છે. આઇસોટોપ્સને નિયુક્ત કરવા માટે, બે સૂચકાંકો સાથે રાસાયણિક તત્વના પ્રતીકનો ઉપયોગ કરો: A Z X. નીચલા અનુક્રમણિકા એ સીરીયલ નંબર છે, ઉપલા અનુક્રમણિકા સમૂહ સંખ્યા છે. ઘણીવાર સબસ્ક્રિપ્ટને અવગણવામાં આવે છે કારણ કે તે તત્વના પ્રતીક દ્વારા જ સૂચવવામાં આવે છે.
ઉદાહરણ તરીકે, તેઓ 14 6 સીને બદલે 14 સી લખે છે.
ન્યુક્લિયસની ક્ષીણ થવાની ક્ષમતા તેની રચના પર આધારિત છે. સમાન તત્વ સ્થિર અને કિરણોત્સર્ગી આઇસોટોપ બંને ધરાવી શકે છે.
ઉદાહરણ તરીકે, કાર્બન આઇસોટોપ 12 C સ્થિર છે, પરંતુ આઇસોટોપ 14 C કિરણોત્સર્ગી છે.
કિરણોત્સર્ગી સડો એ આંકડાકીય ઘટના છે. ક્ષીણ થવાની આઇસોટોપની ક્ષમતા સડો સ્થિરતા દ્વારા વર્ગીકૃત થયેલ છે λ.
સડો સ્થિરાંક λ એ સંભાવના છે કે આપેલ આઇસોટોપનું ન્યુક્લિયસ એકમ સમય દીઠ ક્ષીણ થશે.
ચાલો ટી સમયે કિરણોત્સર્ગી ક્ષીણ ન્યુક્લીની સંખ્યા N દર્શાવીએ, dN 1 - સમય દરમિયાન ક્ષીણ થતા મધ્યવર્તી કેન્દ્રોની સંખ્યા. દ્રવ્યમાં ન્યુક્લિયસની સંખ્યા વિશાળ હોવાથી, મોટી સંખ્યાનો નિયમ સંતુષ્ટ છે. ટૂંકા સમયમાં dt ની સંભાવના dP = λdt આવર્તન સંભાવનાની બરાબર છે: d N 1 / N = dP = λdt. d N 1 / N = λdt- એક સૂત્ર કે જે ક્ષીણ ન્યુક્લીની સંખ્યા નક્કી કરે છે.
સમીકરણનો ઉકેલ છે: , - સૂત્રને કિરણોત્સર્ગી સડોનો નિયમ કહેવામાં આવે છે: ઘાતાંકીય કાયદા અનુસાર સમય સાથે રેડિયોએક્ટિવ ન્યુક્લીની સંખ્યા ઘટતી જાય છે.
અહીં N એ સમય t પર અવિકસિત ન્યુક્લીની સંખ્યા છે; N o - અવિકસિત ન્યુક્લીની પ્રારંભિક સંખ્યા; λ એ કિરણોત્સર્ગી સડો સ્થિરાંક છે.
વ્યવહારમાં, તે સડો સ્થિર નથી કે જે વપરાય છે λ , અને જથ્થો કહેવાય છે અર્ધ જીવન ટી.
અર્ધ-જીવન (T) એ સમય છે જે દરમિયાન રેડિયોએક્ટિવ ન્યુક્લીનો અડધો ભાગ ક્ષીણ થઈ જાય છે.
સમયગાળા દરમિયાન કિરણોત્સર્ગી સડોનો કાયદો અર્ધ-જીવન (T) નું સ્વરૂપ છે:
![]()
અર્ધ-જીવન અને સડો સ્થિરાંક વચ્ચેનો સંબંધ સૂત્ર દ્વારા આપવામાં આવે છે: T = ln(2/λ) = 0.69/λ
અર્ધ-જીવન કાં તો ખૂબ લાંબુ અથવા ખૂબ ટૂંકું હોઈ શકે છે.
કિરણોત્સર્ગી આઇસોટોપની પ્રવૃત્તિની ડિગ્રીનું મૂલ્યાંકન કરવા માટે, પ્રવૃત્તિ નામના જથ્થાનો ઉપયોગ કરવામાં આવે છે.
એકમ સમય દીઠ ક્ષીણ થતી કિરણોત્સર્ગી દવાના ન્યુક્લીની પ્રવૃત્તિ સંખ્યા: A = dN સડો /dt
પ્રવૃત્તિનું SI એકમ 1 બેકરેલ (Bq) = 1 વિઘટન/s છે - દવાની પ્રવૃત્તિ જેમાં 1 વિઘટન 1 s માં થાય છે. પ્રવૃત્તિનું મોટું એકમ 1 રધરફોર્ડ (Rd) = Bq છે. પ્રવૃત્તિના એક ઑફ-સિસ્ટમ એકમનો વારંવાર ઉપયોગ થાય છે - ક્યુરી (Ci), 1 ગ્રામ રેડિયમની પ્રવૃત્તિની બરાબર: 1 Ci = 3.7 Bq.
સમય જતાં, સમાન ઘાતાંકીય કાયદા અનુસાર પ્રવૃત્તિ ઘટે છે જે મુજબ રેડિઓન્યુક્લાઇડ પોતે જ ક્ષીણ થાય છે:
![]() =
.
=
.
વ્યવહારમાં, સૂત્રનો ઉપયોગ પ્રવૃત્તિની ગણતરી કરવા માટે થાય છે:
A = = λN = 0.693 N/T.
જો આપણે દળ અને દળ દ્વારા અણુઓની સંખ્યા વ્યક્ત કરીએ, તો પ્રવૃત્તિની ગણતરી માટેનું સૂત્ર આ સ્વરૂપ લેશે: A = = 0.693 (μT)
એવોગાડ્રોનો નંબર ક્યાં છે; μ - દાઢ સમૂહ.
ન્યુક્લીના કિરણોત્સર્ગી સડોના નિયમો
ન્યુક્લીની સ્વયંભૂ ક્ષીણ થવાની ક્ષમતા, કણોનું ઉત્સર્જન કરે છે, તેને રેડિયોએક્ટિવિટી કહેવામાં આવે છે. કિરણોત્સર્ગી સડો એ આંકડાકીય પ્રક્રિયા છે. દરેક કિરણોત્સર્ગી ન્યુક્લિયસ કોઈપણ ક્ષણે ક્ષીણ થઈ શકે છે અને પર્યાપ્ત સંખ્યામાં ન્યુક્લિયસના સડોના કિસ્સામાં, પેટર્ન ફક્ત સરેરાશ જ જોવા મળે છે.
સતત સડોλ એ એકમ સમય દીઠ પરમાણુ ક્ષયની સંભાવના છે.
જો t સમયે નમૂનામાં N કિરણોત્સર્ગી ન્યુક્લી હોય, તો dt સમય દરમિયાન ક્ષીણ થયેલા ન્યુક્લી dN ની સંખ્યા N ના પ્રમાણસર હોય છે.
dN = -λNdt. (13.1)
એકીકરણ (1) અમે કિરણોત્સર્ગી સડોનો કાયદો મેળવીએ છીએ
N(t) = N 0 e -λt . (13.2)
N 0 એ t = 0 સમયે કિરણોત્સર્ગી ન્યુક્લીની સંખ્યા છે.
સરેરાશ જીવન સમય τ –
. (13.3)
અર્ધ જીવન T 1/2 - સમય કે જે દરમિયાન કિરણોત્સર્ગી ન્યુક્લીની પ્રારંભિક સંખ્યા અડધાથી ઘટી જશે
T 1/2 = ln2/λ=0.693/λ = τln2. (13.4)
પ્રવૃત્તિ A - એકમ સમય દીઠ ક્ષીણ થતા ન્યુક્લીઓની સરેરાશ સંખ્યા
A(t) = λN(t). (13.5)
પ્રવૃત્તિ ક્યુરી (Ci) અને બેકરલ્સ (Bq) માં માપવામાં આવે છે.
1 Ki = 3.7*10 10 decays/s, 1 Bq = 1 decays/s.
મૂળ ન્યુક્લિયસ 1 નો ન્યુક્લિયસ 2 માં ક્ષય, તેના પછી ન્યુક્લિયસ 3 માં સડો, વિભેદક સમીકરણોની સિસ્ટમ દ્વારા વર્ણવવામાં આવે છે
 (13.6)
(13.6)
જ્યાં N 1 (t) અને N 2 (t) એ ન્યુક્લીની સંખ્યા છે, અને λ 1 અને λ 2 એ અનુક્રમે ન્યુક્લી 1 અને 2 ના સડો સ્થિરાંકો છે. પ્રારંભિક શરતો સાથે સિસ્ટમ (6) નો ઉકેલ N 1 (0) = N 10 ; N 2 (0) = 0 હશે
![]() , (13.7a)
, (13.7a)
![]() . (13.7b)
. (13.7b)

| આકૃતિ 13. 1 |
કોરોની સંખ્યા 2 મહત્તમ મૂલ્ય સુધી પહોંચે છે
જો λ 2< λ 1 (), суммарная активностьN 1 (t)λ 1 + N 2 (t)λ 2 будет монотонно уменьшаться.
જો λ 2 >λ 1 ()), ન્યુક્લી 2 ના સંચયને કારણે શરૂઆતમાં કુલ પ્રવૃત્તિ વધે છે.
જો λ 2 >> λ 1 , પૂરતા લાંબા સમયે (7b) માં બીજા ઘાતાંકીયનું યોગદાન પ્રથમ અને બીજા A 2 = λ 2 N 2 અને પ્રથમ આઇસોટોપ્સ A 1 ની પ્રવૃત્તિઓની તુલનામાં નજીવું બની જાય છે. = λ 1 N 1 લગભગ સમાન છે. ભવિષ્યમાં, પ્રથમ અને બીજા બંને આઇસોટોપની પ્રવૃત્તિઓ સમય જતાં તે જ રીતે બદલાશે.
A 1 (t) = N 10 λ 1 = N 1 (t)λ 1 = A 2 (t) = N 2 (t)λ 2 .(13.8)
એટલે કે, કહેવાતા વય-જૂનું સંતુલન, જેમાં ક્ષીણ સાંકળમાં આઇસોટોપ ન્યુક્લીની સંખ્યા એક સરળ સંબંધ દ્વારા સડો સ્થિરાંકો (અર્ધ-જીવન) સાથે સંબંધિત છે.
 . (13.9)
. (13.9)
તેથી, કુદરતી સ્થિતિમાં, કિરણોત્સર્ગી શ્રેણીમાં આનુવંશિક રીતે સંબંધિત તમામ આઇસોટોપ સામાન્ય રીતે તેમના અર્ધ જીવનના આધારે ચોક્કસ માત્રાત્મક ગુણોત્તરમાં જોવા મળે છે.
સામાન્ય કિસ્સામાં, જ્યારે ક્ષયની સાંકળ 1→2→...n હોય છે, ત્યારે પ્રક્રિયાનું વર્ણન વિભેદક સમીકરણોની સિસ્ટમ દ્વારા કરવામાં આવે છે.
dN i /dt = -λ i N i +λ i-1 N i-1 .(13.10)
પ્રારંભિક શરતો N 1 (0) = N 10 સાથેની પ્રવૃત્તિઓ માટે સિસ્ટમ (10) નો ઉકેલ ; N i (0) = 0 હશે
![]() (13.12)
(13.12)
અવિભાજ્યનો અર્થ છે કે જે ઉત્પાદન છેદમાં છે, તેમાં i = m વાળા અવયવને બાદ કરવામાં આવે છે.
આઇસોટોપ્સ
આઇસોટોપ્સ- સમાન રાસાયણિક તત્વની જાતો જે તેમના ભૌતિક રાસાયણિક ગુણધર્મોમાં સમાન હોય છે, પરંતુ તેમના અણુ સમૂહ અલગ હોય છે. "આઇસોટોપ્સ" નામ 1912 માં અંગ્રેજી રેડિયોકેમિસ્ટ ફ્રેડરિક સોડી દ્વારા પ્રસ્તાવિત કરવામાં આવ્યું હતું, જેમણે તેને બે ગ્રીક શબ્દોમાંથી બનાવ્યું હતું: આઇસોસ - સમાન અને ટોપોસ - સ્થળ. આઇસોટોપ્સ મેન્ડેલીવના તત્વોના સામયિક કોષ્ટકના કોષમાં સમાન સ્થાન ધરાવે છે.
કોઈપણ રાસાયણિક તત્વના અણુમાં સકારાત્મક રીતે ચાર્જ થયેલ ન્યુક્લિયસ અને તેની આસપાસના નકારાત્મક ચાર્જવાળા ઇલેક્ટ્રોનનો વાદળ હોય છે ( સેમી.પણએટમ ન્યુક્લિયસ). મેન્ડેલીવ (તેનો અણુ નંબર) ના સામયિક કોષ્ટકમાં રાસાયણિક તત્વની સ્થિતિ તેના અણુઓના ન્યુક્લિયસના ચાર્જ દ્વારા નક્કી કરવામાં આવે છે. આઇસોટોપને તેથી સમાન રાસાયણિક તત્વની જાતો કહેવામાં આવે છે, જેનાં પરમાણુ સમાન પરમાણુ ચાર્જ ધરાવે છે (અને તેથી, વ્યવહારીક રીતે સમાન ઇલેક્ટ્રોન શેલ), પરંતુ પરમાણુ સમૂહ મૂલ્યોમાં ભિન્ન છે. એફ. સોડીની અલંકારિક અભિવ્યક્તિ અનુસાર, આઇસોટોપ્સના પરમાણુ સમાન "બહાર" છે, પરંતુ "અંદર" અલગ છે.
ન્યુટ્રોનની શોધ 1932માં થઈ હતી – હાઇડ્રોજન અણુના ન્યુક્લિયસના સમૂહની નજીકના દળ સાથેનો એક કણ કે જેનો કોઈ ચાર્જ નથી - એક પ્રોટોન , અને ન્યુક્લિયસનું પ્રોટોન-ન્યુટ્રોન મોડલ બનાવવામાં આવ્યું હતું, પરિણામે, વિજ્ઞાને આઇસોટોપ્સની વિભાવનાની અંતિમ આધુનિક વ્યાખ્યા સ્થાપિત કરી હતી: આઇસોટોપ્સ એવા પદાર્થો છે કે જેના પરમાણુ ન્યુક્લિયસ સમાન સંખ્યામાં પ્રોટોન ધરાવે છે અને માત્ર ન્યુટ્રોનની સંખ્યામાં ભિન્ન હોય છે. ન્યુક્લિયસ . દરેક આઇસોટોપ સામાન્ય રીતે પ્રતીકોના સમૂહ દ્વારા સૂચવવામાં આવે છે, જ્યાં X એ રાસાયણિક તત્વનું પ્રતીક છે, Z એ અણુ ન્યુક્લિયસનો ચાર્જ છે (પ્રોટોનની સંખ્યા), A એ આઇસોટોપની સમૂહ સંખ્યા છે (ન્યુક્લિયનની કુલ સંખ્યા - ન્યુક્લિયસમાં પ્રોટોન અને ન્યુટ્રોન, A = Z + N). કારણ કે ન્યુક્લિયસનો ચાર્જ રાસાયણિક તત્વના પ્રતીક સાથે અનન્ય રીતે સંકળાયેલો હોવાનું જણાય છે, સંક્ષેપ માટે સંક્ષેપ A X નો ઉપયોગ ઘણીવાર થાય છે.
આપણા માટે જાણીતા તમામ આઇસોટોપ્સમાંથી, ફક્ત હાઇડ્રોજન આઇસોટોપ્સના પોતાના નામ છે. આમ, આઇસોટોપ 2 H અને 3 H ને ડ્યુટેરિયમ અને ટ્રીટિયમ કહેવામાં આવે છે અને તેને અનુક્રમે D અને T નામ આપવામાં આવ્યું છે (આઇસોટોપ 1 H ને ક્યારેક પ્રોટિયમ પણ કહેવાય છે).
પ્રકૃતિમાં સ્થિર આઇસોટોપ્સ તરીકે થાય છે , અને અસ્થિર - કિરણોત્સર્ગી, અણુઓના મધ્યવર્તી કેન્દ્ર વિવિધ કણો (અથવા કહેવાતા કિરણોત્સર્ગી સડોની પ્રક્રિયાઓ) ના ઉત્સર્જન સાથે અન્ય મધ્યવર્તી કેન્દ્રમાં સ્વયંસ્ફુરિત રૂપાંતરને આધિન છે. લગભગ 270 સ્થિર આઇસોટોપ્સ હવે જાણીતા છે, અને સ્થિર આઇસોટોપ્સ ફક્ત અણુ નંબર Z Ј 83 વાળા તત્વોમાં જોવા મળે છે. અસ્થિર આઇસોટોપ્સની સંખ્યા 2000 કરતાં વધી ગઈ છે, તેમાંના મોટા ભાગના વિવિધ પરમાણુ પ્રતિક્રિયાઓના પરિણામે કૃત્રિમ રીતે મેળવવામાં આવ્યા હતા. ઘણા તત્વોના કિરણોત્સર્ગી આઇસોટોપ્સની સંખ્યા ખૂબ મોટી છે અને બે ડઝન કરતાં વધી શકે છે. સ્થિર આઇસોટોપ્સની સંખ્યા નોંધપાત્ર રીતે ઓછી છે કેટલાક રાસાયણિક તત્વોમાં માત્ર એક સ્થિર આઇસોટોપ (બેરિલિયમ, ફ્લોરિન, સોડિયમ, એલ્યુમિનિયમ, ફોસ્ફરસ, મેંગેનીઝ, સોનું અને સંખ્યાબંધ અન્ય તત્વો) હોય છે. સ્થિર આઇસોટોપ્સની સૌથી મોટી સંખ્યા - 10 - ટીનમાં, લોખંડમાં મળી આવી હતી, ઉદાહરણ તરીકે, ત્યાં 4 છે, અને પારામાં - 7 છે.
આઇસોટોપ્સની શોધ, ઐતિહાસિક પૃષ્ઠભૂમિ. 1808 માં, અંગ્રેજ વૈજ્ઞાનિક પ્રકૃતિવાદી જ્હોન ડાલ્ટને સૌપ્રથમ રાસાયણિક તત્વની વ્યાખ્યા સમાન પ્રકારના પરમાણુ ધરાવતા પદાર્થ તરીકે રજૂ કરી હતી. 1869 માં, રસાયણશાસ્ત્રી ડી.આઈ. મેન્ડેલીવે રાસાયણિક તત્વોના સામયિક નિયમની શોધ કરી. સામયિક કોષ્ટકના કોષમાં ચોક્કસ સ્થાન પર કબજો ધરાવતા પદાર્થ તરીકે તત્વની વિભાવનાને સાબિત કરવામાં એક મુશ્કેલી એ તત્ત્વોના પ્રાયોગિક રીતે અવલોકન કરાયેલ બિન-પૂર્ણાંક અણુ વજન હતું. 1866 માં, અંગ્રેજ ભૌતિકશાસ્ત્રી અને રસાયણશાસ્ત્રી સર વિલિયમ ક્રૂક્સે એવી પૂર્વધારણા રજૂ કરી હતી કે દરેક કુદરતી રાસાયણિક તત્વ એ પદાર્થોનું ચોક્કસ મિશ્રણ છે જે તેમના ગુણધર્મોમાં સમાન છે, પરંતુ અલગ અણુ સમૂહ ધરાવે છે, પરંતુ તે સમયે આવી ધારણા હજુ સુધી ન હતી. પ્રાયોગિક પુષ્ટિ અને તેથી લાંબા સમય સુધી નોંધ્યું ન હતું.
આઇસોટોપ્સની શોધ તરફ એક મહત્વપૂર્ણ પગલું એ રેડિયોએક્ટિવિટીની ઘટનાની શોધ હતી અને અર્ન્સ્ટ રધરફર્ડ અને ફ્રેડરિક સોડી દ્વારા ઘડવામાં આવેલી કિરણોત્સર્ગી સડોની પૂર્વધારણા હતી: રેડિયોએક્ટિવિટી એ અણુના ચાર્જ થયેલા કણ અને અન્ય તત્વના અણુમાં સડો કરતાં વધુ કંઈ નથી. , તેના રાસાયણિક ગુણધર્મોમાં મૂળ કરતાં અલગ છે. પરિણામે, કિરણોત્સર્ગી શ્રેણી અથવા કિરણોત્સર્ગી પરિવારોનો વિચાર ઉભો થયો , જેની શરૂઆતમાં પ્રથમ પિતૃ તત્વ છે, જે કિરણોત્સર્ગી છે, અને અંતે - છેલ્લું સ્થિર તત્વ છે. પરિવર્તનની સાંકળોનું વિશ્લેષણ દર્શાવે છે કે તેમના અભ્યાસક્રમ દરમિયાન, સમાન કિરણોત્સર્ગી તત્વો, ફક્ત અણુ સમૂહમાં અલગ પડે છે, સામયિક સિસ્ટમના એક કોષમાં દેખાઈ શકે છે. હકીકતમાં, આનો અર્થ આઇસોટોપ્સની વિભાવનાની રજૂઆત હતી.
રાસાયણિક તત્વોના સ્થિર આઇસોટોપ્સના અસ્તિત્વની સ્વતંત્ર પુષ્ટિ પછી 1912-1920માં જે.જે. થોમસન અને એસ્ટનના પ્રયોગોમાં હકારાત્મક રીતે ચાર્જ થયેલા કણો (અથવા કહેવાતા ચેનલ બીમ)ના બીમ સાથે મળી હતી. ) ડિસ્ચાર્જ ટ્યુબમાંથી નીકળે છે.
1919 માં, એસ્ટને માસ સ્પેક્ટ્રોગ્રાફ (અથવા માસ સ્પેક્ટ્રોમીટર) નામના સાધનની રચના કરી. . આયન સ્ત્રોતે હજુ પણ ડિસ્ચાર્જ ટ્યુબનો ઉપયોગ કર્યો હતો, પરંતુ એસ્ટને એવી રીત શોધી કાઢી હતી જેમાં ઇલેક્ટ્રિક અને ચુંબકીય ક્ષેત્રોમાં કણોના બીમના ક્રમિક વિચલનને કારણે સમાન ચાર્જ-ટુ-માસ રેશિયો (તેમની ગતિને ધ્યાનમાં લીધા વિના) સાથે કણોનું ધ્યાન કેન્દ્રિત કરવામાં આવ્યું હતું. સ્ક્રીન પર સમાન બિંદુ. એસ્ટનની સાથે, અમેરિકન ડેમ્પસ્ટર દ્વારા તે જ વર્ષોમાં થોડી અલગ ડિઝાઇનનું માસ સ્પેક્ટ્રોમીટર બનાવવામાં આવ્યું હતું. ઘણા સંશોધકોના પ્રયત્નો દ્વારા માસ સ્પેક્ટ્રોમીટરના અનુગામી ઉપયોગ અને સુધારણાના પરિણામે, 1935 સુધીમાં તે સમય સુધીમાં જાણીતા તમામ રાસાયણિક તત્વોની આઇસોટોપિક રચનાઓનું લગભગ સંપૂર્ણ કોષ્ટક સંકલિત કરવામાં આવ્યું હતું.
આઇસોટોપ અલગ કરવાની પદ્ધતિઓ.આઇસોટોપ્સના ગુણધર્મોનો અભ્યાસ કરવા અને ખાસ કરીને વૈજ્ઞાનિક અને લાગુ હેતુઓ માટે તેમના ઉપયોગ માટે, તેમને વધુ કે ઓછા ધ્યાનપાત્ર માત્રામાં મેળવવા જરૂરી છે. પરંપરાગત માસ સ્પેક્ટ્રોમીટરમાં, આઇસોટોપ્સનું લગભગ સંપૂર્ણ વિભાજન પ્રાપ્ત થાય છે, પરંતુ તેમનું પ્રમાણ નહિવત છે. તેથી, વૈજ્ઞાનિકો અને એન્જિનિયરોના પ્રયત્નોનો હેતુ આઇસોટોપ્સને અલગ કરવા માટે અન્ય સંભવિત પદ્ધતિઓ શોધવાનો હતો. સૌ પ્રથમ, બાષ્પીભવન દર, સંતુલન સ્થિરાંકો, રાસાયણિક પ્રતિક્રિયાઓના દર, વગેરે જેવા સમાન તત્વના આઇસોટોપ્સના આવા ગુણધર્મોમાં તફાવતના આધારે, વિભાજનની ભૌતિક રાસાયણિક પદ્ધતિઓમાં નિપુણતા પ્રાપ્ત કરવામાં આવી હતી. તેમાંથી સૌથી વધુ અસરકારક સુધારણા અને આઇસોટોપ વિનિમયની પદ્ધતિઓ હતી, જે પ્રકાશ તત્વોના આઇસોટોપ્સના ઔદ્યોગિક ઉત્પાદનમાં વ્યાપકપણે ઉપયોગમાં લેવાય છે: હાઇડ્રોજન, લિથિયમ, બોરોન, કાર્બન, ઓક્સિજન અને નાઇટ્રોજન.
પદ્ધતિઓના બીજા જૂથમાં કહેવાતી પરમાણુ ગતિ પદ્ધતિઓનો સમાવેશ થાય છે: ગેસ પ્રસરણ, થર્મલ પ્રસરણ, સમૂહ પ્રસરણ (વરાળના પ્રવાહમાં પ્રસરણ), કેન્દ્રત્યાગી. અત્યંત વિખરાયેલા છિદ્રાળુ માધ્યમોમાં આઇસોટોપિક ઘટકોના પ્રસરણના વિવિધ દરો પર આધારિત ગેસ પ્રસરણ પદ્ધતિઓનો ઉપયોગ બીજા વિશ્વ યુદ્ધ દરમિયાન યુનાઇટેડ સ્ટેટ્સમાં યુરેનિયમ આઇસોટોપ વિભાજનના ઔદ્યોગિક ઉત્પાદનનું આયોજન કરવા માટે કહેવાતા મેનહટન પ્રોજેક્ટના ભાગરૂપે કરવામાં આવ્યો હતો. અણુ બોમ્બ. યુરેનિયમની આવશ્યક માત્રા મેળવવા માટે, પ્રકાશ આઇસોટોપ 235 યુ સાથે 90% સુધી સમૃદ્ધ - અણુ બોમ્બનો મુખ્ય "દહનક્ષમ" ઘટક, લગભગ ચાર હજાર હેક્ટરના વિસ્તાર પર કબજો કરીને છોડ બનાવવામાં આવ્યા હતા. યુદ્ધ પછી સમૃદ્ધ યુરેનિયમના ઉત્પાદન માટે છોડ સાથે અણુ કેન્દ્ર બનાવવા માટે 2 બિલિયન ડોલરથી વધુ ફાળવવામાં આવ્યા હતા, લશ્કરી હેતુઓ માટે સમૃદ્ધ યુરેનિયમના ઉત્પાદન માટેના છોડ, વિભાજનની પદ્ધતિના આધારે પણ વિકસાવવામાં આવ્યા હતા. યુએસએસઆરમાં બનેલ. તાજેતરના વર્ષોમાં, આ પદ્ધતિએ સેન્ટ્રીફ્યુગેશનની વધુ કાર્યક્ષમ અને ઓછી ખર્ચાળ પદ્ધતિને માર્ગ આપ્યો છે. આ પદ્ધતિમાં, આઇસોટોપ મિશ્રણને અલગ કરવાની અસર સેન્ટ્રીફ્યુજ રોટરને ભરવાના આઇસોટોપ મિશ્રણના ઘટકો પર કેન્દ્રત્યાગી દળોની વિવિધ અસરોને કારણે પ્રાપ્ત થાય છે, જે ઉપર અને તળિયે મર્યાદિત પાતળી-દિવાલોવાળું સિલિન્ડર છે, જે ફરતી હોય છે. વેક્યૂમ ચેમ્બરમાં ખૂબ જ ઊંચી ઝડપ. કાસ્કેડમાં જોડાયેલા સેંકડો હજારો સેન્ટ્રીફ્યુજ, જેમાંથી દરેકનો રોટર સેકન્ડમાં એક હજારથી વધુ ક્રાંતિ કરે છે, હાલમાં રશિયા અને વિશ્વના અન્ય વિકસિત દેશોમાં આધુનિક વિભાજન પ્લાન્ટ્સમાં ઉપયોગમાં લેવાય છે. સેન્ટ્રીફ્યુજનો ઉપયોગ માત્ર પરમાણુ પાવર પ્લાન્ટના પરમાણુ રિએક્ટરને પાવર કરવા માટે જરૂરી સમૃદ્ધ યુરેનિયમના ઉત્પાદન માટે જ નહીં, પરંતુ સામયિક કોષ્ટકના મધ્ય ભાગમાં લગભગ ત્રીસ રાસાયણિક તત્વોના આઇસોટોપ બનાવવા માટે પણ થાય છે. તાજેતરના વર્ષોમાં વિવિધ આઇસોટોપને અલગ કરવા માટે શક્તિશાળી આયન સ્ત્રોતો સાથે ઇલેક્ટ્રોમેગ્નેટિક વિભાજન એકમોનો ઉપયોગ કરવામાં આવે છે, લેસર વિભાજન પદ્ધતિઓ પણ વ્યાપક બની છે.
આઇસોટોપ્સની અરજી.રાસાયણિક તત્વોના વિવિધ આઇસોટોપનો વ્યાપકપણે વૈજ્ઞાનિક સંશોધન, ઉદ્યોગ અને કૃષિના વિવિધ ક્ષેત્રોમાં, પરમાણુ ઊર્જા, આધુનિક જીવવિજ્ઞાન અને દવામાં, પર્યાવરણીય અભ્યાસો અને અન્ય ક્ષેત્રોમાં વ્યાપકપણે ઉપયોગ થાય છે. વૈજ્ઞાનિક સંશોધન (ઉદાહરણ તરીકે, રાસાયણિક પૃથ્થકરણ) માટે સામાન્ય રીતે વિવિધ તત્વોના દુર્લભ આઇસોટોપની નાની માત્રાની જરૂર પડે છે, જેની ગણતરી ગ્રામ અને મિલિગ્રામમાં પણ થાય છે. તે જ સમયે, અણુ ઊર્જા, દવા અને અન્ય ઉદ્યોગોમાં વ્યાપકપણે ઉપયોગમાં લેવાતા સંખ્યાબંધ આઇસોટોપ્સ માટે, તેમના ઉત્પાદનની જરૂરિયાત ઘણા કિલોગ્રામ અને ટન જેટલી પણ હોઈ શકે છે. આમ, પરમાણુ રિએક્ટરમાં ભારે પાણી D 2 O ના ઉપયોગને કારણે, છેલ્લી સદીના 1990 ના દાયકાની શરૂઆતમાં તેનું વૈશ્વિક ઉત્પાદન દર વર્ષે લગભગ 5000 ટન હતું. હાઇડ્રોજન આઇસોટોપ ડ્યુટેરિયમ, જે ભારે પાણીનો ભાગ છે, જેની સાંદ્રતા હાઇડ્રોજનના કુદરતી મિશ્રણમાં માત્ર 0.015% છે, ટ્રીટિયમ સાથે, તે ભવિષ્યમાં બની જશે, વૈજ્ઞાનિકોના મતે, થર્મોન્યુક્લિયર પાવરના ઇંધણનો મુખ્ય ઘટક ન્યુક્લિયર ફ્યુઝન પ્રતિક્રિયાઓના આધારે કાર્યરત રિએક્ટર. આ કિસ્સામાં, હાઇડ્રોજન આઇસોટોપ્સના ઉત્પાદનની જરૂરિયાત પ્રચંડ હશે.
વૈજ્ઞાનિક સંશોધનમાં, સ્થિર અને કિરણોત્સર્ગી આઇસોટોપનો ઉપયોગ પ્રકૃતિમાં થતી વિવિધ પ્રક્રિયાઓના અભ્યાસમાં આઇસોટોપિક સૂચકાંકો (ટેગ્સ) તરીકે વ્યાપકપણે થાય છે.
કૃષિમાં, આઇસોટોપ્સ ("લેબલવાળા" અણુઓ) નો ઉપયોગ થાય છે, ઉદાહરણ તરીકે, પ્રકાશસંશ્લેષણની પ્રક્રિયાઓનો અભ્યાસ કરવા, ખાતરોની પાચનક્ષમતા અને છોડની નાઇટ્રોજન, ફોસ્ફરસ, પોટેશિયમ, ટ્રેસ તત્વો અને અન્ય પદાર્થોના ઉપયોગની કાર્યક્ષમતા નક્કી કરવા માટે. .
આઇસોટોપ તકનીકોનો વ્યાપકપણે દવામાં ઉપયોગ થાય છે. આમ, યુએસએમાં, આંકડા અનુસાર, દરરોજ 36 હજારથી વધુ તબીબી પ્રક્રિયાઓ કરવામાં આવે છે અને આઇસોટોપ્સનો ઉપયોગ કરીને લગભગ 100 મિલિયન પ્રયોગશાળા પરીક્ષણો કરવામાં આવે છે. સૌથી સામાન્ય પ્રક્રિયાઓમાં ગણતરી કરેલ ટોમોગ્રાફીનો સમાવેશ થાય છે. કાર્બન આઇસોટોપ C13, 99% (લગભગ 1% કુદરતી સામગ્રી) સુધી સમૃદ્ધ, કહેવાતા "ડાયગ્નોસ્ટિક શ્વાસ નિયંત્રણ" માં સક્રિયપણે ઉપયોગમાં લેવાય છે. પરીક્ષણનો સાર ખૂબ જ સરળ છે. સમૃદ્ધ આઇસોટોપ દર્દીના ખોરાકમાં દાખલ કરવામાં આવે છે અને શરીરના વિવિધ અવયવોમાં ચયાપચયની પ્રક્રિયામાં ભાગ લીધા પછી, દર્દી દ્વારા છોડવામાં આવતા કાર્બન ડાયોક્સાઇડ CO 2 ના સ્વરૂપમાં મુક્ત થાય છે, જે સ્પેક્ટ્રોમીટરનો ઉપયોગ કરીને એકત્રિત કરવામાં આવે છે અને તેનું વિશ્લેષણ કરવામાં આવે છે. C 13 આઇસોટોપ સાથે લેબલ થયેલ કાર્બન ડાયોક્સાઇડની વિવિધ માત્રાના પ્રકાશન સાથે સંકળાયેલ પ્રક્રિયાઓના દરોમાં તફાવત, દર્દીના વિવિધ અવયવોની સ્થિતિનું મૂલ્યાંકન કરવાનું શક્ય બનાવે છે. યુ.એસ.માં, આ પરીક્ષણમાંથી પસાર થનારા દર્દીઓની સંખ્યા દર વર્ષે 5 મિલિયન હોવાનો અંદાજ છે. હવે લેસર વિભાજન પદ્ધતિઓનો ઉપયોગ ઔદ્યોગિક ધોરણે અત્યંત સમૃદ્ધ C13 આઇસોટોપ બનાવવા માટે થાય છે.
સંબંધિત માહિતી.
લેક્ચર 2. કિરણોત્સર્ગી સડો અને રેડિયોન્યુક્લાઇડ્સની પ્રવૃત્તિનો મૂળભૂત કાયદો
રેડિઓન્યુક્લાઇડ્સના સડોનો દર અલગ છે - કેટલાક ઝડપથી સડો કરે છે, અન્ય ધીમા. કિરણોત્સર્ગી સડોના દરનું સૂચક છે કિરણોત્સર્ગી સડો સતત, λ [સેકન્ડ-1], જે એક સેકન્ડમાં એક અણુના ક્ષીણ થવાની સંભાવના દર્શાવે છે. દરેક રેડિઓન્યુક્લાઇડ માટે, ક્ષીણ સ્થિરાંકનું પોતાનું મૂલ્ય છે;
એકમ સમય દીઠ કિરણોત્સર્ગી નમૂનામાં નોંધાયેલા ક્ષયની સંખ્યા કહેવાય છે પ્રવૃત્તિ (a ), અથવા નમૂનાની રેડિયોએક્ટિવિટી. પ્રવૃત્તિ મૂલ્ય અણુઓની સંખ્યાના સીધા પ્રમાણસર છે એન કિરણોત્સર્ગી પદાર્થ:
a =λ· એન , (3.2.1)
જ્યાં λ – કિરણોત્સર્ગી સડો સતત, [સેક-1].
હાલમાં, વર્તમાન ઇન્ટરનેશનલ સિસ્ટમ ઓફ યુનિટ્સ SI અનુસાર, રેડિયોએક્ટિવિટીના માપનનું એકમ છે. બેકરેલ [બીકે]. આ એકમને ફ્રેન્ચ વૈજ્ઞાનિક હેનરી બેકરેલના માનમાં તેનું નામ મળ્યું, જેમણે 1856 માં યુરેનિયમની કુદરતી રેડિયોએક્ટિવિટીની ઘટના શોધી કાઢી. એક બેકરેલ પ્રતિ સેકન્ડ 1 સડો સમાન છે બીકે = 1 .
જો કે, પ્રવૃત્તિના બિન-સિસ્ટમ એકમનો ઉપયોગ હજી પણ વારંવાર થાય છે – ક્યુરી [કી], એક ગ્રામ રેડિયમ (જેમાં ~3.7 1010 પ્રતિ સેકન્ડમાં ક્ષીણ થાય છે) ના સડો દરના માપ તરીકે ક્યુરીઝ દ્વારા રજૂ કરવામાં આવ્યું હતું, તેથી
1 કી= 3.7·1010 બીકે.
આ એકમ મોટા જથ્થામાં રેડિયોન્યુક્લાઇડ્સની પ્રવૃત્તિનું મૂલ્યાંકન કરવા માટે અનુકૂળ છે.
સડોના પરિણામે સમય જતાં રેડિયોન્યુક્લાઇડ સાંદ્રતામાં ઘટાડો ઘાતાંકીય સંબંધનું પાલન કરે છે:
 , (3.2.2)
, (3.2.2)
જ્યાં એન t- સમય પછી બાકી રહેલા કિરણોત્સર્ગી તત્વના અણુઓની સંખ્યા tનિરીક્ષણની શરૂઆત પછી; એન 0 - સમયની પ્રારંભિક ક્ષણે અણુઓની સંખ્યા ( t =0 ); λ - કિરણોત્સર્ગી સડો સતત.
વર્ણવેલ અવલંબન કહેવામાં આવે છે કિરણોત્સર્ગી સડોનો મૂળભૂત કાયદો .
તે સમય કે જે દરમિયાન રેડિયોન્યુક્લાઇડ્સના કુલ જથ્થાનો અડધો ભાગ ક્ષીણ થાય છે અર્ધ જીવન ટી½ . એક અર્ધ જીવન પછી, 100 રેડિઓન્યુક્લાઇડ અણુઓમાંથી, માત્ર 50 જ રહે છે (ફિગ. 2.1). આગામી સમાન સમયગાળા દરમિયાન, આ 50 અણુઓમાંથી માત્ર 25 જ બાકી છે, અને તેથી વધુ.
અર્ધ-જીવન અને સડો સ્થિરતા વચ્ચેનો સંબંધ કિરણોત્સર્ગી સડોના મૂળભૂત કાયદાના સમીકરણમાંથી ઉતરી આવ્યો છે:
ખાતે t=ટી½ અને
અમે મેળવીએ છીએ https://pandia.ru/text/80/150/images/image006_47.gif" width="67" height="41 src="> Þ ;
https://pandia.ru/text/80/150/images/image009_37.gif" width="76" height="21">;
એટલે કે..gif" width="81" height="41 src=">.
તેથી, કિરણોત્સર્ગી સડોનો કાયદો નીચે પ્રમાણે લખી શકાય છે:
https://pandia.ru/text/80/150/images/image013_21.gif" width="89" height="39 src=">, (3.2.4)
જ્યાં ખાતે - સમય જતાં ડ્રગ પ્રવૃત્તિ t ; a0 - નિરીક્ષણના પ્રારંભિક ક્ષણે દવાની પ્રવૃત્તિ.
કોઈપણ કિરણોત્સર્ગી પદાર્થની આપેલ રકમની પ્રવૃત્તિ નક્કી કરવી ઘણીવાર જરૂરી છે.
યાદ રાખો કે પદાર્થના જથ્થાનું એકમ છછુંદર છે. છછુંદર એ કાર્બન આઇસોટોપ 12C ના 0.012 kg = 12 g માં સમાયેલ હોય તેટલા જ અણુઓ ધરાવતા પદાર્થનું પ્રમાણ છે.
કોઈપણ પદાર્થના એક છછુંદરમાં એવોગાડ્રોનો નંબર હોય છે એન.એ. અણુ
એન.એ. = 6.02·1023 અણુ.
સરળ પદાર્થો (તત્વો) માટે, એક છછુંદરનો સમૂહ સંખ્યાત્મક રીતે અણુ સમૂહને અનુરૂપ છે એ તત્વ
1mol = એ જી.
ઉદાહરણ તરીકે: મેગ્નેશિયમ માટે: 1 મોલ 24Mg = 24 ગ્રામ.
226Ra માટે: 1 mol 226Ra = 226 g, વગેરે.
માં જે કહેવામાં આવ્યું છે તે ધ્યાનમાં લેવું m પદાર્થ ગ્રામ હશે એન અણુ
https://pandia.ru/text/80/150/images/image015_20.gif" width="156" height="43 src="> (3.2.6)
ઉદાહરણ: ચાલો 226Ra ના 1 ગ્રામની પ્રવૃત્તિની ગણતરી કરીએ, જે λ = 1.38·10-11 સેકન્ડ-1.
a= 1.38·10-11·1/226·6.02·1023 = 3.66·1010 Bq.
જો કિરણોત્સર્ગી તત્વ રાસાયણિક સંયોજનનો ભાગ છે, તો પછી દવાની પ્રવૃત્તિ નક્કી કરતી વખતે તેના સૂત્રને ધ્યાનમાં લેવું જરૂરી છે. પદાર્થની રચનાને ધ્યાનમાં લેતા, સામૂહિક અપૂર્ણાંક નક્કી કરવામાં આવે છે χ પદાર્થમાં રેડિઓન્યુક્લાઇડ, જે ગુણોત્તર દ્વારા નક્કી થાય છે:
https://pandia.ru/text/80/150/images/image017_17.gif" width="118" height="41 src=">
સમસ્યા ઉકેલનું ઉદાહરણ
શરત:
પ્રવૃત્તિ A0 કિરણોત્સર્ગી તત્વ 32P પ્રતિ દિવસ અવલોકન 1000 છે બીકે. એક અઠવાડિયા પછી આ તત્વની પ્રવૃત્તિ અને અણુઓની સંખ્યા નક્કી કરો. અર્ધ જીવન ટી½ 32P = 14.3 દિવસ.
ઉકેલ:
એ) ચાલો 7 દિવસ પછી ફોસ્ફરસ-32 ની પ્રવૃત્તિ શોધીએ:
https://pandia.ru/text/80/150/images/image019_16.gif" width="57" height="41 src=">
જવાબ:એક અઠવાડિયા પછી, દવા 32P ની પ્રવૃત્તિ 712 હશે બીકે,અને કિરણોત્સર્ગી આઇસોટોપ 32P ના અણુઓની સંખ્યા 127.14·106 અણુઓ છે.
સુરક્ષા પ્રશ્નો
1) રેડિયોન્યુક્લાઇડની પ્રવૃત્તિ શું છે?
2) કિરણોત્સર્ગીતાના એકમો અને તેમની વચ્ચેના સંબંધને નામ આપો.
3) કિરણોત્સર્ગી સડો સતત શું છે?
4) કિરણોત્સર્ગી સડોના મૂળભૂત કાયદાને વ્યાખ્યાયિત કરો.
5) અર્ધ જીવન શું છે?
6) રેડિયોન્યુક્લાઇડની પ્રવૃત્તિ અને સમૂહ વચ્ચે શું સંબંધ છે? સૂત્ર લખો.
કાર્યો
1. પ્રવૃત્તિની ગણતરી કરો 1 જી 226Ra. T½ = 1602 વર્ષ.
2. પ્રવૃત્તિની ગણતરી કરો 1 જી 60કો. T½ = 5.3 વર્ષ.
3. એક M-47 ટાંકી શેલમાં 4.3 હોય છે કિલો 238યુ. Т½ = 2.5·109 વર્ષ. અસ્ત્રની પ્રવૃત્તિ નક્કી કરો.
4. 10 વર્ષ પછી 137C ની પ્રવૃત્તિની ગણતરી કરો, જો અવલોકનની પ્રારંભિક ક્ષણે તે 1000 ની બરાબર હોય બીકે. T½ = 30 વર્ષ.
5. એક વર્ષ પહેલા 90Sr ની પ્રવૃત્તિની ગણતરી કરો જો તે હાલમાં 500 ની બરાબર છે બીકે. T½ = 29 વર્ષ.
6. 1 કેવા પ્રકારની પ્રવૃત્તિ બનાવશે? કિલોરેડિયોઆઈસોટોપ 131I, T½ = 8.1 દિવસ?
7. સંદર્ભ ડેટાનો ઉપયોગ કરીને, પ્રવૃત્તિ 1 નક્કી કરો જી 238યુ. Т½ = 2.5·109 વર્ષ.
સંદર્ભ ડેટાનો ઉપયોગ કરીને, પ્રવૃત્તિ 1 નક્કી કરો જી 232મી, Т½ = 1.4·1010 વર્ષ.
8. સંયોજનની પ્રવૃત્તિની ગણતરી કરો: 239Pu316O8.
9. 1 ની પ્રવૃત્તિ સાથે રેડિઓન્યુક્લાઇડના સમૂહની ગણતરી કરો કી:
9.1. 131I, T1/2=8.1 દિવસ;
9.2. 90Sr, T1/2=29 વર્ષ;
9.3. 137Cs, Т1/2=30 વર્ષ;
9.4. 239Pu, Т1/2=2.4·104 વર્ષ.
10. સમૂહ 1 નક્કી કરો mCiકિરણોત્સર્ગી કાર્બન આઇસોટોપ 14C, T½ = 5560 વર્ષ.
11. ફોસ્ફરસ 32P ની કિરણોત્સર્ગી તૈયારી તૈયાર કરવી જરૂરી છે. કયા સમયગાળા પછી 3% દવા બાકી રહેશે? Т½ = 14.29 દિવસ.
12. કુદરતી પોટેશિયમ મિશ્રણમાં 40K કિરણોત્સર્ગી આઇસોટોપના 0.012% હોય છે.
1) કુદરતી પોટેશિયમનો સમૂહ નક્કી કરો, જેમાં 1 હોય છે કી 40K. Т½ = 1.39·109 વર્ષ = 4.4·1018 સેકન્ડ.
2) 40K નો ઉપયોગ કરીને જમીનની કિરણોત્સર્ગીતાની ગણતરી કરો, જો તે જાણીતું હોય કે જમીનના નમૂનામાં પોટેશિયમનું પ્રમાણ 14 છે. kg/t.
13. રેડિયોઆઈસોટોપની પ્રારંભિક પ્રવૃત્તિ 0.001% સુધી ઘટાડવા માટે કેટલા અડધા જીવનની જરૂર છે?
14. છોડ પર 238U ની અસર નક્કી કરવા માટે, બીજને 100 માં પલાળવામાં આવ્યા હતા. મિલીસોલ્યુશન UO2(NO3)2 6H2O, જેમાં કિરણોત્સર્ગી મીઠાનું દળ 6 હતું જી. ઉકેલમાં 238U ની પ્રવૃત્તિ અને ચોક્કસ પ્રવૃત્તિ નક્કી કરો. Т½ = 4.5·109 વર્ષ.
15. પ્રવૃત્તિ 1 ઓળખો ગ્રામ 232મી, Т½ = 1.4·1010 વર્ષ.
16. સમૂહ 1 નક્કી કરો કી 137Cs, Т1/2=30 વર્ષ.
17. પ્રકૃતિમાં પોટેશિયમના સ્થિર અને કિરણોત્સર્ગી આઇસોટોપ્સની સામગ્રી વચ્ચેનો ગુણોત્તર એક સ્થિર મૂલ્ય છે. 40K સામગ્રી 0.01% છે. 40K નો ઉપયોગ કરીને જમીનની કિરણોત્સર્ગીતાની ગણતરી કરો, જો તે જાણીતું હોય કે જમીનના નમૂનામાં પોટેશિયમનું પ્રમાણ 14 છે. kg/t.
18. પર્યાવરણની લિથોજેનિક રેડિયોએક્ટિવિટી મુખ્યત્વે ત્રણ મુખ્ય કુદરતી રેડિઓન્યુક્લાઇડ્સને કારણે રચાય છે: 40K, 238U, 232Th. આઇસોટોપ્સના કુદરતી સરવાળામાં કિરણોત્સર્ગી આઇસોટોપનું પ્રમાણ અનુક્રમે 0.01, 99.3, ~100 છે. રેડિયોએક્ટિવિટીની ગણતરી કરો 1 ટીમાટી, જો તે જાણીતું હોય કે માટીના નમૂનામાં પોટેશિયમની સંબંધિત સામગ્રી 13600 છે g/t, યુરેનિયમ – 1·10-4 g/t, થોરિયમ – 6·10-4 g/t
19. 23,200 બાયવલ્વ મોલસ્કના શેલ્સમાંથી મળી આવ્યા હતા Bq/kg 90 Sr. 10, 30, 50, 100 વર્ષ પછી નમૂનાઓની પ્રવૃત્તિ નક્કી કરો.
20. ચેર્નોબિલ ઝોનમાં બંધ જળાશયોનું મુખ્ય પ્રદૂષણ અણુ પાવર પ્લાન્ટમાં અકસ્માત પછી પ્રથમ વર્ષમાં થયું હતું. તળાવના તળિયેના કાંપમાં. 1999માં અઝબુચિને 1.1·10 Bq/m2 ની ચોક્કસ પ્રવૃત્તિ સાથે 137C ની શોધ કરી. 1986-1987 મુજબ તળિયાના કાંપના m2 દીઠ ઘટીને 137Cs ની સાંદ્રતા (પ્રવૃત્તિ) નક્કી કરો. (12 વર્ષ પહેલાં).
21. 241Am (T½ = 4.32·102 વર્ષ) 241Pu (T½ = 14.4 વર્ષ) થી રચાય છે અને તે સક્રિય ભૂ-રાસાયણિક સ્થળાંતર છે. સંદર્ભ સામગ્રીનો ઉપયોગ કરીને, સમય જતાં પ્લુટોનિયમ-241 ની પ્રવૃત્તિમાં ઘટાડો 1% ની ચોકસાઈ સાથે ગણતરી કરો, જે વર્ષમાં ચેર્નોબિલ આપત્તિ પછી પર્યાવરણમાં 241Am ની રચના મહત્તમ હશે.
22. એપ્રિલ સુધીમાં ચેર્નોબિલ રિએક્ટરના ઉત્સર્જનમાં 241Am ની પ્રવૃત્તિની ગણતરી કરો
2015, જો કે એપ્રિલ 1986 માં 241Am ની પ્રવૃત્તિ 3.82 1012 હતી બીકે,Т½ = 4.32·102 વર્ષ.
23. માટીના નમૂનામાં 390 મળી આવ્યા હતા nCi/કિલો 137Cs. 10, 30, 50, 100 વર્ષ પછીના નમૂનાઓની પ્રવૃત્તિની ગણતરી કરો.
24. તળાવના પલંગના પ્રદૂષણની સરેરાશ સાંદ્રતા. ચેર્નોબિલ એક્સક્લુઝન ઝોનમાં સ્થિત ગ્લુબોકોયે 6.3 104 છે બીકે 241Am અને 7.4·104 238+239+240Pu પ્રતિ 1 m2. આ ડેટા કયા વર્ષમાં મેળવવામાં આવ્યો તેની ગણતરી કરો.
§ 15-જી. કિરણોત્સર્ગી સડોનો કાયદો
"મેન્યુઅલ" સિન્ટિલેશન કાઉન્ટર્સ અને મુખ્યત્વે ગીગર-મુલર કાઉન્ટર્સના આગમનથી, જેણે કણોની ગણતરીને સ્વચાલિત કરવામાં મદદ કરી (જુઓ § 15), ભૌતિકશાસ્ત્રીઓને એક મહત્વપૂર્ણ નિષ્કર્ષ પર લઈ ગયા. કોઈપણ કિરણોત્સર્ગી આઇસોટોપ રેડિયોએક્ટિવિટીના સ્વયંસ્ફુરિત નબળાઇ દ્વારા વર્ગીકૃત થયેલ છે, જે એકમ સમય દીઠ ક્ષીણ થતા ન્યુક્લીની સંખ્યામાં ઘટાડો દર્શાવે છે.
વિવિધ કિરણોત્સર્ગી આઇસોટોપ્સની પ્રવૃત્તિના પ્લોટિંગ આલેખ વૈજ્ઞાનિકોને સમાન અવલંબન તરફ દોરી ગયા, વ્યક્ત ઘાતાંકીય કાર્ય(ચાર્ટ જુઓ). આડી અક્ષ અવલોકનનો સમય બતાવે છે, અને ઊભી અક્ષ અવિકસિત ન્યુક્લીની સંખ્યા દર્શાવે છે. રેખાઓની વક્રતા અલગ હોઈ શકે છે, પરંતુ કાર્ય પોતે, જે આલેખ દ્વારા વર્ણવેલ અવલંબનને વ્યક્ત કરે છે, તે જ રહ્યું:
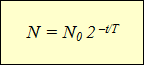
આ સૂત્ર વ્યક્ત કરે છે કિરણોત્સર્ગી સડોનો કાયદો:ન્યુક્લીની સંખ્યા કે જે સમય જતાં ક્ષીણ થઈ નથી તે નેગેટિવ ચિન્હ સાથે લેવામાં આવેલા અવલોકન સમયના અર્ધ-જીવનના ગુણોત્તરની સમાન શક્તિથી 2 દ્વારા મધ્યવર્તી કેન્દ્રોની પ્રારંભિક સંખ્યાના ઉત્પાદન તરીકે નિર્ધારિત કરવામાં આવે છે.
જેમ જેમ તે પ્રયોગો દરમિયાન બહાર આવ્યું છે, વિવિધ કિરણોત્સર્ગી પદાર્થો વિવિધ દ્વારા વર્ગીકૃત કરી શકાય છે અર્ધ જીવન- તે સમય કે જે દરમિયાન હજુ પણ અવિકસિત ન્યુક્લીની સંખ્યા અડધી થઈ ગઈ છે(કોષ્ટક જુઓ).
કેટલાક રાસાયણિક તત્વોના કેટલાક આઇસોટોપ્સનું અર્ધ જીવન. કુદરતી અને કૃત્રિમ આઇસોટોપ્સ બંને માટે મૂલ્યો આપવામાં આવે છે.
| આયોડિન -129 | 15 મા | કાર્બન-14 | 5.7 હજાર વર્ષ | |
| આયોડિન-131 | 8 દિવસ | ઉરણ-235 | 0.7 ગા | |
| આયોડિન -135 | 7 વાગે | ઉરણ-238 | 4.5 અબજ વર્ષ |
અર્ધ જીવન એ સામાન્ય રીતે સ્વીકૃત ભૌતિક જથ્થો છે જે કિરણોત્સર્ગી સડોના દરને દર્શાવે છે. અસંખ્ય પ્રયોગો દર્શાવે છે કે કિરણોત્સર્ગી પદાર્થના ખૂબ લાંબા અવલોકન સાથે પણ, તેનું અર્ધ જીવન સ્થિર છે, એટલે કે, તે પહેલેથી જ ક્ષીણ થઈ ગયેલા અણુઓની સંખ્યા પર નિર્ભર નથી.તેથી, પુરાતત્વીય અને ભૂસ્તરશાસ્ત્રીય શોધની ઉંમર નક્કી કરવાની પદ્ધતિમાં કિરણોત્સર્ગી સડોના કાયદાનો ઉપયોગ થયો છે.
રેડિયોકાર્બન ડેટિંગ પદ્ધતિ.કાર્બન એ પૃથ્વી પરનું એક ખૂબ જ સામાન્ય રાસાયણિક તત્વ છે, જેમાં સ્થિર આઇસોટોપ કાર્બન-12, કાર્બન-13 અને કિરણોત્સર્ગી આઇસોટોપ કાર્બન-14નો સમાવેશ થાય છે, જેનું અર્ધ જીવન 5.7 હજાર વર્ષ છે (કોષ્ટક જુઓ). જીવંત જીવો, ખોરાક લે છે, તેમના પેશીઓમાં ત્રણેય આઇસોટોપ્સ એકઠા કરે છે. જીવતંત્રના જીવનના અંત પછી, કાર્બનનો પુરવઠો બંધ થાય છે, અને સમય જતાં તેની સામગ્રી કુદરતી રીતે ઘટે છે, કિરણોત્સર્ગી સડોને કારણે. માત્ર કાર્બન-14નો ક્ષય થતો હોવાથી, સજીવોના અવશેષોમાં રહેલા કાર્બન આઇસોટોપનો ગુણોત્તર સદીઓ અને સહસ્ત્રાબ્દીમાં બદલાય છે. આ "કાર્બન પ્રમાણ" માપીને, આપણે પુરાતત્વીય શોધની ઉંમર નક્કી કરી શકીએ છીએ.
રેડિયોકાર્બન પૃથ્થકરણની પદ્ધતિ ભૂસ્તરશાસ્ત્રીય ખડકો, તેમજ અશ્મિભૂત માનવ પદાર્થો માટે લાગુ પડે છે, પરંતુ જો કે નમૂનામાં આઇસોટોપનો ગુણોત્તર તેના અસ્તિત્વ દરમિયાન વિક્ષેપિત ન થયો હોય, ઉદાહરણ તરીકે, આગ અથવા મજબૂત સ્ત્રોતના પ્રભાવથી. રેડિયેશનનું. આ પદ્ધતિની શોધ પછી તરત જ આવા કારણોને ધ્યાનમાં લેવામાં નિષ્ફળતા ઘણી સદીઓ અને હજારો વર્ષોથી ભૂલો તરફ દોરી ગઈ. આજે, "સેક્યુલર કેલિબ્રેશન સ્કેલ" નો ઉપયોગ કાર્બન-14 આઇસોટોપ માટે થાય છે, જે લાંબા સમય સુધી જીવતા વૃક્ષોમાં તેના વિતરણ પર આધારિત છે (ઉદાહરણ તરીકે, અમેરિકન મિલેનિયલ રેડવુડ). તેમની ઉંમરની ગણતરી ખૂબ જ સચોટ રીતે કરી શકાય છે - લાકડાની વાર્ષિક રિંગ્સ દ્વારા.
21મી સદીની શરૂઆતમાં રેડિયોકાર્બન ડેટિંગ પદ્ધતિના ઉપયોગની મર્યાદા 60,000 વર્ષ હતી. જૂના નમૂનાઓની ઉંમર માપવા માટે, જેમ કે ખડકો અથવા ઉલ્કાઓ, એક સમાન પદ્ધતિનો ઉપયોગ કરવામાં આવે છે, પરંતુ કાર્બનને બદલે, અભ્યાસ કરવામાં આવતા નમૂનાના મૂળના આધારે, વ્યક્તિ યુરેનિયમ અથવા અન્ય તત્વોના આઇસોટોપ્સને જુએ છે.
તમારા બ્રાઉઝરમાં Javascript અક્ષમ છે.ગણતરીઓ કરવા માટે, તમારે ActiveX નિયંત્રણોને સક્ષમ કરવું આવશ્યક છે!
>> કિરણોત્સર્ગી સડોનો કાયદો. અર્ધ જીવન
§ 101 રેડિયોએક્ટિવ ડિકેનો કાયદો. અર્ધ જીવન
કિરણોત્સર્ગી સડો આંકડાકીય કાયદાનું પાલન કરે છે. રધરફોર્ડ, કિરણોત્સર્ગી પદાર્થોના પરિવર્તનનો અભ્યાસ કરીને, પ્રાયોગિક રીતે સ્થાપિત કર્યું કે તેમની પ્રવૃત્તિ સમય જતાં ઘટતી જાય છે. અગાઉના ફકરામાં આની ચર્ચા કરવામાં આવી હતી. આમ, રેડોનની પ્રવૃત્તિ 1 મિનિટ પછી 2 ગણી ઘટી જાય છે. યુરેનિયમ, થોરિયમ અને રેડિયમ જેવા તત્વોની પ્રવૃત્તિ પણ સમય સાથે ઘટે છે, પરંતુ વધુ ધીમે ધીમે. દરેક કિરણોત્સર્ગી પદાર્થ માટે ચોક્કસ સમય અંતરાલ હોય છે જે દરમિયાન પ્રવૃત્તિમાં 2 ગણો ઘટાડો થાય છે. આ અંતરાલને અર્ધ જીવન કહેવામાં આવે છે. અર્ધ-જીવન T એ સમય છે જે દરમિયાન કિરણોત્સર્ગી અણુઓની અડધા પ્રારંભિક સંખ્યા ક્ષીણ થઈ જાય છે.
પ્રવૃત્તિમાં ઘટાડો, એટલે કે, કિરણોત્સર્ગી દવાઓમાંથી એક માટે સમયના આધારે, પ્રતિ સેકન્ડમાં ક્ષયની સંખ્યા આકૃતિ 13.8 માં દર્શાવવામાં આવી છે. આ પદાર્થનું અર્ધ જીવન 5 દિવસ છે.
ચાલો હવે કિરણોત્સર્ગી સડોના નિયમનું ગાણિતિક સ્વરૂપ મેળવીએ. સમયની પ્રારંભિક ક્ષણે (t=0) કિરણોત્સર્ગી અણુઓની સંખ્યા N 0 ની બરાબર થવા દો. પછી, અર્ધ જીવન પછી, આ સંખ્યા બરાબર થશે
અન્ય સમાન સમય અંતરાલ પછી, આ સંખ્યા આના સમાન થઈ જશે:









