ચાલો ટોલ્યુએન નાઈટ્રેશન કેવી રીતે હાથ ધરવામાં આવે છે તે વિશે વાત કરીએ. આવી ક્રિયાપ્રતિક્રિયા દ્વારા, વિસ્ફોટકો અને ફાર્માસ્યુટિકલ્સના ઉત્પાદનમાં ઉપયોગમાં લેવાતા અર્ધ-તૈયાર ઉત્પાદનોની વિશાળ સંખ્યા પ્રાપ્ત થાય છે.
નાઈટ્રેશનનું મહત્વ
આધુનિક રાસાયણિક ઉદ્યોગમાં સુગંધિત નાઇટ્રો સંયોજનોના રૂપમાં બેન્ઝીન ડેરિવેટિવ્ઝ ઉત્પન્ન થાય છે. નાઈટ્રોબેન્ઝીન એ એનિલિન રંગ, અત્તર અને ફાર્માસ્યુટિકલ ઉત્પાદનમાં મધ્યવર્તી ઉત્પાદન છે. તે સેલ્યુલોઝ નાઇટ્રાઇટ સહિત ઘણા કાર્બનિક સંયોજનો માટે ઉત્તમ દ્રાવક છે, તેની સાથે જિલેટીનસ સમૂહ બનાવે છે. પેટ્રોલિયમ ઉદ્યોગમાં તેનો ઉપયોગ લુબ્રિકેટિંગ તેલ માટે શુદ્ધિકરણ તરીકે થાય છે. ટોલ્યુએનનું નાઈટ્રેશન બેન્ઝિડિન, એનિલિન અને ફેનીલેનેડિયામાઈન ઉત્પન્ન કરે છે.
નાઈટ્રેશન લાક્ષણિકતાઓ
કાર્બનિક સંયોજનના પરમાણુમાં NO2 જૂથની રજૂઆત દ્વારા નાઈટ્રેશનની લાક્ષણિકતા છે. પ્રારંભિક પદાર્થ પર આધાર રાખીને, આ પ્રક્રિયા રેડિકલ, ન્યુક્લિયોફિલિક અથવા ઇલેક્ટ્રોફિલિક પદ્ધતિ અનુસાર થાય છે. નાઈટ્રોનિયમ કેશન્સ, NO2 આયનો અને રેડિકલ સક્રિય કણો તરીકે કાર્ય કરે છે. ટોલ્યુએનની નાઈટ્રેશન પ્રતિક્રિયા એ અવેજી પ્રતિક્રિયા છે. અન્ય કાર્બનિક પદાર્થો માટે, અવેજી નાઈટ્રેશન શક્ય છે, તેમજ ડબલ બોન્ડમાં ઉમેરા પણ શક્ય છે.
સુગંધિત હાઇડ્રોકાર્બન પરમાણુમાં ટોલ્યુએનનું નાઈટ્રેશન નાઈટ્રેટિંગ મિશ્રણ (સલ્ફ્યુરિક અને નાઈટ્રિક એસિડ) નો ઉપયોગ કરીને હાથ ધરવામાં આવે છે. તે આ પ્રક્રિયામાં પાણી દૂર કરનાર એજન્ટ તરીકે કામ કરે છે અને ઉત્પ્રેરક ગુણધર્મો દર્શાવે છે.

પ્રક્રિયા સમીકરણ
ટોલ્યુએનના નાઇટ્રેશનમાં એક હાઇડ્રોજન અણુને નાઇટ્રો જૂથ સાથે બદલવાનો સમાવેશ થાય છે. પ્રક્રિયાનો ફ્લો ડાયાગ્રામ કેવો દેખાય છે?
ટોલ્યુએનના નાઈટ્રેશનનું વર્ણન કરવા માટે, પ્રતિક્રિયા સમીકરણને નીચે પ્રમાણે રજૂ કરી શકાય છે:
ArH + HONO2+ = Ar-NO2 +H2O
તે વ્યક્તિને ફક્ત ક્રિયાપ્રતિક્રિયાના સામાન્ય કોર્સનો જજ કરવાની મંજૂરી આપે છે, પરંતુ આ પ્રક્રિયાની તમામ વિશેષતાઓને જાહેર કરતું નથી. જે વાસ્તવમાં થાય છે તે સુગંધિત હાઇડ્રોકાર્બન અને નાઈટ્રિક એસિડ ઉત્પાદનો વચ્ચેની પ્રતિક્રિયા છે.
ઉત્પાદનોમાં પાણીના અણુઓ હોય છે તે ધ્યાનમાં લેતા, આ નાઈટ્રિક એસિડની સાંદ્રતામાં ઘટાડો તરફ દોરી જાય છે, તેથી ટોલ્યુએનનું નાઈટ્રેશન ધીમું થાય છે. આ સમસ્યાને ટાળવા માટે, આ પ્રક્રિયા નીચા તાપમાને કરવામાં આવે છે, વધુ માત્રામાં નાઈટ્રિક એસિડનો ઉપયોગ કરીને.
સલ્ફ્યુરિક એસિડ ઉપરાંત, પોલિફોસ્ફોરિક એસિડ અને બોરોન ટ્રાઇફ્લોરાઇડનો ઉપયોગ પાણીને દૂર કરનારા એજન્ટ તરીકે થાય છે. તેઓ નાઈટ્રિક એસિડના વપરાશને ઘટાડવા અને ક્રિયાપ્રતિક્રિયાની કાર્યક્ષમતામાં વધારો કરવાનું શક્ય બનાવે છે.

પ્રક્રિયા ઘોંઘાટ
વી. માર્કોવનિકોવ દ્વારા ઓગણીસમી સદીના અંતમાં ટોલ્યુએનના નાઈટ્રેશનનું વર્ણન કરવામાં આવ્યું હતું. તે પ્રતિક્રિયા મિશ્રણમાં હાજરી અને પ્રક્રિયાના દર વચ્ચે જોડાણ સ્થાપિત કરવામાં સક્ષમ હતા. નાઈટ્રોટોલ્યુએનના આધુનિક ઉત્પાદનમાં, નિર્જળ નાઈટ્રિક એસિડનો ઉપયોગ કરવામાં આવે છે, જે થોડી વધુ માત્રામાં લેવામાં આવે છે.
વધુમાં, ટોલ્યુએનના સલ્ફોનેશન અને નાઈટ્રેશનમાં ઉપલબ્ધ પાણીને દૂર કરતા ઘટક બોરોન ફ્લોરાઈડનો ઉપયોગ સામેલ છે. પ્રતિક્રિયા પ્રક્રિયામાં તેનો પરિચય પરિણામી ઉત્પાદનની કિંમત ઘટાડવાનું શક્ય બનાવે છે, જે ટોલ્યુએનના નાઈટ્રેશનને સુલભ બનાવે છે. ચાલુ પ્રક્રિયા માટેનું સમીકરણ નીચે સામાન્ય સ્વરૂપમાં પ્રસ્તુત છે:
ArH + HNO3 + BF3= Ar-NO2 + BF3 ·H2 O
પ્રતિક્રિયા પૂર્ણ થયા પછી, પાણી દાખલ કરવામાં આવે છે, જેના કારણે બોરોન ફ્લોરાઇડ મોનોહાઇડ્રેટ ડાયહાઇડ્રેટ બનાવે છે. તેને શૂન્યાવકાશમાં નિસ્યંદિત કરવામાં આવે છે, પછી કેલ્શિયમ ફ્લોરાઈડ ઉમેરવામાં આવે છે, જે સંયોજનને તેના મૂળ સ્વરૂપમાં પરત કરે છે.

નાઈટ્રેશનની વિશિષ્ટતાઓ
રીએજન્ટ્સ અને પ્રતિક્રિયા સબસ્ટ્રેટની પસંદગી સાથે સંબંધિત આ પ્રક્રિયાની કેટલીક વિશેષતાઓ છે. ચાલો તેમના કેટલાક વિકલ્પોને વધુ વિગતવાર જોઈએ:
- 60-65 ટકા નાઈટ્રિક એસિડ 96 ટકા સલ્ફ્યુરિક એસિડ સાથે મિશ્રિત;
- 98% નાઈટ્રિક એસિડ અને કેન્દ્રિત સલ્ફ્યુરિક એસિડનું મિશ્રણ સહેજ પ્રતિક્રિયાશીલ કાર્બનિક પદાર્થો માટે યોગ્ય છે;
- પોટેશિયમ અથવા એમોનિયમ નાઈટ્રેટ સાથે કેન્દ્રિત સલ્ફ્યુરિક એસિડ પોલિમર નાઈટ્રો સંયોજનોના ઉત્પાદન માટે ઉત્તમ પસંદગી છે.

નાઈટ્રેશન ગતિશાસ્ત્ર
સલ્ફ્યુરિક અને નાઈટ્રિક એસિડના મિશ્રણ સાથે પ્રતિક્રિયા કરીને, તેઓ આયનીય પદ્ધતિ દ્વારા નાઈટ્રેટેડ છે. વી. માર્કોવનિકોવ આ ક્રિયાપ્રતિક્રિયાના વિશિષ્ટતાઓને દર્શાવવામાં વ્યવસ્થાપિત થયા. પ્રક્રિયા ઘણા તબક્કામાં થાય છે. પ્રથમ, નાઈટ્રોસલ્ફ્યુરિક એસિડ રચાય છે, જે જલીય દ્રાવણમાં વિયોજનમાંથી પસાર થાય છે. નાઇટ્રોનિયમ આયનો ટોલ્યુએન સાથે પ્રતિક્રિયા આપે છે, ઉત્પાદન તરીકે નાઇટ્રોટોલ્યુએન બનાવે છે. જ્યારે મિશ્રણમાં પાણીના અણુઓ ઉમેરવામાં આવે છે, ત્યારે પ્રક્રિયા ધીમી પડી જાય છે.
કાર્બનિક પ્રકૃતિવાળા દ્રાવકોમાં - નાઇટ્રોમેથેન, એસેટોનાઇટ્રાઇલ, સલ્ફોલેન - આ કેશનની રચના તમને નાઇટ્રેશનનો દર વધારવાની મંજૂરી આપે છે.
પરિણામી નાઈટ્રોનિયમ કેશન એરોમેટિક ટોલ્યુએન કોર સાથે જોડાય છે, મધ્યવર્તી બનાવે છે. આગળ, પ્રોટોન એબ્સ્ટ્રેક્શન થાય છે, જે નાઈટ્રોટોલ્યુએનની રચના તરફ દોરી જાય છે.
ચાલુ પ્રક્રિયાના વિગતવાર વર્ણન માટે, અમે "સિગ્મા" અને "pi" સંકુલની રચનાને ધ્યાનમાં લઈ શકીએ છીએ. "સિગ્મા" સંકુલની રચના એ ક્રિયાપ્રતિક્રિયાનો મર્યાદિત તબક્કો છે. સુગંધિત સંયોજનના ન્યુક્લિયસમાં કાર્બન અણુમાં નાઇટ્રોનિયમ કેટેશનના ઉમેરાના દર સાથે સીધો સંબંધિત હશે. ટોલ્યુએનમાંથી પ્રોટોનનું નિરાકરણ લગભગ તરત જ થાય છે.
માત્ર અમુક પરિસ્થિતિઓમાં નોંધપાત્ર પ્રાથમિક ગતિ આઇસોટોપ અસર સાથે સંકળાયેલ કોઈપણ અવેજી સમસ્યાઓ હોઈ શકે છે. આ વિવિધ પ્રકારના અવરોધોની હાજરીમાં વિપરીત પ્રક્રિયાના પ્રવેગને કારણે છે.
ઉત્પ્રેરક અને પાણી દૂર કરનાર એજન્ટ તરીકે કેન્દ્રિત સલ્ફ્યુરિક એસિડ પસંદ કરતી વખતે, પ્રતિક્રિયા ઉત્પાદનોની રચના તરફ પ્રક્રિયાના સંતુલનમાં ફેરફાર જોવા મળે છે.

નિષ્કર્ષ
ટોલ્યુએનનું નાઈટ્રેશન નાઈટ્રોટોલ્યુએન ઉત્પન્ન કરે છે, જે રાસાયણિક ઉદ્યોગનું મૂલ્યવાન ઉત્પાદન છે. આ પદાર્થ એક વિસ્ફોટક સંયોજન છે, તેથી તે બ્લાસ્ટિંગ કામગીરીમાં માંગમાં છે. તેના ઔદ્યોગિક ઉત્પાદન સાથે સંકળાયેલી પર્યાવરણીય સમસ્યાઓ પૈકી, અમે નોંધપાત્ર પ્રમાણમાં કેન્દ્રિત સલ્ફ્યુરિક એસિડનો ઉપયોગ નોંધીએ છીએ.
આ સમસ્યાનો સામનો કરવા માટે, રસાયણશાસ્ત્રીઓ નાઈટ્રેશન પ્રક્રિયા પછી ઉત્પન્ન થતા સલ્ફ્યુરિક એસિડના કચરાને ઘટાડવાની રીતો શોધી રહ્યા છે. ઉદાહરણ તરીકે, પ્રક્રિયા નીચા તાપમાને હાથ ધરવામાં આવે છે અને સરળતાથી પુનર્જીવિત માધ્યમોનો ઉપયોગ કરવામાં આવે છે. સલ્ફ્યુરિક એસિડમાં મજબૂત ઓક્સિડાઇઝિંગ ગુણધર્મો છે, જે ધાતુઓના કાટને નકારાત્મક અસર કરે છે અને જીવંત જીવો માટે જોખમ વધારે છે. જો તમે સલામતીના તમામ ધોરણોનું પાલન કરો છો, તો તમે આ સમસ્યાઓને દૂર કરી શકો છો અને ઉચ્ચ-ગુણવત્તાવાળા નાઇટ્રો સંયોજનો મેળવી શકો છો.
નાઈટ્રેશન
નાઈટ્રેશન પ્રતિક્રિયા એ સૌથી વધુ અભ્યાસ કરાયેલ સુગંધિત અવેજી પ્રતિક્રિયાઓમાંની એક છે. પ્રારંભિક હેતુઓ માટે, નાઈટ્રેશન સામાન્ય રીતે કેન્દ્રિત નાઈટ્રિક અને સલ્ફ્યુરિક એસિડના મિશ્રણ સાથે કરવામાં આવે છે, જેને કહેવાતા નાઈટ્રેટિંગ મિશ્રણ . પ્રતિક્રિયાના પ્રથમ તબક્કે, નાઈટ્રોનિયમ આયન + NO 2 ની રચના થાય છે, જે ઇલેક્ટ્રોફિલિક એજન્ટ છે:
HO-NO 2 + H 2 SO 4 H 2 O + -NO 2 + HSO 4 -
H 2 O + -NO 2 + H 2 SO 4 H 3 O + + HSO 4 - + + ના 2
આ દ્રાવણમાં નાઈટ્રોનિયમ આયનની હાજરી સ્પેક્ટ્રોસ્કોપિકલી પુષ્ટિ કરવામાં આવી હતી. કેન્દ્રિત સલ્ફ્યુરિક એસિડમાં નાઈટ્રિક એસિડ લગભગ સંપૂર્ણપણે નાઈટ્રોનિયમ કેશનમાં રૂપાંતરિત થાય છે. બેન્ઝીનની નાઈટ્રેશન પ્રતિક્રિયામાં નાઈટ્રિક એસિડની જ નજીવી અસરકારકતા + NO 2 આયનની ઓછી સામગ્રી દ્વારા સમજાવવામાં આવે છે.
અન્ય પ્રણાલીઓનો ઉપયોગ નાઈટ્રેટિંગ એજન્ટ તરીકે પણ થાય છે, જેમાં ક્યાં તો કેશન + NO 2 અથવા સામાન્ય સૂત્ર NO2-Yનું સંયોજન ઉત્પન્ન થાય છે જ્યાં Y એ સારું છોડવાનું જૂથ છે. આમાંની કેટલીક સિસ્ટમો કે જેને સૌથી વધુ એપ્લિકેશન મળી છે તે પ્રવૃત્તિને વધારવાના ક્રમમાં કોષ્ટક 1 માં રજૂ કરવામાં આવી છે.
કોષ્ટક 1. નાઈટ્રેટિંગ રીએજન્ટ્સ.
| નાઈટ્રેટિંગ રીએજન્ટ | જનરેશન પદ્ધતિ | નાઈટ્રેશનને આધીન એરેનાસ |
| નાઈટ્રિક એસિડ HO-NO2 |
ફિનોલ્સ, ફિનોલ ઇથર્સ, બાયફિનાઇલ | |
| એસિટિલ નાઈટ્રેટ CH 3 C(O)-O-NO 2 | CH 3 COOH + HNO 3 (CH 3 CO) 2 O + HNO 3 | બેન્ઝીન, આલ્કિલબેન્ઝીન |
| નાઇટ્રોજન ડાયોક્સાઇડ N 2 O 4 (O=N-O-NO 2) |
બેન્ઝીન, આલ્કિલબેન્ઝીન | |
| નાઈટ્રેટિંગ મિશ્રણ | H 2 SO 4 conc + HNO 3 | બેન્ઝીન, આલ્કિલબેન્ઝીન, હેલોબેન્ઝીન, બેન્ઝોઇક એસિડ, નાઇટ્રોબેન્ઝીન, નેપ્થાલિન |
| નાઇટ્રોનિયમ ક્લોરાઇડ Сl-NO 2 |
બેન્ઝીન, આલ્કિલબેન્ઝીન, નાઈટ્રોબેન્ઝીન, | |
| નાઇટ્રોનિયમ ટેટ્રાફ્લોરોબોરેટ BF 4 -+ NO 2 | એચ.એફ. 2BF 3 + HNO 3 | ડીનીટ્રોબેન્ઝીન |
અલ્કિલબેન્ઝીન્સની નાઈટ્રેશન પ્રતિક્રિયાના ઉદાહરણનો ઉપયોગ કરીને, ઇલેક્ટ્રોફિલિક અવેજીની દિશા પર અવકાશી પરિબળોનો પ્રભાવ સ્પષ્ટપણે દેખાય છે. આમ, ટોલ્યુએન (મિથાઈલબેન્ઝીન) ના નાઈટ્રેશન દરમિયાન ઓર્થો-આઇસોમર મુખ્ય ઉત્પાદન તરીકે રચાય છે, અને ઇથિલ-માં સંક્રમણ પર, iso-પીધુ- અને ખાસ કરીને ઘસવું-બ્યુટીલ-બેન્ઝીન, તેની ઉપજ નોંધપાત્ર રીતે ઘટે છે (કોષ્ટક 2 જુઓ).
કોષ્ટક 2. નાઈટ્રેશન પ્રતિક્રિયામાં ઓર્થો-, પેરા-આઈસોમર્સના ગુણોત્તર પર અવકાશી પરિબળોનો પ્રભાવ (NO 2 +)
હોદ્દા પર અવેજી, % |
|||
C6H5 -C2H5 |
|||
C6H5-CH(CH3)2 |
|||
C6H5-C(CH3)3 |
|||
આલ્કિલબેન્ઝીન્સના નાઈટ્રેશનનો અભ્યાસ કરતી વખતે, કહેવાતા ipso-અવેજી , જ્યારે બેન્ઝીન રિંગના કાર્બન અણુ પર ઇલેક્ટ્રોફિલિક હુમલો થાય છે જેમાં પહેલેથી જ એક અવેજીકરણ હોય છે, ઉદાહરણ તરીકે:

નાઇટ્રેશનથી વિપરીત, હેલોજનેશન દરમિયાન વિવિધ ઇલેક્ટ્રોફાઇલ્સ દ્વારા સુગંધિત સબસ્ટ્રેટનો હુમલો કરી શકાય છે. મફત હેલોજન, ઉદાહરણ તરીકે, Cl 2 અને Br 2 (નોંધ 35) સક્રિય સુગંધિત રિંગ (ઉદાહરણ તરીકે, ફિનોલ) પર સરળતાથી હુમલો કરી શકે છે, પરંતુ બેન્ઝીન અને આલ્કિલબેન્ઝીન સાથે પ્રતિક્રિયા કરવામાં સક્ષમ નથી (ફોટોકેમિકલ સક્રિયકરણ, જો કે, પછીના કિસ્સામાં. આમૂલ બાજુ સાંકળ અવેજીની ઘટના તરફ દોરી જાય છે વિભાગ IV.3 જુઓ). હુમલો કરનાર હેલોજન પરમાણુનું ધ્રુવીકરણ કરવા માટે, તે જરૂરી છે લેવિસ એસિડ કેટાલિસિસ જેમ કે AlCl 3, FeBr 3, વગેરે; આ કિસ્સામાં, કહેવાતા "ઇલેક્ટ્રોફિલિક એન્ડ" હેલોજન પરમાણુમાં દેખાય છે (હેલ + કેશનની રચના માટે જરૂરી ઊર્જા નોંધપાત્ર રીતે વધારે છે). આ ઇલેક્ટ્રોફિલિક અવેજીને ખૂબ સરળ બનાવે છે:

હેલોજનેશન ખૂબ જ જોરશોરથી આગળ વધે છે જો રીએજન્ટ્સનો ઉપયોગ કરવામાં આવે જેમાં ધ્રુવીકરણના પરિણામે હેલોજન મજબૂત સકારાત્મક ચાર્જ ધરાવે છે અથવા તો કેશન તરીકે પણ અસ્તિત્વ ધરાવે છે. હા, ખૂબ જ નિષ્ક્રિય મેટા-સિલ્વર સલ્ફેટની હાજરીમાં સાંદ્ર સલ્ફ્યુરિક એસિડમાં બ્રોમિન સાથે ડિનિટ્રોબેન્ઝીનને બ્રોમિનેટ કરી શકાય છે. એવું માનવામાં આવે છે કે આ કિસ્સામાં બ્રોમિન કેશન મધ્યવર્તી રીતે રચાય છે:
2Br 2 + Ag 2 SO 4 2Br + + 2AgBr + SO 4 2-
સુગંધિત રિંગમાં ઇલેક્ટ્રોફિલિક અવેજી પ્રતિક્રિયાઓમાં એલિમેન્ટલ આયોડિનની પ્રતિક્રિયા નજીવી છે, તેથી ડાયરેક્ટ આયોડિનેશન ફક્ત ફિનોલ અને સુગંધિત એમાઇન્સના કિસ્સામાં જ શક્ય છે. અન્ય સુગંધિત સંયોજનોનું આયોડિનેશન ઓક્સિડાઇઝિંગ એજન્ટ (સામાન્ય રીતે નાઈટ્રિક એસિડ) ની હાજરીમાં હાથ ધરવામાં આવે છે. એવું માનવામાં આવે છે કે આ પરિસ્થિતિઓમાં ઇલેક્ટ્રોફિલિક એજન્ટની ભૂમિકા I- + OH 2 આયન દ્વારા ભજવવામાં આવે છે.

એરેન્સના હેલોજનેશન માટે, તેનો ઉપયોગ પણ કરી શકાય છે મિશ્રિત હેલોજન, ઉદાહરણ તરીકે, બ્રોમિન મોનોક્લોરાઇડ (BrCl) અથવા આયોડિન (ICl):

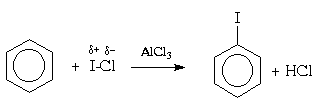
વિવોમાં હેલોજનેશન. જીવંત સજીવોમાં બનતા ઇલેક્ટ્રોફિલિક સુગંધિત હેલોજનેશનના ઉદાહરણ તરીકે, અમે આયોડિન ધરાવતા થાઇરોઇડ હોર્મોન્સના જૈવસંશ્લેષણ દરમિયાન એમિનો એસિડ ટાયરોસિનના આયોડિનેશનની પ્રતિક્રિયાને 3-આયોડોટાયરોસિન અને પછી 3,5-ડિયોડોટાયરોસિન પર ટાંકી શકીએ છીએ:

નાઈટ્રેશન અને હેલોજનેશનની તુલનામાં સલ્ફોનેશનની પદ્ધતિની વિગતોનો ઓછા વિગતવાર અભ્યાસ કરવામાં આવ્યો છે. બેન્ઝીન પોતે ગરમ કેન્દ્રિત સલ્ફ્યુરિક એસિડ સાથે ધીમે ધીમે સલ્ફોનેટ થાય છે, પરંતુ ઓલિયમ સાથે ઝડપથી, નિષ્ક્રિય દ્રાવકમાં SO 3 અથવા પાયરિડિન સાથે SO 3 નું સંકુલ. ઇલેક્ટ્રોફિલિક પ્રજાતિઓની પ્રકૃતિ પ્રતિક્રિયાની સ્થિતિ પર આધારિત છે, પરંતુ તે કદાચ હંમેશા SO 3 હોય છે, કાં તો મુક્ત સ્થિતિમાં અથવા "વાહક" સાથે બંધાયેલ હોય છે, ઉદાહરણ તરીકે, H 2 SO 4 ના સ્વરૂપમાં. સલ્ફ્યુરિક એસિડમાં SO 3 (H 2 S 2 O 7). SO 3 ની નાની માત્રા H 2 SO 4 માં રચાય છે:
2H 2 SO 4 SO 3 + H 3 O + + HSO 4 -
સુગંધિત સબસ્ટ્રેટનો હુમલો સલ્ફર અણુ દ્વારા કરવામાં આવે છે કારણ કે તે મજબૂત રીતે સકારાત્મક ધ્રુવીકરણ છે, એટલે કે, ઇલેક્ટ્રોન-ઉણપ:

સલ્ફોનેશન છે ઉલટાવી શકાય તેવુંપ્રક્રિયા આ વ્યવહારિક મહત્વ છે: જ્યારે સલ્ફોનિક એસિડને વરાળ સાથે ગણવામાં આવે છે, ત્યારે SO 3 H જૂથને હાઇડ્રોજન દ્વારા બદલવામાં આવે છે. આમ, SO 3 H જૂથને અવેજી તરીકે રજૂ કરવું શક્ય છે જે અનુગામી પ્રતિક્રિયાઓને જરૂરી રીતે દિશામાન કરે છે (વિભાગ IV.1.B જુઓ), અને પછી તેને દૂર કરો. નેપ્થાલિનના સલ્ફોનેશનમાં કેટલીક રસપ્રદ લાક્ષણિકતાઓ છે (વિભાગ IV.1.D જુઓ).
હેલોજનની જેમ, આલ્કિલ હલાઇડ્સ ખૂબ જ ધ્રુવીકરણ કરી શકાય છે લેવિસ એસિડ(એલ્યુમિનિયમ અને ઝીંક ક્લોરાઇડ્સ, બોરોન ટ્રાઇફ્લોરાઇડ, વગેરે) કે તેઓ સુગંધિત રિંગમાં ઇલેક્ટ્રોફિલિક અવેજીમાં સક્ષમ બને છે:
R-Cl + AlCl 3 R +... Cl ...- AlCl 3 R + AlCl 4 -
આલ્કિલ હલાઇડ્સ ઉપરાંત, એલ્કેન્સ અથવા આલ્કોહોલ સુગંધિત સંયોજનોના હેલોજનેશન માટે કાર્બોકેશનના સ્ત્રોત બની શકે છે. આ કિસ્સામાં, એલ્કીન અથવા આલ્કોહોલને પ્રોટોનેટ કરવા માટે પ્રોટિક એસિડની હાજરી જરૂરી છે. આલ્કોહોલના કિસ્સામાં, એક એડિટિવ જરૂરી છે સમાન કરતાં ઓછું નથીએસિડની માત્રા (કારણ કે પ્રતિક્રિયા દરમિયાન છોડવામાં આવતું પાણી ઉત્પ્રેરકની સમાન માત્રાને નિષ્ક્રિય કરે છે), જ્યારે આલ્કિલ હલાઇડ્સ અને આલ્કેન્સને સંડોવતા પ્રતિક્રિયાઓમાં તે ઉત્પ્રેરકની થોડી માત્રા ઉમેરવા માટે પૂરતું છે.
પ્રયોગશાળામાં, ફ્રિડેલ-ક્રાફ્ટ્સ આલ્કિલેશનનો મર્યાદિત ઉપયોગ છે, કારણ કે આ પ્રતિક્રિયા સામાન્ય રીતે ઉત્પાદનોના મિશ્રણનું ઉત્પાદન કરે છે, સંખ્યાબંધ કારણોસર:
1) પરિણામી આલ્કિલેશન ઉત્પાદન પ્રારંભિક સંયોજન કરતાં વધુ સરળતાથી ઇલેક્ટ્રોફિલિક સુગંધિત અવેજીની પ્રતિક્રિયાઓમાંથી પસાર થાય છે (આલ્ક એ ઇલેક્ટ્રોન-દાન કરનાર જૂથ છે), તેથી ઉત્પાદનને પછી પ્રાધાન્ય રૂપે અલ્કાયલેટેડ કરવામાં આવે છે. જો કોઈ મોનોઆલ્કિલેશન ઉત્પાદનો મેળવવા માંગે છે, તો તે સુગંધિત સંયોજનનો મોટો જથ્થો લેવો જરૂરી છે.
2) સલ્ફોનેશનની જેમ, ફ્રીડેલ-ક્રાફ્ટ્સ આલ્કિલેશન પ્રતિક્રિયા ઉલટાવી શકાય તેવું(વિભાગ IV.1.D પણ જુઓ).
3) હળવી પરિસ્થિતિઓમાં પણ, પ્રાથમિક અને ગૌણ આલ્કિલ હલાઇડ્સ અનુક્રમે પ્રાથમિક રૂપે ગૌણ અથવા તૃતીય આલ્કિલેરિન આપે છે, કારણ કે આલ્કિલેશન નજીકની પરિસ્થિતિઓમાં થાય છે. એસ એન 1પ્રતિક્રિયાઓ (નોંધ 37) જો તમે નીચા તાપમાને કામ કરો છો તો પુનઃજૂથ કરવાનું ટાળી શકાય છે.
સુગંધિત સંયોજનોનું ફ્રિડેલ-ક્રાફ્ટ એસિલેશન એ ચરબીયુક્ત સુગંધિત કીટોન્સના સંશ્લેષણ માટેની સૌથી મહત્વપૂર્ણ પદ્ધતિ છે. કાર્બોક્સિલિક એસિડ ડેરિવેટિવ્ઝ, જેમ કે એસિલ હલાઇડ્સ અને એનહાઇડ્રાઇડ્સ, ધ્રુવીય કાર્બોનિલ જૂથ ધરાવે છે અને સૈદ્ધાંતિક રીતે સુગંધિત પ્રણાલીઓમાં ઇલેક્ટ્રોફિલિક અવેજીમાં સક્ષમ છે:

જો કે, આ સંયોજનોની ઇલેક્ટ્રોફિલિક પ્રવૃત્તિ ઓછી છે અને લેવિસ એસિડની ક્રિયા દ્વારા તેને વધારવી આવશ્યક છે. આ કિસ્સામાં, એસિડ ઉત્પ્રેરક, એક નિયમ તરીકે, ઓક્સિજન પરમાણુ પર હુમલો કરે છેકાર્બોનિલ સંયોજન અને, ઇલેક્ટ્રોનની ઘનતાને સ્થાનાંતરિત કરીને, પડોશી કાર્બન અણુના હકારાત્મક ચાર્જમાં વધારો કરે છે. પરિણામે, એક ધ્રુવીકરણ સંકુલ રચાય છે (અને, મર્યાદામાં, એક એસિલ કેશન), ઇલેક્ટ્રોફાઇલ તરીકે કાર્ય કરે છે:


એસિલ હલાઇડ્સ સાથેની એસિલેશન પ્રતિક્રિયા અને આલ્કિલ હલાઇડ્સ સાથેની આલ્કિલેશન પ્રતિક્રિયા વચ્ચેનો મહત્વનો તફાવત એ છે કે આમાંની પ્રથમ પ્રતિક્રિયામાં 1 થી વધુ મોલ લેવિસ એસિડ જરૂરી છે, જ્યારે બીજામાં માત્ર ઉત્પ્રેરક માત્રાની જરૂર છે. આ એ હકીકતને કારણે છે કે લેવિસ એસિડ કાર્બોક્સિલિક એસિડના એસીલેટીંગ ડેરિવેટિવ અને કેટોન, પ્રતિક્રિયા ઉત્પાદન બંને સાથે એક જટિલ બનાવે છે. એનહાઇડ્રાઇડ્સ સાથે પ્રતિક્રિયા કરતી વખતે, પરિણામી એસિડ ઉત્પ્રેરકના બીજા છછુંદરને જોડે છે, જેથી કુલ ઓછામાં ઓછા બે છછુંદરની જરૂર હોય. દરેક કિસ્સામાં, પ્રતિક્રિયા પૂર્ણ થયા પછી, એલ્યુમિનિયમ ક્લોરાઇડ (અથવા અન્ય લેવિસ એસિડ) સાથેનું પરિણામી કેટોન કોમ્પ્લેક્સ હાઇડ્રોલિટીક રીતે નાશ પામે છે (બરફ સાથે હાઇડ્રોક્લોરિક એસિડ).
કોઈ પોલિઆસીલેશન જોવા મળતું નથી કારણ કે પરિણામી કેટોન પેરેંટ કમ્પાઉન્ડ કરતાં નોંધપાત્ર રીતે ઓછી પ્રતિક્રિયાશીલ હોય છે (જુઓ વિભાગ IV.1.B). તેથી, મોટાભાગે એલ્કિલબેન્ઝીનને ડાયરેક્ટ આલ્કિલેશન દ્વારા નહીં, પરંતુ ફ્રિડેલ-ક્રાફ્ટ્સ એસીલેશન દ્વારા મેળવવાનું પસંદ કરવામાં આવે છે અને ત્યારબાદ ઘટાડો થાય છે. નાઈટ્રો અથવા સાયનો જૂથો જેવા મજબૂત રીતે નિષ્ક્રિય કરનારા અવેજીઓ સાથે સુગંધિત સંયોજનો પણ ફ્રિડેલ-ક્રાફ્ટ એસીલેટેડ નથી.
નિયંત્રણ કાર્યો
2. ઇલેક્ટ્રોફિલિક સુગંધિત અવેજી પ્રતિક્રિયા માટે સંભવિત ઉર્જા રેખાકૃતિ દોરો જેમાં ધીમા પગલું એ રચના છે
જટિલ (ઉદાહરણ તરીકે, નાઈટ્રોનિયમ બોરોફ્લોરાઈડ સાથે બેન્ઝીનનું નાઈટ્રેશન;
વિભાગ IV.1.A જુઓ).
3. કયું ઉત્પાદન મુખ્યત્વે બ્રોમિનેશન દરમિયાન બને છે: a) જોડી-નાઇટ્રોટોલ્યુએન; b) મેટા-નાઇટ્રોબેન્ઝેનેસલ્ફોનિક એસિડ્સ; વી) ઓર્થો- નાઇટ્રોફેનોલ.
4. એડ્રેનાલિન (1-(3,4"-dihydroxyphenyl)-2-methylaminoethanol) એ એડ્રેનલ મેડ્યુલામાંથી અલગ કરાયેલો પ્રથમ હોર્મોન છે; તે હાલમાં પાયરોકેટેકોલમાંથી ત્રણ તબક્કામાં સંશ્લેષણ કરવામાં આવે છે. આ સંશ્લેષણના પ્રથમ તબક્કા માટેનું સમીકરણ લખો - ક્લોરોએસેટિક એસિડ ક્લોરાઇડ સાથે કેટેકોલ (1,2-ડાયહાઇડ્રોક્સિબેન્ઝીન) ના એસિલેશનની પ્રતિક્રિયા અને પદ્ધતિ સમજાવો).
5. પ્રોટીનની ગુણાત્મક પ્રતિક્રિયાઓમાંની એક ઝેન્થોપ્રોટીન પ્રતિક્રિયા છે, જે સુગંધિત એમિનો એસિડની હાજરી સૂચવે છે. જ્યારે ગરમ થાય ત્યારે તેમાં નાઈટ્રિક એસિડ સાથે પ્રોટીનની સારવારનો સમાવેશ થાય છે. ટાયરોસિન સાથે ઝેન્થોપ્રોટીન પ્રતિક્રિયા માટે સમીકરણ લખો (વિભાગ I જુઓ), પ્રોટીન હાઇડ્રોલિસિસના પરિણામે રચાય છે.
બેન્ઝીનનું નાઈટ્રેશન શુદ્ધ ઉત્પાદનને અલગ કર્યા વિના થોડી માત્રામાં પ્રારંભિક સામગ્રી સાથે કરી શકાય છે. સમીકરણનો ઉપયોગ કરીને નાઇટ્રોબેન્ઝીન મેળવવા માટે:
C 6 H 6 + HNO 3 à C 6 H 5 NO 2+ H 2 O
કેન્દ્રિત નાઈટ્રિક એસિડ (વિશિષ્ટ ગુરુત્વાકર્ષણ 1.4) જરૂરી છે. પ્રતિક્રિયા મિશ્રણને 50-60 ડિગ્રી સેલ્સિયસથી વધુ ગરમ ન કરવું જોઈએ, જ્યારે પાતળું એસિડનો ઉપયોગ કરવામાં આવે છે, ત્યારે વધતા તાપમાન સાથે નાઈટ્રેશન પ્રતિક્રિયા થતી નથી, ડિનાઇટ્રોબેન્ઝીનની નોંધનીય રચના શરૂ થાય છે.
તે સમીકરણ પરથી અનુસરે છે કે પ્રતિક્રિયા માટે પ્રારંભિક સામગ્રીની સમાન અણુની માત્રાની જરૂર છે. જો કે, આ કિસ્સામાં, પ્રતિક્રિયા પૂર્ણ થશે નહીં, કારણ કે છોડેલું પાણી નાઈટ્રિક એસિડને પાતળું કરશે, અને તે તેની નાઈટ્રેટિંગ મિલકત ગુમાવશે. પરિણામે, પ્રતિક્રિયા પૂર્ણ કરવા માટે, સિદ્ધાંત મુજબ જોઈએ તેના કરતાં વધુ નાઈટ્રિક એસિડ લેવું જરૂરી છે. પરંતુ પ્રતિક્રિયાને ખૂબ હિંસક બનતી અટકાવવા માટે, નાઈટ્રિક એસિડને કેન્દ્રિત સલ્ફ્યુરિક એસિડમાં ઓગળવું આવશ્યક છે, જે નાઈટ્રિક એસિડને તેની નાઈટ્રેટિંગ અસરથી વંચિત કરતું નથી અને પ્રતિક્રિયા દરમિયાન છોડેલા પાણીને બાંધે છે.
પ્રતિક્રિયા દરમિયાન તાપમાનમાં વધારો થવાની સંભાવનાને રોકવા માટે, એક જ સમયે તમામ પદાર્થોને મિશ્રિત કરશો નહીં, પરંતુ ધીમે ધીમે એસિડના મિશ્રણમાં બેન્ઝીન ઉમેરો. 8 મિલી ઘટ્ટ સલ્ફ્યુરિક એસિડ અને 5 મિલી સાંદ્ર નાઈટ્રિક એસિડ નાના ફ્લાસ્કમાં રેડવામાં આવે છે. વહેતા પાણી હેઠળ મિશ્રણને ઠંડુ કરો. પછી ઠંડા મિશ્રણમાં 4 મિલી બેન્ઝીન ઉમેરવામાં આવે છે, એક બીજામાં ઓગળતા ન હોય તેવા પ્રવાહીનું વધુ મિશ્રણ મેળવવા માટે ફ્લાસ્કને સતત હલાવતા રહે છે (એસિડનું મિશ્રણ નીચેનું સ્તર બનાવે છે, બેન્ઝીન ટોચનું સ્તર બનાવે છે) . પ્રતિક્રિયાની સંપૂર્ણતા પ્રાપ્ત કરવા માટે તમામ બેન્ઝીન ઉમેર્યા પછી, ફ્લાસ્કને ઊભી ટ્યુબ (બેન્ઝીન વરાળ અસ્થિર હોય છે) સાથે સ્ટોપર વડે બંધ કરવામાં આવે છે અને 60 ° સે પહેલા ગરમ પાણીના સ્નાનમાં ગરમ કરવામાં આવે છે.
પ્રવાહીને વધુ સારી રીતે મિશ્રિત કરવા માટે ફ્લાસ્કને સમય સમય પર હલાવો.
ગરમીની અવધિ પ્રતિક્રિયાની સંપૂર્ણતા પ્રાપ્ત કરવાની જરૂરિયાત દ્વારા નહીં, પરંતુ પાઠમાં સમયની ઉપલબ્ધતા દ્વારા નક્કી કરી શકાય છે. મગમાં કામ કરતી વખતે, ગરમી 30-40 મિનિટ સુધી ચાલુ રાખવી જોઈએ. પાઠમાં, જો એસિડના મિશ્રણમાં બેન્ઝીન ઉમેરવામાં આવે ત્યારે પ્રતિક્રિયા સારી રીતે થઈ હોય તો, 10 મિનિટ સુધી ગરમ કર્યા પછી અને વધારાના હીટિંગ વિના પણ નાઈટ્રોબેન્ઝીનની રચનાનું નિદર્શન કરવું શક્ય છે.
નાઈટ્રોબેન્ઝીન એસિડ મિશ્રણની ટોચ પર એક સ્તરમાં મૂકવામાં આવે છે. ફ્લાસ્કની સામગ્રીને પુષ્કળ પાણી સાથે ગ્લાસમાં રેડવું. આ કિસ્સામાં, એસિડ પાણીમાં ઓગળી જાય છે, જ્યારે નાઇટ્રોબેન્ઝીન ભારે પીળા પ્રવાહીના રૂપમાં કાચના તળિયે એકત્રિત થાય છે. જો સમય પરવાનગી આપે, તો નાઈટ્રોબેન્ઝીનમાંથી અમુક પ્રવાહી કાઢી નાખો અને તેને અલગ કરતા ફનલનો ઉપયોગ કરીને અલગ કરો.
જ્યારે નાઇટ્રોબેન્ઝીનની નોંધપાત્ર માત્રા પ્રાપ્ત થાય છે અને તેને શુદ્ધ કરવું જરૂરી છે, ત્યારે નાઇટ્રોબેન્ઝીનને પાણીથી ધોવાઇ જાય છે, એક પાતળું (5 ટકા) આલ્કલી સોલ્યુશન, પછી ફરીથી પાણીથી, દરેક વખતે વિભાજિત ફનલનો ઉપયોગ કરીને પ્રવાહીને અલગ કરીને. પ્રવાહી સ્પષ્ટ ન થાય ત્યાં સુધી નાઈટ્રોબેન્ઝીનને દાણાદાર કેલ્શિયમ ક્લોરાઇડ સાથે ગરમ કરીને નિર્જલીકૃત કરવામાં આવે છે. નાઈટ્રોબેન્ઝીનની સ્નિગ્ધતા ઘટાડવા અને આ રીતે કેલ્શિયમ ક્લોરાઈડ સાથે વધુ સંપૂર્ણ સંપર્ક પ્રાપ્ત કરવા માટે હીટિંગ જરૂરી છે. છેલ્લે, નાઈટ્રોબેન્ઝીનને 204-207 ° સે તાપમાને એર કૂલર સાથે નાના ફ્લાસ્કમાંથી નિસ્યંદિત કરી શકાય છે. ડિનિટ્રોબેન્ઝીન અવશેષોના વિઘટનને ટાળવા માટે, સૂકા નિસ્યંદનની ભલામણ કરવામાં આવતી નથી.
મિથાઈલબેન્ઝીન (ટોલ્યુએન) ના ભૌતિક ગુણધર્મો બેન્ઝીન જેવા જ છે. સામાન્ય સ્થિતિમાં, તે રંગહીન પ્રવાહી છે, જે પાણીમાં અદ્રાવ્ય છે, પરંતુ કાર્બનિક દ્રાવકોમાં દ્રાવ્ય છે. બેન્ઝીનની જેમ, તે કાર્બનિક સંયોજનો માટે સારું દ્રાવક છે. હાલમાં, ટોલ્યુએનનો ઉપયોગ બેન્ઝીન કરતાં દ્રાવક તરીકે વધુ પ્રમાણમાં થાય છે કારણ કે તેની ઝેરીતા ઘણી ઓછી છે.
રાસાયણિક ગુણધર્મો
મિથાઈલબેન્ઝીનની તમામ પ્રતિક્રિયાઓને બે પ્રકારમાં વિભાજિત કરી શકાય છે: a) બેન્ઝીન રિંગને સંડોવતા પ્રતિક્રિયાઓ, અને b) મિથાઈલ જૂથ સાથે સંકળાયેલી પ્રતિક્રિયાઓ.
સુગંધિત રિંગમાં પ્રતિક્રિયાઓ. મિથાઈલબેન્ઝીન બેન્ઝીન માટે ઉપર વર્ણવેલ તમામ ઇલેક્ટ્રોફિલિક અવેજી પ્રતિક્રિયાઓમાંથી પસાર થાય છે, જેમ કે: નાઈટ્રેશન, હેલોજનેશન, સલ્ફોનેશન અને ફ્રિડેલ-ક્રાફ્ટ્સ પ્રતિક્રિયા. આ બધી પ્રતિક્રિયાઓમાં, મિથાઈલબેન્ઝીન ઉચ્ચ પ્રતિક્રિયાશીલતા દર્શાવે છે અને તેની પ્રતિક્રિયાઓ ઝડપી દરે આગળ વધે છે.
મિથાઈલબેન્ઝીનનું નાઈટ્રેશન બેન્ઝીનની જેમ જ કરી શકાય છે. મિથાઈલબેન્ઝીન ના નાઈટ્રેશનનું ઉત્પાદન એ મિથાઈલનીટ્રોબેન્ઝીનના બે આઈસોમરનું મિશ્રણ છે:

બેન્ઝીન રિંગમાં ટોલ્યુએન (મેથાઈલબેન્ઝીન) નું ક્લોરિનેશન એલ્યુમિનિયમ ક્લોરાઈડની હાજરીમાં ક્લોરિન ગેસને ટોલ્યુએનમાંથી પસાર કરીને પરિપૂર્ણ કરી શકાય છે (પ્રતિક્રિયા અંધારામાં કરવામાં આવે છે). એલ્યુમિનિયમ ક્લોરાઇડ આ કિસ્સામાં ઉત્પ્રેરકની ભૂમિકા ભજવે છે. આ કિસ્સામાં, 2- અને 4-અવેજી આઇસોમર્સ રચાય છે:

કેન્દ્રિત સલ્ફ્યુરિક એસિડ સાથે મિથાઈલબેન્ઝીનનું સલ્ફોનેશન પણ 2- અને 4-અવેજી આઇસોમર્સના મિશ્રણની રચના તરફ દોરી જાય છે:

આ તમામ ઇલેક્ટ્રોફિલિક અવેજી પ્રતિક્રિયાઓની પદ્ધતિ બેન્ઝીનની અનુરૂપ પ્રતિક્રિયાઓની પદ્ધતિ જેવી જ છે. આ પ્રતિક્રિયાઓમાં, 3-અવેજી આઇસોમર્સ એટલી ઓછી માત્રામાં રચાય છે કે તેમની અવગણના કરી શકાય છે. અવેજી જૂથોની દિશાનિર્દેશક (ઓરિએન્ટિંગ) ક્ષમતાને ધ્યાનમાં લેતી વખતે આ વિશેષતાની નીચે વિગતવાર ચર્ચા કરવામાં આવશે.
બાજુ સાંકળ પ્રતિક્રિયાઓ. મિથાઈલબેન્ઝીનમાં મિથાઈલ જૂથ એલ્કેન્સની લાક્ષણિકતા અમુક પ્રતિક્રિયાઓમાંથી પસાર થઈ શકે છે, પરંતુ અન્ય પ્રતિક્રિયાઓ પણ એલ્કેન્સની લાક્ષણિકતા નથી. ચાલો આ દરેક પ્રતિક્રિયાઓનું એક ઉદાહરણ જોઈએ.
અલ્કેન્સની જેમ, મિથાઈલ જૂથને આમૂલ મિકેનિઝમ દ્વારા હેલોજેનેટ કરી શકાય છે. આ પ્રતિક્રિયા કરવા માટે, સૂર્યપ્રકાશ અથવા અલ્ટ્રાવાયોલેટ પ્રકાશના સ્ત્રોતની હાજરીમાં ઉકળતા મેથાઈલબેન્ઝીન દ્વારા ક્લોરિન ફૂંકવામાં આવે છે. નોંધ કરો કે મિથાઈલબેન્ઝીનમાં બેન્ઝીન રિંગના હેલોજનેશન માટે સંપૂર્ણપણે અલગ પરિસ્થિતિઓની જરૂર પડે છે.

મહેરબાની કરીને નોંધ કરો કે આ પ્રતિક્રિયા એક અવેજી છે. વધુ હેલોજનેશન નીચેના સંયોજનોની રચના તરફ દોરી જાય છે:

મિથાઈલબેન્ઝીનનું બ્રોમિનેશન સમાન પરિસ્થિતિઓમાં હાથ ધરવામાં આવે છે અને તે સંબંધિત બ્રોમિન-અવેજી સંયોજનોની રચના તરફ દોરી જાય છે.
અગાઉના વિભાગે સૂચવ્યું હતું કે પોટેશિયમ પરમેંગેનેટ જેવા મજબૂત ઓક્સિડાઇઝિંગ એજન્ટો હોવા છતાં પણ અલ્કેન્સ ઓક્સિડેશન પ્રતિક્રિયાઓમાં પ્રવેશતા નથી. જો કે, ઓક્સાઇડ જેવા પ્રમાણમાં હળવા ઓક્સિડાઇઝિંગ એજન્ટો દ્વારા પણ મિથાઈલબેન્ઝીનમાં મિથાઈલ બાજુની સાંકળ ઓક્સિડેશનને આધીન છે.

મજબૂત ઓક્સિડાઇઝિંગ એજન્ટો, જેમ કે પોટેશિયમ પરમેંગેનેટ, વધુ ઓક્સિડેશનનું કારણ બને છે:

બેન્ઝીન રિંગ પર અવેજીની દિશા નિર્દેશન (ઓરિએન્ટિંગ) અસર
અમે ઉપર સૂચવ્યું છે કે મિથાઈલબેન્ઝીનનું ઈલેક્ટ્રોફિલિક અવેજી મેથાઈલબેન્ઝીનના 2- અને 4-અવેજી આઈસોમર્સની રચના તરફ દોરી જાય છે. તેથી, મિથાઈલબેન્ઝીનમાં મિથાઈલ જૂથને 2,4-નિર્દેશક જૂથ કહેવામાં આવે છે (અથવા, અન્યથા, સ્થિતિ 2 અને 4 તરફ લક્ષી). બેન્ઝીન રિંગ પર અન્ય અવેજીઓ છે જે ઇલેક્ટ્રોફિલિક અવેજી પ્રતિક્રિયાઓમાં 2,4-નિર્દેશક અસર પણ ધરાવે છે. આવી પ્રતિક્રિયાઓ માટે નીચેના સામાન્ય સમીકરણ લખી શકાય છે:

આ સમીકરણમાં ઇલેક્ટ્રોફાઇલનો અર્થ થાય છે અને X-2,4 એ ડાયરેક્ટિંગ અવેજી છે. આવા અવેજી સામાન્ય રીતે સંતૃપ્ત જૂથો છે. આનો સમાવેશ થાય છે. અમુક શરતો હેઠળ, 2,4-નિર્દેશક અવેજી પણ 6-નિર્દેશક તરીકે બહાર આવે છે:

સ્થિતિ 2 અને 4 પર ઇલેક્ટ્રોફિલિક અવેજી પ્રતિક્રિયાઓ સામાન્ય રીતે બેન્ઝીનમાં અનુરૂપ પ્રતિક્રિયાઓ કરતા વધારે દર ધરાવે છે.

આમાં અને જેવા જૂથોનો સમાવેશ થાય છે. પોઝિશન 3 પર ઇલેક્ટ્રોફિલિક અવેજી પ્રતિક્રિયાઓ બેન્ઝીનની અનુરૂપ પ્રતિક્રિયાઓ કરતાં વધુ ધીમેથી આગળ વધે છે.
અવેજીની દિશાનિર્દેશક (ઓરિએન્ટિંગ) ક્ષમતા તેના પર નિર્ભર કરે છે કે શું તેઓ બેન્ઝીન રિંગ માટે ઇલેક્ટ્રોન દાતા છે અથવા તેનાથી વિપરીત,
તેનાથી ઇલેક્ટ્રોન દૂર ખેંચો. 2,4-અવેજી હકારાત્મક પ્રેરક અસર અથવા હકારાત્મક મેસોમેરિક અસરને કારણે થાય છે. -નિર્દેશક જૂથો બેન્ઝીન રિંગમાં ઇલેક્ટ્રોનનું દાન કરે છે, જેના કારણે આ અસરો થાય છે અને આમ રિંગ સક્રિય થાય છે. તેથી તેમને સક્રિય જૂથો કહેવામાં આવે છે. 3-નિર્દેશક જૂથો બેન્ઝીન રિંગમાંથી ઇલેક્ટ્રોનને દૂર ખેંચે છે, જેના કારણે - અને - અસરો થાય છે. આને નિષ્ક્રિય જૂથો કહેવામાં આવે છે.
તો ચાલો ફરીથી કહીએ!
1. સુગંધિત સંયોજનોમાં નીચેના સામાન્ય ગુણધર્મો છે: a) સ્મોકી જ્યોતની રચના સાથે બળી જાય છે;
(સ્કેન જુઓ)
ચોખા. 18.7. બેન્ઝીનની સૌથી મહત્વપૂર્ણ પ્રતિક્રિયાઓ.

ચોખા. 18.8. મિથાઈલબેન્ઝીન (ટોલ્યુએન) ની સૌથી મહત્વપૂર્ણ પ્રતિક્રિયાઓ.
b) અવેજી પ્રતિક્રિયાઓમાંથી પસાર થવું,
c) મુશ્કેલી સાથે વધારાની પ્રતિક્રિયાઓમાંથી પસાર થવું.
2. બેન્ઝીન પરમાણુને બે મર્યાદિત રેઝોનન્ટ સ્ટ્રક્ચર્સ દ્વારા રચાયેલ રેઝોનન્ટ હાઇબ્રિડ તરીકે ગણી શકાય.
3. બેન્ઝીનની સૌથી મહત્વપૂર્ણ રાસાયણિક પ્રતિક્રિયાઓ ફિગમાં બતાવવામાં આવી છે. 18.7.
4. મિથાઈલબેન્ઝીનની સૌથી મહત્વપૂર્ણ રાસાયણિક પ્રતિક્રિયાઓ ફિગમાં બતાવવામાં આવી છે. 18.8.
5. ઘનીકરણ પ્રતિક્રિયાઓમાં, બે પ્રતિક્રિયાશીલ પરમાણુઓ પાણી અથવા હાઇડ્રોજન ક્લોરાઇડ જેવા સરળ સંયોજનના નાના પરમાણુના એક સાથે નાબૂદી સાથે નવા પરમાણુમાં ભેગા થાય છે.
6. બેન્ઝીન રિંગ પર સંતૃપ્ત અવેજીમાં 2,4-દિગ્દર્શન (ઓરિએન્ટિંગ) અસર હોય છે.
7. બેન્ઝીન રિંગ પરના અસંતૃપ્ત અવેજીમાં નિર્દેશન (ઓરિએન્ટિંગ) અસર હોય છે.

સ્થિર મધ્યવર્તી તરીકે -સંકુલનું અસ્તિત્વ સીધા પ્રયોગો દ્વારા સાબિત થયું છે. આ જરૂરી નથી કે ઇલેક્ટ્રોફિલિક ઉમેરણ-નિવારણ પ્રતિક્રિયાની સંક્રમણ સ્થિતિ -જટિલની રચનામાં સમાન હોય. ખરેખર, આ પ્રતિક્રિયાઓમાં સંકુલની ભૂમિકા હજુ પણ ચર્ચાનો વિષય છે. આ વિભાગ સુગંધિત નાઈટ્રેશનની પદ્ધતિ પર ધ્યાન કેન્દ્રિત કરશે, જેણે ખૂબ જ રસ આકર્ષ્યો છે. ઉપર સૂચિબદ્ધ અન્ય ઇલેક્ટ્રોફિલિક ઉમેરણ-નાબૂદી પ્રતિક્રિયાઓ પછી ધ્યાનમાં લેવામાં આવશે.
1960 પહેલા પ્રકાશિત થયેલા તમામ ગતિ, સ્પેક્ટ્રોસ્કોપિક અને ક્રાયોસ્કોપિક કાર્યના પરિણામો એ મતને સમર્થન આપે છે કે નાઈટ્રોનિયમ આયન એરેન્સની નાઈટ્રેશન પ્રતિક્રિયાઓમાં અસરકારક ઈલેક્ટ્રોફાઈલ છે. સ્પેક્ટ્રોસ્કોપિક અને ક્રાયોસ્કોપિક પદ્ધતિઓનો ઉપયોગ કરીને, નિર્જળ નાઈટ્રિક એસિડમાં નાઈટ્રોનિયમ આયનની ઓછી સાંદ્રતા મળી આવી હતી. તે પણ વિશ્વસનીય રીતે સ્થાપિત કરવામાં આવ્યું છે કે સલ્ફ્યુરિક એસિડની મોટી માત્રાની હાજરીમાં, નાઈટ્રિક એસિડ સંપૂર્ણપણે નાઈટ્રોનિયમ બાયસલ્ફેટમાં રૂપાંતરિત થાય છે. જો કે, સુગંધિત સંયોજનોનું નાઈટ્રેશન, બેન્ઝીન જેવી પ્રતિક્રિયાશીલતામાં, પાણીની એટલી માત્રાની હાજરીમાં થાય છે કે નાઈટ્રોનિયમ આયનો શોધી શકાતા નથી. તે જ સમયે, નાઈટ્રેશનમાં નાઈટ્રોનિયમ આયનોની ભાગીદારી પણ મધ્યમ અને નાઈટ્રિક એસિડ વચ્ચેના વિનિમય દર 180 સાથે નાઈટ્રેશનના દરની તુલના કરીને સખત રીતે દર્શાવવામાં આવે છે. પાણીની હાજરીમાં કેટલાક પ્રતિક્રિયાશીલ સબસ્ટ્રેટની નાઈટ્રેશન પ્રતિક્રિયાઓ શૂન્ય ગતિ ક્રમ ધરાવે છે. આ સૂચવે છે કે નાઈટ્રેટિંગ એજન્ટ ધીમા (મર્યાદિત) તબક્કામાં નાઈટ્રિક એસિડમાંથી રચાય છે, જે સુગંધિત રિંગ દ્વારા ઇલેક્ટ્રોફાઈલના હુમલા પહેલા છે. સુગંધિત સબસ્ટ્રેટની ગેરહાજરીમાં, પાણી અને નાઈટ્રિક એસિડ વચ્ચે વિનિમય દર 180 શૂન્ય ક્રમમાં છે, જેમ કે નાઈટ્રેશનમાં. આ પરિણામો નીચેના રેખાકૃતિ (સમીકરણ 28) દ્વારા શ્રેષ્ઠ રીતે સમજાવવામાં આવ્યા છે:
પરક્લોરેટ, ટેટ્રાફ્લોરોબોરેટ અને હેક્સાફ્લોરોફોસ્ફેટ એનિઓન ધરાવતા નાઈટ્રોનિયમ ક્ષારોનું અલગતા અને હકીકત એ છે કે આ ક્ષાર અસરકારક નાઈટ્રેટિંગ એજન્ટ છે, તે પણ અગાઉ દોરેલા નિષ્કર્ષને સમર્થન આપે છે.
નાઈટ્રેશનનો ઉપયોગ મોટી સંખ્યામાં સુગંધિત સંયોજનોની સંબંધિત પ્રતિક્રિયા સ્થાપિત કરવા માટે કરવામાં આવ્યો છે. આંકડાકીય સુધારાઓ સાથે અને અને-સ્થિતિ પર અવેજીના સંબંધિત દરો, કહેવાતા આંશિક દર પરિબળો, મોટી સંખ્યામાં મોનોસબસ્ટિટ્યુટેડ બેન્ઝીન માટે ગણતરી કરવામાં આવી છે. સમાન પ્રાયોગિક પરિસ્થિતિઓ હેઠળ પ્રતિક્રિયા ઉત્પાદનની આઇસોમેરિક રચના નક્કી કરીને ગતિશીલ ડેટાનો ઉપયોગ કરીને અથવા સ્પર્ધાત્મક પ્રતિક્રિયાઓની પદ્ધતિ દ્વારા સંબંધિત દરોના આધારે ગણતરીઓ હાથ ધરવામાં આવી હતી. નાઈટ્રોમેથેન, એસેટોનાઈટ્રાઈલ, એસિટિક એનહાઈડ્રાઈડ અથવા એસિડિક સોલવન્ટ્સમાં નાઈટ્રિક એસિડ સાથે બેન્ઝીન અને ટોલ્યુઈનના સમકક્ષ મિશ્રણના નાઈટ્રેશન દ્વારા ખૂબ સમાન પરિણામો પ્રાપ્ત થયા હતા. આ પરિણામો પણ નાઈટ્રોનિયમ કેશનને સંડોવતા મિકેનિઝમની સાર્વત્રિક પ્રકૃતિની પુષ્ટિ કરે છે. કોષ્ટકમાં 2.5.2 લાક્ષણિક ઉદાહરણો બતાવે છે. તે સ્પષ્ટ છે કે પૂર્વ-તૈયાર નાઇટ્રોનિયમ ક્ષાર સાથેની પ્રતિક્રિયાઓમાં આઇસોમરનું વિતરણ અગાઉ પ્રાપ્ત પરિણામોની નજીક હોવા છતાં, ક્ષાર સાથેની પ્રતિક્રિયાઓમાં સંબંધિત દરો એકબીજાની ખૂબ નજીક છે અને તેથી, આંશિક દર પરિબળ, ઉદાહરણ તરીકે મેટા માટે. -પોઝીશન એટેક, વ્યક્તિગત બેન્ઝીન પોઝિશન કરતાં દેખીતી રીતે નાનો છે.
કોષ્ટક 2.5.2. કેટલાક લાક્ષણિક અણુઓના નાઈટ્રેશનમાં ઓરિએન્ટેશન, સંબંધિત પ્રતિક્રિયા અને આંશિક દર પરિબળો

નીચે એસિટિક એસિડમાં બેન્ઝીનની સરખામણીમાં ટોલ્યુએનના નાઈટ્રેશનના ઉદાહરણનો ઉપયોગ કરીને ગણતરીની પદ્ધતિ છે. યાદ કરો કે બેન્ઝીન છ સમકક્ષ સ્થાન ધરાવે છે, અને ટોલ્યુએનમાં એક પેરા પોઝિશન અને બે ઓર્થો અને મેટા પોઝિશન છે:

પૂર્વ-તૈયાર નાઈટ્રોનિયમ ક્ષાર (કોષ્ટક 2.5.2 જુઓ) નો ઉપયોગ કરીને ટોલ્યુએન સાથે બેન્ઝીનના મિશ્રણના નાઈટ્રેશનનો અભ્યાસ અને એમ-ઝાયલીન અને મેસિટીલીન સાથેના સમાન પ્રયોગો, જેની બેન્ઝીનની તુલનામાં સંબંધિત પ્રતિક્રિયાત્મકતા અનુક્રમે 1.7 અને 2.7 હોવાનું બહાર આવ્યું છે. , અસ્પષ્ટ પ્રશ્નોની સંખ્યામાં વધારો થયો છે. મેટા પોઝિશન માટે આંશિક ગતિ પરિબળની ગણતરી કરતી વખતે પ્રાપ્ત થયેલા અગમ્ય પરિણામો વિશે તે પહેલેથી જ ઉપર ઉલ્લેખિત છે. વધુમાં, તે નોંધવામાં આવ્યું હતું કે જે કિસ્સામાં પ્રતિક્રિયા થવાનો સમય હોય છે તે પહેલાં રિએક્ટન્ટ્સ પૂરતા પ્રમાણમાં એકરૂપ મિશ્રણ બનાવે છે, સ્પર્ધાત્મક વિસ્થાપન પ્રયોગોમાંથી પ્રતિક્રિયાત્મકતા નક્કી કરવાના પરિણામો ભૂલભરેલા હોઈ શકે છે.
દેખીતી રીતે, ગતિ પદ્ધતિઓનો ઉપયોગ કરીને નાઈટ્રોનિયમ ક્ષાર સાથે નાઈટ્રેશનના દર સ્થિરાંકો નક્કી કરતી વખતે આ વિસંગત પ્રતિક્રિયાની પુષ્ટિ થતી નથી. જો કે, વિભિન્ન સાંદ્રતા પર પ્રતિક્રિયા હાથ ધરીને રિએક્ટન્ટ્સનું પૂરતું મિશ્રણ સુનિશ્ચિત કરવાના પ્રયાસો કરવામાં આવ્યા છે. આ પરિણામો એ ધારણા તરફ દોરી ગયા કે નાઈટ્રોનિયમ ક્ષાર સાથેના નાઈટ્રેશનના દર સહિત, ઈલેક્ટ્રોફાઈલ્સ સાથેના એરેન્સની સંખ્યાબંધ પ્રતિક્રિયાઓનો દર એરેન્સની મૂળભૂતતાને બદલે -મૂળભૂતતા સાથે સંબંધિત છે. બીજા શબ્દોમાં કહીએ તો, β-જટિલની રચના એ મર્યાદિત તબક્કો છે. જો કે, ઉપલબ્ધ આઇસોમર વિતરણ ડેટા દ્વારા બતાવ્યા પ્રમાણે, ઇલેક્ટ્રોફાઇલનું સ્થાન -basicity દ્વારા નિયંત્રિત થાય છે. સુગંધિત નાઈટ્રેશનના આ દૃશ્યની ફરીથી વિગતવાર શોધ કરવામાં આવી. તે નોંધવામાં આવ્યું હતું કે નાઈટ્રોનિયમ ક્ષાર સાથે નાઈટ્રેશન ઉત્પાદનોના ગુણોત્તર અને પ્રોટોનેટેડ મિથાઈલબેન્ઝીન્સની સંબંધિત સ્થિરતા વચ્ચેનો સહસંબંધ દેખીતી રીતે -કોમ્પ્લેક્સની સ્થિરતા સાથેના સહસંબંધ કરતાં વધુ ખરાબ નથી. સલ્ફોલેનમાં એસિડના મિશ્રણ સાથે પોલિમિથાઈલબેન્ઝીન્સના સ્પર્ધાત્મક નાઈટ્રેશનના ઉત્પાદનોનો ગુણોત્તર પણ -કોમ્પ્લેક્સની સ્થિરતા સાથે નબળો સંબંધ ધરાવે છે.
રીએજન્ટના મિશ્રણ દરમિયાન પ્રતિક્રિયાની ડિગ્રી સાથે સંબંધિત મુદ્દાનો અભ્યાસ બાયબેન્ઝિલના નાઈટ્રેશનના ઉદાહરણનો ઉપયોગ કરીને કરવામાં આવ્યો હતો, જેમાં દરેક રિંગ ટોલ્યુએનની પ્રતિક્રિયામાં સમાન હોય છે, અને વધુમાં, રિંગ્સ વચ્ચેના અવેજીના પ્રભાવનું સ્થાનાંતરણ. ન્યૂનતમ છે. જ્યારે બાયબેન્ઝિલ અને નાઈટ્રોનિયમ મીઠાની સમાન સાંદ્રતાનો ઉપયોગ કરવામાં આવે અને પ્રતિક્રિયા શરૂ થાય તે પહેલાં રીએજન્ટ સંપૂર્ણપણે મિશ્ર થઈ જાય, ત્યારે મોનોનિટ્રોબિબેન્ઝિલ (50%) અને ડિનિટ્રોબિબેન્ઝિલની રચના થવી જોઈએ. બીજી બાજુ, જો પ્રતિક્રિયા પહેલાં રિએક્ટન્ટ્સ સંપૂર્ણપણે મિશ્રિત ન હોય, તો બિનપ્રક્રિયા ન કરાયેલ સબસ્ટ્રેટ અને ડિનિટ્રોબિબેન્ઝિલનું પ્રમાણ વધવું જોઈએ અને મોનોનિટ્રોબિબેન્ઝિલનું પ્રમાણ ઘટવું જોઈએ. જો કે, આ વિચાર ખૂબ સરળ છે, જે એસિટિક એનહાઇડ્રાઇડમાં નાઈટ્રિક એસિડ સાથે બાયબેન્ઝિલના નાઈટ્રેશનના પરિણામો પરથી સ્પષ્ટપણે અનુસરે છે. આ સિસ્ટમ માટે મિશ્રણની સંપૂર્ણતા મહત્વપૂર્ણ નથી, પરંતુ ડિનિટ્રોબિબિસિલની માત્રા અપેક્ષિત કરતાં માત્ર 55% છે. જ્યારે વિવિધ સાંદ્રતા અને મિશ્રણની પરિસ્થિતિઓનો ઉપયોગ કરીને નાઈટ્રોનિયમ ટેટ્રાફ્લોરોબોરેટ સાથે સલ્ફોલેનમાં બાયબેન્ઝિલનું નાઈટ્રેશન કરવામાં આવે છે, ત્યારે અવ્યવસ્થિત ઉત્પાદનની માત્રા ઉપરોક્ત ગણતરીમાંથી મેળવેલા કરતાં હંમેશા નોંધપાત્ર રીતે વધારે હતી. આમ, નાઈટ્રોનિયમ ક્ષાર સાથે નાઈટ્રેશન દરમિયાન સુગંધિત સંયોજનોની સાપેક્ષ પ્રતિક્રિયા નક્કી કરવા માટે સ્પર્ધાત્મક પ્રતિક્રિયાઓની સરળ પદ્ધતિ યોગ્ય નથી. દેખીતી રીતે, મુખ્ય પ્રભાવ મિશ્રણ ઝડપ છે.
એરેન્સના નાઈટ્રેશનના ગતિશાસ્ત્રનો અભ્યાસ કરતી વખતે પણ રસપ્રદ પરિણામો પ્રાપ્ત થયા હતા, જેની પ્રતિક્રિયાત્મકતા બેન્ઝીન અને ટોલ્યુએન કરતા વધારે છે.
કોઈ એવી અપેક્ષા રાખે છે કે -xylene, -xylene અને mesitylene ની પ્રતિક્રિયાશીલતા બેન્ઝીન (આજુબાજુના પરિબળો અને ) કરતા નોંધપાત્ર રીતે વધારે છે, જો કે, જ્યારે જલીય સલ્ફ્યુરિક એસિડ (68.3%) માં નાઈટ્રેશનના પરિણામોને ધ્યાનમાં લેતા તે તારણ આપે છે કે આ પરિબળ છે. 40 ના મૂલ્ય સુધી મર્યાદિત એવું માનવામાં આવે છે કે આ પ્રતિક્રિયાઓમાં મર્યાદિત પગલું એ નાઈટ્રોનિયમ આયન અને સુગંધિત સબસ્ટ્રેટ વચ્ચે અથડામણની જોડીની રચના છે. આ ધારણા અને દર-મર્યાદિત રચના - જટિલ ની ધારણા વચ્ચે શું તફાવત છે? તે અગાઉ નોંધ્યું હતું કે ઉત્પાદનોનો ગુણોત્તર β-સંકુલોની સ્થિરતા સાથે સારી રીતે સંબંધિત નથી. આ હકીકતોને "અથડામણની જોડી" ની અંદર આકર્ષક ક્રિયાપ્રતિક્રિયાઓનો આશરો લીધા વિના સમજાવી શકાય છે. ઘટકોમાં "અથડામણની જોડી" ના વિયોજન માટે ઊર્જા અવરોધ એસિડિક વાતાવરણમાં વધુ હોઈ શકે છે; આ ઊર્જા જટિલની પસંદગી માટે પૂરતી છે. ગતિ માહિતી અથડામણના પ્રસાર સિદ્ધાંત સાથે સુસંગત હોવાથી, "અથડામણ જોડી" શબ્દને પ્રાધાન્ય આપવું જોઈએ. ઉપરોક્ત તમામ ડેટાની ચર્ચા એ નિષ્કર્ષ તરફ દોરી જાય છે કે સમીકરણો (28) ની યોજના સમીકરણ (29) માં બતાવ્યા પ્રમાણે સંશોધિત થવી જોઈએ, જ્યાં તે માત્ર અસાધારણ સંજોગોમાં જ ઝડપ નક્કી કરે છે. ઓર્થો-, મેટા- અથવા પેરા-પોઝિશન પર વિવિધ હુમલા દર સ્થિરાંકો સૂચવે છે કે આઇસોમરનું વિતરણ મર્યાદિત તબક્કા પર આધારિત નથી, કારણ કે "અથડામણની જોડી" માં સમગ્ર એરેન પરમાણુનો સમાવેશ થાય છે, અને તેના વ્યક્તિગત અણુઓનો સમાવેશ થતો નથી.

ફિગમાં બતાવ્યા પ્રમાણે, નાઈટ્રેશનની ચર્ચાને ઊર્જા રૂપરેખાઓના સંદર્ભમાં સરળતાથી સારાંશ આપી શકાય છે. 2.5.1. પ્રાયોગિક પરિણામો દર્શાવે છે કે બેન્ઝીન અને ટોલ્યુએનના નાઈટ્રેશનના કિસ્સામાં, દર-નિર્ધારણનો તબક્કો એ જટિલ (અનુક્રમે ફિગ. a અને b) ની રચના છે અને "અથડામણ જોડી" ની રચના નાઈટ્રેશનનો દર નક્કી કરે છે. સ્યુડોક્યુમીન (-ટ્રાઇમેથાઇલબેન્ઝીન) (ફિગ. c).
આઇસોમરનું વિતરણ, જે ટોલ્યુએનના નાઈટ્રેશન દરમિયાન શોધાયું હતું (કોષ્ટક 2.5.2 જુઓ.), તાપમાનના સામાન્ય પ્રભાવને બાદ કરતાં, મૂળભૂત રીતે પ્રતિક્રિયાની પરિસ્થિતિઓથી સ્વતંત્ર છે. જો કે, કેટલાક પોલિમિથાઈલબેન્ઝીન્સના અભ્યાસમાંથી મેળવેલા અસામાન્ય પરિણામો નાઈટ્રેશન પ્રતિક્રિયાની સમજને જટિલ બનાવે છે. આમ, એસિટિક એનહાઇડ્રાઇડમાં નાઇટ્રિક એસિડ સાથે નાઇટ્રેશન એસિટોક્સિલેશન ઉત્પાદનો તરફ દોરી જાય છે. આ વસ્તુઓને મિશ્રિત કરે છે, જે સૂચવે છે કે ઇલેક્ટ્રોફિલિક એસિટોક્સિલેશન થઈ રહ્યું છે. હાલમાં આ કેસ હોવાનું જાણવા મળ્યું નથી.


ચોખા. 2.5.1. બેન્ઝીન (a) અને ટોલ્યુએન (b) ની નાઈટ્રેશન પ્રતિક્રિયાઓ અને 5- અને : a, b- ની રચના પ્રતિક્રિયા માટે ઊર્જા પ્રોફાઇલ્સ એ - જટિલ ની રચના છે; c - મર્યાદિત તબક્કો એ અથડામણની જોડીની રચના છે.
જોકે નાઈટ્રિક એસિડ મુખ્યત્વે એસિટિલ નાઈટ્રેટના રૂપમાં હાજર છે, તેમ છતાં ઈલેક્ટ્રોફાઈલની સાચી પ્રકૃતિ અંગે હજુ પણ કેટલીક શંકા છે. આમ, એસિટિક એનહાઇડ્રાઇડમાં નાઈટ્રિક એસિડ -xylene સાથે પ્રતિક્રિયા કરીને -dimethylnitrobenzene અને -dimethylphenylacetateનું મિશ્રણ બનાવે છે. એડક્ટ્સનું અલગતા જેમાં એસિટિલ નાઈટ્રેટને અવેજી સ્થિતિમાં ઉમેરવામાં આવે છે (ipso-એટેક), અને હકીકત એ છે કે આ એડક્ટ્સ દેખીતી રીતે એસિટેટ (57) બનાવવા માટે ઇન્ટ્રામોલેક્યુલર મિકેનિઝમ દ્વારા વિઘટિત થાય છે, સમીકરણ રેખાકૃતિમાં બતાવેલ પદ્ધતિની તરફેણમાં દલીલ કરે છે. (30):

સમાન વ્યસનીઓ (58)-(64) અન્ય એરેન્સ સાથેની પ્રતિક્રિયાઓમાં અલગ પાડવામાં આવ્યા હતા, અને કેટલાક વ્યસનીઓ મધ્યવર્તી તરીકે જોવા મળ્યા હતા. નીચા તાપમાને n-tert-butyltoluene સાથે એસિટિક એનહાઇડ્રાઇડમાં નાઈટ્રિક એસિડની પ્રતિક્રિયા કરીને, ત્રણ એડક્ટ્સ મેળવવામાં આવ્યા હતા અને તેને અલગ કરવામાં આવ્યા હતા. મુખ્ય ઉત્પાદન α-એડક્ટ (64) છે, જે સ્થિતિ 4 (ipso થી tert-Vi) પર સ્ટેરિક અવરોધને કારણે અન્ય બે આઇસોમર કરતાં વધુ માત્રામાં રચાયેલું જણાય છે. અન્ય ન્યુક્લિયોફાઈલ્સ, જેમ કે નાઈટ્રેટ આયન અને પાણી, પણ ipso-અવેજી α-જટિલને ઉમેરી શકે છે. Ipso-અવેજી β-જટિલ એસિડોલિસિસ દ્વારા પુનર્જીવિત થઈ શકે છે.

સલ્ફ્યુરિક એસિડમાં ઓ-ઝાયલીનનું નાઈટ્રેશન -ડાઈમેથાઈલનાઈટ્રોબેન્ઝીન અને -ડાઈમેથાઈલનીટ્રોબેન્ઝીન આપે છે, જેની ઉપજ સિસ્ટમની એસિડિટી પર આધારિત છે. ઓછી એસિડિટી પર, નાઇટ્રોડિમિથાઈલફેનોલ્સ પણ મેળવવામાં આવે છે. એસ્ટર્સ (58) અને (59) નું એસિડોલિસિસ - ડાયમેથાઈલનાઈટ્રોબેન્ઝીન ઉત્પન્ન કરે છે, જેની ઉપજ વધતી એસિડિટી સાથે વધે છે; આ એ સૂચનને સમર્થન આપે છે કે ઓર્થો પોઝિશનના અલ્કિલ જૂથને નાઈટ્રેશનમાં ઘણીવાર પ્રારંભિક ipso હુમલાનો સમાવેશ થાય છે. હકીકત એ છે કે એસિડોલીસીસ (58) અને (59) -ડાઈમેથાઈલનીટ્રોબેન્ઝીન ઉત્પન્ન કરતું નથી તેનો અર્થ એ છે કે મૂળ ipso-અવેજી ઓ-કોમ્પ્લેક્સ "અથડામણ જોડી" માં પાછું રૂપાંતરિત થતું નથી અને નાઈટ્રો જૂથના α અથવા ક્રમિક β-શિફ્ટ થતા નથી. તેમાં. આ પરિણામોને સમીકરણોમાં સારાંશ આપવામાં આવ્યા છે (31). સલ્ફ્યુરિક એસિડમાં -ટ્રાઇમેથાઈલબેન્ઝીન ના નાઈટ્રેશન દરમિયાન ઉપજમાં વધારો અને માધ્યમની વધતી એસિડિટી સાથે અનુક્રમે નાઈટ્રો જૂથના સ્થાનાંતરણને અનુક્રમે થી અને ત્યાં સુધી આભારી છે.

હાલમાં, બિનસલાહભર્યા સ્થાન દ્વારા અનુક્રમિક ઇન્ટ્રામોલેક્યુલર -શિફ્ટનું એક પણ વિશ્વસનીય ઉદાહરણ જાણીતું નથી. જો કે, એક ipso-સ્થિતિમાંથી બીજી ipso-સ્થિતિ દ્વારા ક્રમિક -પાળીઓ જાણીતી છે. ઉદાહરણ તરીકે, (65) નું એસિડોલિસિસ સ્ટ્રક્ચરલ આઇસોમર્સ (66) અને (67) ઉત્પન્ન કરે છે, જેમ કે સમીકરણ (32) માં બતાવ્યા પ્રમાણે.

અગાઉ, ipso અવેજી નાબૂદીનો ઉલ્લેખ કરવામાં આવ્યો હતો, ઉદાહરણ તરીકે પ્રોટોડેસિલેશન અને પ્રોટોડેસલ્ફ્યુરાઇઝેશનના કિસ્સામાં (જુઓ પૃષ્ઠ 330,331). આ દૃષ્ટિકોણથી, અમે ફક્ત નાઇટ્રો જૂથ સાથે ipso અવેજીને બદલવાની ચર્ચા કરીશું. આ પ્રકારની ઘણી પ્રતિક્રિયાઓ લાંબા સમયથી જાણીતી છે, પરંતુ તેમની પદ્ધતિ, એક નિયમ તરીકે, સ્પષ્ટ નથી. આવી પ્રતિક્રિયાઓમાં ડીલકીલેશન, ડીસીલેશન, ડીસીલીલેશન, ડીસલ્ફોનેશન, ડીકાર્બોક્સિલેશન, ડીડિયાઝોટેશન અને ડીહેલોજનેશનનો સમાવેશ થાય છે. ઇલેક્ટ્રોફિલિક હુમલા તરફ અત્યંત સક્રિય એવા સબસ્ટ્રેટને સમાવિષ્ટ કરતી પ્રતિક્રિયાઓમાં પ્રારંભિક નાઇટ્રોસેશન અને ત્યારબાદ ઓક્સિડેશનનો સમાવેશ થઈ શકે છે.








