Radioaktyvumo reiškinį 1896 metais atrado A. Becquerelis, stebėjęs spontanišką nežinomos radiacijos iš urano druskų sklidimą. Netrukus E. Rutherfordas ir Kiuri nustatė, kad radioaktyvaus skilimo metu išsiskiria He branduoliai (α-dalelės), elektronai (β-dalelės) ir kieta elektromagnetinė spinduliuotė (γ-spinduliai).
1934 m. buvo atrastas skilimas su pozitronų emisija (β + -skilimas), o 1940 m. buvo atrastas naujas radioaktyvumo tipas - savaiminis branduolių dalijimasis: daliantis branduolys subyra į du panašios masės fragmentus, tuo pačiu metu vykstant emisijai. neutronų ir γ - kvantai. Branduolių protonų radioaktyvumas buvo pastebėtas 1982 m. Taigi, yra šie radioaktyvaus skilimo tipai: α-skilimas; - irimas; - irimas; e – užfiksuoti.
Radioaktyvumas- kai kurių atomų branduolių gebėjimas spontaniškai (spontaniškai) transformuotis į kitus branduolius, išskiriant daleles.
Atomo branduoliai sudaryti iš protonai ir neutronai, kurie turi bendrinį pavadinimą - nukleonai. Protonų skaičius branduolyje lemia atomo chemines savybes ir yra paskirtas Z(prekės serijos numeris). Nukleonų skaičius branduolyje vadinamas masės skaičius ir žymėti A. Branduoliai su tuo pačiu serijos numeriu ir vadinami skirtingi masės skaičiai izotopų. Visi vieno cheminio elemento izotopai turi tas pačias chemines savybes, tačiau fizinės savybės gali labai skirtis. Izotopams žymėti naudokite cheminio elemento simbolį su dviem indeksais: A Z X. Apatinis indeksas yra serijos numeris, viršutinis indeksas yra masės numeris. Dažnai apatinis indeksas praleidžiamas, nes jį nurodo pats elemento simbolis.
Pavyzdžiui, jie rašo 14 C, o ne 14 6 C.
Branduolio gebėjimas irti priklauso nuo jo sudėties. Tas pats elementas gali turėti ir stabilių, ir radioaktyvių izotopų.
Pavyzdžiui, anglies izotopas 12 C yra stabilus, bet izotopas 14 C yra radioaktyvus.
Radioaktyvusis skilimas yra statistinis reiškinys. Izotopo gebėjimas skilti apibūdinamas skilimo konstanta λ.
Skilimo konstanta λ yra tikimybė, kad tam tikro izotopo branduolys suirs per laiko vienetą.
Pažymime radioaktyvaus skilimo branduolių skaičių N momentu t, dN 1 - branduolių, suyrančių per laiką dt, skaičių. Kadangi branduolių skaičius materijoje yra didžiulis, didelių skaičių dėsnis yra įvykdytas. Branduolinio skilimo tikimybė per trumpą laiką dt randama pagal formulę dP = λdt. Dažnis lygus tikimybei: d N 1 / N = dP = λdt. d N 1 / N = λdt- formulė, nustatanti suirusių branduolių skaičių.
Lygties sprendimas yra toks: , - formulė vadinama radioaktyvaus skilimo dėsniu: Radioaktyviųjų branduolių skaičius laikui bėgant mažėja pagal eksponentinį dėsnį.
Čia N yra nesuirusių branduolių skaičius momentu t; N o - pradinis nesuirusių branduolių skaičius; λ yra radioaktyvaus skilimo konstanta.
Praktikoje nenaudojama skilimo konstanta λ , ir vadinamas kiekis pusinės eliminacijos laikas T.
Pusinės eliminacijos laikas (T) – laikas, per kurį suyra pusė radioaktyviųjų branduolių.
Radioaktyvaus skilimo per laikotarpį dėsnis pusinės eliminacijos laikas (T) turi tokią formą:
![]()
Ryšys tarp pusėjimo trukmės ir skilimo konstantos pateikiamas pagal formulę: T = ln(2/λ) = 0,69/λ
Pusinės eliminacijos laikas gali būti labai ilgas arba labai trumpas.
Radioaktyvaus izotopo aktyvumo laipsniui įvertinti naudojamas dydis, vadinamas aktyvumu.
Radioaktyvaus vaisto, suyrančio per laiko vienetą, branduolių aktyvumo skaičius: A = dN skilimas /dt
SI aktyvumo vienetas yra 1 bekerelis (Bq) = 1 suirimas/s – vaisto aktyvumas, kuriame 1 suirimas vyksta per 1 s. Didesnis aktyvumo vienetas yra 1 reterfordas (Rd) = Bq. Dažnai naudojamas nesisteminis aktyvumo vienetas – kiuris (Ci), lygus 1 g radžio aktyvumui: 1 Ci = 3,7 Bq.
Laikui bėgant aktyvumas mažėja pagal tą patį eksponentinį dėsnį, pagal kurį ir pats radionuklidas:
![]() =
.
=
.
Praktiškai veiklai apskaičiuoti naudojama formulė:
A = = λN = 0,693 N/T.
Jei atomų skaičių išreiškiame per masę ir masę, tada aktyvumo skaičiavimo formulė bus tokia: A = = 0,693 (μT)
kur yra Avogadro numeris; μ – molinė masė.
Branduolių radioaktyvaus skilimo dėsniai
Branduolių gebėjimas spontaniškai irti, išskiriant daleles, vadinamas radioaktyvumu. Radioaktyvusis skilimas yra statistinis procesas. Kiekvienas radioaktyvus branduolys gali suirti bet kuriuo momentu, o modelis stebimas tik vidutiniškai, esant pakankamai dideliam branduolių skaičiui.
Skilimo konstantaλ – branduolio skilimo per laiko vienetą tikimybė.
Jei mėginyje momentu t yra N radioaktyviųjų branduolių, tai per laiką dt suirusių branduolių dN skaičius yra proporcingas N.
dN = -λNdt. (13.1)
Integruodami (1) gauname radioaktyvaus skilimo dėsnį
N(t) = N 0 e -λt . (13.2)
N 0 yra radioaktyviųjų branduolių skaičius momentu t = 0.
Vidutinis gyvenimo laikas τ –
. (13.3)
Pusė gyvenimas T 1/2 – laikas, per kurį pradinis radioaktyviųjų branduolių skaičius sumažės per pusę
T 1/2 = ln2/λ=0,693/λ = τln2. (13.4)
Veikla A – vidutinis per laiko vienetą suyrančių branduolių skaičius
A(t) = λN(t). (13.5)
Aktyvumas matuojamas kiuriais (Ci) ir bekereliais (Bq)
1 Ki = 3,7*10 10 skilimų/s, 1 Bq = 1 skilimas/s.
Pradinio branduolio 1 skilimas į 2 branduolį, po kurio skilimas į 3 branduolį, apibūdinamas diferencialinių lygčių sistema
 (13.6)
(13.6)
kur N 1 (t) ir N 2 (t) yra branduolių skaičius, o λ 1 ir λ 2 yra atitinkamai 1 ir 2 branduolių skilimo konstantos. Sistemos (6) sprendimas su pradinėmis sąlygomis N 1 (0) = N 10 ; N 2 (0) = 0 bus
![]() , (13.7a)
, (13.7a)
![]() . (13.7b)
. (13.7b)

| 13 pav. 1 |
2 branduolių skaičius pasiekia maksimalią vertę
Jei λ 2< λ 1 (), суммарная активностьN 1 (t)λ 1 + N 2 (t)λ 2 будет монотонно уменьшаться.
Jei λ 2 > λ 1 ()), bendras aktyvumas iš pradžių padidėja dėl 2 branduolių kaupimosi.
Jei λ 2 >> λ 1 , pakankamai ilgai antrojo eksponento indėlis į (7b) tampa nereikšmingas, palyginti su pirmojo indėliu ir antrojo aktyvumu A 2 = λ 2 N 2 ir pirmųjų izotopų A 1 = λ 1 N 1 yra beveik lygūs . Ateityje tiek pirmojo, tiek antrojo izotopų veikla laikui bėgant keisis vienodai.
A 1 (t) = N 10 λ 1 = N 1 (t) λ 1 = A 2 (t) = N 2 (t) λ 2 .(13.8)
Tai yra, vadinamasis amžiaus pusiausvyra, kuriame izotopų branduolių skaičius skilimo grandinėje yra susietas su skilimo konstantomis (pusėjimo trukmės) paprastu ryšiu.
 . (13.9)
. (13.9)
Todėl natūralioje būsenoje visi izotopai, genetiškai susiję su radioaktyviosiomis serijomis, paprastai randami tam tikrais kiekybiniais santykiais, priklausomai nuo jų pusėjimo trukmės.
Bendruoju atveju, kai yra skilimų grandinė 1→2→...n, procesas aprašomas diferencialinių lygčių sistema
dN i /dt = -λ i N i +λ i-1 N i-1.(13.10)
Sistemos (10) sprendimas veikloms su pradinėmis sąlygomis N 1 (0) = N 10 ; N i (0) = 0 bus
![]() (13.12)
(13.12)
Pirminis dydis reiškia, kad sandaugoje, kuri yra vardiklyje, koeficientas, kurio i = m, yra praleistas.
Izotopai
IZOTOPAI– to paties cheminio elemento atmainos, kurios yra panašios savo fizikinėmis ir cheminėmis savybėmis, bet turi skirtingą atominę masę. Pavadinimą „izotopai“ 1912 m. pasiūlė anglų radiochemikas Frederickas Soddy, sudaręs jį iš dviejų graikiškų žodžių: isos – identiška ir topos – vieta. Mendelejevo periodinės elementų lentelės langelyje izotopai užima tą pačią vietą.
Bet kurio cheminio elemento atomą sudaro teigiamai įkrautas branduolys ir jį supantis neigiamai įkrautų elektronų debesis ( cm.Taip pat ATOMO BRANDUOLIS). Cheminio elemento vietą Mendelejevo periodinėje lentelėje (jo atominis skaičius) lemia jo atomų branduolio krūvis. Todėl izotopai vadinami to paties cheminio elemento atmainomis, kurių atomai turi tą patį branduolinį krūvį (taigi ir praktiškai tuos pačius elektronų apvalkalus), tačiau skiriasi branduolinės masės reikšmėmis. Pagal vaizdingą F. Soddy išsireiškimą, izotopų atomai yra vienodi „išorėje“, bet skirtingi „viduje“.
Neutronas buvo atrastas 1932 m – dalelė, neturinti krūvio, kurios masė artima vandenilio atomo branduolio masei – protonas , ir buvo sukurtas branduolio protonų-neutronų modelis. Dėl to mokslas nustatė galutinį šiuolaikinį izotopų sąvokos apibrėžimą: izotopai yra medžiagos, kurių atominiai branduoliai susideda iš vienodo protonų skaičiaus ir skiriasi tik neutronų skaičiumi. branduolys . Kiekvienas izotopas paprastai žymimas simbolių rinkiniu, kur X – cheminio elemento simbolis, Z – atomo branduolio krūvis (protonų skaičius), A – izotopo masės skaičius (bendras nukleonų skaičius). - protonai ir neutronai branduolyje, A = Z + N). Kadangi atrodo, kad branduolio krūvis yra vienareikšmiškai susietas su cheminio elemento simboliu, santrumpai dažnai naudojamas tiesiog užrašas A X.
Iš visų mums žinomų izotopų tik vandenilio izotopai turi savo pavadinimus. Taigi, izotopai 2 H ir 3 H vadinami deuteriu ir tričiu ir atitinkamai žymimi D ir T (izotopas 1 H kartais vadinamas protiumi).
Gamtoje atsiranda kaip stabilūs izotopai , ir nestabilus – radioaktyvus, kurio atomų branduoliai spontaniškai virsta kitais branduoliais, išskiriant įvairias daleles (arba vadinamojo radioaktyvaus skilimo procesus). Šiuo metu žinoma apie 270 stabilių izotopų, o stabilūs izotopai randami tik elementuose, kurių atominis skaičius yra Z Ј 83. Nestabilių izotopų skaičius viršija 2000, didžioji dauguma jų buvo gauti dirbtinai dėl įvairių branduolinių reakcijų. Daugelio elementų radioaktyviųjų izotopų skaičius yra labai didelis ir gali viršyti dvi dešimtis. Stabilių izotopų skaičius yra žymiai mažesnis Kai kuriuos cheminius elementus sudaro tik vienas stabilus izotopas (berilis, fluoras, natris, aliuminis, fosforas, manganas, auksas ir daugybė kitų elementų). Daugiausia stabilių izotopų – 10 – rasta alavo, pavyzdžiui, geležyje jų yra 4, gyvsidabrio – 7.
Izotopų atradimas, istorinis fonas. 1808 m. anglų mokslininkas gamtininkas Johnas Daltonas pirmą kartą pristatė cheminio elemento apibrėžimą kaip medžiagą, susidedančią iš to paties tipo atomų. 1869 metais chemikas D.I. Mendelejevas atrado periodinį cheminių elementų dėsnį. Vienas iš sunkumų pagrįsti elemento, kaip tam tikrą vietą periodinės lentelės langelyje užimančios medžiagos, sampratą, buvo eksperimentiškai stebimi nesveikieji skaičiai elementų atominiai svoriai. 1866 metais anglų fizikas ir chemikas seras Williamas Crookesas iškėlė hipotezę, kad kiekvienas natūralus cheminis elementas yra tam tikras mišinys medžiagų, kurios savo savybėmis yra identiškos, tačiau turi skirtingą atominę masę, tačiau tuo metu tokios prielaidos dar nebuvo. eksperimentinis patvirtinimas ir todėl ilgai nepastebėtas.
Svarbus žingsnis izotopų atradimo link buvo radioaktyvumo fenomeno atradimas ir Ernsto Rutherfordo ir Fredericko Soddy suformuluota radioaktyvaus skilimo hipotezė: radioaktyvumas yra ne kas kita, kaip atomo skilimas į įkrautą dalelę ir kito elemento atomą. , savo cheminėmis savybėmis skiriasi nuo pradinės. Dėl to kilo idėja apie radioaktyvias serijas arba radioaktyvias šeimas , kurio pradžioje yra pirmasis pirminis elementas, kuris yra radioaktyvus, o pabaigoje - paskutinis stabilus elementas. Transformacijų grandinių analizė parodė, kad jų eigoje vienoje periodinės sistemos ląstelėje gali atsirasti tie patys radioaktyvieji elementai, besiskiriantys tik atominėmis masėmis. Tiesą sakant, tai reiškė izotopų sąvokos įvedimą.
Nepriklausomas patvirtinimas, kad egzistuoja stabilūs cheminių elementų izotopai, buvo gautas 1912–1920 m. J. J. Thomson ir Aston eksperimentuose su teigiamai įkrautų dalelių pluoštais (arba vadinamaisiais kanalų pluoštais). ) sklindantis iš išleidimo vamzdžio.
1919 m. Aston sukūrė prietaisą, vadinamą masės spektrografu (arba masės spektrometru). . Jonų šaltinis vis dar naudojo išlydžio vamzdį, tačiau Aston rado būdą, kaip nuoseklus dalelių pluošto nukreipimas elektriniuose ir magnetiniuose laukuose lėmė to paties krūvio ir masės santykio dalelių fokusavimą (neatsižvelgiant į jų greitį). tą patį tašką ekrane. Kartu su „Aston“ tais pačiais metais amerikiečių „Dempster“ sukūrė kiek kitokio dizaino masių spektrometrą. Daugelio tyrinėtojų pastangomis vėliau panaudojus ir patobulinus masės spektrometrus, iki 1935 m. buvo sudaryta beveik visa iki tol žinomų cheminių elementų izotopinių kompozicijų lentelė.
Izotopų atskyrimo metodai. Norint ištirti izotopų savybes ir ypač jų panaudojimą mokslo ir taikomiesiems tikslams, būtina jų gauti daugiau ar mažiau pastebimais kiekiais. Įprastiniuose masių spektrometruose pasiekiamas beveik visiškas izotopų atskyrimas, tačiau jų kiekis yra nereikšmingas. Todėl mokslininkų ir inžinierių pastangomis buvo siekiama ieškoti kitų galimų izotopų atskyrimo būdų. Pirmiausia buvo įsisavinti fizikiniai ir cheminiai atskyrimo metodai, pagrįsti tokių to paties elemento izotopų savybių skirtumais kaip garavimo greičiai, pusiausvyros konstantos, cheminių reakcijų greičiai ir kt. Veiksmingiausi iš jų buvo rektifikavimo ir izotopų mainų metodai, plačiai naudojami pramoninėje lengvųjų elementų izotopų gamyboje: vandenilio, ličio, boro, anglies, deguonies ir azoto.
Kitą metodų grupę sudaro vadinamieji molekuliniai kinetiniai metodai: dujų difuzija, terminė difuzija, masės difuzija (difuzija garų sraute), centrifugavimas. Dujų difuzijos metodai, pagrįsti skirtingais izotopinių komponentų difuzijos greičiais labai dispersinėse poringose terpėse, Antrojo pasaulinio karo metais buvo naudojami pramoninei urano izotopų atskyrimo gamybai JAV organizuoti, kaip vadinamojo Manheteno projekto dalis. atominė bomba. Norint gauti reikiamą urano kiekį, prisodrintą iki 90% lengvuoju izotopu 235 U, pagrindiniu „degiuoju“ atominės bombos komponentu, buvo pastatytos gamyklos, užimančios apie keturių tūkstančių hektarų plotą. Atominiam centrui su sodrinto urano gamybos gamyklomis sukurti buvo skirta daugiau nei 2 milijardai JAV dolerių. pastatytas SSRS. Pastaraisiais metais šis metodas užleido vietą efektyvesniam ir pigesniam centrifugavimo būdui. Šiuo metodu izotopų mišinio atskyrimo efektas pasiekiamas dėl skirtingo išcentrinių jėgų poveikio izotopų mišinio komponentams, užpildantiems centrifugos rotorių, kuris yra plonasienis cilindras, ribotas viršuje ir apačioje, besisukantis labai didelis greitis vakuuminėje kameroje. Šiuo metu tiek Rusijoje, tiek kitose išsivysčiusiose pasaulio šalyse šiuolaikinėse atskyrimo gamyklose naudojama šimtai tūkstančių kaskadomis sujungtų centrifugų, kurių kiekvieno rotorius per sekundę daro daugiau nei tūkstantį apsisukimų. Centrifugos naudojamos ne tik prisodrintam uranui, reikalingam atominių elektrinių branduoliniams reaktoriams maitinti, gaminti, bet ir maždaug trisdešimties cheminių elementų izotopams gaminti vidurinėje periodinės lentelės dalyje. Elektromagnetinio atskyrimo įrenginiai su galingais jonų šaltiniais pastaraisiais metais taip pat naudojami atskirti įvairius izotopus, plačiai paplito ir lazerinio atskyrimo metodai.
Izotopų taikymas.Įvairūs cheminių elementų izotopai plačiai naudojami moksliniuose tyrimuose, įvairiose pramonės ir žemės ūkio srityse, branduolinėje energetikoje, šiuolaikinėje biologijoje ir medicinoje, aplinkosaugoje ir kitose srityse. Atliekant mokslinius tyrimus (pavyzdžiui, atliekant cheminę analizę), paprastai reikalingi nedideli retų įvairių elementų izotopų kiekiai, skaičiuojami gramais ir net miligramais per metus. Tuo pačiu metu kai kurių izotopų, plačiai naudojamų branduolinėje energetikoje, medicinoje ir kitose pramonės šakose, jų gamybos poreikis gali siekti daugybę kilogramų ir net tonų. Taigi dėl sunkaus vandens D 2 O naudojimo branduoliniuose reaktoriuose jo pasaulinė gamyba praėjusio amžiaus 90-ųjų pradžioje buvo apie 5000 tonų per metus. Vandenilio izotopas deuteris, kuris yra sunkiojo vandens dalis, kurio koncentracija natūraliame vandenilio mišinyje yra tik 0,015%, kartu su tričiu, mokslininkų teigimu, ateityje taps pagrindiniu termobranduolinės energijos kuro komponentu. reaktoriai, veikiantys branduolių sintezės reakcijų pagrindu. Tokiu atveju vandenilio izotopų gamybos poreikis bus didžiulis.
Moksliniuose tyrimuose stabilūs ir radioaktyvūs izotopai plačiai naudojami kaip izotopiniai indikatoriai (žymės) tiriant įvairiausius gamtoje vykstančius procesus.
Žemės ūkyje izotopai („paženklinti“ atomai) naudojami, pavyzdžiui, fotosintezės procesams, trąšų virškinamumui tirti, augalų azoto, fosforo, kalio, mikroelementų ir kitų medžiagų panaudojimo efektyvumui nustatyti.
Izotopų technologijos plačiai naudojamos medicinoje. Taigi JAV, remiantis statistika, per dieną atliekama daugiau nei 36 tūkstančiai medicininių procedūrų ir apie 100 milijonų laboratorinių tyrimų naudojant izotopus. Dažniausios procedūros yra kompiuterinė tomografija. Anglies izotopas C13, praturtintas iki 99% (natūralus kiekis apie 1%), aktyviai naudojamas vadinamojoje "diagnostinėje kvėpavimo kontrolėje". Testo esmė labai paprasta. Praturtintas izotopas patenka į paciento maistą ir, dalyvaujant medžiagų apykaitos procesuose įvairiuose organizmo organuose, išskiriamas paciento iškvepiamo anglies dioksido CO 2 pavidalu, kuris surenkamas ir analizuojamas spektrometru. Procesų, susijusių su skirtingo anglies dioksido kiekio, pažymėto C 13 izotopu, išsiskyrimu, greičio skirtumai leidžia spręsti apie įvairių paciento organų būklę. JAV pacientų, kuriems bus atliktas šis tyrimas, skaičius siekia 5 milijonus per metus. Dabar labai prisodrintam C13 izotopui pramoniniu mastu gaminti naudojami lazerinio atskyrimo metodai.
Susijusi informacija.
2 paskaita. Pagrindinis radioaktyvaus skilimo dėsnis ir radionuklidų aktyvumas
Radionuklidų skilimo greitis yra skirtingas – vieni skyla greičiau, kiti lėčiau. Radioaktyvaus skilimo greičio rodiklis yra radioaktyvaus skilimo konstanta, λ [sek-1], kuri apibūdina vieno atomo skilimo per vieną sekundę tikimybę. Kiekvienam radionuklidui skilimo konstanta turi savo reikšmę, kuo ji didesnė, tuo greičiau skyla medžiagos branduoliai.
Radioaktyviajame mėginyje per laiko vienetą užfiksuotų skilimų skaičius vadinamas veikla (a ) arba mėginio radioaktyvumą. Aktyvumo vertė yra tiesiogiai proporcinga atomų skaičiui N radioaktyvioji medžiaga:
a =λ· N , (3.2.1)
Kur λ – radioaktyvaus skilimo konstanta, [sek-1].
Šiuo metu pagal galiojančią Tarptautinę vienetų sistemą SI radioaktyvumo matavimo vienetas yra bekerelis [Bk]. Šis padalinys gavo savo pavadinimą prancūzų mokslininko Henri Becquerel garbei, kuris 1856 m. atrado natūralaus urano radioaktyvumo reiškinį. Vienas bekerelis lygus vienam skilimui per sekundę 1 Bk = 1 .
Tačiau vis dar dažnai naudojamas nesisteminis veiklos vienetas – curie [Ki], kurį Curie įvedė kaip vieno gramo radžio skilimo greičio matą (kuriame per sekundę vyksta ~3,7 1010 skilimų), todėl
1 Ki= 3,7·1010 Bk.
Šiuo įrenginiu patogu įvertinti didelių radionuklidų kiekių aktyvumą.
Radionuklidų koncentracijos sumažėjimas laikui bėgant dėl skilimo priklauso nuo eksponentinės priklausomybės:
 , (3.2.2)
, (3.2.2)
Kur N t– radioaktyvaus elemento atomų, likusių po laiko, skaičius t po stebėjimo pradžios; N 0 – atomų skaičius pradiniu laiko momentu ( t =0 ); λ – radioaktyvaus skilimo konstanta.
Aprašyta priklausomybė vadinama Pagrindinis radioaktyvaus skilimo dėsnis .
Vadinamas laikas, per kurį suyra pusė viso radionuklidų kiekio pusinės eliminacijos laikas T½ . Po vieno pusėjimo iš 100 radionuklidų atomų lieka tik 50 (2.1 pav.). Per kitą panašų laikotarpį iš šių 50 atomų liko tik 25 ir t.t.
Ryšys tarp pusėjimo trukmės ir skilimo konstantos gaunamas iš pagrindinio radioaktyvaus skilimo dėsnio lygties:
adresu t=T½ Ir
gauname https://pandia.ru/text/80/150/images/image006_47.gif" width="67" height="41 src="> Þ ;
https://pandia.ru/text/80/150/images/image009_37.gif" width="76" height="21">;
ty..gif" width="81" height="41 src=">.
Todėl radioaktyvaus skilimo dėsnį galima parašyti taip:
https://pandia.ru/text/80/150/images/image013_21.gif" width="89" height="39 src=">, (3.2.4)
Kur adresu – narkotikų aktyvumas laikui bėgant t ; a0 – vaisto aktyvumas pradiniu stebėjimo momentu.
Dažnai reikia nustatyti bet kurios radioaktyviosios medžiagos tam tikro kiekio aktyvumą.
Atminkite, kad medžiagos kiekio vienetas yra molis. Molis – tai medžiagos kiekis, turintis tiek pat atomų, kiek yra 0,012 kg = 12 g anglies izotopo 12C.
Viename molyje bet kurios medžiagos yra Avogadro numeris N.A. atomai:
N.A. = 6,02·1023 atomų.
Paprastoms medžiagoms (elementams) vieno molio masė skaitine prasme atitinka atominę masę A elementas
1 mol = A G.
Pavyzdžiui: Magniui: 1 mol 24Mg = 24 g.
226Ra: 1 mol 226Ra = 226 g ir kt.
Atsižvelgiant į tai, kas buvo pasakyta m gramų medžiagos bus N atomai:
https://pandia.ru/text/80/150/images/image015_20.gif" width="156" height="43 src="> (3.2.6)
Pavyzdys: Apskaičiuokime 1 gramo 226Ra aktyvumą, kuris λ = 1,38·10-11 sek-1.
a= 1,38·10-11·1/226·6,02·1023 = 3,66·1010 Bq.
Jei radioaktyvus elementas yra cheminio junginio dalis, tada nustatant vaisto aktyvumą būtina atsižvelgti į jo formulę. Atsižvelgiant į medžiagos sudėtį, nustatoma masės dalis χ radionuklidas medžiagoje, kuris nustatomas pagal santykį:
https://pandia.ru/text/80/150/images/image017_17.gif" width="118" height="41 src=">
Problemos sprendimo pavyzdys
Būklė:
Veikla A0 radioaktyviojo elemento 32P per stebėjimo dieną yra 1000 Bk. Po savaitės nustatykite šio elemento aktyvumą ir atomų skaičių. Pusė gyvenimas T½ 32P = 14,3 dienos.
Sprendimas:
a) Raskime fosforo-32 aktyvumą po 7 dienų:
https://pandia.ru/text/80/150/images/image019_16.gif" width="57" height="41 src=">
Atsakymas: po savaitės vaisto 32P aktyvumas bus 712 Bk, o radioaktyvaus izotopo 32P atomų skaičius yra 127.14·106 atomai.
Saugumo klausimai
1) Koks yra radionuklido aktyvumas?
2) Įvardykite radioaktyvumo vienetus ir ryšį tarp jų.
3) Kokia yra radioaktyvaus skilimo konstanta?
4) Apibrėžkite pagrindinį radioaktyvaus skilimo dėsnį.
5) Kas yra pusinės eliminacijos laikas?
6) Koks ryšys tarp radionuklido aktyvumo ir masės? Parašykite formulę.
Užduotys
1. Apskaičiuokite veiklą 1 G 226Ra. T½ = 1602 metai.
2. Apskaičiuokite 1 aktyvumą G 60Co. T½ = 5,3 metų.
3. Viename M-47 tanko korpuse yra 4.3 kg 238U. Т½ = 2,5·109 metai. Nustatykite sviedinio aktyvumą.
4. Apskaičiuokite 137Cs aktyvumą po 10 metų, jei pradiniu stebėjimo momentu jis lygus 1000 Bk. T½ = 30 metų.
5. Apskaičiuokite 90Sr aktyvumą prieš metus, jei jis šiuo metu lygus 500 Bk. T½ = 29 metai.
6. Kokią veiklą sukurs 1? kg radioizotopas 131I, T½ = 8,1 dienos?
7. Naudodami pamatinius duomenis nustatykite 1 veiklą G 238U. Т½ = 2,5·109 metai.
Naudodamiesi atskaitos duomenimis, nustatykite 1 veiklą G 232th, Т½ = 1,4·1010 metų.
8. Apskaičiuokite junginio aktyvumą: 239Pu316O8.
9. Apskaičiuokite radionuklido, kurio aktyvumas lygus 1, masę Ki:
9.1. 131I, T1/2=8,1 dienos;
9.2. 90Sr, T1/2=29 metai;
9.3. 137Cs, Т1/2=30 metų;
9.4. 239Pu, Т1/2=2,4·104 metai.
10. Nustatykite masę 1 mCi radioaktyvusis anglies izotopas 14C, T½ = 5560 metų.
11. Būtina paruošti radioaktyvųjį fosforo 32P preparatą. Po kurio laiko liks 3% vaisto? Т½ = 14,29 dienos.
12. Natūraliame kalio mišinyje yra 0,012 % 40K radioaktyvaus izotopo.
1) Nustatykite natūralaus kalio, kuriame yra 1, masę Ki 40 tūkst. Т½ = 1,39 · 109 metai = 4,4 · 1018 sek.
2) Apskaičiuokite dirvožemio radioaktyvumą naudojant 40K, jei žinoma, kad kalio kiekis dirvožemio mėginyje yra 14 kg/t.
13. Kiek pusamžių reikia, kad pradinis radioizotopo aktyvumas sumažėtų iki 0,001 %?
14. Norint nustatyti 238U poveikį augalams, sėklos mirkomos 100 ml tirpalas UO2(NO3)2 6H2O, kuriame radioaktyviosios druskos masė buvo 6 G. Nustatykite 238U aktyvumą ir savitąjį aktyvumą tirpale. Т½ = 4,5·109 metų.
15. Nurodykite 1 veiklą gramų 232th, Т½ = 1,4·1010 metų.
16. Nustatykite masę 1 Ki 137Cs, Т1/2=30 metų.
17. Stabiliųjų ir radioaktyviųjų kalio izotopų kiekio gamtoje santykis yra pastovus dydis. 40K turinys yra 0,01%. Apskaičiuokite dirvožemio radioaktyvumą naudojant 40K, jei žinoma, kad kalio kiekis dirvožemio mėginyje yra 14 kg/t.
18. Litogeninis aplinkos radioaktyvumas susidaro daugiausia dėl trijų pagrindinių gamtinių radionuklidų: 40K, 238U, 232Th. Radioaktyviųjų izotopų dalis natūralioje izotopų sumoje yra atitinkamai 0,01, 99,3, ~100. Apskaičiuokite radioaktyvumą 1 T dirvožemio, jei žinoma, kad santykinis kalio kiekis dirvožemio mėginyje yra 13600 g/t, uranas – 1·10-4 g/t, torio – 6·10-4 g/t.
19. Dvigeldžių moliuskų kiautuose rasta 23 200 Bq/kg 90 Sr. Nustatykite mėginių aktyvumą po 10, 30, 50, 100 metų.
20. Pagrindinė uždarų rezervuarų tarša Černobylio zonoje įvyko pirmaisiais metais po avarijos atominėje elektrinėje. Ežero dugno nuosėdose. Azbuchinas 1999 m. atrado 137Cs, kurių savitasis aktyvumas buvo 1,1·10 Bq/m2. Nustatyti iškritusių 137Cs koncentraciją (aktyvumą) viename dugno nuosėdų m2 1986-1987 m. (prieš 12 metų).
21. 241Am (T½ = 4,32·102 metai) susidaro iš 241Pu (T½ = 14,4 metų) ir yra aktyvus geocheminis migrantas. Naudodamiesi etaloninėmis medžiagomis, 1% tikslumu apskaičiuokite plutonio-241 aktyvumo sumažėjimą laikui bėgant, kuriais metais po Černobylio katastrofos 241Am susidarys aplinkoje maksimaliai.
22. Apskaičiuokite 241Am aktyvumą Černobylio reaktoriaus emisijose balandžio mėn.
2015 m., jeigu 1986 m. balandžio mėn. 241Am aktyvumas buvo 3,82 1012 Bk,Т½ = 4,32·102 metai.
23. Dirvožemio mėginiuose rasta 390 nCi/kg 137Cs. Apskaičiuokite mėginių aktyvumą po 10, 30, 50, 100 metų.
24. Vidutinė ežero dugno taršos koncentracija. Glubokoje, esantis Černobylio draudžiamojoje zonoje, yra 6,3 104 Bk 241Am ir 7,4·104 238+239+240Pu už 1 m2. Apskaičiuokite, kokiais metais šie duomenys gauti.
§ 15-g. Radioaktyvaus skilimo dėsnis
Atsiradę „rankiniai“ scintiliacijos skaitikliai ir, daugiausia, Geigerio-Mulerio skaitikliai, padėję automatizuoti dalelių skaičiavimą (žr. § 15), fizikus padarė svarbią išvadą. Bet kuriam radioaktyviam izotopui būdingas spontaniškas radioaktyvumo susilpnėjimas, išreiškiamas irstančių branduolių skaičiaus sumažėjimu per laiko vienetą.
Įvairių radioaktyviųjų izotopų aktyvumo grafikai atvedė mokslininkus prie tokios pat priklausomybės, išreikštos eksponentinė funkcija(žr. diagramą). Horizontalioje ašyje rodomas stebėjimo laikas, o vertikalioje – nesuirusių branduolių skaičius. Linijų kreivumas galėjo būti skirtingas, tačiau pati funkcija, išreiškianti grafikais aprašytas priklausomybes, liko ta pati:
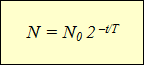
Ši formulė išreiškia Radioaktyvaus skilimo dėsnis: branduolių, kurie laikui bėgant nesuirę, skaičius nustatomas kaip pradinio branduolių skaičiaus sandauga iš 2 su galia, lygia stebėjimo laiko ir pusinės eliminacijos periodo santykiui, paimtam su neigiamu ženklu.
Kaip paaiškėjo eksperimentų metu, įvairios radioaktyviosios medžiagos gali būti charakterizuojamos skirtingai pusinės eliminacijos laikas– laikas, per kurį dar nesuirusių branduolių skaičius sumažėja perpus(žr. lentelę).
Kai kurių cheminių elementų kai kurių izotopų pusinės eliminacijos laikas. Vertės pateiktos tiek natūraliems, tiek dirbtiniams izotopams.
| Jodas-129 | 15 mėn | Anglis-14 | 5,7 tūkstančio metų | |
| Jodas-131 | 8 dienos | Uranas-235 | 0,7 Ga | |
| Jodas-135 | 7 valanda | Uranas-238 | 4,5 milijardo metų |
Pusinės eliminacijos laikas yra visuotinai priimtas fizikinis dydis, apibūdinantis radioaktyvaus skilimo greitį. Daugybė eksperimentų tai rodo net ir labai ilgai stebint radioaktyviąją medžiagą, jos pusinės eliminacijos laikas yra pastovus, tai yra nepriklauso nuo jau suirusių atomų skaičiaus. Todėl radioaktyvaus skilimo dėsnis buvo pritaikytas archeologinių ir geologinių radinių amžiaus nustatymo metodui.
Radioaktyviosios anglies datavimo metodas. Anglis yra labai paplitęs cheminis elementas Žemėje, kurį sudaro stabilūs izotopai anglis-12, anglis-13 ir radioaktyvusis izotopas anglis-14, kurio pusinės eliminacijos laikas yra 5,7 tūkst. metų (žr. lentelę). Gyvi organizmai, vartodami maistą, savo audiniuose kaupia visus tris izotopus. Pasibaigus organizmo gyvavimo laikui, anglies tiekimas sustoja, o laikui bėgant jos kiekis natūraliai mažėja dėl radioaktyvaus skilimo. Kadangi skyla tik anglis-14, anglies izotopų santykis gyvų organizmų iškastinėse liekanose kinta šimtmečius ir tūkstantmečius. Išmatavę šią „anglies proporciją“, galime spręsti apie archeologinio radinio amžių.
Radioaktyviosios anglies analizės metodas taikomas geologinėms uolienoms, taip pat iškastiniams žmogaus objektams, tačiau su sąlyga, kad izotopų santykis mėginyje jo egzistavimo metu nebuvo sutrikdytas, pavyzdžiui, dėl gaisro ar stipraus šaltinio poveikio. radiacijos. Neatsižvelgimas į tokias priežastis iškart po šio metodo atradimo lėmė klaidas kelis šimtmečius ir tūkstantmečius. Šiandien anglies-14 izotopui naudojamos „pasaulietinės kalibravimo svarstyklės“, pagrįstos jo pasiskirstymu ilgaamžiuose medžiuose (pavyzdžiui, Amerikos tūkstantmečio sekvoj). Jų amžių galima labai tiksliai apskaičiuoti – pagal medžio metinius žiedus.
Radioaktyviosios anglies datavimo metodo taikymo riba XXI amžiaus pradžioje buvo 60 000 metų. Senesnių mėginių, pavyzdžiui, uolienų ar meteoritų, amžiui išmatuoti naudojamas panašus metodas, tačiau vietoj anglies žiūrima į urano ar kitų elementų izotopus, priklausomai nuo tiriamo mėginio kilmės.
„Javascript“ jūsų naršyklėje išjungtas.Norėdami atlikti skaičiavimus, turite įjungti ActiveX valdiklius!
>> Radioaktyvaus skilimo dėsnis. Pusė gyvenimas
§ 101 RADIOAKTYVIOJI SKILIMO TEISĖ. PUSĖ GYVYBĖ
Radioaktyvusis skilimas paklūsta statistiniam dėsniui. Rutherfordas, tyrinėdamas radioaktyviųjų medžiagų virsmą, eksperimentiškai nustatė, kad jų aktyvumas laikui bėgant mažėja. Tai buvo aptarta ankstesnėje pastraipoje. Taigi radono aktyvumas po 1 minutės sumažėja 2 kartus. Elementų, tokių kaip uranas, toris ir radis, aktyvumas taip pat mažėja laikui bėgant, tačiau daug lėčiau. Kiekvienai radioaktyviajai medžiagai yra tam tikras laiko intervalas, per kurį aktyvumas sumažėja 2 kartus. Šis intervalas vadinamas pusinės eliminacijos periodu. Pusinės eliminacijos laikas T yra laikas, per kurį suyra pusė pradinio radioaktyviųjų atomų skaičiaus.
Aktyvumo mažėjimas, ty skilimų skaičius per sekundę, priklausomai nuo vieno iš radioaktyviųjų vaistų laiko, parodytas 13.8 pav. Šios medžiagos pusinės eliminacijos laikas yra 5 dienos.
Išveskime matematinę radioaktyvaus skilimo dėsnio formą. Tegu radioaktyviųjų atomų skaičius pradiniu laiko momentu (t= 0) lygus N 0. Tada, pasibaigus pusinės eliminacijos laikui, šis skaičius bus lygus
Po kito panašaus laiko intervalo šis skaičius taps lygus:









