„Matematikas, kaip ir menininkas ar poetas, kuria raštus. O jei jo raštai stabilesni, tai tik todėl, kad jie susideda iš idėjų... Matematiko raštai, kaip ir menininko ar poeto raštai, turi būti gražūs; Idėjos, kaip ir spalvos ar žodžiai, turi atitikti viena kitą. Grožis yra pirmasis reikalavimas: bjauriai matematikai nėra vietos pasaulyje».
G.H.Hardy
Pirmajame skyriuje buvo pažymėta, kad yra gana primityvų paprastos funkcijos, kurio nebegalima išreikšti elementarios funkcijos. Šiuo atžvilgiu tos funkcijų klasės, apie kurias galime tiksliai pasakyti, kad jų antidariniai yra elementarios funkcijos, įgyja didžiulę praktinę reikšmę. Ši funkcijų klasė apima racionalios funkcijos, reiškiantis dviejų santykį algebriniai daugianariai. Daugelis problemų lemia racionaliųjų trupmenų integravimą. Todėl labai svarbu mokėti integruoti tokias funkcijas.
2.1.1. Trupmeninės racionalios funkcijos
Racionalioji trupmena(arba trupmeninė racionali funkcija) vadinamas dviejų algebrinių daugianarių ryšiu:
kur ir yra daugianariai.
Leiskite jums tai priminti daugianario (daugianario, visa racionali funkcija ) nlaipsnis vadinama formos funkcija
Kur ![]() – realūs skaičiai. Pavyzdžiui,
– realūs skaičiai. Pavyzdžiui,
![]()
– pirmojo laipsnio daugianario;
– ketvirtojo laipsnio daugianario ir kt.
Racionalioji trupmena (2.1.1) vadinama teisinga, jeigu laipsnis žemesnis už laipsnį , t.y. n<m, kitaip trupmena vadinama negerai.
Bet kuri neteisinga trupmena gali būti pavaizduota kaip daugianario (sveikosios dalies) ir tinkamos trupmenos (trupmeninės dalies) suma. Netinkamos trupmenos sveikos ir trupmeninės dalys gali būti atskirtos pagal daugianario padalijimo „kampu“ taisyklę.
2.1.1 pavyzdys. Nustatykite šių netinkamų racionalių trupmenų visas ir trupmenines dalis:
A)  , b)
, b)  .
.
Sprendimas . a) Naudodami "kampo" padalijimo algoritmą, gauname

Taigi, mes gauname
 .
.
b) Čia taip pat naudojame „kampo“ padalijimo algoritmą:

Kaip rezultatas, mes gauname
 .
.
Apibendrinkime. Bendruoju atveju neapibrėžtasis racionaliosios trupmenos integralas gali būti pavaizduotas kaip daugianario ir tinkamos racionaliosios trupmenos integralų suma. Rasti polinomų antidarinius nėra sunku. Todėl toliau daugiausia nagrinėsime tinkamas racionaliąsias trupmenas.
2.1.2. Paprasčiausios racionalios trupmenos ir jų integravimas
Tarp tinkamų racionaliųjų trupmenų yra keturi tipai, kurie klasifikuojami kaip paprasčiausios (elementariosios) racionalios trupmenos:
|
3) |
4) |
kur yra sveikasis skaičius, ![]() , t.y. kvadratinis trinaris
, t.y. kvadratinis trinaris ![]() neturi tikrų šaknų.
neturi tikrų šaknų.
Integruoti paprastas 1 ir 2 tipo trupmenas nesukelia didelių sunkumų:
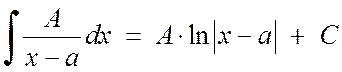 , (2.1.3)
, (2.1.3)
 . (2.1.4)
. (2.1.4)
Dabar panagrinėkime paprastųjų 3 tipo trupmenų integravimą, bet nenagrinėsime 4 tipo trupmenų.
Pradėkime nuo formos integralų
 .
.
Šis integralas paprastai apskaičiuojamas išskiriant tobuląjį vardiklio kvadratą. Rezultatas yra šios formos lentelės integralas
 arba
arba  .
.
2.1.2 pavyzdys. Raskite integralus:
A)  , b)
, b) 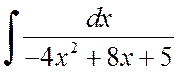 .
.
Sprendimas . a) Iš kvadratinio trinalio pasirinkite visą kvadratą:
Iš čia randame
b) Išskirdami visą kvadratą nuo kvadratinio trinalio, gauname:
Taigi,
 .
.
Norėdami rasti integralą
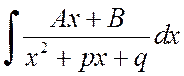
Jūs galite išskirti vardiklio išvestinę skaitiklyje ir išplėsti integralą į dviejų integralų sumą: pirmasis iš jų pakeičiant ![]() priklauso nuo išvaizdos
priklauso nuo išvaizdos
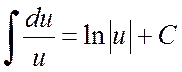 ,
,
o antrasis – į aukščiau aptartą.
2.1.3 pavyzdys. Raskite integralus:
 .
.
Sprendimas
. Atkreipkite dėmesį, kad 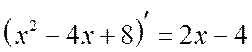 . Išskirkime vardiklio išvestinę skaitiklyje:
. Išskirkime vardiklio išvestinę skaitiklyje:
Pirmasis integralas apskaičiuojamas naudojant pakaitalą ![]() :
:
Antrajame integrale vardiklyje pasirenkame tobulą kvadratą
Pagaliau gauname
2.1.3. Tinkamas racionalus trupmenos plėtimas
paprastųjų trupmenų sumai
Bet kuri tinkama racionali trupmena ![]() gali būti pavaizduota unikaliu būdu kaip paprastųjų trupmenų suma. Norėdami tai padaryti, vardiklis turi būti koeficientas. Iš aukštesnės algebros žinoma, kad kiekvienas daugianomas su realiais koeficientais
gali būti pavaizduota unikaliu būdu kaip paprastųjų trupmenų suma. Norėdami tai padaryti, vardiklis turi būti koeficientas. Iš aukštesnės algebros žinoma, kad kiekvienas daugianomas su realiais koeficientais
Aišku, kad tokios mažos medžiagos dalelės tiesiogiai išmatuoti negalėsime. Atliksime eksperimentą, iš kurio paprastais skaičiavimais galime nustatyti molekulių dydį. Jūs, žinoma, matėte plonas spalvotas plėveles, kurias vandens paviršiuje sudaro naftos produktai (tepalinės alyvos, dyzelinis kuras ir kt.). Plonų plėvelių spalva atsiranda dėl šviesos spindulių, atsispindėjusių nuo viršutinio ir apatinio plėvelės paviršių, persidengimo, reiškinio, vadinamo šviesos trukdžiais. Dėl tos pačios priežasties muilo burbulai mirga visomis vaivorykštės spalvomis.
Fizikos pamokose tyrinėsite trukdžių fenomeną. O dabar mus domina plėvelės storis – ar kada susimąstėte, kokio storio ji yra? Nustatyti plėvelės storį labai paprasta: jos tūrį reikia padalyti iš paviršiaus ploto. Net senovės jūreiviai pastebėjo, kad augalinį aliejų užpylus ant vandens paviršiaus, jis pasklis labai didelėje vietoje (tuo metu susiklostė gana keista nuomonė, kad tokiu būdu galima „nuraminti“ jūrą per audrą). Tikriausiai pirmasis žmogus, kuris išmatavo aliejaus dėmės plotą ant vandens, buvo puikus amerikiečių mokslininkas ir diplomatas Benjaminas Franklinas (1706–1790), kurio atvaizdas yra ant šimto dolerių banknoto. Garsiausias jo išradimas yra žaibolaidis (tiksliau, žaibolaidis). 1774 m. Franklinas išvyko į Europą, kad išspręstų kitą Anglijos ir JAV konfliktą. Laisvu nuo derybų metu jis eksperimentavo su naftos plėvelėmis vandens paviršiuje. Jo nuostabai vienas šaukštas augalinio aliejaus pasklido po visą nedidelio tvenkinio paviršių. Jei į vandenį pilsite ne augalinį, o neklampų mašinų aliejų, dėmė nuo jo nebus tokia didelė: iš vieno lašo susidaro maždaug 20 cm skersmens apskritimas maždaug 300 cm3, vieno lašo tūris yra apie 0,03 cm3. Todėl plėvelės storis yra 0,03 cm1 / 300 cm3 = 0,0001 cm = 0,001 mm - 1 µm. Tūkstantoji milimetro dalis yra labai maža vertė, ne kiekvienas mikroskopas gali pamatyti tokio dydžio dalelę.
Bet ar turime garantiją, kad mašinų alyvos molekulės pasklis po vandenį vienu sluoksniu? Juk tik tokiu atveju plėvelės storis atitiks molekulių dydį. Neturime tokios garantijos, todėl štai kodėl. Molekulės, sudarančios variklio alyvą, vadinamos hidrofobinėmis (iš graikų kalbos išvertus „hidrofobinės“ – „bijo vandens“). Jie vienas prie kito gana gerai „prilimpa“, bet labai nenoriai su vandens molekulėmis. Jei ant vandens paviršiaus išpilama į mašinų alyvą panaši medžiaga, ant jos susidaro gana stora (molekuliniais standartais) plėvelė, susidedanti iš šimtų ir net tūkstančių molekulinių sluoksnių. Be to, kad tokie skaičiavimai patys savaime yra įdomūs, jie turi didelę praktinę reikšmę. Pavyzdžiui, iki šių dienų neįmanoma išvengti avarijų, kai didžiuliai tanklaiviai gabena naftą tūkstančius kilometrų nuo jos gavybos vietos. Dėl tokios avarijos į jūrą gali išsilieti didžiulis kiekis naftos, o tai turės žalingą poveikį gyviems organizmams. Alyva yra klampesnė už variklio alyvą, todėl jos plėvelė ant vandens paviršiaus gali būti kiek storesnė. Taip per vieną iš avarijų išsiliejo 120 000 tonų naftos, kurios plotas siekia 500 km3. Kaip rodo paprastas skaičiavimas, vidutinis tokios plėvelės storis yra 200 mikronų. Plėvelės storis priklauso tiek nuo alyvos rūšies, tiek nuo vandens temperatūros: šaltose jūrose, kur aliejus tampa tirštesnis, plėvelė yra storesnė, šiltose jūrose, kur aliejus tampa mažiau klampus, plėvelė yra plonesnė. Tačiau bet kuriuo atveju didelio tanklaivio avarija, kai į jūrą patenka dešimtys tūkstančių tonų naftos, yra nelaimė. Juk jei visas išsiliejęs aliejus pasiskirstys plonu sluoksniu, susidarys milžiniško ploto dėmė, o pašalinti tokią plėvelę bus itin sunku.
Ar įmanoma padaryti medžiagą pasklidusią ant vandens taip, kad susidarytų tik vienas molekulių sluoksnis (tokia plėvelė vadinama monomolekuline)? Pasirodo, tai įmanoma, tačiau vietoj mašinų alyvos ar naftos reikia vartoti kitą medžiagą. Tokios medžiagos molekulės viename gale turi turėti vadinamąją hidrofilinę (t.y. „vandenį mėgstančią“) atomų grupę, o kitame – hidrofobinę. Kas atsitiks, jei iš tokių molekulių sudaryta medžiaga bus dedama ant vandens paviršiaus? Hidrofilinė molekulių dalis, bandanti ištirpti vandenyje, trauks molekulę į vandenį, o hidrofobinė dalis, kuri „bijo“ vandens, atkakliai vengs sąlyčio su vandeniu. Dėl tokio abipusio „nesusipratimo“ molekulės (jei jos yra šiek tiek „paspaustos“ iš šono naudojant lentą) išsidėstys vandens paviršiuje, kaip parodyta Fig. 3.1: jų hidrofiliniai galai yra įdubę į vandenį, o hidrofobiniai galai išsikiša.
\6666666666ы/
Ryžiai. 3.1. Taip paviršinio aktyvumo medžiagų molekulės orientuojasi ties vandens-oro riba, sudarydamos „Langmuiro akvatoriją“ – pavadintą amerikiečių chemiko ir fiziko Irvingo Langmuiro (1881–1957), kuris 1916 m. sukūrė teoriją apie tokių sluoksnių sandarą. skysčių paviršių
Medžiagos, kurios taip elgiasi, vadinamos aktyviosiomis paviršiaus medžiagomis. Tai apima, pavyzdžiui, muilą ir kitus ploviklius; oleino rūgštis, kuri yra saulėgrąžų aliejaus dalis; palmitino alkoholis, kuris yra palmių aliejaus ir banginių aliejaus dalis. Tokioms medžiagoms pasklidus vandens paviršiuje susidaro daug plonesnės plėvelės nei mašinų alyva. Šis reiškinys žinomas jau seniai, panašūs eksperimentai buvo atlikti dar XVIII amžiuje. Tačiau tik XIX amžiaus pabaigoje – XX amžiaus pradžioje, dėl eksperimentų, kuriuos atliko anglų fizikas Johnas Williamas Rayleighas (1842–1919), vokiečių fizikas Wilhelmas Conradas Rentgenas (1845–1923) ir daugybė kiti mokslininkai parodė, kad plėvelės storis gali siekti tokius mažus dydžius, kurie yra palyginami su atskirų molekulių dydžiais.
Viename iš šių eksperimentų anglų chemikas Neilas Kensingtonas Adamas daugumos mums žinomų medžiagų molekulių ir jonų dydis yra 1 nm. Taigi vandenilio molekulių skersmuo yra maždaug 0,2 nm, jodo - 0,5 nm, etilo alkoholio - 0,4 nm; aliuminio jonų spindulys yra 0,06 nm, natrio - 0,10 nm, chlorido - 0,13 nm, chloro - 0,18 nm, jodo - 0,22 nm. Tačiau tarp molekulių yra ir milžinų, kurių dydžiai pagal molekulinius standartus yra tikrai astronominiai. Taigi aukštesniųjų gyvūnų ir augalų ląstelių branduoliuose yra paveldimumo molekulės – dezoksiribonukleino rūgštys (DNR). Jų ilgis gali viršyti 2 000 000 nm, ty 2 mm!
Baigiant šį skyrių, pateikiame trumpą pasakojimą apie išradingą (nors ir ne patį tiksliausią) metodą, kurį 1908 metais naudojo prancūzų mokslininkas Jeanas Perrinas molekulėms „sverti“. Kaip žinote, didėjant aukščiui, oro tankis mažėja. XIX amžiaus pradžioje prancūzų mokslininkas Pierre'as Laplasas sukūrė formulę, leidžiančią apskaičiuoti slėgį skirtinguose aukščiuose. Pagal šią formulę atmosferos slėgis nukrenta per pusę kas 6 kilometrus. Ši vertė, žinoma, priklauso nuo gravitacijos jėgos, taip pat nuo oro molekulių masės. Jei orą sudarytų ne azotas ir deguonis, o labai lengvos vandenilio molekulės (jos yra 16 kartų lengvesnės už deguonies molekules), tai atmosferos slėgio sumažėjimas per pusę būtų stebimas ne 6 km aukštyje, o maždaug 16 kartų. daugiau, t.y., apie 100 km. Ir atvirkščiai, jei molekulės būtų labai sunkios, atmosfera būtų „prispausta“ prie Žemės paviršiaus ir slėgis greitai sumažėtų didėjant aukščiui.
Samprotavimas tokiu būdu. Vietoj molekulių Perrinas nusprendė naudoti mažyčius gummiguto dažų rutuliukus, suspenduotus vandenyje. Suspensiją (emulsiją) jis bandė paruošti su tokio pat dydžio – maždaug 1 mikrono skersmens – rutuliais. Tada jis įdėjo emulsijos lašą po mikroskopu ir, pasukdamas mikroskopo varžtą vertikaliai, suskaičiavo, kiek gumulėlių yra skirtinguose aukščiuose. Paaiškėjo, kad Laplaso formulė yra gana tinkama emulsijoms: kas 6 µm pakilimo rutulių skaičius regėjimo lauke sumažėjo perpus. Kadangi 6 km yra lygiai milijardą kartų didesnis nei 6 mikronai, Perrinas padarė išvadą, kad deguonies ir azoto molekulės yra tiek pat kartų lengvesnės nei gumulėliai (o jų masę jau galima nustatyti eksperimentiniu būdu).
Ir poskyris, kuriame bendrais bruožais buvo apžvelgti šiuolaikiniai filtravimo metodai, pagrįsti sieto principu. Ir jie užsiminė, kad membraniniai valytuvai išvalo skirtingos kokybės vandenį, kuris priklauso nuo „ląstelių“, vadinamų porų, dydžio šiuose membraniniuose sietuose. Atitinkamai, vandens mikrofiltravimas– Tai pirmoji membraninių vandens valymo sistemų technologija, kurią svarstysime.
Vandens mikrofiltravimas – tai vandens valymas stambių molekulių (makromolekulių) lygyje, pvz., asbesto dalelės, dažai, anglies dulkės, pirmuonių cistos, bakterijos, rūdys. Tuo tarpu makrofiltracija (vandens) veikia smėlį, dideles dumblo daleles, dideles rūdžių daleles ir kt.
Apytiksliai galime teigti, kad makrofiltravimo metu išskiriamos dalelės yra didesnės nei 1 mikrometras (jei naudojama speciali vieno mikrono kasetė). Nors dalelių dydis, kurį pašalina mikrofiltravimas, yra dalelės nuo 1 mikrono iki 0,1 mikrono.
Galite paklausti: "Bet jei būtų pašalintos iki 0,1 mikrono dalelės, ar 100 mikronų dalelės nebūtų užfiksuotos mikrofiltravimu? Kam rašyti "1 mikronas iki 0,1 mikrono" – tai prieštaravimas?"
Tiesą sakant, nėra jokio ypatingo prieštaravimo. Iš tiesų vandens mikrofiltravimas pašalins ir bakterijas, ir didžiulius smėlio gabalus. Tačiau mikrofiltravimo tikslas nėra pašalinti didelius smėlio gabalus. Mikrofiltravimo tikslas yra „pašalinti tam tikro dydžio daleles“. Tada kaip būtų O Didesnės dalelės tiesiog užkimš valytuvą ir sukels papildomų išlaidų.
Taigi, pereikime prie vandens mikrofiltravimo savybių.
Kadangi mikrofiltravimas pašalina 0,1-1 mikrono dydžio daleles, galime tai pasakyti mikrofiltravimas yra membraninė vandens valymo technologija, kuri atliekama ant membraninių sietų, kurių porų ląstelių skersmuo yra 0,1-1 mikronas. Tai yra, ant tokių membranų pašalinamos visos didesnės nei 0,5–1 mikrono medžiagos:
Kaip visiškai jie bus pašalinti, priklauso nuo porų skersmens ir tikrojo, tarkime, bakterijų dydžio. Taigi, jei bakterija yra ilga, bet plona, ji lengvai prasiskverbia pro mikrofiltravimo membranos poras. O storesnė sferinė bakterija liks „sieto“ paviršiuje.
Dažniausiai naudojamas mikrofiltravimas maisto pramonėje(pienui nugriebti, sultims koncentruoti) ir medicinoje(pirminiam vaistinių žaliavų paruošimui). Taip pat naudojamas mikrofiltravimas pramoniniame geriamojo vandens valyme- daugiausia Vakarų šalyse (pavyzdžiui, Paryžiuje). Nors sklando kalbos, kad viename iš vandens gerinimo įrenginių Maskvoje taip pat naudojama mikrofiltravimo technologija. Gal tai tiesa :)
Tačiau yra ir buitinių filtrų, pagrįstų mikrofiltravimu.
Dažniausias pavyzdys yra bėgių mikrofiltravimo membranos. Takelis iš žodžio „track“, tai yra pėdsakas, ir šis pavadinimas yra susijęs su tuo, kaip gaminamos tokio tipo membranos. Procedūra labai paprasta:
- Polimerinę plėvelę bombarduoja dalelės, kurios dėl savo didelės energijos plėvelėje sudegina pėdsakus – maždaug tokio paties dydžio įdubimus, nes dalelės, kuriomis bombarduojamas paviršius, yra tokio pat dydžio.
- Tada ši polimerinė plėvelė yra išgraviruota tirpale, pavyzdžiui, rūgštyje, kad dalelių smūgių pėdsakai prasiskverbtų.
- Na, tada paprasta polimerinės plėvelės džiovinimo ir pritvirtinimo prie pagrindo procedūra - ir viskas, bėgių kelio mikrofiltravimo membrana paruošta!
Dėl to šios membranos turi fiksuotą porų diametrą ir mažą poringumą, lyginant su kitomis membraninėmis vandens valymo sistemomis. Ir išvada: šios membranos pašalins tik tam tikro dydžio daleles.

Taip pat yra sudėtingesnė buitinių membranų mikrofiltravimo versija - mikrofiltravimo membranos, padengtos aktyvuota anglimi. Tai reiškia, kad aukščiau išvardyti veiksmai apima dar vieną veiksmą – plono sluoksnio užtepimą. Šios membranos pašalina ne tik bakterijas ir mechaninius nešvarumus, bet ir
- kvapas,
- organinės medžiagos,
- ir tt
Reikėtų atsižvelgti į tai, kad mikrofiltravimo membranoms yra pavojus. Taigi, bakterijos, kurios nepraėjo pro membraną pradeda gyventi ant šios membranos ir išduoti jūsų gyvenimo produktaiį išvalytą vandenį. Tai yra, atsiranda antrinis apsinuodijimas vandeniu. Norint to išvengti, būtina laikytis gamintojo nurodymų dėl reguliaraus membranų dezinfekavimo.
Antrasis pavojus yra tas bakterijos pačios pradės valgyti šias membranas. Ir jose padarys didžiules skylutes, pro kurias praeis medžiagos, kurias turėtų išlaikyti membrana. Kad taip nenutiktų, turėtumėte įsigyti bakterijoms atsparių medžiagų pagrindu pagamintus filtrus (pavyzdžiui, keramines mikrofiltravimo membranas) arba būti pasiruošusiems dažnai keisti mikrofiltravimo membranas.
Dažnai keisti mikrofiltravimo membranas skatina ir tai, kad jos neįrengtas praplovimo mechanizmas. O membranos poros tiesiog užsikimšusios nešvarumais. Membranos sugenda.
Iš esmės viskas yra apie mikrofiltravimą. Mikrofiltravimas yra gana kokybiškas vandens valymo būdas. Tačiau
Tikrasis mikrofiltravimo tikslas yra ne paruošti vandenį gerti (dėl bakterinio užteršimo pavojaus), o paruošti vandenį prieš kitus etapus.
Mikrofiltravimo etapas pašalina didžiąją dalį vėlesnių vandens valymo etapų naštos.

Remiantis medžiagomis Kaip pasirinkti vandens filtrą: http://voda.blox.ua/2008/07/Kak-vybrat-filtr-dlya-vody-22.html
« Fizika – 10 kl.
Kokius fizinius objektus (sistemas) tiria molekulinė fizika?
Kaip atskirti mechaninius ir šiluminius reiškinius?
Medžiagos struktūros molekulinė kinetinė teorija remiasi trimis teiginiais:
1) medžiaga susideda iš dalelių;
2) šios dalelės juda atsitiktinai;
3) dalelės sąveikauja viena su kita.
Kiekvienas teiginys yra griežtai įrodytas eksperimentais.
Visų be išimties kūnų savybes ir elgesį lemia tarpusavyje sąveikaujančių dalelių judėjimas: molekulės, atomai ar dar smulkesni dariniai – elementariosios dalelės.
Molekulių dydžių įvertinimas. Norint visiškai įsitikinti, kad egzistuoja molekulės, reikia nustatyti jų dydžius. Lengviausias būdas tai padaryti – stebėti, kaip vandens paviršiuje pasklinda aliejaus, pavyzdžiui, alyvuogių aliejaus, lašas. Alyva niekada neužims viso paviršiaus, jei imsime pakankamai platų indą (8.1 pav.). Neįmanoma priversti 1 mm 2 tūrio lašelio išsiskirstyti taip, kad jis užimtų didesnį nei 0,6 m 2 paviršiaus plotą. Tarkime, kad alyvai pasklidus didžiausiame plote susidaro tik vienos molekulės storio sluoksnis – „monomolekulinis sluoksnis“. Šio sluoksnio storį lengva nustatyti ir taip įvertinti alyvuogių aliejaus molekulės dydį.
Alyvos sluoksnio tūris V yra lygus jo paviršiaus ploto S ir sluoksnio storio d sandaugai, ty V = Sd. Todėl alyvuogių aliejaus molekulės linijinis dydis yra:

Šiuolaikiniai instrumentai leidžia pamatyti ir net išmatuoti atskirus atomus ir molekules. 8.2 paveiksle parodyta silicio plokštelės paviršiaus mikrografija, kur iškilimai yra atskiri silicio atomai. Tokie vaizdai pirmą kartą buvo gauti 1981 m. naudojant sudėtingus tunelinius mikroskopus.
Molekulių, įskaitant alyvuogių aliejų, dydžiai yra didesni už atomų dydžius. Bet kurio atomo skersmuo yra maždaug 10–8 cm. Šie matmenys yra tokie maži, kad juos sunku įsivaizduoti. Tokiais atvejais jie griebiasi palyginimų.
Štai vienas iš jų. Jei sugniaužsite pirštus į kumštį ir padidinsite jį iki Žemės rutulio dydžio, tada atomas tokiu pat padidinimu taps kumščio dydžio.
Molekulių skaičius.
Esant labai mažo dydžio molekulėms, jų skaičius bet kuriame makroskopiniame kūne yra didžiulis. Apskaičiuokime apytikslį molekulių skaičių vandens laše, kurio masė yra 1 g, taigi ir tūris 1 cm 3.
Vandens molekulės skersmuo yra maždaug 3 10 -8 cm Atsižvelgiant į tai, kad kiekviena vandens molekulė su tankiu molekulių paketu užima tūrį (3 10 -8 cm) 3, galite rasti molekulių skaičių laše. padalijus lašo tūrį (1 cm 3) iš tūrio vienai molekulei:
Molekulių masė.
Atskirų molekulių ir atomų masės yra labai mažos. Apskaičiavome, kad 1 g vandens yra 3,7 10 22 molekulės. Todėl vienos vandens molekulės (H 2 0) masė yra lygi:
Kitų medžiagų molekulės turi tokią pat masę, išskyrus didžiules organinių medžiagų molekules; pavyzdžiui, baltymų masė šimtus tūkstančių kartų didesnė už atskirų atomų masę. Tačiau vis tiek jų masė makroskopinėmis svarstyklėmis (gramais ir kilogramais) yra itin maža.
Santykinė molekulinė masė.
Kadangi molekulių masės yra labai mažos, skaičiavimuose patogu naudoti santykines, o ne absoliučias masės reikšmes.
Pagal tarptautinį susitarimą visų atomų ir molekulių masės lyginamos su anglies atomo mase (vadinamoji atominių masių anglies skalė).
Santykinė medžiagos molekulinė (arba atominė) masė M r yra tam tikros medžiagos molekulės (arba atomo) masės m 0 ir anglies atomo masės santykis:
Visų cheminių elementų santykinės atominės masės buvo tiksliai išmatuotos. Sudėjus santykines elementų, sudarančių medžiagos molekulę, atomines mases, galime apskaičiuoti santykinę medžiagos molekulinę masę. Pavyzdžiui, anglies dioksido CO 2 santykinė molekulinė masė yra apytiksliai lygi 44, nes santykinė anglies atominė masė yra beveik lygi 12, o deguonies yra maždaug 16: 12 + 2 16 = 44.
Atomų ir molekulių palyginimas su anglies atomo mase buvo priimtas 1961 m. Pagrindinė tokio pasirinkimo priežastis yra ta, kad anglies yra daugybėje skirtingų cheminių junginių. Daugiklis buvo įvestas taip, kad santykinė atomų masė būtų artima sveikiesiems skaičiams.
Molinė vandens masė:
Jei skystyje esančios molekulės yra sandariai supakuotos ir kiekviena iš jų telpa į kubą, kurio tūris V 1 su šonkauliu d, Tai.
Vienos molekulės tūris: ,kur: Vm viena malda, N A- Avogadro numeris.
Vieno molio skysčio tūris: , kur: M- jo molinė masė yra jo tankis.
Molekulės skersmuo:
Skaičiuodami turime: 
Santykinė aliuminio molekulinė masė Mr=27. Nustatykite jo pagrindines molekulines charakteristikas.
1. Aliuminio molinė masė: M=Mr. 10-3 M = 27 . 10 -3
Raskite molekulių, helio (M = 4,10 -3 kg/mol) koncentraciją normaliomis sąlygomis (p = 10 5 Pa, T = 273 K), jų vidutinį kvadratinį greitį ir dujų tankį.Iš kokio gylio vandens telkinyje kyla oro burbulas, jei jo tūris padvigubėja? Nežinome, ar oro temperatūra burbule išlieka tokia pati. Jei jis yra tas pats, tada kilimo procesas apibūdinamas lygtimi pV = pastovus . Jei pasikeičia, tada lygtis.
pV/T=konst
Įvertinkime, ar nepadarėme didelės klaidos, jei nepaisysime temperatūros pokyčių. Tarkime, kad turime nepalankiausią rezultatą, kad oras būtų labai karštas, o vandens temperatūra rezervuaro paviršiuje siektų +25 0 C (298 K). Apačioje temperatūra negali būti žemesnė nei +4 0 C (277 K), nes ši temperatūra atitinka didžiausią vandens tankį. Taigi temperatūros skirtumas yra 21K. Pradinės temperatūros atžvilgiu ši reikšmė yra %%. Vargu ar susidursime su tokiu vandens telkiniu, kurio paviršiaus ir dugno temperatūrų skirtumas lygus įvardintai reikšmei. Be to, burbulas gana greitai išplaukia ir mažai tikėtina, kad pakilimo metu jis turės laiko visiškai sušilti. Taigi tikroji paklaida bus žymiai mažesnė ir mes galime visiškai nepaisyti oro temperatūros pokyčio burbule ir naudoti Boyle-Mariotte dėsnį procesui apibūdinti:, p 1 V 1 = p 2 V 2 Kur: 1 p - oro slėgis burbule gylyje h (p 1 = p atm. + rgh), p 2 - oro slėgis šalia paviršiaus esančiame burbule.
 |
p 2 = p atm.
|
Apverstas stiklas panardinamas į tvenkinį. Kokiame gylyje stiklas pradės skęsti?
Apverstame stikle oras blokuojamas. Problema teigia, kad stiklas pradeda skęsti tik tam tikrame gylyje. Matyt, jei jis bus paleistas gylyje, mažesniame už tam tikrą kritinį gylį, jis plauks aukštyn (darant prielaidą, kad stiklas yra griežtai vertikaliai ir neapvirsta).
Lygis, virš kurio stiklas plūduriuoja ir žemiau kurio jis grimzta, pasižymi vienodomis jėgomis, veikiančiomis stiklą iš skirtingų pusių.
Jėgos, veikiančios stiklą vertikalia kryptimi, yra žemyn nukreipta gravitacinė jėga ir aukštyn plūduriuojanti jėga.
Gravitacijos jėga, veikianti stiklą, yra tiesiogiai proporcinga jo masei.
Iš problemos konteksto matyti, kad stiklui grimztant aukštyn nukreipta jėga mažėja. Plūdrumo jėgos sumažėjimas gali atsirasti tik dėl sumažėjusio išstumto skysčio tūrio, nes skysčiai praktiškai nesuspaudžiami, o vandens tankis paviršiuje ir tam tikrame gylyje yra vienodas.
Išstumto skysčio tūris gali sumažėti dėl oro suspaudimo stikle, o tai, savo ruožtu, gali atsirasti dėl slėgio padidėjimo. Į temperatūros pokytį panardinant stiklą galima nepaisyti, jei nesame suinteresuoti per dideliu rezultato tikslumu. Atitinkamas pagrindimas pateiktas ankstesniame pavyzdyje.
Santykis tarp dujų slėgio ir jų tūrio esant pastoviai temperatūrai išreiškiamas Boyle-Mariotte dėsniu.
Skysčio slėgis iš tikrųjų didėja didėjant gyliui ir perduodamas visomis kryptimis, įskaitant aukštyn, vienodai.
Hidrostatinis slėgis yra tiesiogiai proporcingas skysčio tankiui ir jo aukščiui (panardinimo gyliui).
Užrašę kaip pradinę lygtį lygtį, apibūdinančią stiklo pusiausvyros būseną, nuosekliai pakeitę į ją uždavinio analizės metu rastas išraiškas ir išsprendę gautą lygtį norimam gyliui, darome išvadą, kad norint Norėdami gauti skaitinį atsakymą, turime žinoti vandens tankio, atmosferos slėgio, stiklo masės, jo tūrio ir laisvojo kritimo pagreičio reikšmes.
Visi pateikti argumentai gali būti rodomi taip:
![]()
![]()

Kadangi problemos tekste duomenų nėra, nustatysime patys.
Duota:
Vandens tankis r=10 3 kg/m 3.
Atmosferos slėgis 10 5 Pa.
Stiklinės tūris 200 ml = 2 00. 10 -3 l = 2. 10-4 m 3.
Stiklo masė yra 50 g = 5. 10-2 kg.
Gravitacijos pagreitis g = 10 m/s 2.
Skaitinis sprendimas:

|
Kylančio baliono problemą, kaip ir skęstančio stiklo problemą, galima priskirti prie statinių problemų.
Kamuolys pradės kilti taip pat, kaip stiklas skęsti, kai tik bus sutrikdyta jėgų, veikiančių šiuos kūnus ir nukreiptų aukštyn ir žemyn, lygybė. Rutulį, kaip ir stiklą, veikia gravitacijos jėga, nukreipta žemyn, o plūdrumo jėga nukreipta į viršų.
Plūduriavimo jėga yra susijusi su rutulį supančio šalto oro tankiu. Šį tankį galima rasti iš Mendelejevo-Clapeyrono lygties.
Gravitacijos jėga yra tiesiogiai proporcinga rutulio masei. Rutulio masė, savo ruožtu, susideda iš apvalkalo masės ir karšto oro masės jame. Karšto oro masę taip pat galima rasti iš Mendelejevo-Klapeirono lygties.
Schematiškai samprotavimas gali būti parodytas taip:
![]()

Iš lygties galite išreikšti norimą dydį, įvertinti galimas dydžių, reikalingų skaitiniam problemos sprendimui, reikšmes, pakeisti šiuos kiekius į gautą lygtį ir rasti atsakymą skaitine forma.
Uždarame inde yra 200 g helio. Dujos patiria sudėtingą procesą. Jo parametrų pokytis atsispindi tūrio ir absoliučios temperatūros grafike.1. Išreikškite dujų masę SI.
2. Kokia yra šių dujų santykinė molekulinė masė?
3. Kokia yra šių dujų molinė masė (SI)?
4. Koks yra medžiagos kiekis inde?
5. Kiek dujų molekulių yra inde?
6. Kokia yra vienos šių dujų molekulės masė?
7. Įvardykite procesus 1-2, 2-3, 3-1 skyriuose.
8. Nustatykite dujų tūrį taškuose 1,2, 3, 4 ml, l, m 3.
9. Nustatykite dujų temperatūrą taškuose 1,2, 3, 4 esant 0 C, K.
10. Nustatykite dujų slėgį taškuose 1, 2, 3, 4 mm. rt. Art. , bankomatas, Pa.
11. Pavaizduokite šį procesą slėgio ir absoliučios temperatūros grafike.
12. Pavaizduokite šį procesą slėgio ir tūrio grafike.
Sprendimo nurodymai:
1. Žr. sąlygą.
2. Elemento santykinė molekulinė masė nustatoma naudojant periodinę lentelę.
3. M = p·10 -3 kg/mol.
7. p=const – izobarinis; V=const-izochoric; T=const – izoterminis.
8. 1 m 3 = 10 3 l; 1 l = 10 3 ml. 9. T = t+ 273. 10. 1 atm. = 10 5 Pa = 760 mm Hg. Art.
8-10. Galite naudoti Mendelejevo-Clapeyrono lygtį arba Boyle-Mariotte, Gay-Lussac, Charles dujų dėsnius.
Atsakymai į problemą
| m = 0,2 kg | |||||||
| M r = 4 | |||||||
| M = 4 10 -3 kg/mol | |||||||
| n = 50 mol | |||||||
| N = 3 10 25 | |||||||
| m =6,7 10 -27 kg | |||||||
| 1 - 2 - izobarinis | |||||||
| 2 - 3 - izochorinis | |||||||
| 3 - 1 - izoterminis | |||||||
| № | ml | l | m 3 | ||||
| 2 10 5 | 0,2 | ||||||
| 7 10 5 | 0,7 | ||||||
| 7 10 5 | 0,7 | ||||||
| 4 10 5 | 0,4 | ||||||
| № | 0 C | KAM | |||||
| № | mmHg | atm | Pa | ||||
| 7,6 10 3 | 10 6 | ||||||
| 7,6 10 3 | 10 6 | ||||||
| 2,28 10 3 | 0,3 10 6 | ||||||
| 3,8 10 3 | 0,5 10 6 | ||||||
 |
 |
||||||

 ,
, ,
,






