МОДУЛЬ 1 УУРГИЙН БҮТЭЦ, ШИНЖ, ҮЙЛ АЖИЛЛАГАА
МОДУЛЬ 1 УУРГИЙН БҮТЭЦ, ШИНЖ, ҮЙЛ АЖИЛЛАГАА
Модулийн бүтэц | Сэдвүүд |
Модульчлагдсан нэгж 1 | 1.1. Уургийн бүтцийн зохион байгуулалт. Уургийн уургийн хэлбэр үүсэх үе шатууд 1.2. Уургийн үйл ажиллагааны үндэс. Уургийн үйл ажиллагаанд нөлөөлдөг лигандууд болох эмүүд 1.3. Уургийн денатураци ба тэдгээрийн аяндаа нөхөн сэргэх боломж |
Модульчлагдсан нэгж 2 | 1.4. Гемоглобины жишээг ашиглан олигомер уургийн бүтэц, үйл ажиллагааны онцлог 1.5. Эсийн нөхцөлд уугуул уургийн хэлбэрийг хадгалах 1.6. Төрөл бүрийн уураг. Иммуноглобулины жишээг ашиглан уургийн гэр бүлүүд 1.7. Уургийн физик-химийн шинж чанар, тэдгээрийг ялгах арга |
Модуль нэгж 1 МОНОМЕР УУРГИЙН БҮТЭЦИЙН ЗОХИОН БАЙГУУЛАЛТ, ҮЙЛ АЖИЛЛАГААНЫ ҮНДЭС
Сургалтын зорилго:
1. Удамшлын болон олдмол протеинопати үүсэх механизмыг ойлгохын тулд уургийн бүтцийн онцлог, тэдгээрийн бүтцээс уургийн үйл ажиллагааны хамаарлын талаархи мэдлэгийг ашиглах.
2. Уурагтай харилцан үйлчлэлцэж, идэвхийг нь өөрчилдөг лигандын зарим эмийн эмчилгээний үйл ажиллагааны механизмыг тайлбарлана уу.
3. Уургийн бүтэц, конформацийн лабораторийн талаарх мэдлэгийг ашиглан тэдгээрийн бүтэц, үйл ажиллагааны тогтворгүй байдал, өөрчлөгдөж буй нөхцөлд денатурацид орох хандлагыг ойлгох.
4. Эмнэлгийн материал, багаж хэрэгслийг ариутгах, түүнчлэн антисептикийг ариутгах бодис болгон ашиглах талаар тайлбарлана уу.
Мэдэх:
1. Уургийн бүтцийн зохион байгуулалтын түвшин.
2. Уургийн үндсэн бүтцийн ач холбогдол нь тэдгээрийн бүтэц, үйл ажиллагааны олон янз байдлыг тодорхойлдог.
3. Уургийн идэвхтэй төв үүсэх механизм, уургийн үйл ажиллагааны үндэс болох лигандтай өвөрмөц харилцан үйлчлэл.
4. Экзоген лигандын (эм, хорт бодис, хор) уургийн бүтэц, функциональ үйл ажиллагаанд үзүүлэх нөлөөллийн жишээ.
5. Уургийн денатурацийн шалтгаан, үр дагавар, денатурацийг үүсгэгч хүчин зүйлс.
6. Анагаах ухаанд денатуратлах хүчин зүйлийг антисептик болон эмнэлгийн багаж хэрэгслийг ариутгах хэрэгсэл болгон ашиглах жишээ.
СЭДЭВ 1.1. УУРГИЙН БҮТЭЦИЙН ЗОХИОН БАЙГУУЛАЛТ. УХААН ҮҮСЭХ ҮЕ шатууд
УУРГИЙН ТОХИРОЛЦОО
Уургууд нь полимер молекулууд бөгөөд мономерууд нь ердөө 20 α-амин хүчил юм. Уургийн амин хүчлүүдийн нэгдэл ба дарааллыг хувь хүний ДНХ-ийн генийн бүтцээр тодорхойлдог. Уураг бүр өөрийн өвөрмөц бүтцийн дагуу өөрийн гэсэн үүргийг гүйцэтгэдэг. Тухайн организмын уургийн багц нь түүний фенотип шинж чанар, түүнчлэн удамшлын өвчин эсвэл тэдгээрийн хөгжилд урьдал нөхцөл байдлыг тодорхойлдог.
1. Уургийг бүрдүүлдэг амин хүчлүүд. Пептидийн холбоо.Уургууд нь мономерууд - 20 α-амин хүчлүүдээс бүрдсэн полимерууд бөгөөд тэдгээрийн ерөнхий томъёо нь:
Амин хүчлүүд нь α-нүүрстөрөгчийн атомд холбогдсон радикалуудын бүтэц, хэмжээ, физик-химийн шинж чанараараа ялгаатай байдаг. Амин хүчлүүдийн функциональ бүлгүүд нь янз бүрийн α-амин хүчлүүдийн шинж чанарын шинж чанарыг тодорхойлдог. α-амин хүчилд агуулагдах радикалуудыг хэд хэдэн бүлэгт хувааж болно.
Пролин,Бусад 19 уургийн мономерээс ялгаатай нь энэ нь амин хүчил биш, харин пролин дахь радикал нь α-нүүрстөрөгчийн атом болон имино бүлэгтэй холбоотой байдаг
 Амин хүчлүүд нь усанд уусах чадвараараа ялгаатай байдаг.Энэ нь радикалууд устай (гидрат) харилцан үйлчлэх чадвартай холбоотой юм.
Амин хүчлүүд нь усанд уусах чадвараараа ялгаатай байдаг.Энэ нь радикалууд устай (гидрат) харилцан үйлчлэх чадвартай холбоотой юм.
TO гидрофильанионик, катион болон туйлын цэнэггүй функциональ бүлгүүдийг агуулсан радикалууд орно.
TO гидрофобикметилийн бүлэг, алифатик гинж эсвэл цагираг агуулсан радикалууд орно.
2. Пептидийн холбоо нь амин хүчлүүдийг холбож пептид үүсгэдэг.Пептидийн нийлэгжилтийн явцад нэг амин хүчлийн α-карбоксил бүлэг нь нөгөө амин хүчлийн α-амин бүлэгтэй харилцан үйлчлэлцдэг. пептидийн холбоо:
Уургууд нь полипептид, i.e. пептидийн холбоогоор холбогдсон α-амин хүчлүүдийн шугаман полимерүүд (Зураг 1.1.)
 Цагаан будаа. 1.1. Пептидийн бүтцийг тодорхойлоход ашигладаг нэр томъёо
Цагаан будаа. 1.1. Пептидийн бүтцийг тодорхойлоход ашигладаг нэр томъёо
Полипептидийг бүрдүүлдэг амин хүчлүүдийн мономеруудыг нэрлэдэг амин хүчлийн үлдэгдэл.Давтагдах бүлгүүдийн гинж - NH-CH-CO- хэлбэрүүд пептидийн нуруу.Чөлөөт α-амин бүлэгтэй амин хүчлийн үлдэгдлийг N-терминал, чөлөөт α-карбоксил бүлэгтэйг нь С-терминал гэж нэрлэдэг. Пептидүүдийг N төгсгөлөөс С төгсгөл хүртэл бичиж уншдаг.
Пролиний имино бүлгээс үүссэн пептидийн холбоо нь бусад пептидийн холбооноос ялгаатай: пептидийн бүлгийн азотын атом нь устөрөгчгүй,
Үүний оронд радикалтай холбоо байдаг бөгөөд үүний үр дүнд цагирагны нэг тал нь пептидийн нуруунд багтдаг.
 Пептидүүд нь амин хүчлийн найрлага, амин хүчлүүдийн тоо, амин хүчлийн холболтын дарааллаар ялгаатай байдаг, жишээлбэл, Ser-Ala-Glu-Gis болон His-Glu-Ala-Ser хоёр өөр пептид юм.
Пептидүүд нь амин хүчлийн найрлага, амин хүчлүүдийн тоо, амин хүчлийн холболтын дарааллаар ялгаатай байдаг, жишээлбэл, Ser-Ala-Glu-Gis болон His-Glu-Ala-Ser хоёр өөр пептид юм.
Пептидийн холбоо нь маш хүчтэй бөгөөд тэдгээрийн химийн ферментийн бус гидролиз нь хатуу ширүүн нөхцлийг шаарддаг: шинжилж буй уураг нь 110 градусын температурт 24 цагийн турш төвлөрсөн давсны хүчилд гидролиз болдог. Амьд эсэд пептидийн холбоог тасалж болно протеолитик ферментүүд,дуудсан протеазуудэсвэл пептидийн гидролазууд.
3. Уургийн анхдагч бүтэц.Төрөл бүрийн уургийн пептидийн гинж дэх амин хүчлийн үлдэгдэл нь санамсаргүй байдлаар солигддоггүй, тодорхой дарааллаар байрладаг. Полипептидийн гинжин хэлхээнд байгаа амин хүчлийн үлдэгдлийн шугаман дараалал буюу ээлжийн дарааллыг гэнэ. уургийн анхдагч бүтэц.
Уураг бүрийн анхдагч бүтэц нь ДНХ-ийн молекулд (ген гэж нэрлэгддэг бүсэд) кодлогдсон байдаг бөгөөд транскрипц (мРНХ-д мэдээллийг хуулах) болон орчуулах (уургийн анхдагч бүтцийн нийлэгжилт) үед хэрэгждэг. Иймээс хувь хүний уургийн үндсэн бүтэц нь эцэг эхээс хүүхдэд удамшлын замаар дамждаг мэдээлэл бөгөөд энэ нь тухайн организмын уургийн бүтцийн онцлогийг тодорхойлдог бөгөөд үүнээс одоо байгаа уургийн үйл ажиллагаа хамаарна (Зураг 1.2.).
 Цагаан будаа. 1.2. Хүний биед нийлэгжсэн уургийн генотип ба конформацийн хоорондын хамаарал
Цагаан будаа. 1.2. Хүний биед нийлэгжсэн уургийн генотип ба конформацийн хоорондын хамаарал
Хүний биед ойролцоогоор 100,000 бие даасан уураг тус бүрд байдаг өвөрмөцанхдагч бүтэц. Ижил төрлийн уургийн молекулууд (жишээлбэл, альбумин) нь амин хүчлийн үлдэгдлүүдийн ижил ээлжтэй байдаг бөгөөд энэ нь альбуминыг бусад бие даасан уурагаас ялгаж өгдөг.
Пептидийн гинжин хэлхээнд байгаа амин хүчлийн үлдэгдлүүдийн дарааллыг мэдээллийг бүртгэх хэлбэр гэж үзэж болно. Энэхүү мэдээлэл нь шугаман пептидийн гинжин хэлхээний орон зайн нугалааг илүү нягтралтай гурван хэмжээст бүтэц болгон тодорхойлдог. зохицолхэрэм. Функциональ идэвхтэй уургийн конформац үүсэх процессыг нэрлэдэг нугалах
4. Уургийн зохицол.Пептидийн нуруунд чөлөөт эргэлт нь пептидийн бүлгийн азотын атом ба хөрш α-нүүрстөрөгчийн атомын хооронд, түүнчлэн α-нүүрстөрөгчийн атом ба карбонилийн бүлгийн нүүрстөрөгчийн хооронд боломжтой байдаг. Амин хүчлийн үлдэгдлийн функциональ бүлгүүдийн харилцан үйлчлэлийн улмаас уургийн анхдагч бүтэц нь илүү нарийн төвөгтэй орон зайн бүтцийг олж авах боломжтой. Бөмбөрцөг уургийн хувьд пептидийн гинжин хэлхээний эвхлийн хоёр үндсэн түвшин байдаг. хоёрдогчТэгээд гуравдагч бүтэц.
Уургийн хоёрдогч бүтэцпептидийн нурууны -C=O ба -NH- функциональ бүлгүүдийн хооронд устөрөгчийн холбоо үүссэний үр дүнд үүссэн орон зайн бүтэц юм. Энэ тохиолдолд пептидийн гинж нь хоёр төрлийн ердийн бүтцийг олж авах боломжтой. α-мушгиаТэгээд β-бүтэцүүд.
IN α-мушгиакарбонил бүлгийн хүчилтөрөгчийн атом ба түүнээс 4-р амин хүчлийн амид азотын устөрөгчийн хооронд устөрөгчийн холбоо үүсдэг; амин хүчлийн үлдэгдлийн хажуугийн гинж
хоёрдогч бүтэц үүсэхэд оролцохгүйгээр спираль захын дагуу байрладаг (Зураг 1.3.).
Бөөн радикалууд буюу ижил цэнэгтэй радикалууд нь α-геликс үүсэхээс сэргийлдэг. Цагираган бүтэцтэй пролиний үлдэгдэл нь α-геликсийг тасалдаг, учир нь пептидийн гинжин хэлхээнд азотын атомд устөрөгч байхгүй тул устөрөгчийн холбоо үүсэх боломжгүй юм. Азот ба α-нүүрстөрөгчийн атомын хоорондох холбоо нь пролин цагирагийн нэг хэсэг тул энэ үед пептидийн нуруу нугалж эхэлдэг.
β-бүтэцнь нэг полипептидийн гинжин хэлхээний пептидийн нурууны шугаман хэсгүүдийн хооронд үүсдэг бөгөөд ингэснээр атираат бүтэц үүсгэдэг. Полипептидийн гинж эсвэл тэдгээрийн хэсэг үүсч болно зэрэгцэээсвэл эсрэг параллель β-бүтэцүүд.Эхний тохиолдолд харилцан үйлчилж буй пептидийн гинжин хэлхээний N ба C төгсгөлүүд давхцаж, хоёр дахь нь эсрэг чиглэлтэй байна (Зураг 1.4).
Цагаан будаа. 1.3. Уургийн хоёрдогч бүтэц - α-геликс
 Цагаан будаа. 1.4. Зэрэгцээ ба эсрэг параллель β хуудасны бүтэц
Цагаан будаа. 1.4. Зэрэгцээ ба эсрэг параллель β хуудасны бүтэц
β-бүтэцүүдийг өргөн сумаар зааж өгсөн: A - Antiparallel β-бүтэц. B - Зэрэгцээ β хуудасны бүтэц
Зарим уургийн хувьд янз бүрийн полипептидийн гинжин хэлхээний пептидийн нурууны атомуудын хооронд устөрөгчийн холбоо үүссэний улмаас β-бүтэц үүсч болно.
Мөн уурагт байдаг жигд бус хоёрдогчтой газруудполипептидийн нурууны нугалах, гогцоо, эргэлтийг багтаасан бүтэц. Тэдгээр нь ихэвчлэн пептидийн гинжин хэлхээний чиглэл өөрчлөгддөг газруудад байрладаг, жишээлбэл, параллель β хуудасны бүтэц үүсэх үед.
α-спираль ба β-бүтэц байгаа эсэхээс хамааран бөмбөрцөг уургийг дөрвөн төрөлд хувааж болно.
Цагаан будаа. 1.5. Найман α-спираль агуулсан миоглобин (A) ба гемоглобины β-гинжин (B) хоёрдогч бүтэц
 Цагаан будаа. 1.6. Триосфосфат изомераза ба пируват киназын хоёрдогч бүтэц
Цагаан будаа. 1.6. Триосфосфат изомераза ба пируват киназын хоёрдогч бүтэц
 Цагаан будаа. 1.7. Иммуноглобулин (A) ба супероксид дисмутаза ферментийн (B) тогтмол домэйны хоёрдогч бүтэц
Цагаан будаа. 1.7. Иммуноглобулин (A) ба супероксид дисмутаза ферментийн (B) тогтмол домэйны хоёрдогч бүтэц
IN дөрөв дэх ангилалбага хэмжээний ердийн хоёрдогч бүтцийг агуулсан уургууд багтсан. Эдгээр уургууд нь цистеинээр баялаг жижиг уураг эсвэл металлопротейн агуулдаг.
Уургийн гуравдагч бүтэц- пептидийн гинжин хэлхээнд бие биенээсээ нэлээд зайд байрлах амин хүчлийн радикалуудын харилцан үйлчлэлийн улмаас үүссэн конформацийн төрөл. Ихэнх уургууд нь бөмбөрцөг (бөмбөрцөг уургууд) -тай төстэй орон зайн бүтцийг бүрдүүлдэг.
Гидрофобик амин хүчлийн радикалууд гэж нэрлэгддэг бодисоор нэгдэх хандлагатай байдаг гидрофобик харилцан үйлчлэлба молекул хоорондын ван дер Ваалсын хүчний нөлөөгөөр уургийн бөмбөрцөг дотор өтгөн гидрофобик цөм үүсдэг. Гидрофиль ионжуулсан ба ионжоогүй радикалууд нь уургийн гадаргуу дээр голчлон байрлаж, усанд уусах чадварыг нь тодорхойлдог.
 Цагаан будаа. 1.8. Уургийн гуравдагч бүтэц үүсэх үед амин хүчлийн радикалуудын хооронд үүсдэг бондын төрлүүд
Цагаан будаа. 1.8. Уургийн гуравдагч бүтэц үүсэх үед амин хүчлийн радикалуудын хооронд үүсдэг бондын төрлүүд
1 - ионы холбоо- эерэг ба сөрөг цэнэгтэй функциональ бүлгүүдийн хооронд үүсдэг;
2 - устөрөгчийн холбоо- гидрофиль цэнэггүй бүлэг болон бусад гидрофиль бүлгийн хооронд үүсдэг;
3 - гидрофобик харилцан үйлчлэл- гидрофобик радикалуудын хооронд үүсдэг;
4 - дисульфидын холбоо- цистеины үлдэгдлийн SH бүлгүүдийн исэлдэлт ба тэдгээрийн харилцан үйлчлэлийн улмаас үүсдэг.
Гидрофобик цөмд агуулагдах гидрофил амин хүчлийн үлдэгдэл нь бие биетэйгээ харилцан үйлчилж болно ионТэгээд устөрөгчийн холбоо(Зураг 1.8).
Ион ба устөрөгчийн холбоо, түүнчлэн гидрофобик харилцан үйлчлэл нь сул байдаг: тэдгээрийн энерги нь өрөөний температурт молекулуудын дулааны хөдөлгөөний энергиээс хамаагүй өндөр биш юм. Ийм олон сул холбоо үүссэнээр уургийн конформаци хадгалагдана. Уургийг бүрдүүлдэг атомууд байнгын хөдөлгөөнтэй байдаг тул зарим сул холбоог тасалж, заримыг нь үүсгэх боломжтой бөгөөд энэ нь полипептидийн гинжин хэлхээний бие даасан хэсгүүдийн бага зэрэг хөдөлгөөнд хүргэдэг. Уургийн энэ шинж чанарыг заримыг нь тасалж, бусад сул холбоог бий болгосны үр дүнд конформацийг өөрчлөхийг нэрлэдэг конформацийн labability.
Хүний биед туслах системүүд байдаг гомеостаз- эрүүл биед зөвшөөрөгдөх тодорхой хязгаарт дотоод орчны тогтвортой байдал. Гомеостазын нөхцөлд конформацийн бага зэргийн өөрчлөлт нь уургийн ерөнхий бүтэц, үйл ажиллагааг алдагдуулдаггүй. Уургийн функциональ идэвхтэй хэлбэрийг нэрлэдэг уугуул конформаци.Дотоод орчны өөрчлөлт (жишээлбэл, глюкоз, Ca ион, протон гэх мэт концентраци) нь уургийн үйл ажиллагааны өөрчлөлт, эвдрэлд хүргэдэг.
Зарим уургийн гуравдагч бүтэц тогтворждог дисульфидын холбоо,хоёр үлдэгдлийн -SH бүлгийн харилцан үйлчлэлийн улмаас үүссэн
 Цагаан будаа. 1.9. Уургийн молекул дахь дисульфидын холбоо үүсэх
Цагаан будаа. 1.9. Уургийн молекул дахь дисульфидын холбоо үүсэх
цистеин (Зураг 1.9). Ихэнх эсийн доторх уургууд нь гуравдагч бүтэцдээ ковалент дисульфидын холбоогүй байдаг. Тэдний оршихуй нь эсээс ялгардаг уургийн шинж чанар бөгөөд энэ нь эсийн гаднах нөхцөлд илүү тогтвортой байдлыг хангадаг. Тиймээс дисульфидын холбоо нь инсулин ба иммуноглобулины молекулуудад байдаг.
Инсулин- нойр булчирхайн β-эсүүдэд нийлэгжиж цусан дахь глюкозын концентраци ихэссэний хариуд цусанд ялгардаг уургийн даавар.
 Инсулины бүтцэд полипептидийн А ба В гинжийг холбосон хоёр дисульфидын холбоо, А гинж дотор нэг дисульфидын холбоо байдаг (Зураг 1.10).
Инсулины бүтцэд полипептидийн А ба В гинжийг холбосон хоёр дисульфидын холбоо, А гинж дотор нэг дисульфидын холбоо байдаг (Зураг 1.10).
Цагаан будаа. 1.10. Инсулины бүтэц дэх дисульфидын холбоо 5. Уургийн супер хоёрдогч бүтэц. Өөр өөр үндсэн бүтэц, функц бүхий уургийн хувьд заримдаа тэдгээрийг илрүүлдэгхоёрдогч бүтцийн ижил төстэй хослол ба харьцангуй байрлал;
Эдгээрийг супер хоёрдогч бүтэц гэж нэрлэдэг. Энэ нь уургийн гуравдагч бүтэц үүсэхэд хоёрдогч бүтцийн элементүүдийн өвөрмөц хослол учраас хоёрдогч ба гуравдагч бүтцийн хооронд завсрын байрлалыг эзэлдэг. Supersecondary бүтэц нь "α-helix-turn-a-helix", "leucine zipper", "zinc fingers" гэх мэт тусгай нэртэй байдаг. Ийм супер хоёрдогч бүтэц нь ДНХ-тэй холбох уургийн онцлог шинж юм."Лейцин цахилгаан товч."
 Энэ төрлийн супер хоёрдогч бүтэц нь хоёр уургийг хооронд нь холбоход ашиглагддаг. Харилцан үйлчилдэг уургийн гадаргуу дээр дор хаяж дөрвөн лейциний үлдэгдэл агуулсан α-спираль хэсгүүд байдаг. α-геликс дэх лейциний үлдэгдэл нь зургаан амин хүчлийн зайд байрладаг. α-геликсийн эргэлт бүрт 3.6 амин хүчлийн үлдэгдэл агуулагддаг тул лейциний радикалууд хоёр дахь эргэлт бүрт гадаргуу дээр байрладаг. Нэг уургийн α-геликсийн лейциний үлдэгдэл нь өөр уургийн лейциний үлдэгдэлтэй (гидрофобик харилцан үйлчлэл) харилцан үйлчилж, тэдгээрийг хооронд нь холбодог (Зураг 1.11.). ДНХ-г холбодог олон уураг нь бие биетэйгээ "лейцин цахилгаан товч" -оор холбогддог олигомерик цогцолборт ажилладаг.
Энэ төрлийн супер хоёрдогч бүтэц нь хоёр уургийг хооронд нь холбоход ашиглагддаг. Харилцан үйлчилдэг уургийн гадаргуу дээр дор хаяж дөрвөн лейциний үлдэгдэл агуулсан α-спираль хэсгүүд байдаг. α-геликс дэх лейциний үлдэгдэл нь зургаан амин хүчлийн зайд байрладаг. α-геликсийн эргэлт бүрт 3.6 амин хүчлийн үлдэгдэл агуулагддаг тул лейциний радикалууд хоёр дахь эргэлт бүрт гадаргуу дээр байрладаг. Нэг уургийн α-геликсийн лейциний үлдэгдэл нь өөр уургийн лейциний үлдэгдэлтэй (гидрофобик харилцан үйлчлэл) харилцан үйлчилж, тэдгээрийг хооронд нь холбодог (Зураг 1.11.). ДНХ-г холбодог олон уураг нь бие биетэйгээ "лейцин цахилгаан товч" -оор холбогддог олигомерик цогцолборт ажилладаг.
Ийм уургийн жишээ бол гистонууд юм. Гистонууд- олон тооны эерэг цэнэгтэй амин хүчлүүд агуулсан цөмийн уураг - аргинин ба лизин (80% хүртэл). Гистоны молекулууд нь "лейцин цахилгаан товч" ашиглан найман мономер агуулсан олигомерийн цогцолборуудад нэгтгэгддэг боловч эдгээр молекулуудын ижил төстэй цэнэгийг үл харгалзан үздэг.
"Цайрын хуруу"- ДНХ холбогч уургуудын онцлог шинж чанартай супер хоёрдогч бүтцийн хувилбар нь уургийн гадаргуу дээр сунасан фрагмент хэлбэртэй бөгөөд 20 орчим амин хүчлийн үлдэгдэл агуулдаг (Зураг 1.12). "Өргөтгөсөн хуруу" хэлбэр нь дөрвөн амин хүчлийн радикалтай холбогдсон цайрын атомаар бэхлэгддэг - хоёр цистеины үлдэгдэл, хоёр гистидиний үлдэгдэл. Зарим тохиолдолд гистидиний үлдэгдэл оронд цистеины үлдэгдэл байдаг. Ойролцоогоор цистеины хоёр үлдэгдэл нь бусад хоёр Гисили үлдэгдэлээс ойролцоогоор 12 амин хүчлийн үлдэгдэлээс бүрдэх Cys дарааллаар тусгаарлагддаг. Уургийн энэ хэсэг нь α-геликс үүсгэдэг бөгөөд радикалууд нь ДНХ-ийн гол ховилын зохицуулалтын хэсгүүдтэй тусгайлан холбогдож чаддаг. Бие даасан холболтын өвөрмөц байдал
 Цагаан будаа. 1.12. "Цайрын хуруу" бүтцийг бүрдүүлдэг ДНХ-тэй холбох уургийн бүсийн анхдагч бүтэц (үсэгүүд нь энэ бүтцийг бүрдүүлдэг амин хүчлүүдийг заана)
Цагаан будаа. 1.12. "Цайрын хуруу" бүтцийг бүрдүүлдэг ДНХ-тэй холбох уургийн бүсийн анхдагч бүтэц (үсэгүүд нь энэ бүтцийг бүрдүүлдэг амин хүчлүүдийг заана)
Зохицуулах ДНХ-ийн уураг нь цайрын хурууны бүсэд байрлах амин хүчлийн үлдэгдлүүдийн дарааллаас хамаардаг. Ийм бүтэц нь ялангуяа транскрипцийг зохицуулахад оролцдог стероид гормоны рецепторуудыг агуулдаг (ДНХ-ээс РНХ хүртэлх мэдээллийг унших).
СЭДЭВ 1.2. УУРАГИЙН ҮЙЛ АЖИЛЛАГААНЫ ҮНДЭС. УУРГИЙН ҮЙЛ АЖИЛЛАГААНД НӨЛӨӨЛӨГЧ ЛИГАНД БОЛОХ ЭМ
1. Уургийн идэвхтэй төв ба түүний лигандтай харилцан үйлчлэл.Гуравдагч бүтэц үүсэх үед үндсэн бүтцээрээ бие биенээсээ хол зайд орших амин хүчлийн радикалуудаас бүрдсэн голдуу завсарлагаан дахь функциональ идэвхтэй уургийн гадаргуу дээр бүс үүсдэг. Тухайн уургийн хувьд өвөрмөц бүтэцтэй, тодорхой молекул эсвэл ижил төстэй молекулуудын бүлэгтэй тусгайлан харьцах чадвартай энэ бүсийг уураг-лиганд холбох газар буюу идэвхтэй газар гэж нэрлэдэг. Лиганд нь уурагтай харилцан үйлчилдэг молекулууд юм.
Өндөр өвөрмөц байдалУургийн лигандтай харилцан үйлчлэл нь идэвхтэй төвийн бүтцийг лигандын бүтэцтэй нөхөх замаар хангагдана.
Нэмэлт байдал- энэ бол харилцан үйлчлэх гадаргуугийн орон зайн болон химийн харилцан хамаарал юм. Идэвхтэй төв нь түүнд багтсан лигандтай орон зайн хувьд таарч байхаас гадна идэвхтэй төвд багтсан радикалуудын функциональ бүлгүүд болон лигандыг агуулж байдаг лигандын хооронд холбоо (ион, устөрөгч, гидрофобик харилцан үйлчлэл) үүсэх ёстой. идэвхтэй төвд (Зураг 1.13).
 Цагаан будаа. 1.13. Уургийн лигандтай нэмэлт харилцан үйлчлэл
Цагаан будаа. 1.13. Уургийн лигандтай нэмэлт харилцан үйлчлэл
Зарим лигандууд уургийн идэвхтэй төвд бэхлэгдсэн үед уургийн үйл ажиллагаанд туслах үүрэг гүйцэтгэдэг. Ийм лигандуудыг кофактор гэж нэрлэдэг ба уургийн бус хэсгийг агуулсан уураг гэж нэрлэдэг нарийн төвөгтэй уураг(зөвхөн уургийн хэсгээс бүрдэх энгийн уургуудаас ялгаатай). Уурагтай нягт холбогдсон уургийн бус хэсгийг нэрлэдэг протезийн бүлэг.Жишээлбэл, миоглобин, гемоглобин, цитохромууд нь идэвхтэй төвд нягт наалдсан төмрийн ион агуулсан протезийн бүлэг, гем агуулдаг. Гем агуулсан цогц уурагуудыг гемопротейн гэж нэрлэдэг.
Өвөрмөц лигандууд уурагтай хавсарч байвал эдгээр уургийн үйл ажиллагаа илэрдэг. Тиймээс цусны сийвэн дэх хамгийн чухал уураг болох альбумин нь идэвхтэй төвд өөхний хүчил, билирубин, зарим эм гэх мэт гидрофоб лигандуудыг хавсаргаж тээвэрлэх үүргээ гүйцэтгэдэг (Зураг 1.14).
Пептидийн гинжин хэлхээний гурван хэмжээст бүтэцтэй харилцан үйлчилдэг лигандууд нь зөвхөн бага молекулт органик ба органик бус молекулууд төдийгүй макромолекулууд байж болно.
ДНХ (дээр дурдсан ДНХ холбогч уураг бүхий жишээнүүд);
полисахаридууд;
 Цагаан будаа. 1.14. Генотип ба фенотипийн хоорондын хамаарал
Цагаан будаа. 1.14. Генотип ба фенотипийн хоорондын хамаарал
ДНХ молекулд кодлогдсон хүний уургийн өвөрмөц анхдагч бүтэц нь эсэд өвөрмөц конформаци, идэвхтэй төвийн бүтэц, уургийн функц хэлбэрээр явагддаг.
Эдгээр тохиолдлуудад уураг нь холбогч хэсэгт тохирсон, нэмэлт болох лигандын тодорхой хэсгийг хүлээн зөвшөөрдөг. Тиймээс гепатоцитын гадаргуу дээр инсулин дааврын рецепторын уураг байдаг бөгөөд энэ нь уургийн бүтэцтэй байдаг. Инсулины рецептортой харилцан үйлчлэлцэх нь түүний хэлбэр, дохиоллын системийг идэвхжүүлж, хоол идсэний дараа элэгний эсэд шим тэжээлийг хадгалахад хүргэдэг.
Тиймээс, Уургийн үйл ажиллагаа нь уургийн идэвхтэй төвийн лигандтай тодорхой харилцан үйлчлэлд суурилдаг.
2. Домэйн бүтэц, уургийн үйл ажиллагаанд гүйцэтгэх үүрэг.Бөмбөрцөг уургийн урт полипептидийн гинж нь ихэвчлэн хэд хэдэн нягт, харьцангуй бие даасан бүсэд нугалав. Тэдгээр нь бие даасан гуравдагч бүтэцтэй бөгөөд бөмбөрцөг хэлбэрийн уургуудыг санагдуулдаг бөгөөд тэдгээрийг нэрлэдэг домэйнууд.Уургийн домайн бүтцээс шалтгаалан тэдгээрийн гуравдагч бүтэц үүсэхэд хялбар байдаг.
Домэйн уургуудад лиганд холбох газрууд нь ихэвчлэн домайнуудын хооронд байрладаг. Тиймээс трипсин нь нойр булчирхайн гадна шүүрлийн хэсгээс үүсдэг протеолитик фермент бөгөөд хүнсний уургийг боловсруулахад шаардлагатай байдаг. Энэ нь хоёр домайн бүтэцтэй бөгөөд трипсиныг түүний лиганд - хүнсний уурагтай холбох төв нь хоёр домэйны хоорондох ховилд байрладаг. Идэвхтэй төвд хүнсний уургийн тодорхой хэсгийг үр дүнтэй холбох, түүний пептидийн холбоог гидролиз хийхэд шаардлагатай нөхцлийг бүрдүүлдэг.
Идэвхтэй төв нь лигандтай харилцан үйлчлэх үед уургийн өөр өөр домэйнууд бие биенээсээ харьцангуй хөдөлж болно (Зураг 1.15).
Гексокиназа- ATP ашиглан глюкозын фосфоржилтыг хурдасгадаг фермент. Ферментийн идэвхтэй хэсэг нь хоёр домайны завсарт байрладаг. Гексокиназа нь глюкозтой холбогдох үед түүний эргэн тойрон дахь доменууд хаагдаж, субстрат баригдаж, фосфоржилт үүсдэг (1.15-р зургийг үз).
 Цагаан будаа. 1.15. Гексокиназын домайныг глюкозтой холбох
Цагаан будаа. 1.15. Гексокиназын домайныг глюкозтой холбох
Зарим уургуудад домэйнууд нь янз бүрийн лигандуудтай холбогдож бие даасан функцийг гүйцэтгэдэг. Ийм уургийг олон үйлдэлт гэж нэрлэдэг.
3. Эм нь уургийн үйл ажиллагаанд нөлөөлдөг лигандууд юм.Уургийн лигандын харилцан үйлчлэл нь өвөрмөц шинж чанартай байдаг. Гэсэн хэдий ч уураг ба түүний идэвхтэй төвийн конформацийн лабораторийн улмаас идэвхтэй төв эсвэл молекулын бусад хэсэг дэх уурагтай харилцан үйлчлэх өөр бодисыг сонгох боломжтой.
Байгалийн лигандтай төстэй бүтэцтэй бодисыг нэрлэдэг Лигандын бүтцийн аналогэсвэл байгалийн бус лиганд. Мөн идэвхтэй байрлал дахь уурагтай харилцан үйлчилдэг. Лигандын бүтцийн аналог нь уургийн үйл ажиллагааг сайжруулж чаддаг (агонист),мөн үүнийг багасгах (антагонист).Лиганд ба түүний бүтцийн аналогууд нь нэг газар дахь уурагтай холбогдохын тулд хоорондоо өрсөлддөг. Ийм бодисыг нэрлэдэг өрсөлдөх чадвартай модуляторуудуургийн үйл ажиллагааны (зохицуулагчид). Олон эм нь уургийн дарангуйлагчийн үүрэг гүйцэтгэдэг. Тэдгээрийн заримыг байгалийн лигандын химийн өөрчлөлтөөр олж авдаг. Уургийн функцийг дарангуйлагч нь эм, хор байж болно.
Атропин нь M-холинергик рецепторуудын өрсөлдөх чадвартай дарангуйлагч юм.Ацетилхолин нь холинергик синапсаар мэдрэлийн импульс дамжуулахад зориулагдсан нейротрансмиттер юм. Өдөөлт явуулахын тулд синапсын ан цав руу ялгарсан ацетилхолин нь постсинаптик мембраны рецепторын уурагтай харилцан үйлчлэх ёстой. Хоёр төрөл олдсон холинергик рецепторууд:
М рецепторацетилхолиноос гадна мускаринтай (ялааны агарик токсин) сонгомол харилцан үйлчлэлцдэг. M - холинергик рецепторууд нь гөлгөр булчинд байдаг бөгөөд ацетилхолинтой харьцахдаа тэдгээрийн агшилтыг үүсгэдэг;
H рецепторялангуяа никотинтой холбогддог. N-холинергик рецепторууд нь судалтай араг ясны булчингийн синапсуудад байрладаг.
Тусгай дарангуйлагч М-холинергик рецепторуудатропин юм. Энэ нь belladonna болон henbane ургамлаас олддог.
 Атропин нь ацетилхолин ба тэдгээрийн орон зайн бүтэцтэй төстэй функциональ бүлгүүдтэй тул M-холинергик рецепторуудын өрсөлдөх чадвартай дарангуйлагч юм. Ацетилхолиныг M-холинергик рецептортой холбох нь гөлгөр булчингийн агшилтыг үүсгэдэг тул атропиныг спазмыг намдаах эм болгон ашигладаг. (спазматик).Тиймээс атропиныг нүдний ёроолыг үзэх үед нүдний булчинг тайвшруулах, мөн ходоод гэдэсний коликийн үед спазмыг арилгахад ашигладаг. М-холинергик рецепторууд нь төв мэдрэлийн системд (төв мэдрэлийн систем) байдаг тул их хэмжээний атропин нь төв мэдрэлийн системээс хүсээгүй урвал үүсгэдэг: мотор болон сэтгэцийн цочрол, хий үзэгдэл, таталт.
Атропин нь ацетилхолин ба тэдгээрийн орон зайн бүтэцтэй төстэй функциональ бүлгүүдтэй тул M-холинергик рецепторуудын өрсөлдөх чадвартай дарангуйлагч юм. Ацетилхолиныг M-холинергик рецептортой холбох нь гөлгөр булчингийн агшилтыг үүсгэдэг тул атропиныг спазмыг намдаах эм болгон ашигладаг. (спазматик).Тиймээс атропиныг нүдний ёроолыг үзэх үед нүдний булчинг тайвшруулах, мөн ходоод гэдэсний коликийн үед спазмыг арилгахад ашигладаг. М-холинергик рецепторууд нь төв мэдрэлийн системд (төв мэдрэлийн систем) байдаг тул их хэмжээний атропин нь төв мэдрэлийн системээс хүсээгүй урвал үүсгэдэг: мотор болон сэтгэцийн цочрол, хий үзэгдэл, таталт.
Дитилин нь Н-холинергик рецепторуудын өрсөлдөх чадвартай агонист бөгөөд мэдрэлийн булчингийн синапсуудын үйл ажиллагааг саатуулдаг.
 Араг ясны булчингийн мэдрэлийн булчингийн синапсууд нь H-холинергик рецепторуудыг агуулдаг. Тэдний ацетилхолинтой харьцах нь булчингийн агшилтанд хүргэдэг. Зарим мэс заслын үйл ажиллагаа, түүнчлэн дурангийн судалгаанд араг ясны булчинг тайвшруулдаг эмийг хэрэглэдэг. (булчин сулруулагч).Эдгээрт ацетилхолины бүтцийн аналог болох дитилин орно. Энэ нь H-холинергик рецептортой холбогддог боловч ацетилхолиноос ялгаатай нь ацетилхолинестераза ферментээр маш удаан устдаг. Ионы сувгийг удаан хугацаагаар нээж, мембраны байнгын деполяризацийн үр дүнд мэдрэлийн импульсийн дамжуулалт алдагдаж, булчин сулрах болно. Эхэндээ эдгээр шинж чанаруудыг курарегийн хорд олж илрүүлсэн тул ийм эмийг нэрлэдэг кураре шиг.
Араг ясны булчингийн мэдрэлийн булчингийн синапсууд нь H-холинергик рецепторуудыг агуулдаг. Тэдний ацетилхолинтой харьцах нь булчингийн агшилтанд хүргэдэг. Зарим мэс заслын үйл ажиллагаа, түүнчлэн дурангийн судалгаанд араг ясны булчинг тайвшруулдаг эмийг хэрэглэдэг. (булчин сулруулагч).Эдгээрт ацетилхолины бүтцийн аналог болох дитилин орно. Энэ нь H-холинергик рецептортой холбогддог боловч ацетилхолиноос ялгаатай нь ацетилхолинестераза ферментээр маш удаан устдаг. Ионы сувгийг удаан хугацаагаар нээж, мембраны байнгын деполяризацийн үр дүнд мэдрэлийн импульсийн дамжуулалт алдагдаж, булчин сулрах болно. Эхэндээ эдгээр шинж чанаруудыг курарегийн хорд олж илрүүлсэн тул ийм эмийг нэрлэдэг кураре шиг.
СЭДЭВ 1.3. УУРГИЙН ДЕНАТУРАЦИАЛ БА ТЭДНИЙГ АЯДАА СЭРГЭЭХ БОЛОМЖ
1. Сул харилцан үйлчлэлийн улмаас уургийн үндсэн хэлбэр хадгалагддаг тул уургийг хүрээлэн буй орчны найрлага, шинж чанар өөрчлөгдөх, химийн урвалж, физик хүчин зүйлсийн нөлөөлөл нь тэдгээрийн конформацийн өөрчлөлтийг үүсгэдэг (конформацийн лабиль шинж чанар). Олон тооны холбоог таслах нь уургийн төрөлхийн хэлбэр, денатурацийг устгахад хүргэдэг.
Уургийн денатураци- энэ нь уургийн орон зайн бүтцийг тогтворжуулдаг сул холбоо тасарсанаас үүссэн денатурат бодисын нөлөөн дор тэдний төрөлх хэлбэрийг устгах явдал юм. Денатураци нь уургийн өвөрмөц гурван хэмжээст бүтэц, идэвхтэй төвийг устгаж, түүний биологийн идэвхийг алддаг (Зураг 1.16).
Нэг уургийн бүх денатурат молекулууд нь ижил уургийн бусад молекулуудаас ялгаатай санамсаргүй хэлбэрийг олж авдаг. Идэвхтэй төвийг бүрдүүлдэг амин хүчлийн радикалууд нь бие биенээсээ орон зайн зайд оршдог, өөрөөр хэлбэл. Лигандтай уургийн тусгай холбох газар устдаг. Денатурацийн үед уургийн анхдагч бүтэц өөрчлөгдөөгүй хэвээр байна.
Биологийн судалгаа, анагаах ухаанд денатурат бодисыг хэрэглэх.Биохимийн судалгаанд биологийн материалд бага молекул жинтэй нэгдлүүдийг тодорхойлохын өмнө эхлээд уусмалаас уургийг зайлуулдаг. Энэ зорилгоор трихлорацетик хүчил (TCA) ихэвчлэн ашиглагддаг. Уусмалд TCA нэмсний дараа денатурат уургууд тунадасжиж, шүүж амархан арилгадаг (Хүснэгт 1.1.)
Анагаах ухаанд денатуржуулагч бодисыг ихэвчлэн автоклавт (денатуржуулагч бодис нь өндөр температурт) эмнэлгийн багаж хэрэгсэл, материалыг ариутгахад, эмгэг төрүүлэгч микрофлорыг агуулсан бохирдсон гадаргууг эмчлэхэд антисептик (спирт, фенол, хлорамин) болгон ашигладаг.
2. Уургийн аяндаа дахин идэвхжих- уургийн анхдагч бүтэц, хэлбэр, үйл ажиллагааны детерминизмын нотолгоо. Хувь хүний уураг нь ижил амин хүчлийн дараалалтай, эсэд ижил хэлбэрийг олж авдаг нэг генийн бүтээгдэхүүн юм. Уургийн анхдагч бүтэц нь түүний бүтэц, үйл ажиллагааны талаархи мэдээллийг агуулдаг гэсэн үндсэн дүгнэлтийг зарим уураг (ялангуяа рибонуклеаза ба миоглобин) аяндаа нөхөн сэргээх - денатурацийн дараа төрөлх хэлбэрээ сэргээх чадвар дээр үндэслэн хийсэн.
Орон зайн уургийн бүтцийг бий болгох нь өөрөө угсрах аргаар явагддаг - өвөрмөц анхдагч бүтэцтэй полипептидийн гинж нь уусмал дахь хамгийн бага чөлөөт энергитэй конформацийг хүлээн авах хандлагатай байдаг аяндаа явагддаг процесс юм. Денатурацийн дараа анхдагч бүтцээ хадгалж үлдэх уургийг нөхөн сэргээх чадварыг рибонуклеаза ферменттэй хийсэн туршилтаар тодорхойлсон.
Рибонуклеаза нь РНХ молекул дахь бие даасан нуклеотидын хоорондын холбоог задалдаг фермент юм. Энэхүү бөмбөрцөг уураг нь нэг полипептидийн гинжтэй бөгөөд гуравдагч бүтэц нь олон сул, дөрвөн дисульфидын холбоогоор тогтворждог.
Рибонуклеазыг молекул дахь устөрөгчийн холбоог тасалдаг мочевин, дисульфидын холбоог тасалдаг бууруулагч бодисоор эмчлэх нь ферментийн денатураци, түүний үйл ажиллагааг алдагдахад хүргэдэг.
Диализаар денатурат бодисыг зайлуулах нь уургийн бүтэц, үйл ажиллагааг сэргээхэд хүргэдэг, i.e. дахин төрөх. (Зураг 1.17).
 Цагаан будаа. 1.17. Рибонуклеазын денатураци ба нөхөн сэргэлт
Цагаан будаа. 1.17. Рибонуклеазын денатураци ба нөхөн сэргэлт
A - гуравдагч бүтцэд дөрвөн дисульфидын холбоо байдаг рибонуклеазын унаган хэлбэр; B - денатурат рибонуклеазын молекул;
B - сэргээгдсэн бүтэц, үйл ажиллагаа бүхий рибонуклеазын молекулыг дахин идэвхжүүлсэн
1. Хүснэгт 1.2-ыг бөглөнө үү.
Хүснэгт 1.2. Радикалуудын туйлшралын дагуу амин хүчлүүдийн ангилал
2. Тетрапептидийн томъёог бичнэ үү.
Asp - Pro - Fen - Liz
a) пептидийн нурууг бүрдүүлдэг пептидийн давтагдах бүлгүүд болон амин хүчлийн радикалуудаар илэрхийлэгдэх хувьсах бүлгүүдийг тодруулна;
б) N ба C төгсгөлийг шошголох;
в) пептидийн холбоог тодруулах;
г) ижил амин хүчлээс бүрдсэн өөр пептид бичих;
д) ижил төстэй амин хүчлийн найрлагатай тетрапептидын боломжит хувилбаруудын тоог тоол.
3. Хөхтөн амьтдын нейрогипофизийн бүтцийн хувьд ижил төстэй, хувьслын хувьд ойрхон хоёр пептидийн гормон болох окситоцин ба вазопрессиныг харьцуулсан шинжилгээний жишээн дээр уургийн анхдагч бүтцийн үүргийг тайлбарла (Хүснэгт 1.3).
Хүснэгт 1.3. Окситоцин ба вазопрессины бүтэц, үүрэг
 Үүнийг хийхийн тулд:
Үүнийг хийхийн тулд:
a) хоёр пептидийн найрлага, амин хүчлийн дарааллыг харьцуулах;
б) хоёр пептидийн анхдагч бүтцийн ижил төстэй байдал ба тэдгээрийн биологийн үйл ажиллагааны ижил төстэй байдлыг олох;
в) хоёр пептидийн бүтцийн ялгаа, тэдгээрийн үйл ажиллагааны ялгааг олох;
г) пептидийн анхдагч бүтэц нь тэдгээрийн үйл ажиллагаанд үзүүлэх нөлөөний талаар дүгнэлт гаргах.
4. Бөмбөрцөг уургийн конформац үүсэх үндсэн үе шатуудыг тайлбарлана уу (хоёрдогч, гуравдагч бүтэц, супер хоёрдогч бүтцийн тухай ойлголт). Уургийн бүтэц үүсэхэд оролцдог бондын төрлийг заана уу. Ямар амин хүчлийн радикалууд нь гидрофобик харилцан үйлчлэл, ион, устөрөгчийн холбоо үүсэхэд оролцдог.
Жишээ хэлнэ үү.
5. "Уургийн конформацийн лаборатори" гэсэн ойлголтыг тодорхойлох, түүний оршин тогтнох шалтгаан, ач холбогдлыг зааж өгнө үү.
6. Дараах хэллэгийн утгыг өргөжүүлээрэй: "Уургийн үйл ажиллагаа нь тэдгээрийн лигандтай тодорхой харилцан үйлчлэлд суурилдаг" гэсэн нэр томъёог ашиглан тэдгээрийн утгыг тайлбарлах: уургийн бүтэц, идэвхтэй төв, лиганд, нэмэлт, уургийн үйл ажиллагаа.
7. Нэг жишээн дээр домайн гэж юу болох, уургийн үйл ажиллагаанд ямар үүрэг гүйцэтгэдэг болохыг тайлбарла.
ӨӨРИЙГӨӨ ХЯНАХ ДААЛГАВАР
1. Тоглолт.
Амин хүчлийн радикал дахь функциональ бүлэг:
A. Карбоксил бүлэг B. Гидроксил бүлэг С Гуанидины бүлэг D. Тиол бүлэг E. Амин бүлэг
2. Зөв хариултуудыг сонгоно уу.
Туйлгүй цэнэггүй радикал бүхий амин хүчлүүд нь:
A. Cis B. Asn
B. Glu G. Гурав
3. Зөв хариултуудыг сонгоно уу.
Амин хүчлийн радикалууд:
A. Анхан шатны бүтцийн онцлогийг хангах B. Гуравдагч бүтцийг бүрдүүлэхэд оролцох
B. Уургийн гадаргуу дээр байрлаж уусах чанарт нөлөөлдөг D. Идэвхтэй төвийг бүрдүүлдэг
D. Пептидийн холбоо үүсэхэд оролцоно
4. Зөв хариултуудыг сонгоно уу.
Амин хүчлийн радикалуудын хооронд гидрофобик харилцан үйлчлэл үүсч болно.
A. Tre Lay B. Pro Гурав
B. Met Ile G. Tir Ala D. Val Fen
5. Зөв хариултуудыг сонгоно уу.
Амин хүчлийн радикалуудын хооронд ионы холбоо үүсч болно.
A. Gln Asp B. Apr Liz
B. Liz Glu G. Gis Asp D. Asn 4-р сар
6. Зөв хариултуудыг сонгоно уу.
Амин хүчлийн радикалуудын хооронд устөрөгчийн холбоо үүсч болно.
A. Ser Gln B. Cis Tre
B. Asp Liz G. Glu Asp D. Asn Tre
7. Тоглолт.
Уургийн бүтэц үүсэхэд оролцдог бондын төрөл:
A. Анхдагч бүтэц B. Хоёрдогч бүтэц
B. Гуравдагч бүтэц
D. Хэт хоёрдогч бүтэц E. Конформаци.
1. Пептидийн нурууны атомуудын хоорондох устөрөгчийн холбоо
2. Амин хүчлийн радикалуудын функциональ бүлгүүдийн хоорондын холбоо сул
3. Амин хүчлүүдийн α-амин ба α-карбоксил бүлгүүдийн хоорондын холбоо
8. Зөв хариултуудыг сонгоно уу. Трипсин:
A. Уураг задлагч фермент B. Хоёр домэйн агуулсан
B. Цардуулыг гидролиз болгодог
D. Идэвхтэй сайт нь домайнуудын хооронд байрладаг. D. Хоёр полипептидийн гинжээс бүрдэнэ.
9. Зөв хариултуудыг сонгоно уу. Атропин:
A. Мэдрэл дамжуулагч
B. Ацетилхолины бүтцийн аналог
B. Н-холинергик рецепторуудтай харилцан үйлчилдэг
D. Холинергик синапсаар мэдрэлийн импульсийн дамжуулалтыг бэхжүүлнэ
D. М-холинергик рецепторуудын өрсөлдөөнт дарангуйлагч
10. Зөв мэдэгдлүүдийг сонгоно уу. Уургийн хувьд:
A. Анхдагч бүтэц нь идэвхтэй сайтынхаа бүтцийн талаарх мэдээллийг агуулдаг
B. Идэвхтэй төв нь анхдагч бүтцийн түвшинд үүсдэг
B. Конформац нь ковалент холбоогоор хатуу тогтоогддог
D. Идэвхтэй хэсэг нь ижил төрлийн лигандуудын бүлэгтэй харьцаж болно
уургийн конформацийн labability улмаас D. Хүрээлэн буй орчны өөрчлөлт нь идэвхтэй бодисын ойр дотно байдалд нөлөөлдөг.
төвөөс лиганд
1. 1-B, 2-G, 3-B.
3. A, B, C, D.
7. 1-B, 2-D, 3-A.
8. A, B, C, D.
ҮНДСЭН НЭР ХҮЛЭЭР, ҮЗЭЛЧИЛГЭЭ
1. Уураг, полипептид, амин хүчлүүд
2. Анхдагч, хоёрдогч, гуравдагч уургийн бүтэц
3. Конформаци, уугуул уургийн хэлбэр
4. Уургийн ковалент ба сул холбоо
5. Конформацийн лабиль
6. Уургийн идэвхтэй хэсэг
7. Лигандууд
8. Уураг нугалах
9. Лигандын бүтцийн аналогууд
10. Домэйн уураг
11. Энгийн ба нарийн төвөгтэй уураг
12. Уургийн денатураци, денатурат бодис
13. Уургийг дахин идэвхжүүлэх
Асуудлыг шийдэх
"Уургийн бүтцийн зохион байгуулалт ба тэдгээрийн үйл ажиллагааны үндэс"
1. Уургийн гол үүрэг - гемоглобин А (HbA) нь эд эсэд хүчилтөрөгч тээвэрлэх явдал юм. Хүний популяцид шинж чанар, функц нь өөрчлөгдсөн энэ уургийн олон хэлбэрийг мэддэг - хэвийн бус гемоглобин гэж нэрлэдэг. Жишээлбэл, хадуур эсийн өвчтэй (HbS) өвчтэй өвчтөнүүдийн цусны улаан эсэд агуулагддаг гемоглобин S нь хүчилтөрөгчийн хэсэгчилсэн даралт багатай нөхцөлд уусах чадвар багатай байдаг (венийн цусанд байдаг шиг). Энэ нь энэ уургийн агрегатууд үүсэхэд хүргэдэг. Уураг нь үйл ажиллагаагаа алдаж, тунадасжиж, цусны улаан эсүүд жигд бус хэлбэртэй (зарим нь хадуур хэлбэртэй байдаг) дэлүүнд ердийнхөөс илүү хурдан устдаг. Үүний үр дүнд хадуур эсийн цус багадалт үүсдэг.
HbA-ийн анхдагч бүтцийн цорын ганц ялгаа нь гемоглобины β-гинжин хэлхээний N төгсгөлийн бүсэд илэрсэн. β хэлхээний N төгсгөлийн бүсүүдийг харьцуулж, уургийн анхдагч бүтцийн өөрчлөлт нь түүний шинж чанар, үйл ажиллагаанд хэрхэн нөлөөлж байгааг харуул.
 Үүнийг хийхийн тулд:
Үүнийг хийхийн тулд:
a) HbA-ийн ялгаатай амин хүчлүүдийн томъёог бичиж, эдгээр амин хүчлүүдийн шинж чанарыг (туйлшрал, цэнэг) харьцуулна уу.
б) уусах чадвар буурч, эд эсэд хүчилтөрөгчийн тээвэрлэлт тасалдсан шалтгааны талаар дүгнэлт гаргах.
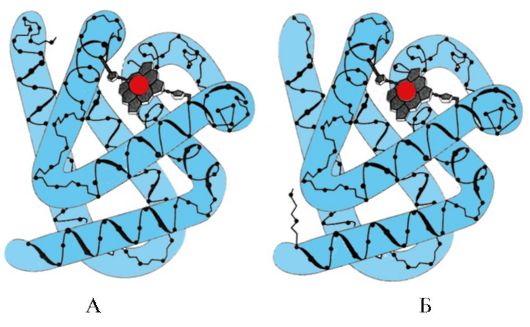
2. Зураг дээр лиганд (идэвхтэй төв) бүхий холбох төвтэй уургийн бүтцийн диаграммыг үзүүлэв. Уураг яагаад лиганд сонгохдоо сонгомол байдгийг тайлбарла. Үүнийг хийхийн тулд:
a) уургийн идэвхтэй төв гэж юу болохыг санаж, зурагт үзүүлсэн уургийн идэвхтэй төвийн бүтцийг авч үзэх;
б) идэвхтэй төвийг бүрдүүлдэг амин хүчлийн радикалуудын томъёог бичих;
в) уургийн идэвхтэй хэсэгтэй тусгайлан харьцаж чадах лигандыг зурах. Идэвхтэй төвийг бүрдүүлдэг амин хүчлийн радикалуудтай холбоо үүсгэж болох функциональ бүлгүүдийг үүн дээр зааж өгөх;
г) идэвхтэй төвийн лиганд ба амин хүчлийн радикалуудын хооронд үүсдэг бондын төрлийг заана;
д) уураг-лигандын харилцан үйлчлэлийн өвөрмөц байдал юунд үндэслэсэн болохыг тайлбарла.
 3.
Зурагт уураг болон хэд хэдэн лигандын идэвхтэй хэсгийг харуулав.
3.
Зурагт уураг болон хэд хэдэн лигандын идэвхтэй хэсгийг харуулав.
Аль лиганд нь уургийн идэвхтэй хэсэгтэй хамгийн их харьцдаг, яагаад гэдгийг тодорхойл.
 Уураг-лигандын цогцолбор үүсэх үед ямар төрлийн холбоо үүсдэг вэ?
Уураг-лигандын цогцолбор үүсэх үед ямар төрлийн холбоо үүсдэг вэ?
4. Байгалийн уургийн лигандын бүтцийн аналогийг уургийн үйл ажиллагааг өөрчлөх эм болгон ашиглаж болно.
Ацетилхолин нь мэдрэлийн булчингийн синапс дахь өдөөлтийг дамжуулах зуучлагч юм. Ацетилхолин нь уураг - араг ясны булчингийн постсинаптик мембраны рецепторуудтай харилцан үйлчлэхэд ионы суваг нээгдэж, булчингийн агшилт үүсдэг. Дитилин нь мэдрэлийн импульсийн дамжуулалтыг мэдрэлийн булчингийн синапсаар тасалдаг тул булчинг тайвшруулах зарим үйл ажиллагаанд хэрэглэдэг эм юм. Дитилиныг булчин сулруулагчийн үйл ажиллагааны механизмыг тайлбарла. Үүнийг хийхийн тулд:
а) ацетилхолин ба дитилиний томъёог бичиж, тэдгээрийн бүтцийг харьцуулах;
б) дитилиний тайвшруулах нөлөөний механизмыг тайлбарлах.
5. Зарим өвчний үед өвчтөний биеийн температур нэмэгддэг бөгөөд энэ нь бие махбодийн хамгаалалтын урвал гэж тооцогддог. Гэсэн хэдий ч өндөр температур нь биеийн уурагт хортой нөлөө үзүүлдэг. Яагаад 40 хэмээс дээш температурт уургийн үйл ажиллагаа алдагдаж, хүний амь насанд аюул заналхийлж байгааг тайлбарла. Үүнийг хийхийн тулд дараахь зүйлийг санаарай.
1) Уургийн бүтэц, түүний бүтцийг үндсэн хэлбэрт хадгалдаг холбоо;
2) Температур нэмэгдэхийн хэрээр уургийн бүтэц, үйл ажиллагаа хэрхэн өөрчлөгддөг вэ?;
3) Гомеостаз гэж юу вэ, хүний эрүүл мэндийг сахихад яагаад чухал вэ?
Модульчлагдсан нэгж 2 ОЛИГОМЕРИК УУРАГУУД ЗОХИЦУУЛАХ НӨЛӨӨЛӨЛИЙН ЗОРИУЛАЛТ БОЛГОГДЛОО. УУРГИЙН БҮТЭЦ, ҮЙЛ АЖИЛЛАГААНЫ олон янз байдал. УУРАГ САЛГААХ, ЦЭВЭРҮҮЛЭХ АРГА
Сургалтын зорилго:
1. Олигомер уургийн бүтэц, үйл ажиллагааны онцлогийн талаархи мэдлэгийг ашиглан тэдгээрийн үйл ажиллагааг зохицуулах дасан зохицох механизмыг ойлгох.
2. Эсийн нөхцөлд уургийн бүтцийг нийлэгжүүлэх, хадгалахад шаперонуудын гүйцэтгэх үүргийг тайлбарла.
3. Бие махбодид нийлэгжсэн уургийн бүтэц, үйл ажиллагааны олон янз байдалаар амьдралын олон янзын илрэлийг тайлбарла.
4. Холбогдох гемопротейн - миоглобин ба гемоглобин, түүнчлэн иммуноглобулины гэр бүлийн таван бүлгийн уургийн төлөөлөгчдийг харьцуулах жишээг ашиглан уургийн бүтэц, тэдгээрийн үйл ажиллагааны хоорондын хамаарлыг шинжлэх.
5. Уургийн физик, химийн шинж чанарын талаарх мэдлэгийг ашиглан бусад уураг, хольцоос цэвэршүүлэх аргыг сонгох.
6. Эмнэлзүйн оношийг батлах буюу тодруулахын тулд цусны сийвэнгийн уургийн тоон болон чанарын найрлагын үр дүнг тайлбарлах.
Мэдэх:
1. Олигомер уургийн бүтцийн онцлог, гемоглобины жишээг ашиглан тэдгээрийн үйл ажиллагааг зохицуулах дасан зохицох механизм.
2. Чаперонуудын бүтэц, үүрэг, эсийн нөхцөлд уургийн унаган хэлбэрийг хадгалахад ач холбогдол.
3. Иммуноглобулины жишээн дээр тэдгээрийн бүтэц, үйл ажиллагааны ижил төстэй байдалд үндэслэн уурагуудыг гэр бүл болгон нэгтгэх зарчим.
4. Уургийг физик-химийн шинж чанарын шинж чанарт үндэслэн ялгах арга.
5. Цусны сийвэнгийн электрофорез нь уургийн чанарын болон тоон найрлагыг үнэлэх арга юм.
СЭДЭВ 1.4. ГЕМОГЛОБИНЫ ЖИШЭЭНД АШИГЛАХ ОЛИГОМЕР УУРГИЙН БҮТЭЦ, ҮЙЛ АЖИЛЛАГААНЫ ОНЦЛОГ
1. Олон уураг нь хэд хэдэн полипептидийн гинж агуулдаг. Ийм уураг гэж нэрлэдэг олигомер,болон бие даасан гинж - протомерууд.Олигомер уураг дахь протомерууд нь олон сул ковалент бус холбоогоор (гидрофобик, ион, устөрөгч) холбогддог. Харилцаа холбоо
протомеруудын ачаар хийгддэг нэмэлт байдалтэдгээрийн холбоо барих гадаргуу.
Олигомер уургийн протомеруудын тоо маш их ялгаатай байж болно: гемоглобин нь 4 протомер, аспартат аминотрансфераза фермент 12 протомер, тамхины мозайк вирусын уураг нь ковалент бус холбоогоор холбогдсон 2120 протомер агуулдаг. Тиймээс олигомер уураг нь маш өндөр молекул жинтэй байж болно.
Нэг протомерын бусадтай харилцан үйлчлэлцэх нь уураг-лигандын харилцан үйлчлэлийн онцгой тохиолдол гэж үзэж болно, учир нь протомер бүр нь бусад протомеруудад лиганд үүрэг гүйцэтгэдэг. Уургийн протомерыг холбох тоо, аргыг нэрлэдэг дөрөвдөгч уургийн бүтэц.
Уургууд нь ижил эсвэл өөр бүтэцтэй протомеруудыг агуулж болно, жишээлбэл, гомодимерууд нь хоёр ижил протомер агуулсан уураг, гетеродимерууд нь хоёр өөр протомер агуулсан уураг юм.
Хэрэв уураг нь өөр өөр протомер агуулдаг бол тэдгээрийн дээр бүтцийн хувьд ялгаатай өөр өөр лиганд бүхий холбох төвүүд үүсч болно. Лиганд нь идэвхтэй газартай холбогдох үед энэ уургийн үйл ажиллагаа илэрдэг. Өөр протомер дээр байрлах төвийг аллостерик гэж нэрлэдэг (идэвхтэй төвөөс ялгаатай). Холбоо барьж байнааллостерийн лиганд эсвэл эффектор; энэ нь зохицуулалтын функцийг гүйцэтгэдэг (Зураг 1.18). Аллостерийн төвийн эффектортой харилцан үйлчлэлцсэнээр олигомер уургийн бүтцэд конформацийн labability улмаас бүтцэд конформацийн өөрчлөлт үүсдэг. Энэ нь тодорхой лигандтай идэвхтэй сайтын ойр дотно байдалд нөлөөлж, уургийн үйл ажиллагааг зохицуулдаг. Олигомер уураг нь дор хаяж нэг лигандтай харилцан үйлчлэх явцад бүх протомеруудын конформаци, үйл ажиллагааны өөрчлөлтийг хамтарсан конформацийн өөрчлөлт гэж нэрлэдэг. Уургийн үйл ажиллагааг сайжруулдаг эффектүүд гэж нэрлэдэгидэвхжүүлэгчид, болон түүний үйл ажиллагааг саатуулдаг эффекторууд -
дарангуйлагч.
 Тиймээс олигомер уураг, түүнчлэн домэйн бүтэцтэй уураг нь мономер уургуудтай харьцуулахад шинэ шинж чанартай байдаг - функцийг аллостерик байдлаар зохицуулах чадвартай (уурагт өөр өөр лигандуудыг хавсаргах замаар зохицуулах). Үүнийг миоглобин ба гемоглобин гэсэн хоёр хоорондоо нягт холбоотой нийлмэл уурагуудын бүтэц, үйл ажиллагааг харьцуулж харж болно.
Тиймээс олигомер уураг, түүнчлэн домэйн бүтэцтэй уураг нь мономер уургуудтай харьцуулахад шинэ шинж чанартай байдаг - функцийг аллостерик байдлаар зохицуулах чадвартай (уурагт өөр өөр лигандуудыг хавсаргах замаар зохицуулах). Үүнийг миоглобин ба гемоглобин гэсэн хоёр хоорондоо нягт холбоотой нийлмэл уурагуудын бүтэц, үйл ажиллагааг харьцуулж харж болно.
Цагаан будаа. 1.18. Димерик уургийн бүтцийн схем
2. Орон зайн бүтэц үүсэх, миоглобины үйл ажиллагаа.
Миоглобин (Mb) нь улаан булчинд агуулагддаг уураг бөгөөд гол үүрэг нь булчингийн эрчимтэй ажилд шаардлагатай O 2-ийн нөөцийг бий болгох явдал юм. Mb нь уургийн хэсэг - apoMb ба уургийн бус хэсэг - гем агуулсан нийлмэл уураг юм. ApoMB-ийн анхдагч бүтэц нь түүний нягт бөмбөрцөг хэлбэрийн хэлбэр, миоглобины уураггүй хэсэг болох гем хавсарсан идэвхтэй төвийн бүтцийг тодорхойлдог. Цуснаас булчинд ирж буй хүчилтөрөгч нь миоглобин дахь Fe+2 гемтэй холбогддог. Mb нь O 2-тэй маш өндөр хамааралтай мономер уураг тул миоглобиноор хүчилтөрөгч ялгарах нь зөвхөн булчингийн эрчимтэй ажлын үед, O 2-ийн хэсэгчилсэн даралт огцом буурах үед л тохиолддог.Улаан булчинд 153 амин хүчлийн үлдэгдлийн тодорхой дарааллаар дүрслэгдсэн MV-ийн анхдагч бүтэц нь орчуулгын явцад рибосом дээр нийлэгждэг. Mb-ийн хоёрдогч бүтэц нь A-аас H хүртэлх латин үсгээр нэрлэгддэг 8 α-геликийг агуулдаг бөгөөд тэдгээрийн хооронд мушгиа бус мужууд байдаг. Mb-ийн гуравдагч бүтэц нь авсаархан бөмбөрцөг хэлбэртэй бөгөөд түүний завсарлагад идэвхтэй төв нь F ба E α-спиральуудын хооронд байрладаг (Зураг 1.19).
 Цагаан будаа. 1.19. Миоглобины бүтэц
Цагаан будаа. 1.19. Миоглобины бүтэц
3. MV-ийн идэвхтэй төвийн бүтэц, үйл ажиллагааны онцлог. Mb-ийн идэвхтэй төв нь үндсэн бүтцээрээ бие биенээсээ өргөн зайд байрладаг гидрофобик амин хүчлийн радикалуудаас бүрддэг (жишээлбэл, Tri 3 9 ба Fen 138) Усанд муу уусдаг лигандууд - гем ба О 2 - идэвхтэй төвд наалддаг. Гем нь apoMB-ийн өвөрмөц лиганд юм (Зураг 1.20), түүний үндэс нь метенил гүүрээр холбогдсон дөрвөн пирролын цагиргуудаас бүрддэг;төв хэсэгт пирролын цагирагуудын азотын атомуудтай дөрвөн координацын холбоогоор холбогдсон Fe+ 2 атом байдаг. Мб-ийн идэвхтэй төвд гидрофобик амин хүчлийн радикалуудаас гадна гидрофилик радикал бүхий хоёр амин хүчлийн үлдэгдэл байдаг. Gis E 7(Gis 64) ба
 GIS F 8
GIS F 8
 (Түүний 93) (Зураг 1.21).
(Түүний 93) (Зураг 1.21).
Цагаан будаа. 1.20. Гемийн бүтэц нь миоглобин ба гемоглобины уургийн бус хэсэг юм
Gis E 7Цагаан будаа. 1.21. Апомиоглобин ба гемоглобины протомеруудын идэвхтэй хэсэгт гем ба O 2-ийн байршил Гем нь apoMB-ийн өвөрмөц лиганд юм (Зураг 1.20), түүний үндэс нь метенил гүүрээр холбогдсон дөрвөн пирролын цагиргуудаас бүрддэг;Гем нь төмрийн атомаар дамжуулан Түүний F8-тай ковалент байдлаар холбогддог. O 2 нь гемийн хавтгайн нөгөө тал дээр төмрийг бэхэлдэг. Түүний E 7 нь O 2-ыг зөв чиглүүлэхэд шаардлагатай бөгөөд хүчилтөрөгчийг Fe + 2 гемд нэмэхэд тусалдаг.
Fe+ 2-тэй зохицуулалтын холбоо үүсгэж, идэвхтэй төвд гемийг хатуу тогтооно.
Fe + 2 гемтэй харилцан үйлчлэх явцад өөр лиганд - O 2-ийн идэвхтэй төвд зөв чиглүүлэхэд шаардлагатай. Гемийн бичил орчин нь O 2-ыг Fe + 2-д хүчтэй, гэхдээ буцах боломжтой холбох нөхцлийг бүрдүүлдэг бөгөөд ус нь гидрофобик идэвхтэй хэсэгт орохоос сэргийлж, Fe + 3 хүртэл исэлдэхэд хүргэдэг.- нарийн төвөгтэй уураг (гемопротейн) -тэй холбоотой миоглобин шиг уургийн гэр бүл. Тэдгээр нь тетрамер бүтэцтэй бөгөөд хоёр α-гинжийг агуулдаг боловч бусад хоёр полипептидийн гинжний (2α-, 2х-гинж) бүтцээрээ ялгаатай байдаг. Хоёр дахь полипептидийн гинжин хэлхээний бүтэц нь Hb-ийн эдгээр хэлбэрийн үйл ажиллагааны онцлогийг тодорхойлдог. Насанд хүрсэн хүний цусны улаан эсийн гемоглобины 98 орчим хувь нь байдаг гемоглобин А(2α-, 2p-гинж).
Ургийн хөгжлийн явцад хоёр үндсэн төрлийн гемоглобины үүрэг гүйцэтгэдэг. үр хөврөлийн Hb(2α, 2ε), ургийн хөгжлийн эхний үе шатанд илэрдэг ба гемоглобин F (ургийн)- (2α, 2γ), ургийн эхэн үеийн гемоглобины ургийн дотоод хөгжлийн зургаа дахь сард орлуулж, зөвхөн төрсний дараа Hb A-ээр солигддог.
Hb A нь насанд хүрэгчдийн цусны улаан эсэд агуулагддаг миоглобин (Mb) -тай холбоотой уураг юм. Түүний бие даасан протомеруудын бүтэц нь миоглобинтой төстэй. Миоглобин ба гемоглобины протомеруудын хоёрдогч ба гуравдагч бүтэц нь тэдний полипептидийн гинжин хэлхээний анхдагч бүтцэд зөвхөн 24 амин хүчлийн үлдэгдэл ижил байдаг (миоглобин шиг гемоглобины протомеруудын хоёрдогч бүтэц нь 8 α-спираль агуулдаг) маш төстэй байдаг. A-аас H хүртэлх латин үсгээр тэмдэглэгдсэн бөгөөд гуравдагч бүтэц нь авсаархан бөмбөрцөг хэлбэртэй байдаг). Гэхдээ миоглобиноос ялгаатай нь гемоглобин нь ковалент бус бондоор холбогдсон дөрвөн полипептидийн гинжээс бүрдэх олигомер бүтэцтэй байдаг (Зураг 1.22).
Hb протомер бүр нь уургийн бус хэсэг - гем ба хөрш протомеруудтай холбоотой байдаг. Hb-ийн уургийн хэсгийг гемтэй холбох нь миоглобинтой төстэй: уургийн идэвхтэй төвд гемийн гидрофоб хэсгүүд нь түүний F 8 ба Түүний E 7-ээс бусад нь гидрофобик амин хүчлийн радикалуудаар хүрээлэгдсэн байдаг. Эдгээр нь гемийн хавтгайн хоёр талд байрладаг бөгөөд уургийн үйл ажиллагаа, хүчилтөрөгчтэй холбогдоход ижил үүрэг гүйцэтгэдэг (миоглобины бүтцийг үзнэ үү).
 Цагаан будаа. 1.22. Гемоглобины олигомер бүтэц
Цагаан будаа. 1.22. Гемоглобины олигомер бүтэц
Үүнээс гадна, Гем нь apoMB-ийн өвөрмөц лиганд юм (Зураг 1.20), түүний үндэс нь метенил гүүрээр холбогдсон дөрвөн пирролын цагиргуудаас бүрддэг;чухал үүрэг гүйцэтгэдэг нэмэлт үүрэг Nv-ийн үйл ажиллагаанд. Чөлөөт гем нь O2-тэй харьцуулахад CO-тай 25000 дахин их хамааралтай байдаг.
5. HB-ийн гол үүрэг бол уушигнаас эдэд O2 тээвэрлэх явдал юм. O2-тэй маш өндөр хамааралтай, улаан булчинд хүчилтөрөгч хадгалах үүргийг гүйцэтгэдэг мономер миоглобиноос ялгаатай нь гемоглобины олигомер бүтэц нь дараахь зүйлийг хангадаг.
1) уушигны хүчилтөрөгчөөр HB хурдан ханасан;
2) HB-ийн O 2 (20-40 мм м.у.б) харьцангуй өндөр хэсэгчилсэн даралтаар эдэд хүчилтөрөгч ялгаруулах чадвар;
3) Hb-ийн O 2-ийн хамаарлыг зохицуулах боломж.
6. Гемоглобины протомеруудын конформацийн хамтын өөрчлөлт нь уушгинд O 2-ийг холбож, эд эсэд ялгарах явцыг хурдасгадаг. Уушигны O 2-ийн өндөр хэсэгчилсэн даралт нь түүнийг дөрвөн протомерын (2α ба 2β) идэвхтэй хэсэгт Hb-тэй холбоход тусалдаг. Миоглобины нэгэн адил протомер бүрийн идэвхтэй төв нь гидрофобик халаасанд хоёр α-спираль (F ба E) хооронд байрладаг. Энэ нь уургийн бус хэсэг - гем агуулдаг бөгөөд олон сул гидрофобик харилцан үйлчлэлээр уургийн хэсэгтэй холбогддог ба Fe 2 + гем ба Түүний F 8 хоорондын нэг хүчтэй холбоо (1.21-р зургийг үз).
Дезоксигемоглобины хувьд түүний F 8-тай энэ холболтын улмаас Fe 2 + атом нь гемийн хавтгайгаас гистидин рүү цухуйдаг. O 2-ыг Fe 2 + -тай холбох нь нэг чөлөөт зохицуулалтын холбоог ашиглан His E 7 бүсэд гемийн нөгөө талд явагддаг. Түүний E 7 нь O 2-ийг гемийн төмрөөр холбох оновчтой нөхцлийг бүрдүүлдэг.
Нэг протомерын Fe + 2 атомд O 2 нэмснээр түүний гемийн хавтгайд шилжиж, дараа нь түүнтэй холбоотой гистидиний үлдэгдэл үүсдэг.
 Цагаан будаа. 1.23. Гемоглобины протомерын конформацийг O 2-тэй хослуулан өөрчлөх
Цагаан будаа. 1.23. Гемоглобины протомерын конформацийг O 2-тэй хослуулан өөрчлөх
Энэ нь бүх полипептидийн гинжин хэлхээний конформацийн лабораторийн улмаас конформацийн өөрчлөлтөд хүргэдэг. Бусад гинжин хэлхээний хэлбэрийг өөрчлөх нь тэдгээрийн дараагийн O 2 молекулуудтай харилцан үйлчлэлийг хөнгөвчилдөг.
Дөрөв дэх O 2 молекул нь гемоглобинтой эхнийхээс 300 дахин амархан наалддаг (Зураг 1.24).
 Цагаан будаа. 1.24. Гемоглобины протомерууд нь O2-тэй харьцахдаа конформацийн хамтын өөрчлөлтүүд
Цагаан будаа. 1.24. Гемоглобины протомерууд нь O2-тэй харьцахдаа конформацийн хамтын өөрчлөлтүүд
Эд эсэд дараагийн O 2 молекул бүр нь өмнөхөөсөө илүү амархан салдаг бөгөөд энэ нь протомеруудын конформацийн хамтарсан өөрчлөлтөөс шалтгаална.
7. Органик бодисын катаболизмын явцад үүссэн CO 2 ба H+ нь гемоглобины O 2-ийн хамаарлыг концентрацитай нь харьцуулан бууруулдаг. Эсийн үйл ажиллагаанд шаардагдах энергийг уушигнаас гемоглобиноор ялгардаг O 2 ашиглан органик бодисыг исэлдүүлэх явцад голчлон митохондрид үйлдвэрлэдэг. Органик бодисын исэлдэлтийн үр дүнд тэдгээрийн задралын эцсийн бүтээгдэхүүнүүд үүсдэг: CO 2 ба K 2 O, тэдгээрийн хэмжээ нь үргэлжилж буй исэлдэлтийн процессын эрчтэй пропорциональ байна.
CO 2 нь эсээс цус руу тархаж, цусны улаан эсэд нэвтэрч, карбангидраза ферментийн нөлөөгөөр нүүрстөрөгчийн хүчил болж хувирдаг. Энэ сул хүчил нь протон ба бикарбонатын ион болж хуваагддаг.
H+ нь Түүний радикалуудтай нэгдэх чадвартай 14 6 гемоглобины α- ба β-гинжин хэлхээнд, i.e. гемээс алслагдсан хэсгүүдэд. Гемоглобины протонжуулалт нь түүний O 2-д ойртох чадварыг бууруулж, oxyHb-ээс O 2-ыг зайлуулах, deoxyHb үүсэх, үүссэн протоны тоотой харьцуулахад эдэд хүчилтөрөгчийн хангамжийг нэмэгдүүлдэг (Зураг 1.25).
Цусны улаан эс дэх H+ концентрацийн өсөлтөөс хамаарч ялгарах хүчилтөрөгчийн хэмжээ ихсэхийг Бор эффект гэж нэрлэдэг (энэ нөлөөг анх нээсэн Данийн физиологич Кристиан Борын нэрээр нэрлэсэн).
Уушигны хүчилтөрөгчийн хэсэгчилсэн даралт ихсэх нь түүнийг deoxyHb-тэй холбоход хувь нэмэр оруулдаг бөгөөд энэ нь уургийн H +-тэй ойртох чадварыг бууруулдаг. Нүүрстөрөгчийн хүчлийн нөлөөн дор ялгарсан протонууд нь бикарбонатуудтай урвалд орж CO 2 ба H 2 O үүсгэдэг.

 Цагаан будаа. 1.25. Hb-ийн O 2-ийн хамаарал нь CO 2 ба протоны концентрацаас хамаарах хамаарал (Бор эффект):
Цагаан будаа. 1.25. Hb-ийн O 2-ийн хамаарал нь CO 2 ба протоны концентрацаас хамаарах хамаарал (Бор эффект):
А- HB-тай цогцолбороос O 2 ялгарахад CO 2 ба H+ агууламжийн нөлөөлөл (Борын нөлөө); Б- уушгинд дезоксигемоглобины хүчилтөрөгчөөр хангах, CO 2 үүсэх, ялгаруулах.
Үүссэн CO 2 нь цулцангийн орон зайд орж, амьсгалсан агаараар арилдаг. Тиймээс эдэд гемоглобины ялгаруулж буй хүчилтөрөгчийн хэмжээг органик бодисын катаболизмын бүтээгдэхүүнээр зохицуулдаг: бодисын задрал илүү эрчимтэй байх тусам, жишээлбэл, биеийн тамирын дасгал хийх үед CO 2 ба H + агууламж өндөр байх тусам хүчилтөрөгчийн хэмжээ ихсэх болно. Hb-ийн O 2-ийн хамаарал буурсны үр дүнд эд эсүүд хүлээн авдаг.
8. Лиганд - 2,3-бисфосфоглицератаар Hb-ийн O2-д ойртох аллостерик зохицуулалт.Эритроцитод глюкозын исэлдэлтийн бүтээгдэхүүн болох 1,3-бисфосфоглицератаас гемоглобины аллостерийн лиганд, 2,3-бисфосфоглицерат (2,3-BPG) нийлэгждэг. Хэвийн нөхцөлд 2,3-BPG-ийн концентраци өндөр, Hb-ийн концентрацитай харьцуулах боломжтой. 2,3-BPG нь -5-ын хүчтэй сөрөг цэнэгтэй.
 Эдийн хялгасан судсан дахь бисфосфоглицерат нь дезоксигемоглобинтой холбогдож, эд эсэд хүчилтөрөгчийн ялгаралтыг нэмэгдүүлж, Hb-ийн O 2-ийн хамаарлыг бууруулдаг.
Эдийн хялгасан судсан дахь бисфосфоглицерат нь дезоксигемоглобинтой холбогдож, эд эсэд хүчилтөрөгчийн ялгаралтыг нэмэгдүүлж, Hb-ийн O 2-ийн хамаарлыг бууруулдаг.
Тетрамер гемоглобины молекулын төвд хөндий байдаг. Энэ нь бүх дөрвөн протомерын амин хүчлийн үлдэгдэлээр үүсдэг (1.22-р зургийг үз). Эд эсийн хялгасан судсанд Hb-ийн протонжуулалт (Бор эффект) нь гем төмөр ба O2 хоорондын холбоо тасрахад хүргэдэг. Молекул дотор
дезоксигемоглобин нь оксигемоглобинтой харьцуулахад протомеруудыг холбодог нэмэлт ионы холбоо үүсдэг бөгөөд үүний үр дүнд оксигемоглобинтой харьцуулахад төвийн хөндийн хэмжээ нэмэгддэг. Төвийн хөндий нь гемоглобинтой 2,3-BPG хавсардаг газар юм. Төвийн хөндийн хэмжээ ялгаатай тул 2,3-BPG нь зөвхөн деоксигемоглобинд хавсарч чаддаг.
2,3-BPG нь уургийн идэвхтэй төвөөс алслагдсан хэсэгт гемоглобинтой харилцан үйлчилдэг бөгөөд үүнд хамаарна. аллостерик(зохицуулалтын) лигандууд ба Hb-ийн төв хөндий нь аллостерийн төв. 2,3-BPG нь хүчтэй сөрөг цэнэгтэй бөгөөд Hb-ийн хоёр β-гинжин хэлхээний эерэг цэнэгтэй таван бүлэгтэй харилцан үйлчилдэг: Val-ийн N-терминал α-амин бүлэг ба Lys 82 Түүний 143 радикалууд (Зураг 1.26).
 Цагаан будаа. 1.26. Дезоксигемоглобины төв хөндий дэх BPG
Цагаан будаа. 1.26. Дезоксигемоглобины төв хөндий дэх BPG
BPG нь β хэлхээ тус бүрт эерэг цэнэгтэй гурван бүлэгт холбогддог.
Эдийн хялгасан судсанд үүссэн дезоксигемоглобин нь 2,3-BPG-тэй харилцан үйлчлэлцэж, β-гинжин хэлхээний эерэг цэнэгтэй радикалууд ба сөрөг цэнэгтэй лигандын хооронд ионы холбоо үүсдэг бөгөөд энэ нь уургийн конформацийг өөрчилж, Hb-ийн O2-д ойртох чадварыг бууруулдаг. . Hb-ийн O 2-ийн хамаарал буурах нь O 2-ийг эдэд илүү үр дүнтэй гаргахад хувь нэмэр оруулдаг.
Уушигны хэсэгчилсэн даралт ихсэх үед хүчилтөрөгч нь Hb-тэй харилцан үйлчилж, гем төмөртэй нэгддэг; Энэ тохиолдолд уургийн конформаци өөрчлөгдөж, төвийн хөндий буурч, 2,3-BPG нь аллостерийн төвөөс шилждэг.
Тиймээс олигомер уураг нь мономер уурагтай харьцуулахад шинэ шинж чанартай байдаг. Сайт дээр лигандуудыг хавсаргах
бие биенээсээ орон зайн алслагдсан (аллостерик) нь уургийн бүх молекулд конформацийн өөрчлөлтийг үүсгэдэг. Зохицуулалтын лигандуудтай харилцан үйлчлэлийн улмаас уургийн молекулын функциональ өөрчлөлт, хүрээлэн буй орчны өөрчлөлтөд дасан зохицох өөрчлөлт гардаг.
СЭДЭВ 1.5. ЭСИЙН НӨХЦӨЛ ДАХЬ УУРАГНЫ УУГАН БАЙДЛЫГ ХАМГААЛАХ
Эсэд полипептидийн гинжний нийлэгжилтийн явцад мембранаар дамжин эсийн холбогдох хэсгүүдэд, нугалах явцад (уугуул конформац үүсэх), олигомер уураг угсрах явцад, түүнчлэн тэдгээрийн үйл ажиллагааны явцад завсрын , уургийн бүтцэд бөөгнөрөлд өртөмтгий, тогтворгүй конформаци үүсдэг. Уургийн молекулын дотор ихэвчлэн уугуул конформацид нуугдаж байдаг гидрофобик радикалууд нь гадаргуу дээр тогтворгүй конформацаар илэрч, усанд муу уусдаг уургийн бүлгүүдтэй нэгдэх хандлагатай байдаг. Мэдэгдэж буй бүх организмын эсүүдээс эсийн уургийн оновчтой нугалах, үйл ажиллагааны явцад тэдгээрийн төрөлхийн хэлбэрийг тогтворжуулах, хамгийн чухал нь гомеостаз алдагдсан үед эсийн доторх уургийн бүтэц, үйл ажиллагааг хадгалах тусгай уураг олдсон. Эдгээр уураг гэж нэрлэгддэг "чаперонууд"Энэ нь францаар "эмээ" гэсэн утгатай.
1. Молекулын шаперонууд ба тэдгээрийн уургийн денатурациас сэргийлэх үүрэг.
Шаперонуудыг (CH) дэд хэсгүүдийн массын дагуу ангилдаг. Өндөр молекул жинтэй чаперонууд 60-аас 110 кДа хүртэл жинтэй байдаг. Тэдгээрийн дотроос Ш-60, Ш-70, Ш-90 гэсэн гурван анги хамгийн их судлагдсан байдаг. Анги бүр нь холбогдох уургийн гэр бүлийг агуулдаг. Тиймээс Sh-70 нь 66-78 кДа молекул жинтэй уураг агуулдаг. Бага молекул жинтэй шаперонууд нь 40-15 кДа молекул жинтэй байдаг.
Хамгаалагчдын дунд байдаг бүрдүүлэгчСуурийн нийлэгжилт нь биеийн эсэд үзүүлэх стрессээс хамаардаггүй уураг, ба өдөөгддөггүй,хэвийн нөхцөлд синтез нь сул боловч стрессийн үед огцом нэмэгддэг. Өдөөгддөг чаперонуудыг өндөр температурт өртсөн эсүүдээс анх илрүүлсэн тул "дулааны цочролын уураг" гэж нэрлэдэг. Эсэд уураг их хэмжээгээр агуулагддаг тул хэсэгчлэн денатурат уургийн аяндаа дахин идэвхжих нь хэцүү байдаг. Sh-70 нь денатураци үүсэхээс сэргийлж, уургийн унаган хэлбэрийг сэргээхэд тусалдаг. Молекулын шаперонууд-70- цитоплазм, цөм, эндоплазмын торлог бүрхэвч, митохондри зэрэг бүх хэсэгт агуулагддаг өндөр хадгалагдсан уургийн ангилал. Ш-70 нэг полипептидийн гинжин хэлхээний карбоксил төгсгөлд урт пептидтэй харилцан үйлчлэх чадвартай ховил бүхий хэсэг байдаг.
гидрофобик радикалуудаар баяжуулсан 7-9 амин хүчлийн үлдэгдэл. Бөмбөрцөг уургийн ийм бүсүүд ойролцоогоор 16 амин хүчил тутамд тохиолддог. Sh-70 нь уургийг температурын идэвхгүй байдлаас хамгаалж, хэсэгчлэн денатурат уургийн хэлбэр, үйл ажиллагааг сэргээх чадвартай.
2. Уургийн нугалахад шаперонуудын үүрэг.Рибосом дээр уургийн нийлэгжилтийн үед полипептидийн N-терминал хэсэг нь С-терминалын өмнө нийлэгждэг. Төрөлхийн хэлбэрийг бий болгохын тулд уургийн амин хүчлийн бүрэн дараалал шаардлагатай. Уургийн нийлэгжилтийн явцад каперон-70 нь идэвхтэй төвийн бүтцийн улмаас синтез дуусах хүртэл гидрофобик амин хүчлийн радикалуудаар баяжуулсан полипептидийн бөөгнөрөлд өртөмтгий хэсгүүдийг хааж чаддаг (Зураг 1.27, А). ).
 Цагаан будаа. 1.27. Уургийн нугалахад каперонуудын оролцоо
Цагаан будаа. 1.27. Уургийн нугалахад каперонуудын оролцоо
А - синтезжүүлсэн полипептидийн хэсгүүдийн хоорондох гидрофобик харилцан үйлчлэлээс урьдчилан сэргийлэхэд chaperones-70-ийн оролцоо; B - капероны цогцолбор дахь уургийн уугуул конформаци үүсэх
Домэйн бүтэц гэх мэт нарийн төвөгтэй конформаци бүхий өндөр молекул жинтэй олон уургууд Sh-60-аас үүссэн тусгай орон зайд нугалж байдаг. Ш-60 14 дэд нэгжээс бүрдсэн олигомер цогцолборын үүрэг гүйцэтгэдэг. Тэд хоёр хөндий цагираг үүсгэдэг бөгөөд тус бүр нь долоон дэд хэсгээс бүрддэг бөгөөд эдгээр цагиргууд нь хоорондоо холбогддог. Sh-60 дэд нэгж бүр нь цагираг, завсрын болон экваторын хөндий рүү чиглэсэн гидрофобик радикалуудаар баяжуулсан оройн (орой) гэсэн гурван бүсээс бүрдэнэ (Зураг 1.28).
 Цагаан будаа. 1.28. 14 Ш-60-аас бүрдэх чаперонины цогцолборын бүтэц
Цагаан будаа. 1.28. 14 Ш-60-аас бүрдэх чаперонины цогцолборын бүтэц
A - хажуугийн харагдах байдал; B - дээд харагдах байдал
Гадаргуу дээр задарсан молекулуудын шинж чанартай элементүүд, ялангуяа гидрофобик радикалууд бүхий нийлэгжүүлсэн уураг нь капероны цагиргуудын хөндийд ордог. Эдгээр хөндийн өвөрмөц орчинд энергийн хувьд хамгийн таатай цорын ганц нь олдох хүртэл боломжит конформацуудыг тоолно (Зураг 1.27, B). Конформаци үүсэх, уургийн ялгаралт нь экваторын бүсэд ATP гидролиз дагалддаг. Дүрмээр бол ийм капероноос хамааралтай нугалах нь ихээхэн хэмжээний эрчим хүч шаарддаг.
Шаперонууд нь уургийн гурван хэмжээст бүтцийг бүрдүүлэх, хэсэгчлэн денатурат уургийг нөхөн сэргээхэд оролцохоос гадна олигомер уургийг нэгтгэх, денатурат уургийг таних, лизосом руу тээвэрлэх зэрэг үндсэн процессуудыг явуулахад шаардлагатай байдаг. мембранаар уураг тээвэрлэх, уургийн цогцолборуудын үйл ажиллагааг зохицуулахад оролцох.
СЭДЭВ 1.6. ТӨРЛИЙН УУРАГ. УУРАГТАЙ ГЭР БҮЛ: ИММУНОГЛОБУЛИНЫН ЖИШЭЭ
1. Уургууд нь бие даасан эсүүд болон бүхэл бүтэн олон эсийн организмын амьдралд шийдвэрлэх үүрэг гүйцэтгэдэг бөгөөд тэдгээрийн үйл ажиллагаа нь гайхалтай олон янз байдаг. Энэ нь уургийн анхдагч бүтэц, конформацийн шинж чанар, идэвхтэй төвийн өвөрмөц бүтэц, тусгай лигандуудыг холбох чадвараар тодорхойлогддог.
Пептидийн гинжин хэлхээний бүх боломжит хувилбаруудын маш бага хэсэг нь орон зайн тогтвортой бүтцийг авч чаддаг; олонхи
Тэдгээрийн ихэнх нь Гиббсийн энергитэй ижил төстэй боловч өөр өөр шинж чанартай олон хэлбэрийг авч болно. Биологийн хувьсалаар сонгогдсон ихэнх мэдэгдэж буй уургуудын анхдагч бүтэц нь энэ уургийн үйл ажиллагааны шинж чанарыг тодорхойлдог нэг конформацийн онцгой тогтвортой байдлыг хангадаг.
2. Уургийн гэр бүл.Биологийн нэг зүйлийн дотор амин хүчлийн үлдэгдлийг орлуулах нь холбогдох функцийг гүйцэтгэдэг, нэг төрлийн амин хүчлийн дараалалтай өөр өөр уураг үүсэхэд хүргэдэг. Ийм холбоотой уургууд нь гайхалтай төстэй бүтэцтэй байдаг: α-спираль ба/эсвэл β-бүтэцүүдийн тоо ба харьцангуй байрлал, полипептидийн гинжин хэлхээний ихэнх эргэлт, гулзайлт нь ижил төстэй эсвэл ижил байдаг. Полипептидийн гинжин хэлхээний гомолог бүсүүдтэй, ижил төстэй бүтэцтэй, холбогдох функц бүхий уурагуудыг уургийн гэр бүлд ангилдаг. Уургийн гэр бүлийн жишээ: серин протеиназа, иммуноглобулины гэр бүл, миоглобины гэр бүл.
Серин протеиназууд- протеолитик ферментийн үүргийг гүйцэтгэдэг уургийн гэр бүл. Эдгээрт хоол боловсруулах ферментүүд - химотрипсин, трипсин, эластаза болон цусны бүлэгнэлтийн олон хүчин зүйлүүд орно. Эдгээр уургууд нь байрлалынхаа 40%-д ижил амин хүчлүүдтэй бөгөөд маш төстэй бүтэцтэй байдаг (Зураг 1.29).

Цагаан будаа. 1.29. Эластаза (A) ба химотрипсин (B) -ийн орон зайн бүтэц
Зарим амин хүчлийг орлуулах нь эдгээр уургийн субстратын өвөрмөц байдлыг өөрчлөх, гэр бүлийн доторх функциональ олон янз байдал үүсэхэд хүргэсэн.
3. Иммуноглобулины гэр бүл.Дархлааны тогтолцооны үйл ажиллагаанд иммуноглобулины супер гэр бүлийн уургууд асар их үүрэг гүйцэтгэдэг бөгөөд үүнд гурван төрлийн уураг багтдаг.
эсрэгбие (иммуноглобулин);
Т-лимфоцитын рецепторууд;
Гистокомпатын үндсэн цогцолборын уургууд - MHC 1 ба 2-р анги (Гистос нийцтэй байдлын үндсэн цогцолбор).
Эдгээр бүх уургууд нь домен бүтэцтэй, гомолог дархлаатай төстэй домайнуудаас бүрддэг бөгөөд ижил төстэй үүрэг гүйцэтгэдэг: цус, лимф эсвэл эс хоорондын шингэнд ууссан (эсрэгбие) эсвэл эсийн гадаргуу дээр (өөрийн эсвэл) байрладаг гадны бүтэцтэй харилцан үйлчилдэг. гадаад).
4. Эсрэг биетүүд- бие махбодид гадны биет орохын хариуд В лимфоцитоор үүсгэгддэг өвөрмөц уургууд. эсрэгтөрөгч.
Эсрэгбиеийн бүтцийн онцлог
Хамгийн энгийн эсрэгбие молекулууд нь дөрвөн полипептидийн гинжээс бүрддэг: хоёр ижил хөнгөн - L, 220 орчим амин хүчил, хоёр ижил хүнд - H, 440-700 амин хүчлээс бүрддэг. Эсрэгбиеийн молекул дахь бүх дөрвөн гинж нь олон ковалент бус холбоо, дөрвөн дисульфидын холбоогоор холбогддог (Зураг 1.30).
Эсрэгбиеийн хөнгөн гинж нь полипептидийн гинжин хэлхээний N төгсгөлийн бүсэд байрладаг хувьсах домэйн (VL) ба C төгсгөлд байрладаг тогтмол домэйн (CL) гэсэн хоёр домэйнээс бүрдэнэ. Хүнд гинж нь ихэвчлэн дөрвөн домэйнтэй байдаг: нэг хувьсагч (VH), N-төгсгөлд байрладаг ба гурван тогтмол домэйн (CH1, CH2, CH3) (1.30-р зургийг үз). Иммуноглобулины домайн бүр нь цистеины хоёр үлдэгдэл дисульфидын холбоогоор холбогдсон β хуудасны дээд бүтэцтэй байдаг.
Хоёр тогтмол домэйн CH1 ба CH2 хооронд олон тооны пролины үлдэгдэл агуулсан бүс байдаг бөгөөд энэ нь хоёрдогч бүтэц үүсэхээс сэргийлж, энэ сегмент дэх хөрш H-гинжний харилцан үйлчлэлээс сэргийлдэг. Энэ нугасны бүс нь эсрэгбиеийн молекулын уян хатан чанарыг өгдөг. Хүнд ба хөнгөн гинжин хэлхээний хувьсах домэйнуудын хооронд эсрэгтөрөгчийг холбох хоёр ижил газар байдаг (антигенийг холбох идэвхтэй газрууд) тул ийм эсрэгбиемүүдийг ихэвчлэн нэрлэдэг. хоёр валент.Антигенийг эсрэгбиетэй холбоход хоёр гинжин хэлхээний хувьсах бүсийн бүх амин хүчлийн дараалал оролцдоггүй, харин гинж бүрийн хэт хувьсах бүс нутагт зөвхөн 20-30 амин хүчил байдаг. Эдгээр мужууд нь эсрэгбие бүрийн төрөл бүрийн нэмэлт эсрэгтөрөгчтэй харьцах өвөрмөц чадварыг тодорхойлдог.
Эсрэгбие нь гадны биетүүдийн халдлагаас хамгаалах биеийн хамгаалалтын шугамын нэг юм. Тэдний үйл ажиллагааг хоёр үе шатанд хувааж болно: эхний үе шат нь гадны биетүүдийн гадаргуу дээрх эсрэгтөрөгчийг таних, холбох явдал бөгөөд энэ нь эсрэгбиеийн бүтцэд эсрэгтөрөгчийг холбох газрууд байдаг тул боломжтой байдаг; хоёр дахь шат нь эсрэгтөрөгчийг идэвхгүйжүүлэх, устгах үйл явцыг эхлүүлэх явдал юм. Хоёр дахь шатны өвөрмөц байдал нь эсрэгбиеийн ангиллаас хамаарна. Тогтмол домэйны бүтцээрээ бие биенээсээ ялгаатай хүнд гинжний таван ангилал байдаг: α, δ, ε, γ ба μ, тэдгээрийн дагуу иммуноглобулины таван ангиллыг ялгадаг: A, D, E, G, M.
Хүнд гинжний бүтцийн онцлог нь хүнд гинжний нугасны бүс ба С төгсгөлийн бүсүүдэд анги тус бүрийн конформацийн шинж чанарыг өгдөг. Антиген нь эсрэгбиетэй холбогдонгуут тогтмол домэйн дэх конформацийн өөрчлөлтүүд нь эсрэгтөрөгчийг зайлуулах замыг тодорхойлдог.
 Цагаан будаа. 1. 30. IgG-ийн домайн бүтэц
Цагаан будаа. 1. 30. IgG-ийн домайн бүтэц
Иммуноглобулин М
Иммуноглобулин M нь хоёр хэлбэртэй байдаг.
Мономер хэлбэр- 1-р ангиллын эсрэгбие нь В лимфоцитыг хөгжүүлснээр үүсдэг. Дараа нь олон В эсүүд өөр төрлийн эсрэгбие үүсгэдэг, гэхдээ ижил эсрэгтөрөгчтэй холбох газартай байдаг. IgM нь мембранд суулгагдсан бөгөөд эсрэгтөрөгчийг таних рецепторын үүрэг гүйцэтгэдэг. Сүүлний хэсэгт 25 гидрофобик амин хүчлийн үлдэгдэл байгаа тул IgM-ийг эсийн мембранд нэгтгэх боломжтой.
IgM-ийн нууц хэлбэрдисульфидын холбоо болон нэмэлт полипептидийн J гинжээр холбогдсон таван мономер дэд нэгжийг агуулдаг (Зураг 1.31). Энэ хэлбэрийн мономеруудын хүнд гинж нь гидрофобик сүүлийг агуулдаггүй. Пентамер нь эсрэгтөрөгчийг холбох 10 цэгтэй тул бие махбодид анх нэвтэрч буй эсрэгтөрөгчийг таньж, арилгахад үр дүнтэй байдаг. IgM-ийн нууц хэлбэр нь дархлааны анхдагч хариу урвалын үед цусанд ялгардаг эсрэгбиеийн үндсэн ангилал юм. IgM-ийг эсрэгтөрөгчтэй холбох нь IgM-ийн конформацийг өөрчилдөг бөгөөд түүнийг комплемент системийн эхний уургийн бүрэлдэхүүн хэсэгтэй (комплемент систем нь эсрэгтөрөгчийг устгахад оролцдог уургийн багц юм) холбож, энэ системийг идэвхжүүлдэг. Хэрэв эсрэгтөрөгч нь бичил биетний гадаргуу дээр байрладаг бол нэмэлт систем нь эсийн мембраны бүрэн бүтэн байдлыг зөрчиж, бактерийн эсийн үхэлд хүргэдэг.
Иммуноглобулин Г
Цусан дахь энэ бүлгийн иммуноглобулинууд (бүх Igs-ийн 75%) тоон үзүүлэлтээр давамгайлдаг. IgG - мономерууд, хоёрдогч дархлааны хариу урвалын үед цусанд ялгардаг эсрэгбиеийн үндсэн анги юм. IgG нь бичил биетний гадаргуугийн эсрэгтөрөгчтэй харилцан үйлчилсний дараа эсрэгтөрөгч-эсрэгбиеийн цогцолбор нь комплемент системийн уурагуудыг холбож, идэвхжүүлэх эсвэл макрофаг, нейтрофилийн тусгай рецепторуудтай харилцан үйлчилж чаддаг. Фагоцитуудтай харилцах нь хүргэдэг
 Цагаан будаа. 1.31. IgM-ийн шүүрлийн хэлбэрийн бүтэц
Цагаан будаа. 1.31. IgM-ийн шүүрлийн хэлбэрийн бүтэц
эсрэгтөрөгч-эсрэгбиеийн цогцолборыг шингээх, эсийн фагосом дахь устгах. IgG нь ихэсийн саадыг нэвтлэн ургийг халдвараас хамгаалах чадвартай цорын ганц төрлийн эсрэгбие юм.
Иммуноглобулин А
Эсрэгбиеийн үндсэн анги нь шүүрэлд (сүү, шүлс, амьсгалын замын болон гэдэсний замын шүүрэл) агуулагддаг. IgA нь үндсэндээ димер хэлбэрээр ялгардаг ба мономерууд нь нэмэлт J гинжээр дамжин өөр хоорондоо холбогддог (Зураг 1.32).
IgA нь комплемент систем болон фагоцит эсүүдтэй харьцдаггүй, харин бичил биетүүдтэй холбогдон эсрэгбие нь хучуур эдийн эсэд наалдаж, бие махбодид нэвтрэн орохоос сэргийлдэг.
Иммуноглобулин E
Иммуноглобулин Е нь хүнд ε-гинж нь нэг хувьсагч, дөрвөн тогтмол домэйн бүхий иммуноглобулины M-ийн μ-гинж агуулсан мономеруудаар төлөөлдөг. Шөл ялгасны дараа IgE нь түүнтэй холбогддог
 Цагаан будаа. 1.32. IgA-ийн бүтэц
Цагаан будаа. 1.32. IgA-ийн бүтэц
шигүү мөхлөгт эс ба базофилын гадаргуу дээрх харгалзах рецептор бүхий C-терминал бүсүүд. Үүний үр дүнд тэдгээр нь эдгээр эсийн гадаргуу дээрх эсрэгтөрөгчийн рецептор болдог (Зураг 1.33).
 Цагаан будаа. 1.33. шигүү мөхлөгт эсийн гадаргуу дээрх эсрэгтөрөгчтэй IgE-ийн харилцан үйлчлэл
Цагаан будаа. 1.33. шигүү мөхлөгт эсийн гадаргуу дээрх эсрэгтөрөгчтэй IgE-ийн харилцан үйлчлэл
Антиген нь IgE-ийн эсрэгтөрөгчтэй холбогдох газруудад наалдсаны дараа эсүүд биологийн идэвхт бодис (гистамин, серотонин) ялгаруулах дохиог хүлээн авдаг бөгөөд энэ нь үрэвслийн урвалыг хөгжүүлэх, харшлын урвалын илрэлийг голлон хариуцдаг. астма, чонон хөрвөс, хадлан халуурах.
Иммуноглобулин D
Иммуноглобулин D нь сийвэн дэх маш бага хэмжээгээр агуулагддаг бөгөөд тэдгээр нь мономерууд юм. Хүнд δ гинж нь нэг хувьсагч, гурван тогтмол домэйнтэй байдаг. IgD нь В-лимфоцитуудын рецепторын үүрэг гүйцэтгэдэг; В-лимфоцитын (IgD) гадаргуу дээрх тусгай эсрэгтөрөгчийн рецепторуудтай харилцан үйлчлэлцэх нь эдгээр дохиог эсэд дамжуулах, өгөгдсөн лимфоцитын клоныг үржүүлэх механизмыг идэвхжүүлэхэд хүргэдэг.
СЭДЭВ 1.7. УУРГИЙН ФИЗИК ХИМИЙН ШИНЖ, ТЭДГЭЭР САЛДАХ АРГА
1. Хувь хүний уураг нь физик, химийн шинж чанараараа ялгаатай байдаг.
Молекулын хэлбэр;
Молекулын жин;
Нийт цэнэгийн хэмжээ нь амин хүчлүүдийн анион ба катион бүлгийн харьцаанаас хамаарна;
Молекулын гадаргуу дээрх туйлт ба туйлшгүй амин хүчлийн радикалуудын харьцаа;
Төрөл бүрийн денатурат бодисыг эсэргүүцэх зэрэг.
2. Уургийн уусах чанар нь хамаарнадээр дурдсан уургийн шинж чанар, түүнчлэн уураг ууссан орчны найрлага (рН-ийн утга, давсны найрлага, температур, уурагтай харилцан үйлчлэх бусад органик бодисууд байгаа эсэх). Уургийн молекулуудын цэнэгийн хэмжээ нь тэдний уусах чадварт нөлөөлдөг хүчин зүйлүүдийн нэг юм. Изоцахилгаан цэгийн цэнэг алдагдах үед уураг нь илүү амархан нэгдэж, тунадас үүсгэдэг. Энэ нь ялангуяа гидрофобик амин хүчлийн радикалууд гадаргуу дээр гарч ирдэг денатурат уургийн хувьд онцлог юм.
Уургийн молекулын гадаргуу дээр эерэг ба сөрөг цэнэгтэй амин хүчлийн радикалууд байдаг. Эдгээр бүлгүүдийн тоо, улмаар уургийн нийт цэнэг нь орчны рН-ээс хамаарна, өөрөөр хэлбэл. H+ - ба OH - бүлгүүдийн концентрацийн харьцаа. Хүчиллэг орчинд H+ концентрацийн өсөлт нь карбоксил бүлгийн -COO - + H+ > - COOH-ийн диссоциацийг дарангуйлж, уургийн сөрөг цэнэгийг бууруулдаг. Шүлтлэг орчинд илүүдэл OH - NH 3 + + OH - - NH 2 + H 2 O амин бүлгүүдийн диссоциацийн явцад үүссэн протонуудтай холбогдож ус үүсэх нь уургийн эерэг цэнэгийг бууруулахад хүргэдэг. . Уургийн цэвэр тэг цэнэгтэй байх рН-ийн утгыг нэрлэдэг изоэлектрик цэг (IEP). IET-д эерэг ба сөрөг цэнэгтэй бүлгүүдийн тоо ижил байна, i.e. уураг нь изоэлектрик төлөвт байна.
3. Бие даасан уурагуудыг салгах.Биеийн бүтэц, үйл ажиллагааны онцлог нь түүнд нийлэгжсэн уургийн багцаас хамаардаг. Уургийн бүтэц, шинж чанарыг судлах нь тэдгээрийг эсээс тусгаарлаж, бусад уураг, органик молекулуудаас цэвэршүүлэхгүйгээр боломжгүй юм. Бие даасан уургийг тусгаарлах, цэвэршүүлэх үе шатууд:
Эсийн устгалсудалж буй эдийг гомогенатыг олж авах.
Гомогенатыг фракц болгон хуваахЦентрифуг хийх замаар хүссэн уураг агуулсан цөмийн, митохондрийн, цитозолын эсвэл бусад фракцыг олж авна.
Сонгомол дулааны денатураци- уургийн уусмалыг богино хугацаанд халаах, энэ хугацаанд зарим денатурат уургийн хольцыг арилгах боломжтой (хэрэв уураг харьцангуй халуунд тэсвэртэй бол).
Давслах.Уусмал дахь давсны янз бүрийн концентрацид янз бүрийн уураг тунадас үүсгэдэг. Давсны концентрацийг аажмаар нэмэгдүүлснээр тэдгээрийн аль нэгэнд нь тусгаарлагдсан уургийн давамгайлсан агууламж бүхий хэд хэдэн тусдаа фракцуудыг олж авах боломжтой.
Аммонийн сульфатыг ихэвчлэн уургийн хуваагдалд ашигладаг. Хамгийн бага уусах чадвартай уураг нь давсны концентраци багатай үед тунадас үүсгэдэг.Гель шүүлтүүр
- хавдсан Сефадекс мөхлөгөөр молекулуудыг шигших арга (нүх бүхий декстраны гурван хэмжээст полисахаридын гинж). Уургууд нь Sephadex-ээр дүүрсэн баганаар дамжин өнгөрөх хурд нь тэдний молекулын жингээс хамаарна: уургийн молекулуудын масс бага байх тусам тэдгээр нь мөхлөгт амархан нэвтэрч, масс нь их байх тусам тэд илүү хурдан ялгардаг багана.Хэт төвөөс зугтах
- центрифугийн хоолойд уурагуудыг хэт центрифугийн роторт оруулах арга. Ротор эргэх үед уургийн тунадасжилтын хурд нь тэдний молекул жинтэй пропорциональ байна: хүнд уургийн фракцууд нь туршилтын хоолойн ёроолд, хөнгөн нь гадаргууд ойрхон байрладаг.Электрофорез
- цахилгаан орон дахь уургийн хөдөлгөөний хурдны ялгаан дээр үндэслэсэн арга. Энэ утга нь уургийн цэнэгтэй пропорциональ байна. Уургийн электрофорезыг цаасан дээр (энэ тохиолдолд уургийн хөдөлгөөний хурд нь зөвхөн тэдгээрийн цэнэгтэй пропорциональ байна) эсвэл тодорхой нүхний хэмжээтэй полиакриламид гель (уургийн хөдөлгөөний хурд нь тэдгээрийн цэнэг ба молекул жинтэй пропорциональ) хэлбэрээр хийгддэг. .- эсрэг цэнэгтэй ион солилцооны давирхайн бүлгүүдтэй (уусдаггүй полимер материал) уургийн ионжсон бүлгүүдийг холбоход суурилсан фракцын арга. Уургийн давирхайтай холбогдох хүч нь уургийн цэнэгтэй пропорциональ байна. Ион солилцооны полимерт шингэсэн уураг нь NaCl уусмалын концентрацийг нэмэгдүүлснээр угааж болно; уургийн цэнэг бага байх тусам давирхайн ионы бүлгүүдтэй холбогдсон уургийг угаахад шаардагдах NaCl-ийн концентраци бага байх болно.
Ойролцоох хроматографи- бие даасан уургуудыг тусгаарлах хамгийн өвөрмөц арга бол уургийн лиганд нь идэвхгүй полимерт хавсардаг. Уургийн уусмалыг полимер бүхий баганаар нэвтрүүлэхэд уураг нь лигандтай нэмэлт холболтын улмаас баганад зөвхөн тухайн лигандын өвөрмөц уураг шингэдэг.
Диализ- тусгаарлагдсан уургийн уусмалаас бага молекул жинтэй нэгдлүүдийг арилгахад ашигладаг арга. Энэ арга нь бага молекул жинтэй бодисуудаас ялгаатай нь уураг нь хагас нэвчдэг мембранаар дамжих чадваргүйд суурилдаг. Энэ нь уургийг бага молекулын хольцоос, жишээлбэл, давсны дараа давснаас цэвэрлэхэд хэрэглэгддэг.
ХИЧЭЭЛИЙН ГАЦАХ АЖЛЫН ДААЛГАВАР
1. Хүснэгтийг бөглөнө үү. 1.4.
Хүснэгт 1.4. Холбогдох уургийн бүтэц, үйл ажиллагааны харьцуулсан шинжилгээ - миоглобин ба гемоглобин
a) Mb ба Hb-ийн идэвхтэй төвийн бүтцийг санаарай. Эдгээр уургийн идэвхтэй төвүүд үүсэхэд гидрофобик амин хүчлийн радикалууд ямар үүрэг гүйцэтгэдэг вэ? Mb ба Hb-ийн идэвхтэй төвийн бүтэц, түүнд ligandуудыг холбох механизмыг тайлбарлана уу. Түүний F 8 ба E 7 үлдэгдэл нь Mb ба Hb-ийн идэвхтэй төвийн үйл ажиллагаанд ямар үүрэг гүйцэтгэдэг вэ?
б) гемоглобин болох олигомер уураг нь мономер миоглобинтой харьцуулахад ямар шинэ шинж чанартай вэ? Гемоглобины молекул дахь протомеруудын конформацийн хамтын өөрчлөлтийн үүрэг, гемоглобины хүчилтөрөгчтэй ойртох чанарт CO 2 ба протоны концентрацийн нөлөө, түүнчлэн Hb функцийн аллостерик зохицуулалтад 2,3-BPG-ийн үүргийг тайлбарлана уу. .
2. Молекулын чаперонуудыг тэдгээрийн бүтэц, үйл ажиллагааны хоорондын хамаарлыг анхаарч үзээрэй.
3. Ямар уураг нь гэр бүлд хуваагддаг вэ? Иммуноглобулины гэр бүлийн жишээг ашиглан энэ гэр бүлийн уургийн ижил төстэй бүтэц, холбогдох функцийг тодорхойлно.
4. Биохимийн болон эмийн зориулалтаар цэвэршүүлсэн бие даасан уураг ихэвчлэн шаардлагатай байдаг. Уургийн физик-химийн ямар шинж чанарт үндэслэн тэдгээрийг ялгах, цэвэршүүлэх аргуудыг тайлбарлана уу.
ӨӨРИЙГӨӨ ХЯНАХ ДААЛГАВАР
1. Зөв хариултуудыг сонгоно уу.
Гемоглобины үүрэг:
A. Уушигнаас эдэд O 2 зөөвөрлөх B. Эдээс уушиг руу H+ тээвэрлэх.
B. Цусны рН-ийг тогтмол байлгах D. Уушигнаас эд эс рүү СО 2 тээвэрлэх
D. CO 2-ыг эд эсээс уушиг руу зөөвөрлөх
2. Зөв хариултуудыг сонгоно уу. Лигандα -протомер Hb нь:А.Хеме
B. Хүчилтөрөгч
B. CO G. 2,3-BPG
D. β-протомер
3. Зөв хариултуудыг сонгоно уу.
Миоглобиноос ялгаатай гемоглобин:
A. Дөрөвдөгч бүтэцтэй
B. Хоёрдогч бүтэц нь зөвхөн α-мушгиа хэлбэрээр илэрхийлэгдэнэ
B. Нарийн төвөгтэй уурагт хамаарна
D. Аллостерийн лигандтай харилцан үйлчилнэ D. Гемтэй ковалентаар холбогдоно
4. Зөв хариултуудыг сонгоно уу.
Hb-ийн O2-ийн хамаарал буурдаг:
A. Нэг O 2 молекул нэмэгдэхэд B. Нэг O 2 молекулыг арилгахад
B. 2,3-BPG-тэй харьцах үед
D. Протомерууд H + D. 2,3-BPG-ийн концентраци буурах үед
5. Тоглолт.
HB төрлүүд нь дараахь шинж чанартай байдаг.
A. Деокси хэлбэрээр фибрилляр агрегат үүсгэдэг B. Хоёр α- ба хоёр δ-гинж агуулсан.
B. Насанд хүрэгчдийн эритроцит дахь Hb зонхилох хэлбэр D. Идэвхтэй төвд Fe+ 3 агуулсан гем агуулсан.
D. Хоёр α- ба хоёр γ-гинж агуулсан 1. HbA 2.
6. Тоглолт.
Hb лигандууд:
A. Аллостерийн төвд Hb-тэй холбогддог
B. Hb-ийн идэвхтэй хэсэгт маш өндөр хамааралтай
B. Нэгдсэнээр Hb-ийн O 2 G-д ойртох чадварыг нэмэгдүүлнэ. Fe+ 2-ыг Fe+ 3 болгон исэлдүүлнэ.
D. ТүүнийF8-тай ковалент холбоо үүсгэнэ
7. Зөв хариултуудыг сонгоно уу.
Хөтлөгчид:
A. Эсийн бүх хэсэгт байдаг уураг
B. Стрессийн үед нийлэгжилт нэмэгддэг
B. Денатурат уургийн гидролизд оролцоно
D. Уургийн унаган хэлбэрийг хадгалахад оролцох
D. Тэд уургийн конформаци үүсдэг органеллуудыг үүсгэдэг.
8. Тохирох. Иммуноглобулин:
A. Нууцлаг хэлбэр нь пентамер юм.
B. Ихэсийн саадыг нэвчих Ig ангилал
B. Ig - шигүү мөхлөгт эсийн рецептор
D. Эпителийн эсийн шүүрэлд агуулагдах Ig-ийн үндсэн анги. D. В-лимфоцитын рецептор, түүний идэвхжүүлэлт нь эсийн өсөлтийг баталгаажуулдаг
9. Зөв хариултуудыг сонгоно уу.
Иммуноглобулин Е:
A. Макрофаг үүсгэдэг B. Тэд хүнд ε гинжтэй.
B. Т-лимфоцитын мембранд суулгагдсан
D. шигүү мөхлөгт эс ба базофилд мембраны эсрэгтөрөгчийн рецепторын үүрэг гүйцэтгэнэ
D. Харшлын урвалыг хариуцдаг
10. Зөв хариултуудыг сонгоно уу.
Уургийг ялгах арга нь тэдгээрийн молекул жингийн ялгаан дээр суурилдаг.
A. Гель шүүлтүүр
B. Хэт төвөөс зугтах
B. Полиакриламидын гель электрофорез D. Ион солилцооны хроматограф
D. Ойролцоо хроматографи
11. Зөв хариултыг сонгоно уу.
Уургийг ялгах арга нь усанд уусах чадварын ялгаан дээр суурилдаг.
A. Гель шүүлтүүр B. Давслах
B. Ион солилцооны хроматограф D. Ойролцоо хроматограф
D. Полиакриламидын гель дэх электрофорез
“ӨӨРИЙГӨӨ ХЯНАЛТЫН ДААЛГАВАР” ХАРИУЛАХ СТАНДАРТ
1. A, B, C, D
2. A, B, C, D
5. 1-Б, 2-А, 3-Г
6. 1-Б, 2-Б, 3-А
7. A, B, D, D
8. 1-G; 2-Б, 3-Б
ҮНДСЭН НЭР ХҮЛЭЭР, ҮЗЭЛЧИЛГЭЭ
1. Олигомер уураг, протомер, уургийн дөрөвдөгч бүтэц
2. Протомерын конформацийн хамтын өөрчлөлт
3. Бор эффект
4. Уургийн үйл ажиллагааны аллостерийн зохицуулалт, аллостерийн төв ба аллостерийн эффектор
5. Молекулын шаперонууд, дулааны цохилтын уургууд
6. Уургийн гэр бүл (серин протеаз, иммуноглобулин)
7. IgM-, G-, E-, A-бүтэц функциональ хамаарал
8. Уургийн нийт цэнэг, уургийн изоэлектрик цэг
9. Электрофорез
10. Давслах
11. Гель шүүлтүүр
12. Ион солилцооны хроматографи
13. Хэт төвөөс зугтах
14. Ойролцоо хроматографи
15. Цусны сийвэнгийн уургийн электрофорез
АНГИЙН АЖЛЫН ДААЛГАВАР
1. Гемоглобин (Hb) ба миоглобин (Mb) -ийн хүчилтөрөгчтэй ханасан түвшингийн эд эс дэх хэсэгчилсэн даралтаас хамаарлыг харьцуул.
 Цагаан будаа. 1.34. Ханалтын хамаарал Mv баNHтүүний хэсэгчилсэн даралтаас хүчилтөрөгч
Цагаан будаа. 1.34. Ханалтын хамаарал Mv баNHтүүний хэсэгчилсэн даралтаас хүчилтөрөгч
Уургийн хүчилтөрөгчийн ханалтын муруй хэлбэр нь өөр өөр байдаг гэдгийг анхаарна уу: миоглобины хувьд - гипербола, гемоглобины хувьд - сигмоид хэлбэр.
1. Mb ба Hb нь O2-ээр ханасан хүчилтөрөгчийн хэсэгчилсэн даралтын утгыг 50% харьцуулна уу. Эдгээр уургуудын аль нь O2-тэй илүү хамааралтай вэ?
2. Mb-ийн ямар бүтцийн онцлогууд нь түүний O 2-д өндөр хамааралтай болохыг тодорхойлдог вэ?
3. HB-ийн бүтцийн ямар онцлог нь амарч буй эдүүдийн хялгасан судсанд (O2-ын харьцангуй өндөр хэсэгчилсэн даралттай үед) O2-ыг ялгаруулах, ажлын булчинд энэ ялгаралтыг огцом нэмэгдүүлэх боломжийг олгодог вэ? Олигомер уургийн ямар шинж чанар ийм нөлөө үзүүлдэг вэ?
4. Хүчилтөрөгчжүүлсэн гемоглобин ямар хэмжээний O 2 (% -иар) амарч, ажиллаж байгаа булчингуудад өгдөгийг тооцоолно уу?
5. уургийн бүтэц, үйл ажиллагааны хоорондын хамаарлын талаар дүгнэлт хийх.
2. Капилляр дахь гемоглобинаас ялгарах хүчилтөрөгчийн хэмжээ нь эд эс дэх катаболик үйл явцын эрчмээс хамаарна (Бор эффект). Эдийн бодисын солилцооны өөрчлөлт нь Hb-ийн O2-ийн хамаарлыг хэрхэн зохицуулдаг вэ? CO 2 ба H+-ийн O 2-д Hb-ийн хамааралд үзүүлэх нөлөө
 1. Бор эффектийг тайлбарла.
1. Бор эффектийг тайлбарла.
2. диаграммд үзүүлсэн процесс ямар чиглэлд явагдах вэ?
a) уушигны хялгасан судаснуудад;
б) эдийн хялгасан судсанд уу?
3. Бор эффектийн физиологийн ач холбогдол юу вэ?
4. Гемээс алслагдсан газруудад Hb-ийн H+-тэй харилцан үйлчлэлцэх нь уургийн O 2-д ойртох чадварыг яагаад өөрчилдөг вэ?
3. Hb-ийн O2-тэй ойр дотно байдал нь түүний лиганд - 2,3-бисфосфоглицератын концентрацаас хамаардаг бөгөөд энэ нь Hb-ийн O2-ийн хамаарлын аллостерик зохицуулагч юм.
Идэвхтэй цэгээс алслагдсан хэсэгт лигандын харилцан үйлчлэл яагаад уургийн үйл ажиллагаанд нөлөөлдөг вэ? 2,3-BPG нь Hb-ийн O2-ийн хамаарлыг хэрхэн зохицуулдаг вэ? Асуудлыг шийдэхийн тулд дараах асуултуудад хариулна уу.
1. 2.3-бисфосфоглицерат (2,3-BPG) хаанаас, юунаас нийлэгждэг вэ? Түүний томьёог бичээд энэ молекулын цэнэгийг заана уу.
2. Гемоглобины аль хэлбэр (окси эсвэл деокси) BPG-тэй харилцан үйлчлэлцдэг, яагаад? Hb молекулын аль хэсэгт харилцан үйлчлэл үүсдэг вэ?
3. диаграммд үзүүлсэн процесс ямар чиглэлд явагдах вэ?
a) эдийн хялгасан судаснуудад;
б) уушигны хялгасан судсанд уу?
4. цогцолборын агууламж өндөр байх ёстой газар
Nv-2,3-BFG:
a) тайван байдалд байгаа булчингийн хялгасан судсанд;
б) ажиллаж буй булчингийн хялгасан судсанд (эритроцит дахь BPG-ийн ижил концентрацийг хангасан)?
4. 5. Хэрэв эритроцит дахь BPG-ийн концентраци нэмэгдвэл хүн өндөр уулын нөхцөлд дасан зохицох үед HB-ийн хүчилтөрөгчтэй харьцах харьцаа хэрхэн өөрчлөгдөх вэ? Энэ үзэгдлийн физиологийн ач холбогдол юу вэ?
5. Хадгалсан цусыг хадгалах явцад 2,3-BPG-ийг устгах нь HB-ийн үйл ажиллагааг алдагдуулдаг. Хэрэв эритроцит дахь 2,3-BPG-ийн концентраци 8-аас 0,5 ммоль/л хүртэл буурч байвал хадгалсан цусан дахь HB-ийн O 2-ийн хамаарал хэрхэн өөрчлөгдөх вэ? Гурав хоногийн дараа 2,3-BPG-ийн концентрацийг сэргээвэл ийм цусыг хүнд өвчтэй өвчтөнүүдэд сэлбэх боломжтой юу? Цусанд 2,3-BPG нэмснээр цусны улаан эсийн үйл ажиллагааг сэргээх боломжтой юу?
Хамгийн энгийн иммуноглобулины молекулуудын бүтцийг санаарай. Дархлааны тогтолцоонд иммуноглобулин ямар үүрэг гүйцэтгэдэг вэ? Яагаад Ig-ийг ихэвчлэн бивалент гэж нэрлэдэг вэ? Igs-ийн бүтэц нь тэдний үйл ажиллагаатай хэрхэн холбоотой вэ? (Иммуноглобулины ангиллын жишээг ашиглан тайлбарла.)
6. Уургийн физик-химийн шинж чанар, тэдгээрийг ялгах арга.
Уургийн цэвэр цэнэг уусах чанарт хэрхэн нөлөөлдөг вэ?
a) рН 7-д пептидийн нийт цэнэгийг тодорхойлно
Ala-Glu-Tre-Pro-Asp-Liz-Cis<7, рН <<7?
б) рН >7, рН үед энэ пептидийн цэнэг хэрхэн өөрчлөгдөх вэ?
в) уургийн изоэлектрик цэг (IEP) гэж юу вэ, энэ нь ямар орчинд оршдог вэ?
Энэ пептидийн IET?
7. г) энэ пептидийн хамгийн бага уусах чадвар нь ямар рН-ийн утгаар ажиглагдах вэ.
8. Гель шүүлтүүрийг бие даасан уурагуудыг ялгахад ашигладаг. 160,000, 80,000, 60,000-тай тэнцүү молекул жинтэй A, B, C уураг агуулсан хольцыг гель шүүлтүүрээр шинжлэв (Зураг 1.35). Хавдсан гель мөхлөгүүд нь 70,000-аас бага молекул жинтэй уургийг нэвчүүлэх чадвартай байдаг. Аль график нь бутархайлалтын үр дүнг зөв тусгасан бэ? А, В, С уураг баганаас ялгарах дарааллыг заана уу.
 Цагаан будаа. 1.35. Уургийг ялгахын тулд гель шүүлтүүрийг ашиглах
Цагаан будаа. 1.35. Уургийг ялгахын тулд гель шүүлтүүрийг ашиглах
9. Зураг дээр. 1.36, А нь эрүүл хүний цусны сийвэнгийн уургийн электрофорезийн диаграммыг цаасан дээр харуулав. Энэ аргыг ашиглан олж авсан уургийн фракцуудын харьцангуй хэмжээ нь: альбумин 54-58%, α 1 - глобулин 6-7%, α 2 - глобулин 8-9%, β-глобулин 13%, γ-глобулин 11-12% .
 Цагаан будаа. 1.36 Эрүүл хүн (А) ба өвчтөний (В) цусны сийвэнгийн уургийн цаасан дээрх электрофорез.
Цагаан будаа. 1.36 Эрүүл хүн (А) ба өвчтөний (В) цусны сийвэнгийн уургийн цаасан дээрх электрофорез.
I - γ-глобулинууд; II - β-глобулин; III -α 2 - глобулин; IV -α 2 - глобулин; V - альбуминууд
Олон өвчин ийлдсийн уургийн найрлага дахь тоон өөрчлөлт (диспротеинеми) дагалддаг. Оношлогоо хийх, өвчний хүнд байдал, үе шатыг үнэлэхдээ эдгээр өөрчлөлтийн шинж чанарыг харгалзан үздэг.
Хүснэгтэд өгсөн өгөгдлийг ашиглан. 1.5, Зураг дээр үзүүлсэн электрофорезийн дүр төрхөөр тодорхойлогддог өвчний талаар таамагла. 1.36.
Хүснэгт 1.5. Эмгэг судлалын сийвэнгийн уургийн концентрацийн өөрчлөлт
П ЭРВИЧНАЯ БҮТЭЦБЕЛКОВ
Уургийн үндсэн бүтэц нь тухай мэдээллийг агуулдаг түүний орон зайн бүтэц.
1. Уургийн пептидийн гинжин хэлхээнд агуулагдах амин хүчлийн үлдэгдэл нь санамсаргүй байдлаар солигддоггүй, тодорхой дарааллаар байрладаг. Полипептидийн гинжин хэлхээнд байгаа амин хүчлийн үлдэгдлийн шугаман дарааллыг нэрлэдэг уургийн анхдагч бүтэц.
2. Уураг бүрийн анхдагч бүтэц нь ДНХ-ийн молекулд (ген гэж нэрлэгддэг бүс) кодлогдсон бөгөөд транскрипц (мРНХ-д мэдээллийг хуулах) болон орчуулах (пептидийн гинжин нийлэгжилт) үед хэрэгждэг.
3. Хүний биед агуулагдах 50,000 бие даасан уураг тус бүрд байдаг өвөрмөцтухайн бие даасан уургийн хувьд анхдагч бүтэц. Бие даасан уургийн бүх молекулууд (жишээлбэл, альбумин) амин хүчлийн үлдэгдлүүдийн ижил ээлжтэй байдаг бөгөөд энэ нь альбуминыг бусад бие даасан уурагаас ялгаж өгдөг.
4. Пептидийн гинжин хэлхээнд байгаа амин хүчлийн үлдэгдлүүдийн дарааллыг гэж үзэж болно
бүртгэлийн маягт
зарим мэдээлэлтэй.
Энэхүү мэдээлэл нь урт шугаман пептидийн гинжин хэлхээг илүү нягт гурван хэмжээст бүтэц болгон орон зайн нугалахад хүргэдэг.
ТОХИРУУЛАЛТБЕЛКОВ
1. Бие даасан уургийн шугаман полипептидийн гинж нь амин хүчлүүдийн функциональ бүлгүүдийн харилцан үйлчлэлийн улмаас тодорхой орон зайн гурван хэмжээст бүтэц буюу конформацийг олж авдаг. Бөмбөрцөгт уургууд байдаг
үндсэн хоёр төрөл зохицолпептидийн гинж: хоёрдогч ба гуравдагч бүтэц.
ХОЁРДУГААРБҮТЭЦБЕЛКОВ
2. Уургийн хоёрдогч бүтэцнь пептидийн нурууны функциональ бүлгүүдийн харилцан үйлчлэлийн үр дүнд үүссэн орон зайн бүтэц юм. Энэ тохиолдолд пептидийн гинж нь ердийн бүтцийг олж авах боломжтой хоёр төрөл:ос-спиральТэгээд p-бүтэцүүд.
Цагаан будаа. 1.2. Уургийн хоёрдогч бүтэц нь a-helix юм.
Ос-спираль хэлбэрээрУстөрөгчийн холбоо нь карбоксил бүлгийн хүчилтөрөгчийн атом ба усны хооронд үүсдэг 4 амин хүчлээр дамжин пептидийн нурууны амид азотын төрөл; амин хүчлийн үлдэгдлийн хажуугийн гинж нь хоёрдогч бүтцийг бүрдүүлдэг устөрөгчийн холбоо үүсэхэд оролцдоггүй мушгиа захын дагуу байрладаг (Зураг 1.2).
Их хэмжээний үлдэгдэл эсвэл ижил няцаах цэнэгтэй үлдэгдэл үүсэхээс сэргийлнэα-геликс үүсэхийг дэмжинэ.
Пролины үлдэгдэл нь цагираган бүтэцтэй, пептидийн гинжин хэлхээний азотын атомд устөрөгч дутагдсанаас устөрөгчийн холбоо үүсгэх чадваргүйн улмаас α-геликсийг тасалдаг.
Б-Бүтэцнэг полипептидийн гинжин хэлхээний шугаман хэсгүүдийн хооронд атираа үүсгэх, эсвэл өөр өөр полипептидийн гинжин хэлхээний хооронд үүсдэг. Полипептидийн гинж эсвэл тэдгээрийн хэсэг үүсч болно зэрэгцээ(Харилцаж буй пептидийн гинжин хэлхээний N ба C төгсгөлүүд ижил байна) эсвэл эсрэг параллель(Харилцаж буй пептидийн гинжин хэлхээний N ба C төгсгөлүүд нь эсрэг чиглэлд байрладаг) p-бүтэцүүд(Зураг 1.3).
INУургууд нь мөн адил бус хоёрдогч бүтэцтэй хэсгүүдийг агуулдаг бөгөөд тэдгээрийг нэрлэдэг санамсаргүй орооцолдолд,Хэдийгээр эдгээр бүтэц нь нэг уургийн молекулаас нөгөөд тийм ч их өөрчлөгддөггүй.
Гуравдагч шатБҮТЭЦБЕЛКОВ
3. Уургийн гуравдагч бүтэцнь амин хүчлийн радикалуудын харилцан үйлчлэлийн үр дүнд бий болсон гурван хэмжээст орон зайн бүтэц бөгөөд энэ нь пептидийн гинжин хэлхээнд бие биенээсээ нэлээд зайд байрладаг.
Цагаан будаа. 1.3. Антипараллель (бета бүтэц.)
.jpg)
Гидрофобик амин хүчлийн радикалууд нь уургийн бөмбөрцөг бүтцэд нэгдэх хандлагатай байдаг. хөтөч-рофобик харилцан үйлчлэлба молекул хоорондын ван дер Ваалсын хүчнүүд нь нягт гидрофобик цөмийг үүсгэдэг. Гидрофиль ионжуулсан ба ионжоогүй амин хүчлийн радикалууд нь уургийн гадаргуу дээр голчлон байрлаж, усанд уусах чадварыг нь тодорхойлдог.
Гидрофобик цөмд агуулагдах гидрофил амин хүчлүүд нь хоорондоо харилцан үйлчлэлцэж чаддаг ионТэгээд устөрөгчийн холбоо(будаа. 1.4).
.jpg)
Цагаан будаа. 1.4. Уургийн гуравдагч бүтэц үүсэх үед амин хүчлийн радикалуудын хооронд үүсдэг бондын төрлүүд. 1 - ионы холбоо; 2 - устөрөгчийн холбоо; 3 - гидрофобик харилцан үйлчлэл; 4 - дисульфидын холбоо.
|
|
Цагаан будаа. 1.5. Хүний инсулины бүтэц дэх дисульфидын холбоо.
Ион, устөрөгч, гидрофобын холбоо нь сул байдаг: тэдгээрийн энерги нь өрөөний температурт молекулуудын дулааны хөдөлгөөний энергиээс хамаагүй өндөр биш юм.
Ийм олон сул холбоосууд гарч ирснээр уургийн зохицол хадгалагдана.
Уургийн конформацийн lababilityУургийн зарим нь тасарч, бусад сул холбоо үүссэний улмаас зохицолд бага зэрэг өөрчлөлт орох чадвар юм.
Зарим уургийн гуравдагч бүтэц тогтворждог дисульфидын холбоо,Хоёр цистеины үлдэгдлийн SH бүлгийн харилцан үйлчлэлийн үр дүнд үүсдэг.
Ихэнх эсийн доторх уургууд нь ковалент дисульфидын холбоогүй байдаг. Тэдний оршихуй нь эсээс ялгардаг уургийн шинж чанартай байдаг, жишээлбэл, дисульфидын холбоо нь инсулин ба иммуноглобулины молекулуудад байдаг;
Инсулин- нойр булчирхайн бета эсүүдэд нийлэгждэг уургийн даавар. Цусан дахь глюкозын концентраци нэмэгдсэний хариуд эсээс ялгардаг. Инсулины бүтцэд 2 полипептид А- ба В-гинжийг холбосон 2 дисульфидын холбоо, А-гинжин дотор 1 дисульфидын холбоо байдаг (Зураг 1.5).
Уургийн хоёрдогч бүтцийн онцлог нь радикал хоорондын харилцан үйлчлэлийн шинж чанар, гуравдагч бүтэцэд нөлөөлдөг.
4. Хоёрдогч бүтэц солигдох тодорхой тодорхой дараалал нь янз бүрийн бүтэц, үүрэг бүхий олон уурагт ажиглагддаг бөгөөд үүнийг супер хоёрдогч бүтэц гэж нэрлэдэг.
Ийм захиалгат бүтцийг ихэвчлэн бүтцийн хээ гэж нэрлэдэг.тусгай нэртэй байдаг: "a-helix-turn-a-helix", "лейцин цахилгаан товч", "цинк хуруу", "P-баррель бүтэц" гэх мэт.
α-спираль ба β-бүтэц байгаа эсэхээс хамааран бөмбөрцөг уургийг 4 ангилалд хувааж болно.
1. Эхний ангилалд зөвхөн α-helices агуулсан уураг, жишээ нь миоглобин ба гемоглобин (Зураг 1.6) орно.
2. Хоёрдахь ангилалд a-helices ба (3-бүтэц. Энэ тохиолдолд a- ба (3-бүтэц) нь ихэвчлэн өөр өөр уурагт агуулагдах ижил төрлийн нэгдлүүдийг үүсгэдэг уургууд багтана.
Жишээ. P-баррель төрлийн супер хоёрдогч бүтэц.
Триосфосфат изомераза фермент нь P-баррель хэлбэрийн супер хоёрдогч бүтэцтэй бөгөөд тус бүр нь (3-бүтэц нь P-баррель дотор байрладаг бөгөөд полипептидийн α-спираль бүстэй холбоотой байдаг.молекулын гадаргуу дээр байрлах гинж (Зураг 1.7, A).
Цагаан будаа. 1.7. p-баррель төрлийн супер хоёрдогч бүтэц.
a - триософосфатын изомераза; b - Пиру Ватка Назигийн домэйн.
.jpg)
Пируват киназа ферментийн молекулын аль нэг мужид ижил супер хоёрдогч бүтэц олдсон (Зураг 1.7, b). Домэйн нь бүтэц нь бие даасан бөмбөрцөг уурагтай төстэй молекулын нэг хэсэг юм.
P-бүтэц ба ос-спиральтай суперсекундар бүтэц үүссэн өөр нэг жишээ. Лактат дегидрогеназа (LDH) ба фосфоглицератын киназын аль нэгэнд полипептидийн гинжин хэлхээний P-бүтэцүүд нь эрчилсэн хуудас хэлбэрээр төв хэсэгт байрладаг бөгөөд P-бүтэц бүр нь α-спираль мужтай холбоотой байдаг. молекулын гадаргуу дээр (Зураг 1.8).
Цагаан будаа. 1.8. Хоёрдогч бүтэц нь олон фер-цагдаа.
А-лактатдегидрогеназын домайн; б—фосфоглицератын киназын домайн.
.jpg) 3. Гурав дахь ангилалд байгаа уургууд орнозөвхөн хоёрдогч p-бүтэцийг агуулсан. Ийм бүтэц нь иммуноглобулин, ферментийн супероксид дисмутазаас олддог (Зураг 1.9).
3. Гурав дахь ангилалд байгаа уургууд орнозөвхөн хоёрдогч p-бүтэцийг агуулсан. Ийм бүтэц нь иммуноглобулин, ферментийн супероксид дисмутазаас олддог (Зураг 1.9).
Цагаан будаа. 1.9. Иммуноглобулины тогтмол домэйны хоёрдогч бүтэц (А)
мөн супероксид дисмутаза фермент (б).
.jpg)
4. Дөрөв дэх ангилалд зөвхөн бага хэмжээний ердийн хоёрдогч бүтцийг агуулсан уураг орно. Эдгээр уургууд нь цистинээр баялаг жижиг уураг эсвэл металлопротейн агуулдаг.
ДНХ-тэй холбодог уургууд нь нийтлэг төрлийн супер хоёрдогч бүтэцтэй байдаг: "os-helix-turn-os-helix", "лейцин цахилгаан товч", "цинк-хуруунууд чинь."ДНХ-тэй холбох уураг нь тодорхой нуклеотидын дараалал бүхий ДНХ-ийн бүсийг нөхөх холбоосыг агуулдаг. Эдгээр уураг нь генийн үйл ажиллагааг зохицуулахад оролцдог.
« А-
Спираль - эргэлт - спираль"
Цагаан будаа. 1.10. Дээд боловсролыг холбох
"a-helix-turn-a-helis" бүтэц
гол ховилд D
|
|
.jpg) хүзүүний ховил сайнжижиг мушгиа хэсгүүдтэй уурагуудыг холбоход тохирсон.
хүзүүний ховил сайнжижиг мушгиа хэсгүүдтэй уурагуудыг холбоход тохирсон.
Энэхүү бүтцийн загварт 2 мушгиа орно: нэг нь богино, нөгөө нь урт, полипептидийн гинжин хэлхээний эргэлтээр холбогдсон (Зураг 1.10).
Богино α-геликс нь ДНХ-ийн ховил дээр, урт α-геликс нь гол ховилд байрлаж, амин хүчлийн радикалуудын ДНХ нуклеотидуудтай ковалент бус өвөрмөц холбоог үүсгэдэг.
Ихэнхдээ ийм бүтэцтэй уураг нь димер үүсгэдэг, олигомер уураг нь 2 супер хоёрдогч бүтэцтэй байдаг.
Тэд бие биенээсээ тодорхой зайд байрладаг бөгөөд уургийн гадаргуугаас дээш гарч ирдэг (Зураг 1.11).Ийм хоёр бүтэц нь гол ховилын зэргэлдээх хэсгүүдэд ДНХ-г холбож чаддаг
гүйгээруургийн бүтцэд мэдэгдэхүйц өөрчлөлт орно.
"Цайрын хуруу"
"Цайрын хуруу" нь 20 орчим амин хүчлийн үлдэгдэл агуулсан уургийн хэсэг юм (Зураг 1.12).
Цайрын атом нь 4 амин хүчлийн радикалтай холбоотой байдаг: 2 цистеины үлдэгдэл, 2 гистидиний үлдэгдэл.
Зарим тохиолдолд гистидиний үлдэгдэл оронд цистеины үлдэгдэл байдаг.
Цагаан будаа. 1.12. ДНХ-тэй холбох бүсийн бүтэц"Цайрын хуруу" хэлбэрийн уураг.
.jpg)
Уургийн энэ хэсэг нь α-геликс үүсгэдэг бөгөөд энэ нь ДНХ-ийн гол ховилын зохицуулалтын хэсгүүдтэй тусгайлан холбогдож чаддаг.
Хувь хүний зохицуулалтын ДНХ-тэй холбох уургийн холболтын өвөрмөц байдал нь цайрын хурууны бүсэд байрлах амин хүчлийн үлдэгдлүүдийн дарааллаас хамаарна.
"Лейцин цахилгаан товч"
Харилцан үйлчилдэг уургууд нь дор хаяж 4 лейциний үлдэгдэл агуулсан α-спираль мужтай байдаг.
Лейциний үлдэгдэл нь бие биенээсээ 6 амин хүчлээр байрладаг.
α-геликсийн эргэлт бүрт 3,6 амин хүчлийн үлдэгдэл агуулагддаг тул лейциний радикалууд хоёр дахь эргэлт бүрт гадаргуу дээр байрладаг.
Нэг уургийн α-геликсийн лейциний үлдэгдэл нь өөр уургийн лейциний үлдэгдэлтэй (гидрофобик харилцан үйлчлэл) харилцан үйлчилж, тэдгээрийг хооронд нь холбодог (Зураг 1.13).
.jpg) ДНХ-тэй холбодог олон уураг нь ДНХ-тэй олигомер бүтэц хэлбэрээр харилцан үйлчилдэг бөгөөд дэд хэсгүүд нь хоорондоо "лейцин цахилгаан товч"-оор холбогддог. Ийм уургийн жишээ бол гистонууд юм.
ДНХ-тэй холбодог олон уураг нь ДНХ-тэй олигомер бүтэц хэлбэрээр харилцан үйлчилдэг бөгөөд дэд хэсгүүд нь хоорондоо "лейцин цахилгаан товч"-оор холбогддог. Ийм уургийн жишээ бол гистонууд юм.
Гистонууд- олон тооны эерэг цэнэгтэй амин хүчлүүд агуулсан цөмийн уураг - аргинин ба лизин (80% хүртэл).
Гистоны молекулууд нь эдгээр молекулуудын хүчтэй эерэг цэнэгийг үл харгалзан "лейцин цахилгаан товч" ашиглан 8 мономер агуулсан олигомерийн цогцолбор болгон нэгтгэдэг.
Үргэлжлэл.Ижил анхдагч бүтэцтэй бие даасан уургийн бүх молекулууд уусмал дахь ижил хэлбэрийг олж авдаг.
Тиймээс, пептидийн гинжин хэлхээний орон зайн зохион байгуулалтын шинж чанарыг амин хүчлээр тодорхойлнонайрлага дахь амин хүчлийн үлдэгдлүүдийн ээлжгинж.Иймээс конформаци нь бие даасан уургийн үндсэн бүтэцтэй адил өвөрмөц шинж чанар юм.
Хэрэм- α-амин хүчлийн үлдэгдэлээс бүрдэх өндөр молекул жинтэй органик нэгдлүүд.
IN уургийн найрлаганүүрстөрөгч, устөрөгч, азот, хүчилтөрөгч, хүхэр орно. Зарим уураг нь фосфор, төмөр, цайр, зэс агуулсан бусад молекулуудтай нэгдэл үүсгэдэг.
Уургууд нь том молекул жинтэй: өндөгний альбумин - 36,000, гемоглобин - 152,000, миозин - 500,000 Харьцуулбал: архины молекул жин 46, цууны хүчил - 60, бензол - 78.
Уургийн амин хүчлийн найрлага
Хэрэм- үечилсэн бус полимер, тэдгээрийн мономерууд α-амин хүчлүүд. Ерөнхийдөө 20 төрлийн α-амин хүчлийг уургийн мономер гэж нэрлэдэг боловч тэдгээрийн 170 гаруй нь эс, эдэд байдаг.
Хүн болон бусад амьтдын биед амин хүчлүүд нийлэгжих боломжтой эсэхээс хамааран тэдгээрийг дараахь байдлаар ялгадаг. чухал бус амин хүчлүүд- синтез хийх боломжтой; чухал амин хүчлүүд- синтез хийх боломжгүй. Чухал амин хүчлүүд нь бие махбодийг хоол хүнсээр хангах ёстой. Ургамал бүх төрлийн амин хүчлийг нийлэгжүүлдэг.
Амин хүчлийн найрлагаас хамааран уураг нь: бүрэн- бүхэл бүтэн амин хүчлийг агуулсан; гэмтэлтэй- Тэдний найрлагад зарим амин хүчлүүд дутагдаж байна. Хэрэв уураг нь зөвхөн амин хүчлээс бүрддэг бол тэдгээрийг нэрлэдэг энгийн. Хэрэв уураг нь амин хүчлээс гадна амин хүчлийн бус бүрэлдэхүүн хэсэг (хиймэл бүлэг) агуулдаг бол тэдгээрийг гэж нэрлэдэг. цогцолбор. Протезийн бүлгийг металл (металлопротейн), нүүрс ус (гликопротейн), липид (липопротейн), нуклейн хүчил (нуклеопротейн) -ээр төлөөлж болно.
Бүгд амин хүчил агуулдаг: 1) карбоксил бүлэг (-COOH), 2) амин бүлэг (-NH 2), 3) радикал буюу R-бүлэг (молекулын үлдсэн хэсэг). Радикалын бүтэц нь янз бүрийн төрлийн амин хүчлүүдийн хувьд өөр өөр байдаг. Амин хүчлүүдийн найрлагад орсон амин бүлэг ба карбоксил бүлгийн тооноос хамааран тэдгээрийг дараахь байдлаар ялгана. төвийг сахисан амин хүчилнэг карбоксил бүлэг, нэг амин бүлэгтэй байх; үндсэн амин хүчлүүднэгээс илүү амин бүлэгтэй байх; хүчиллэг амин хүчилнэгээс олон карбоксил бүлэгтэй.
Амин хүчил нь амфотер нэгдлүүд, учир нь уусмалд тэдгээр нь хүчил ба суурийн үүрэг гүйцэтгэдэг. Усан уусмалд амин хүчлүүд өөр өөр ионы хэлбэрээр байдаг.
Пептидийн холбоо
Пептидүүд- пептидийн холбоогоор холбогдсон амин хүчлийн үлдэгдэлээс бүрдэх органик бодисууд.
Пептид үүсэх нь амин хүчлүүдийн конденсацийн урвалын үр дүнд үүсдэг. Нэг амин хүчлийн амин бүлэг нь нөгөөгийн карбоксил бүлэгтэй харилцан үйлчлэхэд тэдгээрийн хооронд ковалент азот-нүүрстөрөгчийн холбоо үүсдэг бөгөөд үүнийг гэнэ. пептид. Пептидэд агуулагдах амин хүчлийн үлдэгдлийн тооноос хамаарч байдаг дипептид, трипептид, тетрапептидгэх мэт. Пептидийн холбоо үүсэх нь олон удаа давтагдаж болно. Энэ нь үүсэхэд хүргэдэг полипептидүүд. Пептидийн нэг төгсгөлд чөлөөт амин бүлэг (N-төгсгөл гэж нэрлэдэг), нөгөө талд нь чөлөөт карбоксил бүлэг (С-төгсгөл гэж нэрлэдэг) байдаг.

Уургийн молекулуудын орон зайн зохион байгуулалт
Уургийн тодорхой функцийг гүйцэтгэх нь тэдгээрийн молекулуудын орон зайн тохиргооноос хамаардаг бөгөөд эсүүд уурагуудыг задалсан хэлбэрээр, гинж хэлбэрээр хадгалах нь энергийн хувьд тааламжгүй байдаг тул полипептидийн гинж нь эвхэгддэг. тодорхой гурван хэмжээст бүтэц буюу конформаци. 4 түвшинтэй уургийн орон зайн зохион байгуулалт.
Анхдагч уургийн бүтэц- уургийн молекулыг бүрдүүлдэг полипептидийн гинжин хэлхээнд амин хүчлийн үлдэгдлийн байршлын дараалал. Амин хүчлүүдийн хоорондын холбоо нь пептидийн холбоо юм.

Хэрэв уургийн молекул нь зөвхөн 10 амин хүчлийн үлдэгдэлээс бүрддэг бол амин хүчлүүдийн ээлжийн дарааллаар ялгаатай уургийн молекулуудын онолын хувьд боломжтой хувилбаруудын тоо 10 20 байна. 20 амин хүчлүүдтэй тул та тэдгээрээс илүү олон төрлийн хослол хийж болно. Хүний биед бие биенээсээ болон бусад организмын уурагуудаас ялгаатай арван мянга орчим янз бүрийн уураг олдсон.
Энэ нь уургийн молекулын шинж чанар, түүний орон зайн тохиргоог тодорхойлдог уургийн молекулын анхдагч бүтэц юм. Полипептидийн гинжин хэлхээнд нэг амин хүчлийг нөгөө амин хүчлээр солих нь уургийн шинж чанар, функцийг өөрчлөхөд хүргэдэг. Жишээлбэл, гемоглобины β-дэд хэсэг дэх зургаа дахь глютамины амин хүчлийг валинаар солих нь гемоглобины молекул бүхэлдээ үндсэн үүргээ гүйцэтгэх боломжгүй болоход хүргэдэг - хүчилтөрөгч тээвэрлэх; Ийм тохиолдолд тухайн хүн хадуур эсийн цус багадалт гэж нэрлэгддэг өвчин тусдаг.
Хоёрдогч бүтэц- полипептидийн гинжийг спираль хэлбэрээр нугалах (өргөтгөсөн булаг шиг харагдаж байна). Спираль эргэлтүүд нь карбоксил ба амин бүлгийн хооронд үүссэн устөрөгчийн холбоогоор бэхждэг. Бараг бүх CO ба NH бүлгүүд устөрөгчийн холбоо үүсэхэд оролцдог. Эдгээр нь пептидийнхээс сул боловч олон удаа давтагдах нь энэ тохиргоонд тогтвортой байдал, хатуу байдлыг өгдөг. Хоёрдогч бүтцийн түвшинд уураг байдаг: фиброин (торго, аалзны тор), кератин (үс, хумс), коллаген (шөрмөс).



Гуравдагч бүтэц- химийн холбоо (устөрөгч, ион, дисульфид) үүсэх, амин хүчлийн үлдэгдлийн радикалуудын хооронд гидрофобик харилцан үйлчлэлийг бий болгосны үр дүнд полипептидийн гинжийг бөмбөрцөг болгон савлах. Гуравдагч бүтэц үүсэхэд гол үүрэг нь гидрофилик-гидрофобик харилцан үйлчлэлээр гүйцэтгэдэг. Усан уусмалд гидрофобик радикалууд нь уснаас нуугдаж, бөмбөрцөг дотор бүлэглэдэг бол гидрофилик радикалууд нь чийгшүүлэх (усны диполуудтай харилцан үйлчлэлцэх) нь молекулын гадаргуу дээр гарч ирэх хандлагатай байдаг. Зарим уургийн хувьд гуравдагч бүтэц нь хоёр цистеины үлдэгдэл хүхрийн атомуудын хооронд үүссэн дисульфидын ковалент холбоогоор тогтворждог. Гуравдагч бүтцийн түвшинд фермент, эсрэгбие, зарим дааврууд байдаг.

Дөрөвдөгчийн бүтэцМолекулууд нь хоёр ба түүнээс дээш бөмбөрцөгөөс бүрддэг нарийн төвөгтэй уургийн шинж чанар. Дэд хэсгүүд нь молекулд ион, гидрофобик, электростатик харилцан үйлчлэлээр тогтдог. Заримдаа дөрөвдөгч бүтэц үүсэх үед дэд хэсгүүдийн хооронд дисульфидын холбоо үүсдэг. Дөрөвдөгч бүтэцтэй хамгийн их судлагдсан уураг гемоглобин. Энэ нь хоёр α дэд нэгж (141 амин хүчлийн үлдэгдэл) ба хоёр β дэд нэгж (146 амин хүчлийн үлдэгдэл) -ээс үүсдэг. Дэд нэгж бүртэй холбоотой төмөр агуулсан гемийн молекул байдаг.
Хэрэв ямар нэг шалтгааны улмаас уургийн орон зайн хэлбэр нь хэвийн хэмжээнээс хазайвал уураг нь үүргээ гүйцэтгэж чадахгүй. Жишээлбэл, "галзуу үнээний өвчин" (хөвөн хэлбэрийн энцефалопати) шалтгаан нь мэдрэлийн эсийн гадаргуугийн уураг болох прионуудын хэвийн бус хэлбэр юм.
Уургийн шинж чанар
Амин хүчлийн найрлага, уургийн молекулын бүтэц нь үүнийг тодорхойлдог шинж чанарууд. Уургууд нь амин хүчлийн радикалуудаар тодорхойлогддог үндсэн ба хүчиллэг шинж чанаруудыг нэгтгэдэг: уураг дахь хүчиллэг амин хүчлүүд их байх тусам хүчиллэг шинж чанар нь илүү тод илэрдэг. Хандивлах, H + нэмэх чадварыг тодорхойлсон уургийн буферийн шинж чанар; Хамгийн хүчирхэг буферийн нэг нь цусны улаан эсийн гемоглобин бөгөөд цусны рН-ийг тогтмол түвшинд байлгадаг. Уусдаг уураг (фибриноген), механик функцийг гүйцэтгэдэг уусдаггүй уураг (фиброин, кератин, коллаген) байдаг. Химийн идэвхтэй уургууд (ферментүүд), хүрээлэн буй орчны янз бүрийн нөхцөлд тэсвэртэй, хэт тогтворгүй байдаг химийн идэвхгүй уургууд байдаг.
Гадаад хүчин зүйлүүд (дулаан, хэт ягаан туяа, хүнд металл ба тэдгээрийн давс, рН-ийн өөрчлөлт, цацраг туяа, шингэн алдалт)
уургийн молекулын бүтцийн зохион байгуулалтыг тасалдуулж болно. Өгөгдсөн уургийн молекулд хамаарах гурван хэмжээст хэлбэрийг алдах үйл явцыг гэнэ денатураци. Денатурацийн шалтгаан нь тодорхой уургийн бүтцийг тогтворжуулах холбоог таслах явдал юм. Эхний үед хамгийн сул холбоо тасарч, нөхцөл байдал улам чангарах тусам илүү хүчтэй холбоо тасардаг. Тиймээс эхлээд дөрөвдөгч, дараа нь гуравдагч, хоёрдогч бүтэц алдагддаг. Орон зайн тохиргооны өөрчлөлт нь уургийн шинж чанарыг өөрчлөхөд хүргэдэг бөгөөд үүний үр дүнд уураг нь өөрийн биологийн функцийг гүйцэтгэх боломжгүй болгодог. Хэрэв денатураци нь анхдагч бүтцийг устгахад дагалддаггүй бол энэ нь байж болно буцаах боломжтой, энэ тохиолдолд уургийн конформацийн шинж чанарыг өөрөө сэргээх нь тохиолддог. Жишээлбэл, мембраны рецепторын уургууд ийм денатурацид ордог. Денатурацийн дараа уургийн бүтцийг сэргээх үйл явц гэж нэрлэдэг нөхөн сэргээх. Хэрэв уургийн орон зайн тохиргоог сэргээх боломжгүй бол денатураци гэж нэрлэдэг эргэлт буцалтгүй.
Уургийн үүрэг
| Чиг үүрэг | Жишээ ба тайлбар |
|---|---|
| Барилга | Уургууд нь эсийн болон эсийн гаднах бүтцийг бий болгоход оролцдог: тэдгээр нь эсийн мембран (липопротейн, гликопротейн), үс (кератин), шөрмөс (коллаген) гэх мэт хэсэг юм. |
| Тээвэрлэлт | Цусан дахь уураг гемоглобин нь хүчилтөрөгчийг холбож, уушигнаас бүх эд, эрхтэн рүү зөөвөрлөж, тэдгээрээс нүүрстөрөгчийн давхар ислийг уушгинд шилжүүлдэг; Эсийн мембраны найрлагад тодорхой бодис, ионыг эсээс гадаад орчин, буцаж руу идэвхтэй, хатуу сонгомол дамжуулалтыг хангадаг тусгай уургууд орно. |
| Зохицуулалтын | Уургийн гормонууд нь бодисын солилцооны үйл явцыг зохицуулахад оролцдог. Жишээлбэл, инсулин даавар нь цусан дахь глюкозын түвшинг зохицуулж, гликогенийн нийлэгжилтийг дэмжиж, нүүрс уснаас өөх тос үүсэхийг нэмэгдүүлдэг. |
| Хамгаалах | Бие махбодид гадны уураг эсвэл бичил биетэн (эсрэгтөрөгч) нэвтрэн орохын хариуд тусгай уураг үүсдэг - тэдгээрийг холбож, саармагжуулах чадвартай эсрэгбие. Фибриногенээс үүссэн фибрин нь цус алдалтыг зогсооход тусалдаг. |
| Мотор | Актин ба миозин агшилтын уураг нь олон эст амьтдын булчингийн агшилтыг хангадаг. |
| Дохио | Эсийн гадаргуугийн мембранд уургийн молекулууд оршдог бөгөөд тэдгээр нь хүрээлэн буй орчны хүчин зүйлийн нөлөөгөөр гуравдагч бүтэцээ өөрчлөх чадвартай бөгөөд ингэснээр гадаад орчноос дохио хүлээн авч, эс рүү тушаал дамжуулах чадвартай байдаг. |
| Хадгалах | Амьтны биед өндөгний альбумин, сүүний казеин зэргээс бусад уураг нь дүрмээр бол хадгалагддаггүй. Гэхдээ уургийн ачаар зарим бодисыг биед хадгалах боломжтой, жишээлбэл, гемоглобины задралын үед төмрийг биеэс зайлуулдаггүй, харин ферритин уурагтай нэгдэл үүсгэдэг. |
| Эрчим хүч | 1 г уураг задрахад эцсийн бүтээгдэхүүн болоход 17.6 кЖ ялгардаг. Нэгдүгээрт, уураг нь амин хүчлүүд болон дараа нь эцсийн бүтээгдэхүүн болох ус, нүүрстөрөгчийн давхар исэл, аммиак болж задардаг. Гэсэн хэдий ч уураг нь бусад эх үүсвэрүүд (нүүрс ус, өөх тос) дууссан үед л эрчим хүчний эх үүсвэр болдог. |
| Каталитик | Уургийн хамгийн чухал үүргүүдийн нэг. Уургуудаар хангадаг - эсэд тохиолддог биохимийн урвалыг хурдасгадаг ферментүүд. Жишээлбэл, рибулоз бифосфат карбоксилаза нь фотосинтезийн үед CO 2-ийн бэхэлгээг хурдасгадаг. |
Ферментүүд
Ферментүүд, эсвэл ферментүүд, нь биологийн катализатор болох уургийн тусгай анги юм. Ферментийн ачаар биохимийн урвал асар хурдтай явагддаг. Ферментийн урвалын хурд нь органик бус катализаторын оролцоотойгоор явагдах урвалын хурдаас хэдэн арван мянга дахин (заримдаа сая сая) өндөр байдаг. Ферментийн үйлчилдэг бодисыг нэрлэдэг субстрат.
Ферментүүд нь бөмбөрцөг хэлбэртэй уураг, бүтцийн онцлогферментийг энгийн ба нарийн төвөгтэй гэж хоёр бүлэгт хувааж болно. Энгийн ферментүүдэнгийн уурагууд, өөрөөр хэлбэл. зөвхөн амин хүчлүүдээс бүрддэг. Нарийн төвөгтэй ферментүүднарийн төвөгтэй уураг, өөрөөр хэлбэл. Уургийн хэсгээс гадна тэдгээр нь уургийн бус шинж чанартай бүлэг агуулдаг. кофактор. Зарим ферментүүд витаминыг кофактор болгон ашигладаг. Ферментийн молекул нь идэвхтэй төв гэж нэрлэгддэг тусгай хэсгийг агуулдаг. Идэвхтэй төв- ферментийн жижиг хэсэг (гурваас арван хоёр амин хүчлийн үлдэгдэл), энд субстрат эсвэл субстратыг холбосноор фермент-субстратын цогцолбор үүсдэг. Урвал дууссаны дараа фермент-субстратын цогцолбор нь фермент болон урвалын бүтээгдэхүүн(үүд) болж задардаг. Зарим ферментүүд (идэвхтэй бусад) байдаг. аллостерийн төвүүд- ферментийн хурд зохицуулагч бэхлэгдсэн хэсгүүд ( аллостерийн ферментүүд).

Ферментийн катализын урвалууд нь: 1) өндөр үр ашигтай, 2) хатуу сонгомол, үйл ажиллагааны чиглэл, 3) субстратын өвөрмөц байдал, 4) нарийн, нарийн зохицуулалтаар тодорхойлогддог. Ферментийн катализын урвалын субстрат ба урвалын өвөрмөц чанарыг E. Fischer (1890), Д. Koshland (1959) нарын таамаглалаар тайлбарлав.
Э.Фишер (түлхүүр түгжих таамаглал)ферментийн идэвхтэй газар ба субстратын орон зайн тохиргоо нь хоорондоо яг таарч байх ёстой гэж санал болгосон. Субстратыг "түлхүүр", ферментийг "түгжээ"-тэй харьцуулдаг.
Д.Кошланд (гар бээлийний таамаглал)субстратын бүтэц ба ферментийн идэвхтэй төвийн хоорондын орон зайн харилцан хамаарал нь зөвхөн бие биетэйгээ харилцан үйлчлэх мөчид үүсдэг гэж санал болгосон. Энэ таамаглалыг бас нэрлэдэг өдөөгдсөн захидал харилцааны таамаглал.
Ферментийн урвалын хурд нь: 1) температур, 2) ферментийн концентраци, 3) субстратын концентраци, 4) рН-ээс хамаарна. Ферментүүд нь уураг байдаг тул физиологийн хэвийн нөхцөлд тэдний үйл ажиллагаа хамгийн өндөр байдаг гэдгийг онцлон тэмдэглэх нь зүйтэй.
Ихэнх ферментүүд зөвхөн 0-40 хэмийн температурт ажиллах боломжтой. Эдгээр хязгаарт температурын 10 ° C-ийн өсөлт тутамд урвалын хурд ойролцоогоор 2 дахин нэмэгддэг. 40 ° C-аас дээш температурт уураг денатурацид орж, ферментийн идэвхжил буурдаг. Хөлдөлтийн ойролцоо температурт ферментүүд идэвхгүй болдог.
Субстратын хэмжээ ихсэх тусам ферментийн урвалын хурд нь субстратын молекулуудын тоо ферментийн молекулуудын тоотой тэнцэх хүртэл нэмэгддэг. Субстратын хэмжээ цаашид нэмэгдэх тусам ферментийн идэвхтэй төвүүд ханасан тул хурд нэмэгдэхгүй. Нэгж хугацаанд илүү олон тооны субстратын молекулууд өөрчлөгддөг тул ферментийн концентраци нэмэгдэх нь катализаторын идэвхжил нэмэгдэхэд хүргэдэг.

Фермент бүрийн хувьд хамгийн их үйл ажиллагаа явуулдаг рН-ийн оновчтой утга байдаг (пепсин - 2.0, шүлсний амилаза - 6.8, нойр булчирхайн липаз - 9.0). Өндөр эсвэл бага рН-ийн утгад ферментийн идэвхжил буурдаг. РН-ийн огцом өөрчлөлтөөр фермент денатурат үүсдэг.
Аллостерийн ферментийн хурдыг аллостерийн төвүүдэд наалддаг бодисоор зохицуулдаг. Хэрэв эдгээр бодисууд урвалыг хурдасгадаг бол тэдгээрийг нэрлэдэг идэвхжүүлэгчид, хэрэв тэд удааширвал - дарангуйлагч.
Ферментийн ангилал
Химийн хувиргалтын төрлөөс хамааран ферментүүдийг 6 ангилалд хуваадаг.
- оксиредуктазууд(устөрөгч, хүчилтөрөгч эсвэл электрон атомыг нэг бодисоос нөгөөд шилжүүлэх - дегидрогеназа),
- трансферазууд(метил, ацил, фосфат эсвэл амин бүлгийг нэг бодисоос нөгөөд шилжүүлэх - трансаминаза),
- гидролазууд(субстратаас хоёр бүтээгдэхүүн үүсдэг гидролизийн урвал - амилаза, липаза),
- ляза(субстратад гидролизийн бус нэмэлт эсвэл түүнээс хэсэг бүлэг атомуудыг салгах, энэ тохиолдолд C-C, C-N, C-O, C-S холбоог тасалж болно - декарбоксилаза),
- изомераза(молекулын дахин зохион байгуулалт - изомераза),
- ligases(C-C, C-N, C-O, C-S бондууд үүссэний үр дүнд хоёр молекулын холболт - синтетаза).
Ангиуд нь эргээд дэд болон дэд ангиудад хуваагдана. Одоогийн олон улсын ангилалд фермент бүр цэгээр тусгаарлагдсан дөрвөн тооноос бүрдэх тусгай кодтой байдаг. Эхний тоо нь анги, хоёр дахь нь дэд анги, гурав дахь нь дэд анги, дөрөв дэх нь энэ дэд ангиллын ферментийн серийн дугаар, жишээлбэл, аргиназа код нь 3.5.3.1.
руу оч лекц №2"Нүүрс ус ба липидийн бүтэц, үүрэг"
руу оч лекц №4"АТФ нуклейн хүчлүүдийн бүтэц, үүрэг"
Одоо бараг бүх сургуулийн биологийн хичээл уураг гэж юу болохыг мэддэг болсон. Тэд амьд амьтны эсэд олон үүрэг гүйцэтгэдэг.
Уургууд гэж юу вэ?
Эдгээр нь нарийн төвөгтэй органик нэгдлүүд юм. Эдгээр нь амин хүчлүүдээс бүрддэг бөгөөд үүнээс нийт 20 байдаг боловч тэдгээрийг өөр өөр дарааллаар нэгтгэснээр та сая сая янз бүрийн химийн бодисуудыг авах боломжтой.
Уургийн бүтэц
Уургууд гэж юу болохыг аль хэдийн мэдсэний дараа бид тэдгээрийн бүтцийг илүү нарийвчлан авч үзэх боломжтой. Энэ төрлийн бодис нь анхдагч, хоёрдогч, гуравдагч, дөрөвдөгч бүтэцтэй байдаг.
Анхдагч бүтэц
Энэ бол амин хүчлүүд зөв дарааллаар холбогддог гинж юм. Энэ ээлж нь уургийн төрлийг тодорхойлдог. Энэ ангиллын бодис бүрийн хувьд энэ нь хувь хүн юм. Тодорхой уургийн физик, химийн шинж чанар нь үндсэн бүтцээс ихээхэн хамаардаг.
Хоёрдогч бүтэц
Энэ бол карбоксил ба имино бүлгийн хооронд устөрөгчийн холбоо үүссэний улмаас полипептидийн гинжин хэлхээний орон зайн хэлбэр юм. Хамгийн түгээмэл хоёр төрөл байдаг: альфа спираль ба бета бүтэц нь тууз шиг харагддаг. Эхнийх нь ижил полипептидийн гинжин хэлхээний молекулуудын хооронд, хоёр дахь нь зэрэгцээ байрладаг хоёр ба түүнээс дээш гинжний хооронд холбоо үүссэний улмаас үүсдэг. Гэсэн хэдий ч түүний зарим хэсгүүдийг 180 градус эргүүлсэн тохиолдолд нэг полимер дотор бета бүтэц гарч ирэх боломжтой.

Гуравдагч бүтэц
Энэ нь альфа мушгиа, энгийн полипептидийн гинж, бета бүтцийн хэсгүүдийн орон зайд бие биентэйгээ харьцангуй солигдох ба зохион байгуулалт юм.
Дөрөвдөгчийн бүтэц
Мөн бөмбөрцөг ба фибрилляр гэсэн хоёр төрөл байдаг. Энэ бүтэц нь электростатик харилцан үйлчлэл, устөрөгчийн холбооноос болж үүсдэг. Бөмбөрцөг нь жижиг бөмбөг хэлбэртэй, фибрилляр нь утас хэлбэртэй байдаг. Эхний төрлийн дөрөвдөгч бүтэцтэй уургийн жишээ бол альбумин, инсулин, иммуноглобулин гэх мэт; фибрилляр - фиброин, кератин, коллаген болон бусад. Бүтцийн хувьд бүр ч нарийн төвөгтэй уураг байдаг, жишээлбэл, булчингийн эдэд байдаг миозин нь хоёр бөмбөрцөг толгой байрладаг фибрилляр хэлбэртэй саваа байдаг;
Уургийн химийн найрлага

Уургийн амин хүчлийн найрлагыг өөр өөр дараалал, хэмжээгээр нэгтгэсэн хорин амин хүчлээр төлөөлж болно.
Эдгээр нь глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин, метионин, лизин, аргинин, аспарагины хүчил, аспарагин, глутамины хүчил, глутамин, фенилаланин, тирозин, триптофан, гистидин, пролин юм. Тэдгээрийн дотор орлуулшгүй, өөрөөр хэлбэл хүний бие өөрөө үйлдвэрлэх чадваргүй байдаг. Насанд хүрэгчдэд ийм амин хүчил 8, хүүхдэд 2 өөр байдаг: лейцин, изолейцин, валин, метионин, лизин, триптофан, фенилаланин, треонин, түүнчлэн гистидин, аргинин.
Өөр өөр бүтэцтэй уургийн жишээ
Бөмбөрцөг уургийн алдартай төлөөлөгч бол альбумин юм. Гуравдагч бүтэц нь нэг полипептидийн гинжээр холбогдсон альфа спиральуудаас бүрддэг.

Анхдагч нь аспарагины хүчил, аланин, цистеин, глицин зэрэг амин хүчлүүдээр үүсгэгддэг. Энэ уураг нь цусны сийвэнгээс олддог бөгөөд тодорхой бодисыг зөөвөрлөх үүргийг гүйцэтгэдэг. Фибрилляруудын дотроос фиброин ба коллагеныг ялгаж болно. Эхнийх нь гуравдагч бүтэц нь нэг полипептидийн гинжээр холбогдсон бета бүтцийн бодис юм. Гинж нь өөрөө аланин, глицин, цистеин, сериний ээлж юм. Энэхүү химийн нэгдэл нь аалзны тор, торго, шувууны өдний гол бүрэлдэхүүн хэсэг юм.
Денатураци гэж юу вэ?
Энэ нь уургийн эхлээд дөрөвдөгч, дараа нь гуравдагч, хоёрдогч бүтцийг устгах үйл явц юм. Ийм зүйл тохиолдсон уураг нь үүргээ гүйцэтгэхээ больж, үндсэн физик, химийн шинж чанараа алддаг. Энэ үйл явц нь ихэвчлэн өндөр температур эсвэл түрэмгий химийн бодист өртсөний улмаас үүсдэг. Жишээлбэл, дөчин хэмээс дээш температурт организмын цусаар хүчилтөрөгчийг дамжуулдаг гемоглобин денатурат болж эхэлдэг. Ийм учраас температурын ийм хүчтэй өсөлт нь хүний хувьд аюултай юм.

Уургийн үүрэг
Уургууд гэж юу болохыг олж мэдсэнийхээ дараа та эдгээр бодисуудын эсийн болон бүхэл бүтэн организмын амьдралд гүйцэтгэх үүргийг анхаарч үзэх боломжтой. Тэд үндсэн есөн үүргийг гүйцэтгэдэг. Эхнийх нь хуванцар юм. Эдгээр нь амьд организмын олон бүтцийн бүрэлдэхүүн хэсэг бөгөөд эсийн барилгын материал болдог. Хоёр дахь нь тээвэрлэлт. Уургууд нь энэ зорилгоор бодисыг зөөвөрлөх чадвартай байдаг: альбумин, гемоглобин, түүнчлэн эсийн плазмын мембран дээр байрлах янз бүрийн тээвэрлэгч уургууд нь зөвхөн тодорхой бодисыг хүрээлэн буй орчноос цитоплазм руу нэвтрүүлэх боломжийг олгодог. Гурав дахь функц нь хамгаалалт юм. Үүнийг дархлааны тогтолцооны нэг хэсэг болох иммуноглобулин, арьсны үндсэн бүрэлдэхүүн хэсэг болох коллаген гүйцэтгэдэг. Түүнчлэн хүний бие болон бусад организм дахь уураг нь зохицуулах үүргийг гүйцэтгэдэг, учир нь ийм бодисоор төлөөлдөг олон тооны гормонууд, жишээлбэл, инсулин байдаг. Эдгээр химийн нэгдлүүдийн өөр нэг үүрэг бол дохиолол юм. Эдгээр бодисууд нь эсээс эс рүү цахилгаан импульс дамжуулдаг. Зургаа дахь функц нь мотор юм. Үүнийг гүйцэтгэдэг уургийн алдартай төлөөлөгчид бол агшилт хийх чадвартай актин ба миозин юм (тэдгээр нь булчинд байдаг). Ийм бодисууд нь нөөц бодис болж чаддаг, гэхдээ эдгээр нь ихэвчлэн сүүнд агуулагддаг уураг юм. Тэд мөн каталитик функцийг гүйцэтгэдэг - байгальд уургийн ферментүүд байдаг. Хамгийн сүүлчийн үүрэг бол рецептор юм. Нэг буюу өөр хүчин зүйлийн нөлөөн дор хэсэгчлэн денатуратлагдсан уураг байдаг бөгөөд ингэснээр бүхэл эсэд дохио өгдөг бөгөөд энэ нь цааш дамжуулдаг.
ЛАмин хүчлүүдийн функциональ бүлгүүдийн харилцан үйлчлэлийн улмаас бие даасан уургийн шугаман полипептидийн гинж нь "конформац" гэж нэрлэгддэг орон зайн гурван хэмжээст бүтцийг олж авдаг. Бие даасан уургийн бүх молекулууд (өөрөөр хэлбэл ижил анхдагч бүтэцтэй) уусмал дахь ижил хэлбэрийг үүсгэдэг. Тиймээс орон зайн бүтцийг бий болгоход шаардлагатай бүх мэдээлэл уургийн анхдагч бүтцэд байрладаг.
Уургийн хувьд полипептидийн гинжин хэлхээний 2 үндсэн хэлбэр байдаг: хоёрдогч ба гуравдагч бүтэц.
2. Уургийн хоёрдогч бүтэц -пептидийн нурууны функциональ бүлгүүдийн харилцан үйлчлэлийн үр дүнд бий болсон орон зайн бүтэц.
Энэ тохиолдолд пептидийн гинж нь хоёр төрлийн ердийн бүтцийг олж авах боломжтой. α-мушгиа
β-бүтэцβ-бүтэц гэж бид баян хуур шиг нугалсан хуудастай төстэй дүрсийг хэлнэ. Энэ зураг нь нэг полипептидийн гинжин хэлхээний шугаман бүсийн пептидийн бүлгийн атомуудын хооронд эсвэл өөр өөр полипептидийн бүлгүүдийн хооронд олон устөрөгчийн холбоо үүссэний улмаас үүссэн.

Бонд нь устөрөгч,тэдгээр нь макромолекулуудын бие даасан хэсгүүдийг тогтворжуулдаг.
3. Уургийн гуравдагч бүтэц -полипептидийн гинжин хэлхээнд бие биенээсээ нэлээд зайд байрлах амин хүчлийн радикалуудын харилцан үйлчлэлийн улмаас үүссэн гурван хэмжээст орон зайн бүтэц.
Бүтцийн хувьд гидрофобик харилцан үйлчлэл нь чухал үүрэг гүйцэтгэдэг янз бүрийн харилцан үйлчлэлээр тогтворжсон хоёрдогч бүтцийн элементүүдээс бүрддэг.
уургийн гуравдагч бүтцийг тогтворжуулахад дараахь зүйлс орно.
· ковалент холбоо (хоёр цистеины үлдэгдэл - дисульфидын гүүр хооронд);
· амин хүчлийн үлдэгдлийн эсрэг цэнэгтэй хажуугийн бүлгүүдийн хоорондох ионы холбоо;
· устөрөгчийн холбоо;
· гидрофиль-гидрофобик харилцан үйлчлэл. Эргэн тойрон дахь усны молекулуудтай харилцан үйлчлэлцэх үед уургийн молекул нь "атираа" хийх хандлагатай байдаг бөгөөд ингэснээр амин хүчлүүдийн туйлт бус хажуугийн бүлгүүд усан уусмалаас тусгаарлагддаг; молекулын гадаргуу дээр туйлын гидрофилик хажуугийн бүлгүүд гарч ирдэг.
4. Дөрөвдөгчийн бүтэц нь нэг уургийн цогцолбор дотор хэд хэдэн полипептидийн гинжин хэлхээний харьцангуй зохион байгуулалт юм. Дөрөвдөгч бүтэцтэй уургийг бүрдүүлдэг уургийн молекулууд нь рибосомууд дээр тус тусад нь үүсдэг бөгөөд нийлэгжилт дууссаны дараа л нийтлэг супрамолекулын бүтцийг бүрдүүлдэг. Дөрөвдөгч бүтэцтэй уураг нь ижил ба өөр полипептидийн гинжийг агуулж болно. Дөрөвдөгч бүтцийг тогтворжуулахад оролцоно гуравдагч шатыг тогтворжуулахтай ижил төрлийн харилцан үйлчлэл. Супрамолекул уургийн цогцолбор нь хэдэн арван молекулаас бүрдэх боломжтой.
Үүрэг.
Бие махбодид пептид үүсэх нь хэдхэн минутын дотор явагддаг бол лабораторид химийн нийлэгжилт нь нэлээд урт процесс бөгөөд хэдэн өдөр шаардагдах бөгөөд синтезийн технологийг хөгжүүлэхэд хэдэн жил шаардагдана. Гэсэн хэдий ч байгалийн пептидийн аналогийг нэгтгэх ажлыг хийх талаар нэлээд хүчтэй аргументууд байдаг. Нэгдүгээрт, пептидийн химийн өөрчлөлтөөр анхдагч бүтцийн таамаглалыг батлах боломжтой. Зарим дааврын амин хүчлийн дарааллыг лабораторид аналогийн нийлэгжилтээр дамжуулан нарийн мэддэг болсон.
Хоёрдугаарт, синтетик пептидүүд нь амин хүчлийн дарааллын бүтэц ба түүний үйл ажиллагааны хоорондын хамаарлыг илүү нарийвчлан судлах боломжийг олгодог. Пептидийн өвөрмөц бүтэц ба түүний биологийн идэвхи хоорондын хамаарлыг тодруулахын тулд мянга гаруй аналогийн синтез дээр асар их ажил хийсэн. Үүний үр дүнд пептидийн бүтцэд зөвхөн нэг амин хүчлийг орлуулах нь түүний биологийн идэвхийг хэд хэдэн удаа нэмэгдүүлэх эсвэл чиглэлийг өөрчлөх боломжтой болохыг тогтоожээ. Мөн амин хүчлийн дарааллын уртыг өөрчлөх нь пептидийн идэвхтэй төвүүдийн байршил, рецепторын харилцан үйлчлэлийн газрыг тодорхойлоход тусалдаг.
Гуравдугаарт, анхны амин хүчлийн дарааллыг өөрчилсний ачаар фармакологийн эм авах боломжтой болсон. Байгалийн пептидийн аналогийг бий болгосноор биологийн үр нөлөөг сайжруулж, удаан эдэлгээтэй болгодог молекулуудын илүү "үр дүнтэй" тохиргоог тодорхойлох боломжтой болгодог.
Дөрөвдүгээрт, пептидийн химийн нийлэгжилт нь эдийн засгийн хувьд ашигтай. Ихэнх эмчилгээний эмийг байгалийн гаралтай бүтээгдэхүүнээр хийсэн бол хэдэн арван дахин илүү үнэтэй байх болно.
Ихэнхдээ идэвхтэй пептидүүд байгальд зөвхөн нанограмм хэмжээтэй байдаг. Нэмж дурдахад байгалийн гаралтай пептидүүдийг цэвэршүүлэх, тусгаарлах аргууд нь хүссэн амин хүчлийн дарааллыг эсрэг эсвэл өөр нөлөө бүхий пептидүүдээс бүрэн салгаж чадахгүй. Хүний биед нийлэгжсэн тодорхой пептидийн хувьд тэдгээрийг зөвхөн лабораторийн нөхцөлд нийлэгжүүлэх замаар олж авах боломжтой.
57. Уургийн ангилал: энгийн ба нарийн төвөгтэй, бөмбөрцөг ба фибрилляр, мономер ба олигомер. Бие дэх уургийн үйл ажиллагаа.
Бүтцийн төрлөөр ангилах
Бүтцийн ерөнхий төрлөөс хамааран уурагуудыг гурван бүлэгт хувааж болно.
1. Фибрилляр уургууд - полимер үүсгэдэг, тэдгээрийн бүтэц нь ихэвчлэн маш тогтмол бөгөөд янз бүрийн гинж хоорондын харилцан үйлчлэлээр голчлон хадгалагддаг. Эдгээр нь микрофиламент, микротубул, фибрил үүсгэж, эс, эд эсийн бүтцийг дэмждэг. Фибрилляр уураг нь кератин ба коллаген агуулдаг.
2. Бөмбөрцөг уургууд нь усанд уусдаг, молекулын ерөнхий хэлбэр нь их бага бөмбөрцөг хэлбэртэй байдаг.
3. Мембран уураг - эсийн мембранаар дамждаг домайнуудтай боловч тэдгээрийн зарим хэсэг нь мембранаас эс хоорондын орчин, эсийн цитоплазм руу цухуйдаг. Мембран уураг нь рецепторын үүрэг гүйцэтгэдэг, өөрөөр хэлбэл дохио дамжуулахаас гадна янз бүрийн бодисын мембран дамжуулалтыг хангадаг. Тээвэрлэгч уураг нь зөвхөн тодорхой молекулууд эсвэл тодорхой төрлийн дохиог мембранаар нэвтрүүлэх боломжийг олгодог.
Энгийн уураг , Нарийн төвөгтэй уураг
Пептидийн гинжин хэлхээнээс гадна олон уураг нь амин хүчлийн бус бүлгүүдийг агуулдаг бөгөөд энэ шалгуурын дагуу уураг нь хоёр том бүлэгт хуваагддаг. энгийн ба нарийн төвөгтэй уураг(уураг). Энгийн уургууд нь зөвхөн полипептидийн гинжээс бүрддэг; нийлмэл уураг нь амин хүчлийн бус буюу хиймэл бүлгүүдийг агуулдаг.
Энгийн.
Бөмбөрцөг уургийн дотроос бид дараахь зүйлийг ялгаж чадна.
1. альбуминууд - рН-ийн өргөн хүрээний (4-8.5) усанд уусдаг, аммонийн сульфатын 70-100% -ийн уусмалаар тунадаг;
2. их хэмжээний молекул жинтэй, усанд бага уусдаг, давсны уусмалд уусдаг олон үйлдэлт глобулинууд нь ихэвчлэн нүүрс усны хэсгийг агуулдаг;
3. гистонууд нь молекул дахь аргинин, лизин үлдэгдэл ихтэй бага молекул жинтэй уураг бөгөөд тэдгээрийн үндсэн шинж чанарыг тодорхойлдог;
4. протаминууд нь бүр ч өндөр аргинины агууламжаар (85% хүртэл) ялгагдана, гистонууд шиг тэд нуклейн хүчлүүдтэй тогтвортой нэгдлүүдийг бүрдүүлж, зохицуулалтын болон дарангуйлагч уургийн үүрэг гүйцэтгэдэг - нуклеопротейны салшгүй хэсэг;
5. проламинууд нь усанд уусдаггүй, 50-90% этанолд уусдаг глютамины хүчил (30-45%) ба пролин (15% хүртэл) өндөр агууламжаар тодорхойлогддог;
6. Глютелин нь проламинтай адил 45% орчим глютамины хүчил агуулдаг бөгөөд ихэвчлэн үр тарианы уурагт байдаг.
Фибрилляр уураг нь фиброз бүтэцтэй бөгөөд ус, давсны уусмалд бараг уусдаггүй. Молекул дахь полипептидийн гинж нь хоорондоо параллель байрладаг. Холбогч эдийн бүтцийн элементүүд (коллаген, кератин, эластин) үүсэхэд оролцоно.
Нарийн төвөгтэй уураг
(уурагууд, Холопротеинууд) нь пептидийн гинж (энгийн уураг) -аас гадна амин хүчлийн бус бүрэлдэхүүн хэсэг болох протезийн бүлэг агуулсан хоёр бүрэлдэхүүн хэсэгтэй уураг юм. Нарийн төвөгтэй уургууд гидролизд ороход амин хүчлээс гадна уургийн бус хэсэг буюу түүний задралын бүтээгдэхүүн ялгардаг.
Төрөл бүрийн органик (липид, нүүрс ус) болон органик бус (металл) бодисууд протезийн бүлгийн үүрэг гүйцэтгэдэг.
Протезийн бүлгүүдийн химийн шинж чанараас хамааран нарийн төвөгтэй уургийн дотроос дараахь ангиллыг ялгадаг.
· Протезийн бүлэг болгон ковалентаар холбогдсон нүүрс усны үлдэгдэл агуулсан гликопротейнууд ба тэдгээрийн дэд ангилал - протеогликанууд, мукополисахаридын протезийн бүлгүүд. Серин эсвэл треонины гидроксил бүлгүүд ихэвчлэн нүүрс усны үлдэгдэлтэй холбоо үүсгэхэд оролцдог. Ихэнх эсийн гаднах уураг, ялангуяа иммуноглобулин нь гликопротейн юм. Протеогликануудын нүүрсустөрөгчийн хэсэг нь ~ 95% нь эс хоорондын матрицын гол бүрэлдэхүүн хэсэг юм.
· Протезийн хэсэг болох ковалент бус липид агуулсан липопротейн. Липопротейн нь липидийг липидтэй холбож, липидийн тээвэрлэлтийн үүргийг гүйцэтгэдэг аполипопротейн уургуудаас бүрддэг.
· Гемийн бус координат металлын ион агуулсан металлопротейн. Металопротейнуудын дунд хадгалах, тээвэрлэх функцийг гүйцэтгэдэг уураг (жишээлбэл, төмөр агуулсан ферритин, трансферрин) ба ферментүүд (жишээлбэл, цайр агуулсан нүүрстөрөгчийн ангидраз ба зэс, манган, төмөр болон бусад металлын ионуудыг агуулсан төрөл бүрийн супероксидын дисмутаза) идэвхтэй төвүүд байдаг. )
· Ковалентын холбоогүй ДНХ буюу РНХ агуулсан нуклеопротейн, ялангуяа хромосомыг бүрдүүлдэг хроматин нь нуклеопротейн юм.
· Протезийн бүлэг болгон ковалентаар холбогдсон фосфорын хүчлийн үлдэгдэл агуулсан фосфопротейн. Серин эсвэл треонины гидроксил бүлгүүд нь фосфаттай эфирийн холбоо үүсгэхэд оролцдог, ялангуяа фосфопротейн юм.
· Хромопротейн гэдэг нь янз бүрийн химийн шинж чанартай өнгөт протезийн бүлэг бүхий нийлмэл уургийн нэгдсэн нэр юм. Эдгээрт янз бүрийн функцийг гүйцэтгэдэг металл агуулсан порфирин протезийн бүлэгтэй олон уураг орно - гемопротеин (протезийн бүлэг болох гем агуулсан уураг - гемоглобин, цитохром гэх мэт), флавин бүлэгтэй хлорофиллууд гэх мэт;
1. Бүтцийн үйл ажиллагаа
2. Хамгаалалтын функц
3. Зохицуулах чиг үүрэг
4. Сэрүүлгийн функц
5. Тээврийн функц
6. Сэлбэг (нөөц) функц
7. Хүлээн авагчийн үйл ажиллагаа
8. Мотор (мотор) функц

.jpg)
.jpg)







