Относится к группе щелочных металлов , символ К, ат. н. 19; ат. м. 39, 098. Мягкий серебристо-белый металл. Химически очень активен, сильный восстановитель, на воздухе легко окисляется. Открыт английским химиком Г. Дэви в 1807. Плотность 0,856. Т-ра плавления 63,55 ? С, т-ра кипения 760 ? С. Твердость по Бринеллю 400 кПа. Металлический К. легко режется ножом. К. - один из наиболее распространенных петрогенных элементов земной коры - 2,5% (по массе). Важнейшие минералы: сильвин , карналлит , каинит , лангбейнит . Содержание К. в ультраосновных горных пород 0,03%, в основных 0,83%, средних 2,3%, в кислых 3,34%. Максимальные концентрации К. (до 7%) выявлены в щелочных породах агпаитового ряда. Главные калийные минералы в этих породах щелочные полевые шпаты , слюда , нефелин , лейцит . При испарении морской воды в осадок выпадают такие минералы К. сильвинит , карналлит , каинит , полигалит . Вследствие интенсивного испарения мор. воды в прошлые геологические эпохи, особенно в пермский период, были образованы крупные месторождения калийных солей.
1. История
2. Распространение в природе
Калий - довольно распространенный химический элемент , на него приходится 2,6% массы земной коры. В связи с высокой химической активностью в свободном состоянии в природе он не встречаются, а только в виде различных соединений. Некоторые из них, как хлорид калия, образуют мощные месторождения.
Богатые в мире месторождения солей калия в виде минералов сильвин KCl, сильвинита KCl ? NaCl, карналлита КCl ? MgCl 2 ? 6H 2 O и каинитов KCl ? MgSO 4 ? 3H 2 O расположены вблизи г. Соликамска. Кроме того, значительные залежи соединений калия найдены в Белоруссии (г. Солигорск) и в Украине (г. Калуш и г. Стебник в Прикарпатье).
3. Физические свойства
В свободном состоянии калий - серебристо-белый легкий металл. Плотность - 0,856 г / см 3. Металл очень мягкий и легко режется ножом. Температуры плавления - 63,38 ? С.
4. Химические свойства
Калий относится к главной подгруппы первой группы периодической системы Менделеева. его атомы имеют на внешнем электронном слое по одному электрону, который они легко теряют и превращаются в ионы с одним положительным зарядом. Поэтому в своих соединениях калий бывает только положительно одновалентным. Калий - очень активный металл. Легко теряя свои валентные электроны, он очень сильными восстановителем. В электрохимическом ряду напряжений он занимает первое место слева от водорода. В сухом воздухе калий энергично взаимодействует с кислородом воздуха и превращаются в супероксид:
- 4K + O 2 -> 2KO 2
Поэтому его хранят под слоем керосина или минерального масла.
С водой реагирует очень бурно, даже со взрывом. Еще более бурно реагирует с кислотами (тоже со взрывом). Во влажном воздухе металл легко превращаются в гидроксид:
- 2K + 2H 2 O -> 2KOH + H 2
а последний, взаимодействуя с углекислым газом воздуха, - в карбонат:
- 2KOH + CO 2 -> K 2 CO 3 + H 2 O
При высокой температуре калий может восстанавливать оксиды алюминия, кремния и т.д. в свободных элементов:
- SiO 2 + 4K -> Si + 2K 2 O
5. Получение
В свободном состоянии калий получают электролизом расплавленных хлоридов или гидроксидов. При электролизе расплавленных едких щелочей положительно заряженные ионы металлов притягиваются к отрицательно заряженному катоду, присоединяют по одному электрону (восстанавливаются) и превращаются в атомы свободных металлов, а отрицательно заряженные ионы гидроксила притягиваются к положительно заряженному аноду, отдают ему по одному электрону и превращаются в электро- нейтральные группы OH, которые разлагаются с образованием воды и кислорода, выделяемого на аноде.
Получение металлического калия электролизом расплавленного KCl можно изобразить следующим уравнениям:
KCl ↓ - Катод Анод + K + + e = K ? Cl - e = Cl ?
6. Применение
Металлический калий служит катализатором при получении некоторых видов синтетического каучука.
Соединения К. применяют в сельском хозяйстве в качестве удобрения, для изготовления стекла, взрывчатых веществ, в медицине, ядерной технике и т.п..
Применяют альгит калия для лечения заболевания губ у детей.
7. Соли калия
Калий образует соли со всеми кислотами. Соли калия по своим свойствам очень близки к солей натрия. Важнейшие из них:
КАЛИЙ (латинский Kalium), К, химический элемент I гpyппы короткой формы (1-й группы длинной формы) периодической системы; атомный номер 19; атомная масса 39,0983; относится к щелочным металлам. Природный калий состоит из трёх изотопов: 39 К (93,2581%), 40 К (0,0117%; слаборадиоактивный, Т 1/2 1,277·10 9 лет, β-распад до 40 Са), 41 К (6,7302%). Искусственно получены радиоизотопы с массовыми числами 32-54.
Историческая справка. Некоторые соединения калия были известны в древности, например калия карбонат К 2 СО 3 (так называемая растительная щёлочь) выделяли из древесной золы и использовали при варке мыла. Металлический калий впервые получил Г. Дэви в 1807 электролизом влажного твёрдого гидроксида КОН и назвал потассием (английский potassium от английский potash - название карбоната калия). В 1809 году было предложено название «калий» (от арабского аль-кали - поташ). Название «потассий» сохранилось в Великобритании, США, Франции и других странах. В России с 1840 употребляют название «калий», принятое также в Германии, Австрии, Скандинавских странах.
Распространённость в природе . Содержание калия в земной коре составляет 2,6% по массе. В свободном состоянии калий в природе не встречается. В значительных количествах калий содержится в силикатах нефелине и лейците, полевых шпатах (например, в ортоклазе), слюдах (например, в мусковите). Собственные минералы калия - сильвин, сильвинит, карналлит, каинит, лангбейнит K 2 SО 4 ∙2MgSО 4 образуют большие скопления природных калийных солей. В результате действия воды и диоксида углерода калий переходит в растворимые соединения, которые частично уносятся в моря, частично удерживаются почвой. Соли калия содержатся также в рапе соляных озёр и подземных рассолах.
Свойства . Конфигурация внешней электронной оболочки атома калия 4s 1 ; в соединениях проявляет степень окисления +1; энергии ионизации К 0 →К + →К 2+ соответственно равны 4,3407 и 31,8196 эВ; электроотрицательность по Полингу 0,82; атомный радиус 220 пм, радиус иона К + 152 пм (координационное число 6).
Калий - серебристо-белый мягкий металл; кристаллическая решётка кубическая объёмноцентрированная; t пл 63,38 °С, t кип 759 °С, плотность 856 кг/м 3 (20 °С); теплоёмкость 29,60 Дж/(моль·К) при 298 К.
Калий поддаётся прессованию и прокатыванию, легко режется ножом и сохраняет пластичность при низких температурах; твёрдость по Бринеллю 0,4 мПа.
Калий - металл высокой химической активности (калий хранят под слоем бензина, керосина или минерального масла). При нормальных условиях калий взаимодействует с кислородом (образуется оксид К 2 О, пероксид К 2 О 2 , надпероксид КО 2 - основной продукт), галогенами (соответствующие калия галогениды), при нагревании - с серой (сульфид К 2 S), селеном (селенид К 2 Se), теллуром (теллурид К 2 Те), с фосфором в атмосфере азота (фосфиды К 3 Р и К 2 Р5), углеродом (слоистые соединения состава КС 8 - КС 60), водородом (гидрид КН). С азотом калий взаимодействует только при воздействии электрического разряда (в небольшом количестве образуются азид KN 3 и нитрид К 3 N). Калий взаимодействует с некоторыми металлами, образуя интерметаллиды или твёрдые растворы (сплавы калия). Наибольшее практическое значение имеют сплавы с натрием, отличающиеся высокой химической активностью; получают сплавлением металлов в инертной атмосфере или при действии металлического натрия на гидроксид КОН или хлорид КСl.
Металлический калий - сильный восстановитель: энергично (при нормальных условиях - со взрывом и воспламенением металла) реагирует с водой (образуется калия гидроксид КОН), бурно (иногда со взрывом) реагирует с кислотами (образуются соответствующие соли, например калия дихромат, калия нитрат, калия перманганат, калия фосфаты, калия цианид), восстанавливает оксиды В, Si, Al, Ag, Bi, Co, Cr, Cu, Hg, Ni, Pb, Sn, Ti до элементов; сульфаты, сульфиты, нитраты, нитриты, карбонаты и фосфаты других металлов - до оксидов соответствующих металлов. Металлический калий медленно растворяется в жидком аммиаке, при этом образуется тёмно-синий раствор с металлической проводимостью; растворённый металл постепенно реагирует с аммиаком с образованием амида: 2К + 2NH 3 = 2KNH 2 + Н 2 . Калий взаимодействует с различными органическими соединениями: спиртами (образуются алкоголяты, например этилат С 2 Н 5 ОК), ацетиленом (ацетилениды КС≡СН и КС≡СК), алкилгалогенидами (калийалкилы, например этилкалий С 2 Н 5 К) и арилгалогенидами (калийарилы, например фенилкалий С 6 Н 5 К). Металлический калий инициирует реакции полимеризации алкенов и диенов. С N- и О-донорными полициклическими лигандами (краун-эфирами, криптандами и другими ионофорами) калий образует комплексные соединения.
При работе с калием необходимо учитывать его высокую реакционную способность, в том числе способность загораться при контакте с водой. В целях безопасности необходимо использовать резиновые перчатки, защитные очки или маску. С большим количеством калия следует работать в специальных камерах, в инертной атмосфере (аргон, азот). Для тушения горящего калия применяют поваренную соль NaCl или кальцинированную соду Na 2 СО 3 .
Биологическая роль . Калий относится к биогенным элементам. Суточная потребность человека в калии около 2 г. В живых организмах ионы калия играют важную роль в процессах регуляции обмена веществ, в частности, транспорта ионов через клеточные мембраны (смотри, например, в статье Ионные насосы).
Получение . В промышленности калий получают восстановлением расплавленного гидроксида КОН или хлорида КСl металлическим натрием в противоточной колонне с последующей конденсацией паров калия. Перспективны вакуум-термические способы получения калия, основанные на восстановлении хлорида КСl при нагревании смесью алюминия или кремния с оксидом кальция (6КСl + 2Al + 4СаО = 6К + ЗСаСl 2 + СаО·Аl 2 О 3 или 4КСl + Si + 4СаО = 4К + 2CaCl 2 + 2CaО∙SiО 2), а также способ, основанный на получении сплава калия со свинцом электролизом карбоната К 2 СО 3 или хлорида КСl с расплавленным свинцовым катодом и последующей отгонке из сплава калия. Объём мирового производства калия около 28 т/год (2004).
Применение . Металлический калий - материал электродов в химических источниках тока, катализатор в процессах получения синтетического каучука. Широко применяют различные соединения калия: пероксид К 2 О 2 и надпероксид КО 2 - компоненты составов для регенерации кислорода (на подводных лодках, космических кораблях и в других закрытых помещениях), гидрид КН - восстановитель в химическом синтезе, сплав калия с натрием (10-60% Na по массе, жидкий при комнатной температуре) - теплоноситель в ядерных реакторах, восстановитель в производстве титана, реагент для очистки газов от кислорода и паров воды; соли калия используют в качестве калийных удобрений, компонентов моющих средств. Комплексы калия с ионофорами являются моделями для изучения транспорта ионов калия через клеточные мембраны. Радиоизотоп 42 К (Т 1/2 12,36 ч) применяют как радиоактивный индикатор в химии, медицине и биологии.
Лит.: Натрий и калий. Л., 1959; Степин Б. Д., Цветков А. А. Неорганическая химия. М., 1994; Неорганическая химия: химия элементов / Под редакцией Ю. Д. Третьякова. М., 2004. Т. 2.
Калий - щелочной металл, который достаточно широко распространен на Земле. Соединения калия с давних времен знакомы людям. Элемент был открыт в 1807 году и был изначально назван потассием. Однако, название не прижилось и чуть позже элемент был назван калием.
С давних времен люди получали поташ (карбонат калия) из продуктов горения. Его использовали как моющее средство, чуть позже его начали применять для производства различных сельскохозяйственных удобрений, для изготовления стекла и других целей. На сегодняшний день поташ даже является официально зарегистрированной пищевой добавкой.
Характеристика калия
Физические свойства

Элемент имеет бледно-серебристый цвет. На только что образовавшейся поверхности возникает характерный блеск. Калий - легкий металл. Легко плавится. Его можно растворить в ртути, в результате этого процесса образуются амальгамы. Горит красновато-фиолетовым пламенем.
Химические свойства

Калий является металлом и обладает всеми соответствующими свойствами. Также элемент относится к группе щелочных. Этим и объясняется его повышенная химическая активность. Калий, реагируя с другими веществами, отдает электроны, является сильным восстановителем.
- Вступает в бурную реакцию с кислородом, образуя супероксид калия.
- При нагревании реагирует с водородом.
- Хорошо реагирует со всеми неметаллическими элементами, образуя при этом нитриды, фосфиды, сульфиды и другие соединения.
- Вступает в реакцию со многими сложными веществами: солями, оксидами, а также с водой. Реакция с водой протекает очень бурно, со взрывом.

Соединения калия достаточно распространены в природе. В чистом виде калий встретить нельзя. Причина этому - его повышенная химическая активность.
Где же в природе можно найти калий?
- Во-первых, калий в достаточно больших количествах содержится в коре Земли. Его содержание оценивается примерно в 2,4%. Калий является важной составляющей почвы, горных пород.
- Во-вторых, большие залежи солей калия зафиксированы на местах испарения древних морей.
- Также существенное количество калия содержат в себе воды Мирового океана. В водах Мирового океана концентрация калия составляет примерно 0,06%. В отдельных водоемах (например, Мертвое море), концентрация калия может быть и 1,5%. Такая повышенная концентрация делает экономически выгодной добычу калия. Так, в Иордании стоит завод по добыче калия из вод Мертвого моря.
Области применения калия
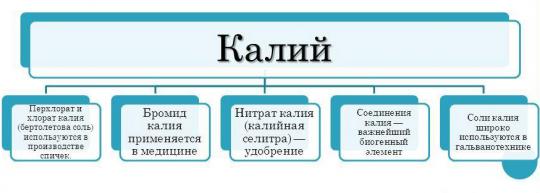
Сфера использования калия существенно уже по сравнению с тем же натрием. Это обусловлено тем, что калий обладает большей химической активностью. Кроме того, калий является более дорогим металлом. Тем не менее, калий все же используется в различных отраслях промышленности.
- Активней всего калий используют в химической промышленности для производства удобрений. Калий является важным элементом для растений. Довольно часто растения испытывают нехватку калия, что приводит к тому, что растение не может использовать весь свой потенциал роста. Растение становится ослабленным, медленнее растет, стебель слабеет, листья желтеют и опадают, семена становятся менее всхожими. Дефицит калия в таких случаях восполняют с помощью удобрений. Именно калийные удобрения являются основной продукцией, для которой используется калий. Самым распространенным калийным удобрением является хлорид калия (KCl).
- Кроме того, элемент и его соединения используют в машиностроении. Гидроксид калия - важнейший элемент для изготовления аккумуляторов.
- Соединения калия также используются в пищевой промышленности. Яркий пример - нитрат калия. Вещество является пищевой добавкой. Используется в качестве консерванта.
Cтраница 1
Чистый калий - серебристо-белый металл с плотностью 0 86, мягкий, плавится при температуре 63 55 С, температура кипения 760 С. Химически калий очень активен. На воздухе быстро окисляется.
Чистый калий - серебристо-белый металл с плотностью 0 86, мягкий, плавится при температуре 63 55 С, температура кипения 760 С. Химически калий очень активен.
| Изотерма равновесия в системе KX Na K NaX в зависимости от аниона (X (данные Ринка. |
Для получения чистого калия пары подвергают ректификации. Готовый продукт содержит 99 5 % калия. На 1 т получаемого калия расходуется 3 2 т КС1, 0 73 т натрия, 620 м3 очищенного азота и - 8000 кВт - ч электроэнергии.
| Кривая зависимости коэффициента вторичной эмиссии о от скорости первичных электронов (в вольтах о / (. /. |
Для чистых щелочных металлов 8 невелико (чистый калий 8 1), несмотря на малую работу выхода.
На рабочем участке с искусственными центрами парообразования вначале были проведены опыты на чистом калии, а затем на сплаве натрий-калий при концентрациях до-63 вес.
В круглодонную колбу емкостью 500 мл, снабженную мешалкой с ртутным затвором, холодильником с сухим льдом, закрытым трубкой с натронной известью (все соединения на шлифах), отгоняют 150 мл аммиака и прибавляют маленькими кусочками при перемешивании 7 8 г (0 2 г-атома) чистого калия, который переводят в амид калия добавлением небольшого кусочка ржавого железа. Стеклянную пришлифованную пробку заменяют капельной воронкой.
Несмотря на значительную разницу в значениях упругости паров калия и свинца, невозможно при однократной отгонке получить в конденсате чистый калий без свинца. Для получения чистого калия без свинца необходима либо вторичная дистилляция, либо такое аппаратурное оформление процесса, при котором предусматривалась бы частичная дефлегмация паров металлов.
Велером (он брал для реакции чистый калий), ему же принадлежит описание химических свойств алюминия.
Калий плавится при температуре 63 7 С. При столь высокой растворимости кислорода вблизи точки затвердевания чистый калий не может быть удовлетворительно очищен от кислорода в холодных ловушках. В сплавах калия с натрием кислород связан с натрием ; растворимость Na O в сплаве и металлическом калии такая же, как в натрии. Это позволяет воспользоваться для очистки металла холодными ловушками. Однако специальная добавка натрия к калию для очистки его от кислорода требует рассмотрения другого метода, называемого методом геттерной очистки. Заключается он во введении на горячем участке контура добавки, которая с кислородом образует более прочное соединение, чем очищаемый металл.
Чем объяснить, что при температуре выше 700 С металлический натрий (менее активный металл) способен вытеснять калий (более активный металл) из его соединений. Может ли такой процесс найти практическое применение при получении чистого калия.
Синтез проводят в трехгорлой колбе, снабженной мешалкой Гершберга, обратным холодильником и стеклянной пробкой. После высушивания прибора метилат калия получают, добавляя абсолютный метанол к 0 9 г (0 23 моля) чистого калия под слоем бензола. Растворители удаляют при пониженном давлении и к сухому остатку добавляют 1 180 г (0 0197 моля) М О-чевины - N 5 в 4 мл абсолютного метанола. В 8 мл метанола растворяют 4 3 г (0 02 моля) ацетамидомалонового эфира и полученный раствор приливают сразу одной порцией к раствору мочевины. Смесь нагревают с обратным холодильником и перемешивают в течение 4 час.
Калий (К) - химический элемент с атомным номером 19. Чистый калий представляет собой щелочной металл серебристо-белого цвета, очень похожий на алюминий, только намного мягче его.
Калий - химически чрезвычайно активный металл. На воздухе он очень быстро окисляется до оксида и гидроокиси за счет взаимодействия с кислородом воздуха и содержащимися в нем водяными парами. Если кусочек калия поместить в воду, он горит фиолетовым пламенем или даже взрывается. Поэтому в природе чистый калий не встречается.
Однако, калий - довольно распространенный химический элемент на Земле, который встречается в виде водорастворимых солей в морской воде, а также в большом количестве других минералов (слюды, полевого шпата, сильвинита, карналлита, каинита и т.д.). Средняя концентрация калия в морской воде 380 мг/л. Вообще, среди всех химических элементов по распространенности он занимает 7-е место, а среди всех металлов - 5-е. Земля на 2,4% состоит из калия.
В химическом плане калий очень похож на натрий , хотя и несколько активнее последнего. А вот в биологическом плане калий является антагонистом натрия, но об этом чуть позже.
С соединениями калия люди знакомы с незапамятных времен. Так, всем известный поташ (смесь карбоната, хлорида и сульфата калия и соды) использовался в качестве моющего средства еще в XI веке. Добывали его так: сжигали солому или древесину, затем ее смешивали с водой и взбалтывали, после этого фильтровали и уже затем выпаривали.
Впервые элементарный калий был выделен в 1807 путем электролиза гидроксида калия (едкого кали). Заслуга открытия калия принадлежит английскому химику Дэви.
Значение калия для организма человека
Калий, без преувеличения, биогенный элемент. Его в том или ином количестве можно обнаружить почти во всех живых организмах: растениях, грибах и животных. К недостатку калия в почве очень чувствительны все растения, и это - чуть ли не основная причина бедности почв. Не случайно, почти 90% всех извлекаемых из недр минералов калия используется в качестве калийных удобрений, а добывающие их комбинаты всегда занимают ведущие места в экономике. С учетом все возрастающей численности населения планеты потребность в калийных удобрениях будет только расти.
В живых организмах калий содержится преимущественно в межклеточной жидкости. В самих клетках его концентрация примерно в 40 раз ниже.
Основная функция калия в любом живом организме - обеспечение осмотического давления между клеткой и цитоплазмой. Сам механизм такого водно-минерального баланса хорошо изучен: в процессе жизнедеятельности клетки избытки ионов калия проникают за пределы цитоплазмы, и для сохранения необходимой концентрации они должны попадать в цитоплазму клетки обратно, что обеспечивается т.н. натрий-калиевым насосом.
Еще одна важнейшая функция калия - создание условий для наличия мембранного потенциала, за счет чего обеспечивается передача мышечных сокращений и нервных импульсов, а также поддержание кислотно-щелочного баланса.
Калий также активизирует работу ферментной системы организма, обеспечивая углеводный и белковый обмен (он необходим для синтеза белка и для преобразования глюкозы в гликоген), улучшает деятельность кишечника, необходим для поддержания функции почек по выведению из организма лишней влаги вместе с продуктами метаболизма.
Ежедневно взрослому человеку требуется 1,8-5,0 г калия, детская доза (в зависимости от возраста) - 0,6-1,7 г. Потребность в поступлении калия сильно зависит от массы тела, физиологического состояния, физической активности, климатических условий.
Источники калия
В животной пище концентрация калия примерно такая же, как в растительной, но предпочтение следует отдавать именно животной пище, поскольку в таком случае человек получает сбалансированное содержание калия и натрия. При употреблении растительной пищи концентрация калия в организме будет расти, а натрия - снижаться, что может привести к нежелательным последствиям. При этом следует иметь в виду, что в силу высокой растворимости соединений калия, почти весь он (на 95%) при поступлении в организм усваивается. Основная часть калия усваивается уже в тонком кишечнике.
- говядина (241 мг%);
- рыба (от 200 мг%);
- молоко (127 мг%).
Растительные продукты с высоким содержанием калия:
- соя (1800 мг%);
- фасоль (1050 мг%);
- горох (900 мг%);
- картофель (429 мг%);
- хлеб (240 мг%);
- свекла (155 мг%);
- капуста (149 мг%;);
- морковь (129 мг%);
- шоколад;
- шпинат , арбуз, дыня, яблоки, абрикосы (в т.ч. урюк и курага), киви, бананы, цитрусовые (особенно помело), виноград (в т.ч. изюм), авокадо.
Нехватка калия в организме человека
Недостаток калия в организме - явление довольно распространенное. Типичные причины дефицита калия следующие:
- недостаточное поступление в организм вместе с пищей;
- нарушения калиевого обмена;
- заболевания органов выделительных и пищеварительных систем (кишечника, печени, почек, легких);
- рвота, использование слабительных и диуретиков, продолжительный понос, обильное потение и иное обезвоживание организма;
- нервно-психические перегрузки, хроническая усталость;
- избыточное поступление в организм антагонистов калия (натрия, рубидия, цезия, таллия).
Симптомы дефицита калия в организме:
- нервно-психическое истощение, хроническая усталость, депрессия;
- снижение иммунитета;
- слабость в мышцах (миастения);
- ухудшение функции надпочечников, почек, учащенное мочеиспускание;
- гипертония;
- тошнота, рвота, атонический запор;
- сердечная аритмия, нарушения в работе миокарда, сердечная недостаточность, инфаркт;
- нарушение работы дыхательной системы (учащенное поверхностное дыхание);
- ломкость волос и ногтей, сухость кожи;
- язвенные заболевания органов пищеварения, гастриты;
- заболевания половых органов, бесплодие, эрозия шейки матки.
Следует также знать, что в процессе приготовления пищи, особенно при варке, продукты теряют значительную часть калия. Причиной этого является все та же высокая растворимость соединений калия. Поэтому при недостатке калия пищу предпочтительно готовить методом запекания или тушения. Повысить усвоение калия можно, сбалансировав употребление содержащих его продуктов приемом витамина В 6 или продуктов с высоким содержанием этого витамина.
Существенно уменьшает усвоение калия употребление алкоголя. Кстати, самый быстрый способ вызвать нехватку калия в организме - систематически пить пиво с соленостями (вяленой и копченой рыбой, чипсами, орешками, сухарями и т.д.).
Избыток калия в организме человека
Все хорошо в меру. Поэтому, прежде чем налегать на содержащие калий продукты, необходимо удостовериться в правильности дозировки. Так, уже разовый прием 6 г калия (естественно, в составе солей) может вызвать симптомы избытка, а 14 г считается летальной дозой.
Причиной избытка калия в организме может стать:
- чрезмерное потребление растительных продуктов с высоким содержанием калия (например, постоянная картофельная диета);
- прием пищевых добавок и минеральных комплексов с высоким содержанием калия;
- нарушение калиевого обмена;
- инсулит-дефицитное состояние;
- нарушение работы почек, в том числе почечная недостаточность;
- нарушение функционирования симпатоадреналиновой системы и др.
Симптомы избытка калия :
- нервозность, гиперактивность, повышенная тревожность, потливость;
- мышечная слабость и другие нервно-мышечные нарушения;
- нейроциркуляторная дистония;
- аритмия;
- нарушения работы кишечника (колики в тонком кишечнике);
- паралич скелетной мускулатуры;
- учащенный диурез;
- повышение риска развития сахарного диабета.








