Цацраг идэвхжлийн үзэгдлийг 1896 онд ураны давснаас үл мэдэгдэх цацраг туяа аяндаа ялгарч байгааг ажигласан А.Беккерел нээжээ. Удалгүй Э.Рутерфорд ба Кюри нар цацраг идэвхт задралын үед Хэ цөм (α-бөөм), электрон (β-бөөм) болон хатуу цахилгаан соронзон цацраг (γ-туяа) ялгардаг болохыг тогтоожээ.
1934 онд позитроны ялгаралттай задрал (β + - задрал), 1940 онд шинэ төрлийн цацраг идэвхт бодис нээгдсэн - цөмийн аяндаа хуваагдал: задралын цөм нь нэгэн зэрэг ялгарах масстай харьцуулж болохуйц хоёр хэсэг болж хуваагддаг. нейтроны болон γ - квант. Цөмийн протоны цацраг идэвхт байдал 1982 онд ажиглагдсан.Иймээс цацраг идэвхт задралын дараах төрлүүд байдаг: α-задрал; - муудах; - ялзрах; e - барих.
Цацраг идэвхит- зарим атомын цөмүүд бөөмс ялгаруулах замаар аяндаа (аяндаа) өөр цөм болж хувирах чадвар.
Атомын цөмүүд нь үүнээс бүрдэнэ протон ба нейтрон, ерөнхий нэртэй - нуклонууд.Цөм дэх протоны тоо нь атомын химийн шинж чанарыг тодорхойлдог бөгөөд тодорхойлогддог З(зүйлийн серийн дугаар). Нуклонуудын тооцөмд гэж нэрлэдэг массын тооболон тэмдэглэнэ А. Ижил серийн дугаартай цөммөн өөр өөр массын тоонуудыг дууддаг изотопууд. Нэг химийн элементийн бүх изотопууд ижил химийн шинж чанартай байдаг ч физик шинж чанар нь маш өөр байж болно. Изотопуудыг тодорхойлохын тулд хоёр индекс бүхий химийн элементийн тэмдгийг ашиглана: A Z X. Доод индекс нь серийн дугаар, дээд индекс нь массын дугаар юм. Ихэнхдээ тухайн элементийн тэмдгээр тэмдэглэгдсэн байдаг тул дэд тэмдгийг орхигдуулдаг.
Жишээлбэл, тэд 14 6 С биш харин 14 С гэж бичдэг.
Цөмийн задрах чадвар нь түүний найрлагаас хамаардаг. Ижил элемент нь тогтвортой болон цацраг идэвхт изотопуудтай байж болно.
Жишээлбэл, нүүрстөрөгчийн 12 С изотоп тогтвортой, харин 14 С изотоп нь цацраг идэвхт бодис юм.
Цацраг идэвхт задрал нь статистикийн үзэгдэл юм. Изотопын задрах чадвар нь задралын тогтмолоор тодорхойлогддог λ.
Ялзалтын тогтмол λ нь тухайн изотопын цөм нэгж хугацаанд задрах магадлал юм.
t хугацаанд цацраг идэвхт задралын цөмийн N тоог, dN 1 - dt хугацаанд задрах цөмийн тоог тэмдэглэе. Матери дахь цөмийн тоо асар их тул олон тооны хууль хангагдсан байдаг. Богино хугацаанд цөмийн задралын магадлалыг dt томъёогоор олно dP = λdt Давтамж нь магадлалтай тэнцүү байна: d N 1 / N = dP = λdt. d N 1 / N = λdt- задарсан цөмийн тоог тодорхойлох томъёо.
Тэгшитгэлийн шийдэл нь: , - томъёог цацраг идэвхт задралын хууль гэнэ. Цацраг идэвхт цөмийн тоо цаг хугацаа өнгөрөх тусам экспоненциал хуулийн дагуу буурдаг.
Энд N нь t хугацааны задралгүй цөмийн тоо; N o - задралгүй цөмийн анхны тоо; λ нь цацраг идэвхт задралын тогтмол юм.
Практикт энэ нь задралын тогтмолыг ашигладаггүй λ , мөн дуудагдсан тоо хэмжээ хагас задралын хугацаа Т.
Хагас задралын хугацаа (T) нь цацраг идэвхт цөмийн хагас задрах хугацаа юм.
Цаг хугацаа өнгөрөхөд цацраг идэвхт задралын хууль Хагас задралын хугацаа (T) нь дараах хэлбэртэй байна.
![]()
Хагас задрал ба задралын тогтмолын хоорондын хамаарлыг дараах томъёогоор тодорхойлно: T = ln(2/λ) = 0.69/λ
Хагас задралын хугацаа нь маш урт эсвэл маш богино байж болно.
Цацраг идэвхт изотопын идэвхжлийн зэрэглэлийг үнэлэхийн тулд идэвх гэж нэрлэгддэг хэмжигдэхүүнийг ашигладаг.
Нэгж хугацаанд задрах цацраг идэвхт эмийн бөөмийн идэвхтэй тоо: A = dN задрал /dt
SI үйл ажиллагааны нэгж нь 1 беккерел (Bq) = 1 задрал/с - 1 секундэд 1 задрал явагдах эмийн идэвхжил. Илүү том үйл ажиллагааны нэгж нь 1 Рутерфорд (Rd) = Bq. Системээс гадуурх үйл ажиллагааны нэгжийг ихэвчлэн ашигладаг - кюри (Ci), 1 г радийн идэвхжилтэй тэнцүү: 1 Ci = 3.7 Bq.
Цаг хугацаа өнгөрөхөд идэвхжил нь ижил экспоненциал хуулийн дагуу буурдаг бөгөөд үүний дагуу радионуклид өөрөө ялзардаг.
![]() =
.
=
.
Практикт үйл ажиллагааг тооцоолоход дараах томъёог ашигладаг.
A = = λN = 0.693 N/T.
Хэрэв бид атомын тоог масс ба массаар илэрхийлбэл үйл ажиллагааг тооцоолох томъёо нь дараах хэлбэртэй болно: A = = 0.693 (μT)
Авогадрогийн дугаар хаана байна; μ - молийн масс.
Цөмийн цацраг идэвхт задралын хуулиуд
Бөөмүүдийн аяндаа задрах, бөөмс ялгаруулах чадварыг цацраг идэвхит чанар гэж нэрлэдэг. Цацраг идэвхт задрал нь статистик процесс юм. Цацраг идэвхт цөм бүр ямар ч үед задарч болох ба энэ нь хангалттай олон тооны цөм задарсан тохиолдолд л дунджаар ажиглагддаг.
Ялзрал тогтмолλ нь цаг хугацааны нэгж дэх цөмийн задралын магадлал юм.
Хэрэв дээжинд t хугацаанд N цацраг идэвхт цөм байгаа бол dt хугацаанд задарсан dN цөмийн тоо N-тэй пропорциональ байна.
dN = -λNdt. (13.1)
(1)-ийг нэгтгэснээр бид цацраг идэвхт задралын хуулийг олж авна
N(t) = N 0 e -λt . (13.2)
N 0 нь t = 0 үед цацраг идэвхт цөмийн тоо юм.
Амьдралын дундаж хугацаа τ –
. (13.3)
Хагас амьдрал T 1/2 - цацраг идэвхт цөмийн анхны тоо хоёр дахин буурах хугацаа
T 1/2 = ln2/λ=0.693/λ = τln2. (13.4)
Үйл ажиллагаа A - нэгж хугацаанд задрах цөмийн дундаж тоо
A(t) = λN(t). (13.5)
Үйл ажиллагааг кюри (Ci) ба беккерел (Bq) -аар хэмждэг.
1 Ki = 3.7*10 10 задрал/с, 1 Bq = 1 задрал/с.
Анхны 1-р цөм 2-р цөм болж, дараа нь 3-р цөм болж задрахыг дифференциал тэгшитгэлийн системээр дүрсэлсэн.
 (13.6)
(13.6)
Энд N 1 (t) ба N 2 (t) нь бөөмийн тоо, λ 1 ба λ 2 нь 1 ба 2 цөмийн задралын тогтмолууд юм. N 1 (0) = N 10 анхны нөхцөлтэй (6) системийн шийдэл; N 2 (0) = 0 байх болно
![]() , (13.7а)
, (13.7а)
![]() . (13.7б)
. (13.7б)

| Зураг 13. 1 |
Цөмийн тоо 2 хамгийн их утгад хүрнэ
Хэрэв λ 2< λ 1 (), суммарная активностьN 1 (t)λ 1 + N 2 (t)λ 2 будет монотонно уменьшаться.
Хэрэв λ 2 >λ 1 ()) бол 2-р бөөмийн хуримтлалаас болж нийт идэвхжил эхлээд нэмэгддэг.
Хэрэв λ 2 >> λ 1 бол хангалттай урт хугацаанд (7b) дахь хоёр дахь экспоненциалын хувь нэмэр нь эхний болон хоёр дахь A 2 = λ 2 N 2 ба эхний изотопуудын А 1-ийн үйл ажиллагаатай харьцуулахад өчүүхэн бага болно. = λ 1 N 1 бараг тэнцүү байна. Ирээдүйд эхний болон хоёр дахь изотопуудын үйл ажиллагаа цаг хугацааны явцад ижил байдлаар өөрчлөгдөх болно.
A 1 (t) = N 10 λ 1 = N 1 (t)λ 1 = A 2 (t) = N 2 (t)λ 2.(13.8)
Энэ нь гэж нэрлэгддэг зүйл юм насны тэнцвэр, үүнд задралын гинжин хэлхээн дэх изотопын цөмийн тоо нь задралын тогтмол (хагас задралын хугацаа) -тай энгийн харилцаатай холбоотой байдаг.
 . (13.9)
. (13.9)
Тиймээс байгалийн нөхцөлд цацраг идэвхт цувралд генетикийн холбоотой бүх изотопууд нь хагас задралын хугацаанаас хамааран тодорхой тооны харьцаатай байдаг.
Ерөнхий тохиолдолд 1→2→...n задралын гинж байх үед процессыг дифференциал тэгшитгэлийн системээр тодорхойлно.
dN i /dt = -λ i N i +λ i-1 N i-1 .(13.10)
N 1 (0) = N 10 анхны нөхцөл бүхий үйл ажиллагааны систем (10) -ын шийдэл; N i (0) = 0 болно
![]() (13.12)
(13.12)
Үндсэн гэдэг нь хуваарьт байгаа үржвэрт i = m-тэй хүчин зүйлийг орхигдуулсан гэсэн үг юм.
Изотопууд
ИЗОТОПУУД- физик-химийн шинж чанараараа ижил төстэй боловч өөр өөр атомын масстай ижил химийн элементийн сортууд. "Изотопууд" гэсэн нэрийг 1912 онд Английн радиохимич Фредерик Содди санал болгосон бөгөөд энэ нь грек хэлний изос - ижил, топос - газар гэсэн хоёр үгнээс гаралтай. Изотопууд нь Менделеевийн элементүүдийн үелэх системийн эсийн нэг байрыг эзэлдэг.
Аливаа химийн элементийн атом нь эерэг цэнэгтэй цөм ба түүнийг хүрээлсэн сөрөг цэнэгтэй электронуудын үүлнээс бүрдэнэ. см.МөнАТОМ ЦӨМ). Менделеевийн үелэх систем дэх химийн элементийн байрлалыг (түүний серийн дугаар) атомын цөмийн цэнэгээр тодорхойлно. Тиймээс изотопуудыг ижил химийн элементийн сортууд гэж нэрлэдэг бөгөөд атомууд нь ижил цөмийн цэнэгтэй (тиймээс бараг ижил электрон бүрхүүлтэй) боловч цөмийн массын утгаараа ялгаатай байдаг. Ф.Соддигийн дүрсэлсэн хэллэгээр изотопын атомууд нь ижил “гадна”, “дотор” нь өөр байдаг.
Нейтроныг 1932 онд нээсэн – устөрөгчийн атомын цөмийн масстай ойролцоо масстай цэнэггүй бөөмс - протон , Үүний үр дүнд шинжлэх ухаан нь изотопын тухай ойлголтын орчин үеийн эцсийн тодорхойлолтыг бий болгосон: изотопууд нь атомын цөм нь ижил тооны протоноос бүрдэх ба зөвхөн нейтроны тоогоор ялгаатай бодис юм. цөм . Изотоп бүрийг ихэвчлэн олон тооны тэмдэгтээр тэмдэглэдэг бөгөөд X нь химийн элементийн тэмдэг, Z нь атомын цөмийн цэнэг (протоны тоо), А нь изотопын массын тоо (нуклонуудын нийт тоо) юм. - цөм дэх протон ба нейтрон, A = Z + N). Цөмийн цэнэг нь химийн элементийн тэмдэгтэй онцгой холбоотой мэт харагддаг тул товчилсон үгэнд ихэвчлэн A X тэмдэглэгээг ашигладаг.
Бидний мэддэг бүх изотопуудаас зөвхөн устөрөгчийн изотопууд өөрийн гэсэн нэртэй байдаг. Тиймээс 2 H ба 3 H изотопуудыг дейтерий ба тритий гэж нэрлэдэг бөгөөд тус тусад нь D ба T гэж нэрлэгддэг (1 H изотопыг заримдаа протиум гэж нэрлэдэг).
Байгальд тогтвортой изотоп хэлбэрээр тохиолддог , ба тогтворгүй - цацраг идэвхт, атомын цөм нь янз бүрийн бөөмс (эсвэл цацраг идэвхт задрал гэж нэрлэгддэг процесс) ялгарснаар бусад цөмд аяндаа хувирдаг. Одоо 270 орчим тогтвортой изотопууд мэдэгдэж байгаа бөгөөд тогтвортой изотопууд нь зөвхөн атомын дугаар Z Ј 83-тай элементүүдээс олддог. Тогтворгүй изотопуудын тоо 2000-аас давж, тэдгээрийн дийлэнх хувийг янз бүрийн цөмийн урвалын үр дүнд зохиомлоор олж авсан. Олон элементийн цацраг идэвхт изотопын тоо маш их бөгөөд хоёр арав гаруй байж болно. Тогтвортой изотопуудын тоо мэдэгдэхүйц бага байна Зарим химийн элементүүд нь зөвхөн нэг тогтвортой изотопоос (бериллий, фтор, натри, хөнгөн цагаан, фосфор, марганец, алт болон бусад хэд хэдэн элемент) бүрдэнэ. Хамгийн олон тооны тогтвортой изотопууд - 10 нь цагаан тугалга, төмрөөс 4, мөнгөн усанд 7 байдаг.
Изотопын нээлт, түүхэн суурь. 1808 онд Английн эрдэмтэн байгаль судлаач Жон Далтон анх удаа химийн элементийг ижил төрлийн атомуудаас бүрдэх бодис гэж тодорхойлсон байдаг. 1869 онд химич Д.И. Менделеев химийн элементүүдийн үечилсэн хуулийг нээсэн. Үелэх системийн эсэд тодорхой байр эзэлдэг бодис болох элементийн тухай ойлголтыг батлахад тулгардаг бэрхшээлүүдийн нэг нь туршилтаар ажиглагдсан элементүүдийн бүхэл бус атомын жин байв. 1866 онд Английн физикч, химич Сэр Уильям Крукес байгалийн химийн элемент бүр нь шинж чанараараа ижил боловч өөр өөр атомын масстай бодисуудын тодорхой холимог гэсэн таамаглал дэвшүүлсэн боловч тэр үед ийм таамаглал хараахан байгаагүй. туршилтын баталгаа, тиймээс удаан үргэлжилсэн анзаарсангүй.
Изотопуудыг нээх чухал алхам бол Эрнст Рутерфорд, Фредерик Содди нарын боловсруулсан цацраг идэвхт бодисын үзэгдэл ба цацраг идэвхт задралын таамаглалыг нээсэн явдал юм: цацраг идэвхит байдал нь атомыг цэнэглэгдсэн бөөмс болон өөр элементийн атом болгон задлахаас өөр зүйл биш юм. , химийн шинж чанараараа анхныхаасаа ялгаатай. Үүний үр дүнд цацраг идэвхт цуврал эсвэл цацраг идэвхт гэр бүлийн тухай санаа гарч ирэв , түүний эхэнд цацраг идэвхт шинж чанартай анхны эх элемент, төгсгөлд нь сүүлчийн тогтвортой элемент байдаг. Өөрчлөлтийн гинжин хэлхээний дүн шинжилгээ нь тэдгээрийн явцад зөвхөн атомын массаар ялгаатай ижил цацраг идэвхт элементүүд үелэх системийн нэг эсэд илэрч болохыг харуулсан. Үнэн хэрэгтээ энэ нь изотопын тухай ойлголтыг нэвтрүүлсэн гэсэн үг юм.
Дараа нь 1912-1920 онд Ж.Ж. Томсон, Астон нарын эерэг цэнэгтэй бөөмсийн цацраг (эсвэл сувгийн цацраг гэж нэрлэгддэг цацраг) дээр хийсэн туршилтаар химийн элементүүдийн тогтвортой изотопууд байгаагийн бие даасан баталгааг олж авсан. ) гадагшлуулах хоолойноос гардаг.
1919 онд Астон масс спектрограф (эсвэл масс спектрометр) хэмээх багаж зохион бүтээжээ. . Ионы эх үүсвэр нь гадагшлуулах хоолойг ашигласан хэвээр байгаа боловч Астон бөөмсийн цацрагийн дараалсан хазайлт нь цахилгаан ба соронзон орон дахь бөөмсийг ижил цэнэгийн массын харьцаатай (тэдгээрийн хурднаас үл хамааран) төвлөрүүлэхэд хүргэдэг аргыг олсон. дэлгэц дээрх ижил цэг. Астонтой хамт арай өөр загвартай масс спектрометрийг Америкийн Демпстер тэр жилүүдэд бүтээжээ. Олон судлаачдын хүчин чармайлтаар масс спектрометрийг дараа нь ашиглаж, сайжруулсны үр дүнд 1935 он гэхэд тухайн үед мэдэгдэж байсан бүх химийн элементүүдийн изотопын найрлагын бараг бүрэн хүснэгтийг эмхэтгэсэн.
Изотопыг ялгах арга.Изотопын шинж чанарыг судлах, ялангуяа шинжлэх ухаан, хэрэглээний зориулалтаар ашиглахын тулд тэдгээрийг мэдэгдэхүйц хэмжээгээр олж авах шаардлагатай. Уламжлалт масс спектрометрийн хувьд изотопуудыг бараг бүрэн салгах боломжтой боловч тэдгээрийн тоо хэмжээ маш бага байдаг. Тиймээс эрдэмтэд, инженерүүдийн хүчин чармайлт изотопуудыг салгах бусад боломжит аргуудыг хайхад чиглэв. Юуны өмнө ижил элементийн изотопуудын ууршилтын хурд, тэнцвэрийн тогтмол байдал, химийн урвалын хурд гэх мэт шинж чанаруудын ялгаан дээр үндэслэн тусгаарлах физик-химийн аргыг эзэмшсэн. Тэдгээрийн дотроос хамгийн үр дүнтэй нь устөрөгч, литий, бор, нүүрстөрөгч, хүчилтөрөгч, азот зэрэг хөнгөн элементийн изотопуудыг үйлдвэрлэлийн үйлдвэрлэлд өргөн ашигладаг залруулах, изотоп солилцох аргууд байв.
Өөр нэг бүлэг аргууд нь молекул кинетик гэж нэрлэгддэг аргуудаас бүрддэг: хийн тархалт, дулааны тархалт, массын тархалт (уурын урсгал дахь тархалт), центрифуг. Өндөр тархалттай сүвэрхэг орчинд изотопын бүрэлдэхүүн хэсгүүдийн тархалтын янз бүрийн түвшинд суурилсан хийн диффузийн аргыг Дэлхийн 2-р дайны үед АНУ-д ураны изотопыг ялгах үйлдвэрлэлийн үйлдвэрлэлийг зохион байгуулах зорилгоор Манхэттэн төслийн хүрээнд ашигласан. атомын бөмбөг. Атомын бөмбөгийн гол "шатамхай" бүрэлдэхүүн хэсэг болох 235 U хөнгөн изотопоор 90% хүртэл баяжуулсан шаардлагатай хэмжээний ураныг авахын тулд дөрвөн мянга орчим га талбайг эзэлсэн үйлдвэрүүд барьсан. Баяжуулсан уран үйлдвэрлэх үйлдвэрүүд бүхий атомын төвийг бий болгоход 2 тэрбум гаруй доллар хуваарилсан бөгөөд дайны дараа баяжуулсан ураныг ялгах аргад суурилсан цэргийн зориулалтаар үйлдвэрлэж, үйлдвэрлэжээ. ЗХУ-д баригдсан. Сүүлийн жилүүдэд энэ арга нь центрифуг хийх илүү үр ашигтай, бага өртөгтэй арга руу орлоо. Энэ аргын хувьд центрифугийн роторыг дүүргэх изотопын хольцын бүрэлдэхүүн хэсгүүдэд төвөөс зугтах хүчний янз бүрийн нөлөөгөөр изотопын хольцыг салгах үр дүнд хүрдэг бөгөөд энэ нь дээд ба доод хэсэгт хязгаарлагдмал нимгэн ханатай цилиндр юм. вакуум камерт өндөр хурдтай . Хэдэн зуун мянган центрифуг каскад холбосон бөгөөд тэдгээрийн ротор нь секундэд мянга гаруй эргэлт хийдэг бөгөөд одоогийн байдлаар Орос болон дэлхийн бусад өндөр хөгжилтэй орнуудад орчин үеийн салгах үйлдвэрүүдэд ашиглагдаж байна. Центрифуг нь атомын цахилгаан станцын цөмийн реакторыг тэжээхэд шаардлагатай баяжуулсан ураныг үйлдвэрлэхээс гадна үелэх системийн дунд хэсэгт байрлах гуч орчим химийн элементийн изотопыг үйлдвэрлэхэд ашигладаг. Хүчтэй ионы эх үүсвэр бүхий цахилгаан соронзон тусгаарлах төхөөрөмжийг сүүлийн жилүүдэд янз бүрийн изотопуудыг салгахад ашигладаг бөгөөд лазераар ялгах аргууд бас өргөн тархсан.
Изотопын хэрэглээ.Химийн элементийн янз бүрийн изотопуудыг шинжлэх ухааны судалгаа, үйлдвэрлэл, хөдөө аж ахуйн янз бүрийн салбарт, цөмийн энерги, орчин үеийн биологи, анагаах ухаан, байгаль орчны судалгаа болон бусад салбарт өргөн ашигладаг. Шинжлэх ухааны судалгаанд (жишээлбэл, химийн шинжилгээнд) жил бүр граммаар, бүр миллиграммаар тооцдог янз бүрийн элементийн ховор изотопуудыг бага хэмжээгээр шаарддаг. Үүний зэрэгцээ цөмийн эрчим хүч, анагаах ухаан болон бусад салбарт өргөн хэрэглэгддэг олон тооны изотопуудын хувьд тэдгээрийг үйлдвэрлэх хэрэгцээ олон килограмм, тэр байтугай тонн хүртэл байж болно. Ийнхүү цөмийн реакторуудад хүнд ус D 2 O ашигласны улмаас өнгөрсөн зууны 1990-ээд оны эхээр дэлхийн хэмжээнд олборлолт жилд 5000 орчим тонн байжээ. Хүнд усны нэг хэсэг болох устөрөгчийн изотоп дейтерий нь байгалийн холимог дахь устөрөгчийн агууламж ердөө 0.015%, тритийтэй хамт ирээдүйд термоядролын эрчим хүчний түлшний гол бүрэлдэхүүн хэсэг болно гэж эрдэмтдийн үзэж байна. цөмийн хайлуулах урвалын үндсэн дээр ажилладаг реакторууд. Энэ тохиолдолд устөрөгчийн изотопыг үйлдвэрлэх хэрэгцээ асар их байх болно.
Шинжлэх ухааны судалгаанд тогтвортой, цацраг идэвхт изотопуудыг байгальд тохиолддог олон төрлийн үйл явцыг судлахад изотопын үзүүлэлт (шошго) болгон өргөн ашигладаг.
Хөдөө аж ахуйд изотопуудыг ("шошготой" атомууд) жишээ нь фотосинтезийн үйл явц, бордооны шингэцийг судлах, ургамлын азот, фосфор, кали, ул мөр элемент болон бусад бодисыг ашиглах үр ашгийг тодорхойлоход ашигладаг. .
Анагаах ухаанд изотопын технологи өргөн хэрэглэгддэг. Тиймээс АНУ-д статистикийн мэдээгээр өдөрт 36 мянга гаруй эмнэлгийн процедур, изотоп ашиглан 100 сая орчим лабораторийн шинжилгээ хийдэг. Хамгийн түгээмэл арга бол компьютерийн томографи юм. 99% (байгалийн агууламж 1%) хүртэл баяжуулсан нүүрстөрөгчийн изотоп С13 нь "амьсгалын оношилгооны хяналт" гэж нэрлэгддэг аргад идэвхтэй ашиглагддаг. Туршилтын мөн чанар нь маш энгийн. Баяжуулсан изотопыг өвчтөний хоолонд нэвтрүүлж, биеийн янз бүрийн эрхтэн дэх бодисын солилцооны үйл явцад оролцсны дараа өвчтөний амьсгалсан нүүрстөрөгчийн давхар исэл CO 2 хэлбэрээр ялгардаг бөгөөд үүнийг цуглуулж, спектрометр ашиглан шинжилдэг. С 13 изотопоор тэмдэглэсэн өөр өөр хэмжээний нүүрстөрөгчийн давхар ислийг ялгаруулахтай холбоотой үйл явцын хурдны ялгаа нь өвчтөний янз бүрийн эрхтнүүдийн нөхцөл байдлыг дүгнэх боломжийг олгодог. АНУ-д энэ шинжилгээнд хамрагдах өвчтөний тоог жилд 5 сая гэж тооцдог. Одоо лазераар ялгах аргыг үйлдвэрлэлийн хэмжээнд өндөр баяжуулсан С13 изотопыг үйлдвэрлэхэд ашигладаг.
Холбогдох мэдээлэл.
Лекц 2. Цацраг идэвхт задралын үндсэн хууль ба радионуклидын идэвхжил
Радионуклидын задралын хурд өөр өөр байдаг - зарим нь илүү хурдан, зарим нь удаан ялзардаг. Цацраг идэвхт задралын хурдны үзүүлэлт нь цацраг идэвхт задралын тогтмол байдал, λ [сек-1], энэ нь нэг секундэд нэг атом задрах магадлалыг тодорхойлдог. Радионуклид бүрийн хувьд задралын тогтмол нь өөрийн гэсэн утгатай байдаг, энэ нь том байх тусам бодисын цөмүүд хурдан ялзардаг.
Нэгж хугацаанд цацраг идэвхт дээжинд бүртгэгдсэн задралын тоог гэнэ үйл ажиллагаа (а ), эсвэл дээжийн цацраг идэвхт байдал. Үйл ажиллагааны утга нь атомын тоотой шууд пропорциональ байна Н цацраг идэвхт бодис:
а =λ· Н , (3.2.1)
Хаана λ – цацраг идэвхт задралын тогтмол, [сек-1].
Одоогийн байдлаар SI нэгжийн олон улсын системийн дагуу цацраг идэвхт бодисын хэмжилтийн нэгж нь Беккерел [Бк]. Энэ нэгж нь 1856 онд ураны байгалийн цацраг идэвхт байдлын үзэгдлийг нээсэн Францын эрдэмтэн Анри Беккерелийн нэрэмжит нэрээр нэрлэгдсэн юм. Нэг беккерел нь секундэд нэг задралтай тэнцүү 1 Бк = 1 .
Гэсэн хэдий ч үйл ажиллагааны системийн бус нэгжийг ихэвчлэн ашигладаг хэвээр байна – кюри [Ки], нэг грамм радиумын задралын хурдыг хэмждэг хэмжүүр болгон Кюри (секундэд ~3.7 1010 задрал гардаг) гэж нэвтрүүлсэн.
1 Ки= 3.7·1010 Бк.
Энэ нэгж нь их хэмжээний радионуклидын идэвхийг үнэлэхэд тохиромжтой.
Ялзралын үр дүнд цаг хугацааны явцад радионуклидын концентраци буурах нь экспоненциал хамаарлыг дагаж мөрддөг.
 , (3.2.2)
, (3.2.2)
Хаана Н т- цаг хугацааны дараа үлдсэн цацраг идэвхт элементийн атомын тоо тажиглалт эхэлсний дараа; Н 0 - цаг хугацааны анхны агшин дахь атомын тоо ( т =0 ); λ - цацраг идэвхт задралын тогтмол.
Тайлбарласан хамаарлыг нэрлэдэг цацраг идэвхт задралын үндсэн хууль .
Нийт радионуклидын тэн хагас нь задрах хугацааг нэрлэдэг хагас задралын хугацаа Т½ . Нэг хагас задралын хугацааны дараа 100 радионуклидын атомаас ердөө 50 нь үлдэнэ (Зураг 2.1). Дараагийн ижил төстэй хугацаанд эдгээр 50 атомаас ердөө 25 нь л үлдэнэ гэх мэт.
Хагас задралын хугацаа ба задралын тогтмол байдлын хоорондын хамаарлыг цацраг идэвхт задралын үндсэн хуулийн тэгшитгэлээс гаргаж авна.
цагт т=Т½ Тэгээд
бид авдаг https://pandia.ru/text/80/150/images/image006_47.gif" width="67" height="41 src="> Þ ;
https://pandia.ru/text/80/150/images/image009_37.gif" өргөн "76" өндөр "21">;
өөрөөр хэлбэл.gif" өргөн "81" өндөр "41 src=">.
Иймд цацраг идэвхт задралын хуулийг дараах байдлаар бичиж болно.
https://pandia.ru/text/80/150/images/image013_21.gif" width="89" height="39 src=">, (3.2.4)
Хаана цагт - цаг хугацааны явцад эмийн үйл ажиллагаа т ; а0 - ажиглалтын эхний мөчид эмийн үйл ажиллагаа.
Аливаа цацраг идэвхт бодисын тодорхой хэмжээний идэвхийг тодорхойлох шаардлагатай байдаг.
Бодисын тоо хэмжээний нэгж нь мэнгэ гэдгийг санаарай. Моль гэдэг нь 0.012 кг = 12 г нүүрстөрөгчийн изотоп 12С-д агуулагдахтай ижил тооны атом агуулсан бодисын хэмжээг хэлнэ.
Аливаа бодисын нэг моль нь Авогадрогийн тоог агуулдаг Н.А. атомууд:
Н.А. = 6.02·1023 атом.
Энгийн бодисуудын (элементүүдийн) хувьд нэг молийн масс нь атомын масстай тоогоор тохирдог А элемент
1 моль = А Г.
Жишээ нь: Магнийн хувьд: 1 моль 24Мг = 24 г.
226Ra-ийн хувьд: 1 моль 226Ra = 226 г гэх мэт.
Хэлэлцсэн зүйлийг харгалзан үзсэн м грамм бодис байх болно Н атомууд:
https://pandia.ru/text/80/150/images/image015_20.gif" өргөн "156" өндөр "43 src="> (3.2.6)
Жишээ: 1 грамм 226Ra-ийн идэвхийг тооцоолъё λ = 1.38·10-11 сек-1.
а= 1.38·10-11·1/226·6.02·1023 = 3.66·1010 Bq.
Хэрэв цацраг идэвхт элемент нь химийн нэгдлүүдийн нэг хэсэг бол эмийн идэвхийг тодорхойлохдоо түүний томъёог харгалзан үзэх шаардлагатай. Бодисын найрлагыг харгалзан массын хэсгийг тодорхойлно χ Энэ харьцаагаар тодорхойлогддог бодис дахь радионуклид:
https://pandia.ru/text/80/150/images/image017_17.gif" өргөн "118" өндөр "41 src=">
Асуудлын шийдлийн жишээ
Нөхцөл:
Үйл ажиллагаа A0 Ажиглалтын өдөрт 32Р цацраг идэвхт элемент 1000 байна Бк. Долоо хоногийн дараа энэ элементийн идэвхжил, атомын тоог тодорхойлно. Хагас амьдрал Т½ 32P = 14.3 хоног.
Шийдэл:
a) 7 хоногийн дараа фосфор-32-ын идэвхийг олцгооё.
https://pandia.ru/text/80/150/images/image019_16.gif" өргөн "57" өндөр "41 src=">
Хариулт:долоо хоногийн дараа 32P эмийн идэвхжил 712 болно Бк,мөн цацраг идэвхт изотоп 32Р-ын атомын тоо 127.14·106 атом.
Аюулгүй байдлын асуултууд
1) Радионуклидын идэвхжил юу вэ?
2) Цацраг идэвхжлийн нэгж, тэдгээрийн хоорондын хамаарлыг нэрлэ.
3) Цацраг идэвхт задралын тогтмол хэмжээ хэд вэ?
4) Цацраг идэвхт задралын үндсэн хуулийг тодорхойл.
5) Хагас задралын хугацаа гэж юу вэ?
6) Радионуклидын идэвхжил ба массын хооронд ямар хамааралтай вэ? Томьёог бичнэ үү.
Даалгаврууд
1. Үйл ажиллагаа 1-ийг тооцоол Г 226Ra. T½ = 1602 жил.
2. Үйл ажиллагаа 1-ийг тооцоол Г 60Co. T½ = 5.3 жил.
3. M-47 танкийн нэг бүрхүүлд 4.3 кг 238U. Т½ = 2.5·109 жил. Савны үйл ажиллагааг тодорхойлох.
4. Ажиглалтын эхний мөчид 1000-тай тэнцүү бол 10 жилийн дараа 137С-ийн идэвхийг тооцоол. Бк. T½ = 30 жил.
5. Одоо 500-тай тэнцэж байгаа бол жилийн өмнөх 90Sr-ийн идэвхжилийг тооцоол Бк. T½ = 29 жил.
6. 1 ямар төрлийн үйл ажиллагааг бий болгох вэ? кградиоизотоп 131I, T½ = 8.1 хоног?
7. Лавлах өгөгдлийг ашиглан үйл ажиллагаа 1-ийг тодорхойлно Г 238U. Т½ = 2.5·109 жил.
Лавлах өгөгдлийг ашиглан үйл ажиллагаа 1-ийг тодорхойлно Г 232th, Т½ = 1.4·1010 жил.
8. Нэгдлийн идэвхийг тооцоол: 239Pu316O8.
9. 1 идэвхжилтэй радионуклидын массыг тооцоол Ки:
9.1. 131I, T1/2=8.1 хоног;
9.2. 90Sr, T1/2=29 жил;
9.3. 137С, Т1/2=30 жил;
9.4. 239Пу, Т1/2=2.4·104 жил.
10. 1-ийн массыг тодорхойлно mCiцацраг идэвхт нүүрстөрөгчийн изотоп 14C, T½ = 5560 жил.
11. Фосфор 32Р цацраг идэвхт бэлдмэл бэлтгэх шаардлагатай. Хэдэн хугацааны дараа эмийн 3% үлдэх вэ? Т½ = 14.29 хоног.
12. Байгалийн калийн хольц нь 40К цацраг идэвхт изотопын 0.012%-ийг агуулдаг.
1) 1-ийг агуулсан байгалийн калийн массыг тодорхойл Ки 40К. Т½ = 1.39·109 жил = 4.4·1018 сек.
2) Хөрсний дээжинд калийн агууламж 14 байгаа нь мэдэгдэж байгаа бол 40К ашиглан хөрсний цацраг идэвхт чанарыг тооцоол. кг/т.
13. Радиоизотопын анхны идэвхжил 0.001% хүртэл буурахад хэдэн хагас задралын хугацаа шаардлагатай вэ?
14. 238U-ийн ургамалд үзүүлэх нөлөөг тодорхойлохын тулд үрийг 100-д дэвтээсэн. мл UO2(NO3)2 6H2O уусмал, үүнд цацраг идэвхт давсны масс 6 байсан. Г. Уусмал дахь 238U-ийн идэвхжил, тодорхой идэвхийг тодорхойлно. Т½ = 4.5·109 жил.
15. Үйл ажиллагаа 1-ийг тодорхойлох грамм 232th, Т½ = 1.4·1010 жил.
16. 1-ийн массыг тодорхойл Ки 137С, Т1/2=30 жил.
17. Байгаль дахь калийн тогтвортой ба цацраг идэвхт изотопын агууламжийн харьцаа нь тогтмол утга юм. 40K агуулга нь 0.01% байна. Хөрсний дээжинд калийн агууламж 14 байгаа нь мэдэгдэж байгаа бол 40К ашиглан хөрсний цацраг идэвхт чанарыг тооцоол. кг/т.
18. Хүрээлэн буй орчны литоген цацраг идэвхт байдал нь үндсэн гурван байгалийн радионуклидаас үүсдэг: 40K, 238U, 232Th. Байгалийн изотопын нийлбэр дэх цацраг идэвхт изотопын эзлэх хувь 0.01, 99.3, ~100 байна. Цацраг идэвхжлийг тооцоолох 1 Тхөрс, хэрэв хөрсний дээж дэх калийн харьцангуй агууламж 13600 байгаа нь мэдэгдэж байгаа бол г/т, уран – 1·10-4 г/т, торий – 6·10-4 г/т.
19. Хоёр хавхлагт нялцгай биетний хясаанаас 23200 ширхэг олджээ Бк/кг 90 Sr. 10, 30, 50, 100 жилийн дараа дээжийн идэвхийг тодорхойлох.
20. Чернобылийн бүсийн битүү усан сангуудын гол бохирдол нь АЦС-ын ослын дараах эхний жилд болсон. Нуурын ёроолын хурдас дахь . Азбучин 1999 онд 1.1·10 Бк/м2 өвөрмөц идэвхжилтэй 137С-г илрүүлсэн. 1986-1987 оны байдлаар ёроолын хурдас м2 тутамд унасан 137С-ийн концентраци (идэвхжил)-ийг тодорхойлно. (12 жилийн өмнө).
21. 241Am (T½ = 4.32·102 жил) нь 241Pu (T½ = 14.4 жил) -ээс үүссэн бөгөөд геохимийн идэвхтэй шилжин суурьшдаг. Лавлагаа материалыг ашиглан плутони-241-ийн идэвхжил цаг хугацааны явцад буурч, Чернобылийн гамшгаас хойш аль онд байгаль орчинд 241Am үүсэх нь хамгийн их байх болно гэдгийг 1% -ийн нарийвчлалтайгаар тооцоол.
22. Дөрөвдүгээр сарын байдлаар Чернобылийн реакторын ялгаруулалтын 241Am идэвхжилийг тооцоол.
2015, 1986 оны 4-р сард 241Am-ийн үйл ажиллагаа 3.82 1012 байсан бол Бк,Т½ = 4.32·102 жил.
23. Хөрсний дээжээс 390 nCi/кг 137С. 10, 30, 50, 100 жилийн дараа дээжийн идэвхжилийг тооцоол.
24. Нуурын ёроолын бохирдлын дундаж агууламж. Чернобылийн ослын бүсэд байрладаг Глубокое нь 6.3 104. Бк 1 м2 талбайд 241Ам ба 7.4·104 238+239+240Пу. Эдгээр мэдээллийг хэдэн онд олж авсныг тооцоол.
§ 15-г. Цацраг идэвхт задралын хууль
"Гарын авлагын" сцинтилляцын тоолуур болон голчлон бөөмийн тооллогыг автоматжуулахад тусалсан Гейгер-Мюллерийн тоолуур гарч ирснээр (§ 15-ыг үзнэ үү) физикчдийг чухал дүгнэлтэд хүргэв. Аливаа цацраг идэвхт изотоп нь цацраг идэвхт чанар нь аяндаа сулрах шинж чанартай байдаг бөгөөд энэ нь нэгж хугацаанд задрах цөмийн тоо буурах замаар илэрхийлэгддэг.
Төрөл бүрийн цацраг идэвхт изотопуудын үйл ажиллагааны графикийг зурах нь эрдэмтдийг ижил хамааралтай байдалд хүргэв. экспоненциал функц(графикийг үзнэ үү). Хэвтээ тэнхлэг нь ажиглалтын цагийг, босоо тэнхлэг нь задралгүй цөмийн тоог харуулдаг. Шугамын муруйлт өөр байж болох ч графикаар тодорхойлсон хамаарлыг илэрхийлсэн функц нь ижил хэвээр байв.
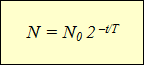
Энэ томъёог илэрхийлнэ цацраг идэвхт задралын хууль:Цаг хугацааны явцад ялзраагүй цөмийн тоог сөрөг тэмдгээр авсан ажиглалтын хугацааг хагас задралын хугацаатай харьцуулсан хүчин чадалд 2-оор үржүүлсэн анхны цөмийн тоог тодорхойлно.
Туршилтын явцад янз бүрийн цацраг идэвхт бодисууд өөр өөр шинж чанартай байдаг хагас задралын хугацаа– задрахгүй байгаа цөмийн тоо хоёр дахин багассан хугацаа(хүснэгтийг үзнэ үү).
Зарим химийн элементийн зарим изотопуудын хагас задралын хугацаа. Байгалийн болон хиймэл изотопын хувьд утгыг өгдөг.
| Иод-129 | 15 сая | Нүүрстөрөгч-14 | 5.7 мянган жил | |
| Иод-131 | 8 хоног | Уран-235 | 0.7 Га | |
| Иод - 135 | 7 цаг | Уран-238 | 4.5 тэрбум жил |
Хагас задралын хугацаа нь цацраг идэвхт задралын хурдыг тодорхойлдог нийтээр хүлээн зөвшөөрөгдсөн физик хэмжигдэхүүн юм. Олон тооны туршилтууд үүнийг харуулж байна цацраг идэвхт бодисыг маш удаан ажигласан ч түүний хагас задралын хугацаа тогтмол байдаг, өөрөөр хэлбэл аль хэдийн задарсан атомын тооноос хамаардаггүй.Тиймээс цацраг идэвхт задралын хууль нь археологи, геологийн олдворуудын насыг тодорхойлох аргад хэрэглэгдэх болсон.
Радиокарбон тодорхойлох арга.Нүүрстөрөгч нь дэлхий дээрх маш түгээмэл химийн элемент бөгөөд үүнд нүүрстөрөгч-12, нүүрстөрөгч-13, цацраг идэвхт изотоп нүүрстөрөгч-14 зэрэг хагас задралын хугацаа нь 5.7 мянган жил байдаг (хүснэгтийг үз). Амьд организмууд хоол хүнс хэрэглэж байхдаа эд эсдээ гурван изотопыг хуримтлуулдаг. Организмын амьдрал дууссаны дараа нүүрстөрөгчийн нийлүүлэлт зогсч, цаг хугацаа өнгөрөх тусам түүний агууламж цацраг идэвхт задралын улмаас байгалийн жамаар буурдаг. Зөвхөн нүүрстөрөгч-14 ялзардаг тул амьд организмын чулуужсан үлдэгдэл дэх нүүрстөрөгчийн изотопуудын харьцаа олон зуун, мянган жилийн туршид өөрчлөгддөг. Энэхүү “нүүрстөрөгчийн хувь хэмжээг” хэмжсэнээр бид археологийн олдворын насыг дүгнэж болно.
Радионүүрстөрөгчийн шинжилгээний арга нь геологийн чулуулаг, мөн хүний чулуужсан объектод хамаарах боловч дээж дэх изотопуудын харьцаа нь оршин тогтнох явцад, жишээлбэл, гал түймэр эсвэл хүчтэй эх үүсвэрийн нөлөөгөөр эвдрэлд ороогүй тохиолдолд хэрэглэнэ. цацрагийн. Энэ аргыг нээсэн даруйдаа ийм шалтгааныг анхаарч үзээгүй нь хэдэн зуун, мянган жилийн турш алдаа гаргахад хүргэсэн. Өнөөдөр нүүрстөрөгч-14 изотопын хувьд урт наслалт мод (жишээлбэл, Америкийн мянганы улаан мод) дахь тархалтад үндэслэн "шаардлагагүй калибровкийн хэмжүүр" ашигладаг. Тэдний насыг маш нарийн тооцоолж болно - жилийн модны цагиргууд.
21-р зууны эхэн үед радио нүүрстөрөгчийн онолын аргын хэрэглээний хязгаар нь 60,000 жил байв. Чулуулаг, солир зэрэг хуучин дээжийн насыг хэмжихийн тулд ижил төстэй аргыг ашигладаг боловч судалж буй дээжийн гарал үүслээс хамааран нүүрстөрөгчийн оронд уран эсвэл бусад элементийн изотопуудыг ажигладаг.
Таны хөтөч дээр Javascript идэвхгүй байна.Тооцоолол хийхийн тулд та ActiveX хяналтыг идэвхжүүлэх ёстой!
>> Цацраг идэвхт задралын хууль. Хагас амьдрал
§ 101 ЦАГААН ИДЭВХИЙ ЭДЛЭЛИЙН ХУУЛЬ. ХАГАС АМЬДРАЛ
Цацраг идэвхт задрал нь статистикийн хуульд захирагддаг. Рутерфорд цацраг идэвхт бодисын өөрчлөлтийг судалж байхдаа тэдгээрийн идэвхжил нь цаг хугацааны явцад буурдаг болохыг туршилтаар тогтоожээ. Үүнийг өмнөх догол мөрөнд авч үзсэн. Тиймээс 1 минутын дараа радоны идэвхжил 2 дахин буурдаг. Уран, торий, радий зэрэг элементүүдийн идэвхжил цаг хугацаа өнгөрөх тусам багасдаг ч хамаагүй удаан байдаг. Цацраг идэвхт бодис бүрийн хувьд идэвхжил 2 дахин буурдаг тодорхой хугацааны интервал байдаг. Энэ интервалыг хагас задралын хугацаа гэж нэрлэдэг. Хагас задралын хугацаа нь цацраг идэвхт атомын эхний хагасын задралын хугацаа юм.
Цацраг идэвхт бодисуудын аль нэгнийх нь хугацаанаас хамаарч идэвхжил буурах, өөрөөр хэлбэл секундэд задрах тоо зэргийг Зураг 13.8-д үзүүлэв. Энэ бодисын хагас задралын хугацаа 5 хоног байна.
Одоо цацраг идэвхт задралын хуулийн математик хэлбэрийг олж авъя. Цагийн анхны момент дэх цацраг идэвхт атомын тоог (t= 0) N 0-тэй тэнцүү болго. Дараа нь хагас задралын дараа энэ тоо тэнцүү болно
Өөр ижил төстэй хугацааны дараа энэ тоо дараахтай тэнцүү болно:









