АРЭНЕС
Үнэрт нүүрсустөрөгч (арен) Бүтэц, химийн шинж чанарын нийтлэг шинж чанарыг тодорхойлдог ароматик үзэл баримтлалаар нэгтгэгдсэн мөчлөгт нүүрсустөрөгчид.
Ангилал
Молекул дахь бензолын цагиргуудын тоонд үндэслэн аренуудыг хуваанадээр:
мононуклеар
олон цөмт

Нэршил ба изомеризм
Бензолын цувралын нүүрсустөрөгчийн бүтцийн өвөг нь бензол C 6 H 6үүнээс гомологуудын системчилсэн нэрс үүссэн.
Моноцикл нэгдлүүдийн хувьд дараах системгүй (жижиг) нэрсийг хадгална.

Орлуулагчдын байрлалыг хамгийн бага тоогоор зааж өгсөн (дугаарлах чиглэл нь хамаагүй),
|
|
|
мөн хоёр орлуулсан нэгдлүүдийн хувьд та тэмдэглэгээг ашиглаж болно орто, мета, хос.
|
|
|
|
Хэрэв цагирагт гурван орлуулагч байгаа бол тэд хамгийн бага тоог хүлээн авах ёстой, өөрөөр хэлбэл. "1,2,4" мөр нь "1,3,4"-ээс давуу талтай.


1,2-диметил-4-этилбензол (зөв нэр) 3,4-диметил-1-этилбензол (буруу нэр)
Монор орлуулсан аренуудын изомеризм нь ди- болон олон орлуулсан бензолын гомологууд дахь орлуулагчийн нүүрстөрөгчийн араг ясны бүтэцтэй холбоотой бөгөөд цөм дэх орлуулагчдын өөр өөр зохицуулалтаас үүдэлтэй нэмэлт изомеризм үүсдэг.
C 9 H 12 найрлагатай үнэрт нүүрсустөрөгчийн изомеризм:
|
|
|
|
|
Физик шинж чанар
Аренуудын буцлах, хайлах цэгүүд нь алкан, алкен, алкинуудаас өндөр, тэдгээр нь бага зэрэг туйлширч, усанд уусдаггүй, туйлшралгүй органик уусгагчид сайн уусдаг. Арена нь тодорхой үнэртэй шингэн эсвэл хатуу бодис юм. Бензол ба олон өтгөрүүлсэн аренууд нь хортой бөгөөд тэдгээрийн зарим нь хорт хавдар үүсгэх шинж чанартай байдаг. Бие дэх өтгөрүүлсэн аренуудын исэлдэлтийн завсрын бүтээгдэхүүн нь эпоксид бөгөөд тэдгээр нь өөрөө шууд хорт хавдар үүсгэдэг эсвэл хорт хавдар үүсгэгч бодисуудын урьдал бодис юм.
Арена авах
Олон тооны анхилуун үнэрт нүүрсустөрөгч нь практик ач холбогдолтой бөгөөд томоохон үйлдвэрлэлийн хэмжээнд үйлдвэрлэгддэг. Үйлдвэрлэлийн хэд хэдэн арга нь нүүрс, газрын тос боловсруулахад суурилдаг.
Газрын тос нь алифатик эсвэл ацикл нүүрсустөрөгчийг анхилуун үнэрт болгон хувиргах голчлон алифатик болон алицикл нүүрсустөрөгчөөс бүрддэг бөгөөд газрын тосыг үнэртүүлэх аргыг боловсруулсан бөгөөд түүний химийн үндсийг Н.Д. Зелинский, Б.А. Казанский.
1. Циклжих ба усгүйжүүлэх:
2. Гидродесметиляци:

3. Бензолын гомологуудыг алкилизаци эсвэл ацилжилтын дараа карбонилийн бүлгийг бууруулж бэлтгэдэг.
a) Friedel-Crafts алкилизаци:

b) Friedel-Crafts ациляци:

4. Wurtz-Fitting урвалаар бифенил бэлтгэх:
5. Фридел-Крафтс урвалаар дифенилметан бэлтгэх:
Бүтэц ба химийн шинж чанар.
Үнэрт байдлын шалгуур:
Цикл коньюгат системүүдийн онолын тооцоо, туршилтын судалгаан дээр үндэслэн нэгдэл нь дараах байдалтай байвал анхилуун үнэртэй болохыг тогтоожээ.
- Хавтгай циклик σ-араг яс;
- Цагирагийн бүх атомыг хамарсан, n = 0, 1, 2, 3 гэх мэт 4n + 2 агуулсан хавсарсан хаалттай π-электрон систем. Энэхүү жорыг гэж нэрлэдэг Хюккелийн дүрэм.Үнэрт чанарын шалгуур нь нэгдмэл үнэрт системийг бусад бүхнээс ялгах боломжийг олгодог. Бензол нь π электронуудын секстет агуулдаг ба n = 1 үед Хюккелийн дүрмийг баримталдаг.

Үнэрт чанар нь юу өгдөг вэ:
Ханаагүй байдлын өндөр түвшинг үл харгалзан үнэрт нэгдлүүд нь исэлдүүлэгч бодис, температурт тэсвэртэй бөгөөд нэмэлт урвалаас илүү орлуулах урвалд өртөмтгий байдаг. Эдгээр нэгдлүүд нь термодинамикийн тогтвортой байдлыг нэмэгдүүлсэн бөгөөд энэ нь үнэрт цагирагийн системийн өндөр коньюгацийн энерги (150 кЖ / моль) -ээр хангагдсан тул аренууд орлуулах урвалд ордог бөгөөд үүний үр дүнд үнэрт чанарыг хадгалдаг.
Үнэрт цагираг дахь электрофил орлуулах урвалын механизм:
Бензолын цагирагийн π-коньюгат системийн электрон нягт нь электрофиль урвалжуудын довтолгоонд тохиромжтой зорилт юм.
Ихэвчлэн катализатор, зохих нөхцлийг ашиглан урвалын явцад электрофил урвалжууд үүсдэг.
E – Y → E δ + – Y δ - → E + + Y -
π-цогцолбор үүсэх.Цагирагийн π-электрон үүлний электрофилын анхны дайралт нь урвалжийг π-системтэй уялдуулж, донор хүлээн авагч төрлийн цогцолбор үүсэхэд хүргэдэг. π-цогцолбор.Үнэрийн систем тасалддаггүй:

σ-цогцолбор үүсэх.Цагирагийн π-системийн хоёр электроны улмаас электрофил нь нүүрстөрөгчийн атомтай ковалент холбоо үүсгэдэг хязгаарлах үе шат бөгөөд энэ нь нүүрстөрөгчийн атомын шилжилтийг дагалддаг. sp 2 -В sp 3 -эрлийз төлөв байдал, үнэрт эвдрэлийн үед молекул нь карбокат болж хувирдаг.

σ-цогцолборыг тогтворжуулах. Энэ нь суурь ашиглан σ-комплексээс протоныг гарган авах замаар хийгддэг. Энэ тохиолдолд C-H эвдэрсэн ковалент холбооны хоёр электроны улмаас цагирагийн хаалттай π-систем сэргээгддэг, өөрөөр хэлбэл. молекул анхилуун үнэрт төлөвт буцаж ирдэг:

Электрофиль орлуулалтын реактив ба чиг баримжаа дахь орлуулагчдын нөлөө
Бензолын цагираг дээрх орлуулагчид нь тархалтын жигд байдлыг алдагдуулдаг π- цагирагийн электрон үүл үүсч, улмаар цагирагийн реактив байдалд нөлөөлдөг.
- Электрон хандивлагч орлуулагчид (D) цагирагийн электрон нягтыг нэмэгдүүлж, электрофил орлуулах хурдыг нэмэгдүүлдэг идэвхжүүлж байна.
- Электрон татах орлуулагч (A) нь цагирагийн электрон нягтыг бууруулж, урвалын хурдыг бууруулдаг. халдваргүйжүүлэх.
Үнэрт нүүрсустөрөгч- молекул нь бензолын цагираг агуулсан нүүрстөрөгч ба устөрөгчийн нэгдлүүд. Аромат нүүрсустөрөгчийн хамгийн чухал төлөөлөгчид бол бензол ба түүний гомологууд - бензолын молекул дахь нэг буюу хэд хэдэн устөрөгчийн атомыг нүүрсустөрөгчийн үлдэгдэлтэй солих бүтээгдэхүүн юм.
Бензолын молекулын бүтэц
Анхны үнэрт бодис болох бензолыг 1825 онд М.Фарадей нээжээ. Түүний молекулын томьёо нь тогтоогдсон - C 6 H 6. Хэрэв бид түүний найрлагыг ижил тооны нүүрстөрөгчийн атом агуулсан ханасан нүүрсустөрөгчийн найрлагатай харьцуулж үзвэл - гексан (C 6 H 14) бол бензол нь найман устөрөгчийн атомыг агуулдаг болохыг харж болно. . Мэдэгдэж байгаагаар олон тооны холбоо, мөчлөгийн харагдах байдал нь нүүрсустөрөгчийн молекул дахь устөрөгчийн атомын тоо буурахад хүргэдэг. 1865 онд Ф.Кекуле түүний бүтцийн томъёог циклогексантриен - 1, 3, 5 гэж санал болгосон.

Тиймээс молекул харгалзах болно Кекулегийн томъёо, давхар холбоо агуулсан тул бензол нь ханаагүй байх ёстой, өөрөөр хэлбэл нэмэлт урвалд амархан орох ёстой: устөрөгчжилт, броминжуулалт, усжилт гэх мэт.
Гэсэн хэдий ч олон тооны туршилтуудын өгөгдөл нь бензол нь зөвхөн хатуу ширүүн нөхцөлд (өндөр температур, гэрэлтүүлэгт) нэмэлт урвалд ордог бөгөөд исэлдэлтэнд тэсвэртэй болохыг харуулсан. Үүний хамгийн онцлог урвал бол орлуулах урвал юм, тиймээс бензол нь ахиу нүүрсустөрөгчид илүү ойр байдаг.
Эдгээр зөрүүг тайлбарлахыг оролдсон олон эрдэмтэд бензолын бүтцийн янз бүрийн хувилбаруудыг санал болгосон. Бензолын молекулын бүтцийг ацетиленээс үүсэх урвалаар батлав. Бодит байдал дээр бензол дахь нүүрстөрөгч-нүүрстөрөгчийн холбоо нь ижил төстэй бөгөөд тэдгээрийн шинж чанар нь дан эсвэл давхар бондынхтой төстэй биш юм.
Одоогийн байдлаар бензолыг Кекуле томъёогоор эсвэл тойрог дүрсэлсэн зургаан өнцөгтөөр тэмдэглэдэг.
![]()
Тэгэхээр бензолын бүтцийн онцлог юу вэ? Судлаачдын мэдээлэл, тооцоонд үндэслэн нүүрстөрөгчийн зургаан атом бүгд нэг төлөвт байна гэсэн дүгнэлтэд хүрсэн. sp 2 -гибридизаци ба нэг хавтгайд хэвтэх. Эрлийзжүүлээгүй х-давхар холбоог бүрдүүлдэг нүүрстөрөгчийн атомын орбиталууд (Кекуле томъёо) цагирагийн хавтгайд перпендикуляр, хоорондоо параллель байна.
Тэд хоорондоо давхцаж, нэг π-системийг бүрдүүлдэг. Тиймээс Кекулегийн томъёонд дүрсэлсэн ээлжлэн давхар бондын систем нь нэгдмэл, давхцсан бондын мөчлөгийн систем юм. Энэ систем нь бензолын цагирагийн хоёр талд байрлах электрон нягтын хоёр тороид (пончик) бүсээс бүрдэнэ. Иймд бензолыг циклогексатриен-1,3,5 гэхээсээ илүү төвд (π-систем) тойрогтой ердийн зургаан өнцөгт хэлбэрээр дүрслэх нь илүү логик юм. 
Америкийн эрдэмтэн Л.Паулинг бензолыг электрон нягтын тархалтаар ялгаатай, бие биедээ байнга хувирдаг хоёр хилийн бүтэц хэлбэрээр төлөөлөхийг санал болгов, өөрөөр хэлбэл үүнийг хоёр бүтцийн "дундаж" гэж үзэх завсрын нэгдэл гэж үздэг.
Бондын уртыг хэмжих нь эдгээр таамаглалыг баталж байна. Бензол дахь бүх C-C бондууд ижил урттай (0.139 нм) байдаг нь тогтоогдсон. Эдгээр нь дан С-С бондоос (0.154 нм) арай богино, давхар бондоос (0.132 нм) урт байдаг.
Мөн молекулууд нь хэд хэдэн циклийн бүтцийг агуулсан нэгдлүүд байдаг.

Изомеризм ба нэршил
Бензолын гомологууд нь тодорхойлогддог хэд хэдэн орлуулагчийн байрлалын изомеризм. Бензолын хамгийн энгийн гомолог - толуол (метилбензол) - ийм изомерууд байдаггүй; Дараах гомологийг дөрвөн изомер хэлбэрээр үзүүлэв.

Жижиг орлуулагчтай үнэрт нүүрсустөрөгчийн нэрний үндэс нь үг юм бензол. Ароматик цагираг дахь атомуудыг хамгийн ихээс хамгийн бага орлуулагч хүртэл дугаарлана.

Хуучин нэр томъёоны дагуу 2, 6-р байрыг дууддаг ортопозууд, 4 - хос-, мөн 3 ба 5 - мета заалтууд.
Физик шинж чанар
Хэвийн нөхцөлд бензол ба түүний хамгийн энгийн гомологууд нь тааламжгүй үнэртэй маш хортой шингэн юм. Тэд усанд муу уусдаг боловч органик уусгагчид сайн уусдаг.
Бензолын химийн шинж чанар
Орлуулах урвалууд. Үнэрт нүүрсустөрөгчид орлуулах урвалд ордог.
1. Бромжилт.Катализатор, төмрийн бромид (ΙΙΙ) байлцуулан бромтой урвалд ороход бензолын цагираг дахь устөрөгчийн атомуудын аль нэгийг бромын атомаар сольж болно.

2. Бензол ба түүний гомологийн нитратжуулалт. Үнэрт нүүрсустөрөгч нь хүхрийн хүчилтэй (хүхрийн болон азотын хүчлүүдийн хольцыг нитратлах хольц гэж нэрлэдэг) азотын хүчилтэй харилцан үйлчлэхэд устөрөгчийн атом нь нитро бүлэг -NO2-ээр солигдоно.

Энэ урвалд үүссэн нитробензолыг бууруулснаар анилин будагч бодисыг олж авдаг.

Энэ урвалыг Оросын химич Зининийн нэрээр нэрлэсэн.
Нэмэлт урвалууд.Мөн үнэрт нэгдлүүд нь бензолын цагирагт нэмэлт урвалд орж болно. Энэ тохиолдолд циклогексан эсвэл түүний деривативууд үүсдэг.
1. Устөрөгчжүүлэх. Бензолын каталитик устөрөгчжилт нь алкенуудын устөрөгчжилтөөс өндөр температурт явагддаг.
![]()
2. Хлоржуулах.Урвал нь хэт ягаан туяагаар гэрэлтэх үед үүсдэг ба чөлөөт радикал:

Бензолын гомологууд
Тэдний молекулуудын найрлага нь C n H 2 n-6 томъёотой тохирч байна. Бензолын хамгийн ойрын гомологууд нь:
Толуолын дараах бензолын бүх гомологууд изомеруудтай байдаг. Изомеризм нь орлуулагчийн тоо, бүтэц (1, 2) болон бензолын цагираг дахь орлуулагчийн байрлалтай (2, 3, 4) холбоотой байж болно. C 8 H 10 ерөнхий томъёоны нэгдлүүд:

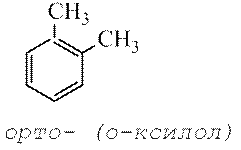
Бензолын цагираг дээрх хоёр ижил эсвэл өөр орлуулагчийн харьцангуй байршлыг зааж өгдөг хуучин нэр томъёоны дагуу угтваруудыг ашигладаг. орто- (товчилсон o-) - орлуулагчид нь хөрш нүүрстөрөгчийн атомуудад байрладаг; мета-(м-) – нэг нүүрстөрөгчийн атомаар дамжуулан ба хос— (П-) – бие биенийхээ эсрэг орлуулагч.
Бензолын гомологийн цувралын анхны гишүүд нь өвөрмөц үнэртэй шингэн юм. Тэд уснаас хөнгөн байдаг. Тэд сайн уусгагч юм.
Бензолын гомологууд урвалд ордог орлуулалт (бромжуулах, нитратжуулах). Толуол нь халах үед перманганатаар исэлддэг.

Бензолын гомологуудыг будагч бодис, ургамал хамгааллын бүтээгдэхүүн, хуванцар, эм үйлдвэрлэхэд уусгагч болгон ашигладаг.



















Үнэрт химийн нэгдлүүд буюу аренууд нь молекулууд нь зургаан нүүрстөрөгчийн атомын тогтвортой цагираг агуулсан карбоциклик нэгдлүүдийн томоохон бүлэг юм. Үүнийг "бензолын цагираг" гэж нэрлэдэг бөгөөд аренуудын физик, химийн тусгай шинж чанарыг хариуцдаг.
Анхилуун үнэрт нүүрсустөрөгчид бензол болон түүний бүх гомологууд ба деривативууд орно.
Арен молекулууд нь хэд хэдэн бензолын цагираг агуулж болно. Ийм нэгдлүүдийг олон цөмийн үнэрт нэгдлүүд гэж нэрлэдэг. Жишээлбэл, нафталин нь ноосон бүтээгдэхүүнийг эрвээхэйнээс хамгаалах алдартай эм юм.
Бензол
Аренийн энэхүү хамгийн энгийн төлөөлөгч нь зөвхөн бензолын цагирагаас бүрддэг. Түүний молекулын томъёо нь C 6 Η 6 юм. Бензолын молекулын бүтцийн томьёо нь ихэвчлэн 1865 онд А.Кекулегийн санал болгосон мөчлөгт хэлбэрээр илэрхийлэгддэг.
Энэ томьёоны давуу тал нь цагираг дахь бүх С ба Н атомын найрлага, эквивалентыг нарийн тусгадагт оршино. Гэсэн хэдий ч энэ нь аренуудын олон химийн шинж чанарыг тайлбарлаж чадаагүй тул гурван хосолсон C = C давхар холбоо байгаа тухай мэдэгдэл алдаатай байна. Энэ нь орчин үеийн холболтын онол гарч ирснээр л тодорхой болсон.
Үүний зэрэгцээ өнөөдөр бензолын томъёог Кекулегийн санал болгосон байдлаар бичдэг. Нэгдүгээрт, түүний тусламжтайгаар химийн урвалын тэгшитгэлийг бичихэд тохиромжтой. Хоёрдугаарт, орчин үеийн химичүүд үүнийг жинхэнэ бүтэц биш харин зөвхөн бэлгэдэл гэж үздэг. Бензолын молекулын бүтцийг өнөөдөр янз бүрийн бүтцийн томъёогоор дамжуулж байна.
Бензолын цагирагийн бүтэц
Бензолын цагирагийн гол онцлог нь уламжлалт утгаараа дан болон давхар холбоогүй байх явдал юм. Орчин үеийн үзэл баримтлалын дагуу бензолын молекул нь хажуугийн урт нь 0.140 нм-тэй тэнцэх хавтгай зургаан өнцөгт хэлбэртэй байдаг. Бензол дахь C-C бондын урт нь дан (түүний урт нь 0.154 нм) ба давхар (0.134 нм) хоорондын завсрын утга болох нь харагдаж байна. C-H холбоо нь мөн ижил хавтгайд байрладаг бөгөөд зургаан өнцөгтийн ирмэгүүдтэй 120 ° өнцгийг үүсгэдэг.
Бензолын бүтэц дэх С атом бүр sp2 эрлийз төлөвт байна. Энэ нь гурван эрлийз орбиталаар дамжуулан ойролцоо байрладаг хоёр С атом, нэг Н атомаар холбогддог бөгөөд энэ нь гурван s-бонд үүсгэдэг. Өөр нэг, гэхдээ аль хэдийн эрлийзжээгүй, 2p тойрог зам нь хөрш зэргэлдээх С атомуудын ижил орбиталуудтай (баруун ба зүүн талд) давхцдаг. Түүний тэнхлэг нь цагирагийн хавтгайд перпендикуляр байдаг бөгөөд энэ нь тойрог замууд нь түүний дээр ба доор давхцдаг гэсэн үг юм. Энэ тохиолдолд нийтлэг хаалттай π-электрон систем үүсдэг. Зургаан С атомын 2p орбиталууд ижил давхцсанаас болж С-С ба С=С бондын нэгэн төрлийн “тэнцүүлэлт” үүснэ.
Энэ үйл явцын үр дүн нь ийм "нэг хагас" бондын давхар ба дан бондтой ижил төстэй байдал юм. Энэ нь аренууд нь алкан ба алкенуудын аль алинд нь хамаарах химийн шинж чанарыг харуулдаг болохыг тайлбарлаж байна.
Бензолын цагираг дахь нүүрстөрөгч-нүүрстөрөгчийн бондын энерги 490 кЖ/моль. Энэ нь нэг ба олон давхар бондын энергийн дундаж юм.

Аренагийн нэршил
Үнэрт нүүрсустөрөгчийн нэрсийн үндэс нь бензол юм. Цагираг дахь атомууд нь хамгийн өндөр орлуулагчаас эхлэн дугаарлагдсан байдаг. Хэрэв орлуулагчид тэнцүү бол дугаарлалт нь хамгийн богино замаар явагдана.
Бензолын олон гомологуудын хувьд өчүүхэн нэрсийг ихэвчлэн ашигладаг: стирол, толуол, ксилол гэх мэт. Орлуулагчдын харьцангуй байрлалыг тусгахын тулд орто-, мета-, пара- угтварыг ашиглах нь заншилтай байдаг.
Хэрэв молекул нь карбонил эсвэл карбоксил гэх мэт функциональ бүлгүүдийг агуулдаг бол арен молекулыг түүнтэй холбогдсон ароматик радикал гэж үзнэ. Жишээлбэл, -C 6 H 5 - фенил, - C 6 H 4 - фенилен, C 6 H 5 - C H 2 - бензил.
Физик шинж чанар
Бензолын гомологийн цувралын анхны төлөөлөгчид нь өвөрмөц үнэртэй өнгөгүй шингэн юм. Тэдний жин нь уснаас хөнгөн бөгөөд тэдгээр нь бараг уусдаггүй боловч ихэнх органик уусгагчид сайн уусдаг.
Бүх үнэрт нүүрсустөрөгчид нь утаат дөлөөр шатдаг бөгөөд энэ нь молекул дахь C агууламж өндөртэй холбоотой юм. Бензолын гомолог цувралын молекулын жин нэмэгдэхийн хэрээр тэдгээрийн хайлах болон буцлах цэгүүд нэмэгддэг.
Бензолын химийн шинж чанар
Аренуудын янз бүрийн химийн шинж чанаруудаас орлуулах урвалыг тусад нь дурдах хэрэгтэй. Мөн онцгой нөхцөл, исэлдэлтийн процессын дагуу явагддаг нэмэлт урвалууд нь маш чухал юм.
Орлуулах урвалууд
Бензолын цагирагийн нэлээд хөдөлгөөнт π-электронууд нь довтолж буй электрофилуудтай маш идэвхтэй хариу үйлдэл үзүүлэх чадвартай. Энэхүү электрофил орлуулалт нь бензол дахь бензолын цагираг болон түүний гомологууд дахь холбогдох нүүрсустөрөгчийн гинжин хэлхээг хамардаг. Энэ үйл явцын механизмыг органик хими зарим талаар нарийвчлан судалсан. Электрофилийн халдлагатай холбоотой аренуудын химийн шинж чанар нь гурван үе шаттайгаар явагддаг.
- Эхний шат. π-комплексийн харагдах байдал нь бензолын цагирагийн π-электрон системийг зургаан π-электронтой холбосон X + бөөмстэй холбосонтой холбоотой юм.

Бензолыг халаахгүйгээр төмөр эсвэл хөнгөн цагаан бромидтой хамт бромжуулах нь бромобензол үүсэхэд хүргэдэг.
C 6 Η 6 + Br 2 —> C 6 Η 5 -Br + ΗBr.
Азотын болон хүхрийн хүчлийн хольцтой нитратжуулалт нь цагираг дахь нитро бүлэгтэй нэгдлүүдийг үйлдвэрлэхэд хүргэдэг.
C 6 Η 6 + ΗONO 2 -> C 6 Η 5 -NO 2 + Η 2 O.
Сульфонжуулалтыг урвалын үр дүнд үүссэн бисульфони ионоор гүйцэтгэдэг.
3Η 2 SO 4 ⇄ SO 3 Η + + Η 3 O + + 2ΗSO 4 - ,
эсвэл хүхрийн гурвалсан исэл.
Аренийн энэхүү химийн шинж чанарт тохирох урвал нь:
C 6 H 6 + SO 3 H + —> C 6 H 5 — SO 3 H + H +.
Алкил ба ацил орлуулах урвал буюу Фридел-Крафтс урвалыг усгүй AlCl 3-ийн дэргэд явуулна.

Бензолын хувьд эдгээр урвалууд нь магадлал багатай бөгөөд хүндрэлтэй байдаг. Бензолд устөрөгчийн галид ба усыг нэмэх нь тохиолддоггүй. Гэсэн хэдий ч цагаан алт байгаа тохиолдолд маш өндөр температурт устөрөгчжих урвал боломжтой:
C 6 Η 6 + 3H 2 -> C 6 H 12.
Хэт ягаан туяагаар цацрах үед хлорын молекулууд нь бензолын молекултай нэгдэж болно.
C 6 Η 6 + 3Cl 2 —> C 6 Η 6 Cl 6.
Исэлдэлтийн урвалууд
Бензол нь исэлдүүлэгч бодисуудад маш тэсвэртэй байдаг. Тиймээс калийн перманганатын ягаан уусмалыг өнгө алддаггүй. Гэсэн хэдий ч ванадийн исэл байгаа тохиолдолд энэ нь атмосферийн хүчилтөрөгчөөр исэлдэж, малений хүчил болж болно.
C 6 H 6 + 4O -> COOΗ-CΗ = CΗ-COOΗ.
Агаарт бензол нь тортог хэлбэрээр шатдаг.
2C 6 Η 6 + 3O2 → 12C + 6 Η 2 O.
Аренуудын химийн шинж чанар
- Орлуулах.


Чиглүүлэх дүрэм
Электрофиль бодис бензолын цагирагтай харилцан үйлчлэх үед орлуулагч ямар байрлалд (o-, m- эсвэл p-) орохыг дараах дүрмээр тодорхойлно.
- хэрэв бензолын цагирагт аль хэдийн орлуулагч байгаа бол энэ орлуулагч нь ирж буй бүлгийг тодорхой байрлалд чиглүүлдэг;
- бүх чиг баримжаатай орлуулагчдыг хоёр бүлэгт хуваадаг: эхний төрлийн чиг баримжаа нь ирж буй бүлэг атомуудыг орто- ба пара байрлал руу чиглүүлдэг (-NH 2, -OH, -CH 3, -C 2 H 5, галоген); Хоёр дахь төрлийн чиглүүлэгч нь орж ирж буй орлуулагчдыг мета байрлал руу чиглүүлдэг (-NO 2, -SO 3 H, -COHO, -COOH).
Чиглэлийг чиглүүлэх хүчийг бууруулах дарааллаар энд жагсаав.
Ихэнх урвалд гурван изомер үүсэх нь ажиглагддаг тул бүлгийн орлуулагчдын энэ хуваагдал нь нөхцөлт гэдгийг тэмдэглэх нь зүйтэй. Ориентууд нь зөвхөн изомеруудын аль нь илүү их хэмжээгээр олж авахад нөлөөлдөг.
Арена авах
Аренийн гол эх үүсвэр нь нүүрсийг хуурай нэрэх, газрын тос боловсруулах юм. Нүүрсний давирхай нь бүх төрлийн үнэрт нүүрсустөрөгчийг асар их хэмжээгээр агуулдаг. Зарим төрлийн тос нь 60% хүртэл арен агуулдаг бөгөөд үүнийг энгийн нэрэх, пиролиз эсвэл хагарлаар амархан тусгаарлаж болно.
Синтетик бэлтгэх арга, аренийн химийн шинж чанар нь ихэвчлэн хоорондоо холбоотой байдаг. Бензолыг түүний гомологуудын нэгэн адил дараах аргуудын аль нэгээр олж авдаг.
1. Газрын тосны бүтээгдэхүүний шинэчлэл. Алканыг усгүйжүүлэх нь бензол ба түүний олон гомологийг нэгтгэх үйлдвэрлэлийн хамгийн чухал арга юм. Урвалыг t = 350-450 o C температурт халаасан катализатор (Pt, Cr 2 O 3, Mo ба V оксид) дээр хий дамжуулах замаар явуулна.
C 6 H 14 —> C 6 Η 6 + 4 Η 2.
2. Вюрц-Фиттигийн урвал. Энэ нь органик металлын нэгдлүүдийг олж авах үе шатаар явагддаг. Урвалын үр дүнд хэд хэдэн бүтээгдэхүүнийг авч болно.
3. Ацетилений тримеризаци. Ацетилен нь өөрөө гомологийн нэгэн адил катализатороор халаахад арен үүсгэх чадвартай.
3C 2 Η 2 -> C 6 Η 6.
4. Фридел-Крафтсын урвал. Бензолын гомологийг олж авах, хувиргах аргыг аренуудын химийн шинж чанарын талаар дээр дурдсан болно.
5. Харгалзах давсуудаас бэлтгэх. Бензойны хүчлийн давсыг шүлтээр нэрэх замаар бензолыг тусгаарлаж болно.
C 6 Η 5 —COONa + NaOΗ —> C 6 Η 6 + Na 2 CO 3 .
6. Кетоныг бууруулах:
C 6 Η 5 -CO-CΗ 3 + Zn + 2ΗCl -> C 6 Η 5 -CΗ 2 -CΗ 3 + Η 2 O + ZnCl 2;
CΗ 3 -C 6 Η 5 -CO-CΗ 3 + NΗ 2 -NΗ 2 —> CΗ 3 -C 6 Η 5 -CΗ 2 -CΗ 3 + Η 2 O.
Талбайн хэрэглээ
Арены химийн шинж чанар, хэрэглээний талбарууд нь шууд хамааралтай байдаг, учир нь анхилуун үнэрт нэгдлүүдийн дийлэнх хэсгийг химийн үйлдвэрлэлд цаашдын нийлэгжилтэд ашигладаг бөгөөд бэлэн хэлбэрээр ашигладаггүй. Үл хамаарах зүйл бол уусгагч болгон ашигладаг бодис юм.
Бензол C 6 × 6 нь этилбензол, кумен, циклогексаны нийлэгжилтэнд голчлон ашиглагддаг. Үүний үндсэн дээр резин, хуванцар, утас, будагч бодис, гадаргуугийн идэвхтэй бодис, шавьж устгах бодис, эм зэрэг янз бүрийн полимер үйлдвэрлэх завсрын бүтээгдэхүүнийг олж авдаг.

Толуол C 6 H 5 -CH 3 нь будагч бодис, эм, тэсрэх бодис үйлдвэрлэхэд ашиглагддаг.
Холимог хэлбэрээр (техникийн ксилол) C 6 Η 4 (C 3) 2 ксилолыг органик бодисын нийлэгжилтэнд уусгагч эсвэл эхлэлийн бэлдмэл болгон ашигладаг.
Изопропилбензол (эсвэл кумен) C 6 H 4 -C H (C H 3) 2 нь фенол ба ацетоныг нийлэгжүүлэх эхлэлийн урвалж юм.
Винилбензол (стирол) C 6 Η 5 -CΗ=CΗ 2 нь хамгийн чухал полимер материал болох полистиролыг үйлдвэрлэх түүхий эд юм.
ТОДОРХОЙЛОЛТ
Үнэрт нүүрсустөрөгч (арен)– молекулууд нь нэг буюу хэд хэдэн бензолын цагираг агуулсан бодисууд. Бензолын гомолог цувралын ерөнхий томьёо C n H 2 n -6
Үнэрт нүүрсустөрөгчийн хамгийн энгийн төлөөлөгчид бол бензол - C 6 H 6 ба толуол - C 6 H 5 - CH 3 юм. Аренуудаас гаргаж авсан нүүрсустөрөгчийн радикалуудыг: C 6 H 5 - - фенил (Ph-) ба C 6 H 5 -CH 2 - - бензил гэж нэрлэдэг.
Бензолын молекул дахь нүүрстөрөгчийн зургаан атом бүгд sp 2 эрлийз төлөвт байна. Нүүрстөрөгчийн атом бүр нэг хавтгайд байрлах өөр хоёр нүүрстөрөгчийн атом, нэг устөрөгчийн атомтай 3σ холбоо үүсгэдэг. Зургаан нүүрстөрөгчийн атом нь ердийн зургаан өнцөгт (бензолын молекулын σ-араг яс) үүсгэдэг.
Нүүрстөрөгчийн атом бүр нэг электрон агуулсан эрлийзжээгүй p орбиталтай байдаг. Зургаан p-электрон нь нэг π-электрон үүл (үнэрт систем) үүсгэдэг бөгөөд энэ нь зургаан гишүүнтэй цагираг дотор тойрог хэлбэрээр дүрслэгдсэн байдаг.
Аренуудын химийн шинж чанар
Бензол ба түүний гомологууд нь электрофил механизмаар явагддаг орлуулах урвалаар тодорхойлогддог.
- галогенжилт (бензол нь катализаторын дэргэд хлор, бромтой урвалд ордог - усгүй AlCl 3, FeCl 3, AlBr 3)
C 6 H 6 + Cl 2 = C 6 H 5 -Cl + HCl
- нитратжуулалт (бензол нь нитратлах хольцтой амархан урвалд ордог - төвлөрсөн азот ба хүхрийн хүчлийн холимог)

- алкенуудтай алкилизаци
C 6 H 6 + CH 2 = CH-CH 3 → C 6 H 5 -CH(CH 3) 2
Бензолд нэмэлт урвал нь үнэрт системийг устгахад хүргэдэг бөгөөд зөвхөн хатуу ширүүн нөхцөлд тохиолддог.
- устөрөгчжүүлэх (халах үед урвал явагддаг, катализатор нь Pt)

- хлор нэмэх (хэт ягаан туяаны нөлөөн дор хатуу бүтээгдэхүүн үүсэх замаар үүсдэг - гексахлорциклогексан (гексахлоран) - C 6 H 6 Cl 6)

Аренагийн физик шинж чанарууд
Бензолын гомологийн цувралын анхны гишүүд нь өвөрмөц үнэртэй өнгөгүй шингэн юм. Тэд уснаас хөнгөн бөгөөд бараг уусдаггүй. Тэд органик уусгагчид сайн уусдаг бөгөөд өөрсдөө сайн уусгагч юм.
Арена авах
Бензол ба түүний гомологийг олж авах үндсэн аргууд:
- алкануудын дегидроциклизаци (катализатор - Pt, Cr 3 O 2)

- циклоалканыг усгүйжүүлэх (халах үед урвал явагддаг, катализатор нь Pt)

- ацетилений тримеризаци (600С хүртэл халаахад урвал явагддаг, катализатор нь идэвхжүүлсэн нүүрс юм)
3HC≡CH → C 6 H 6
- бензолын алкилизаци (Фридел-Крафтс урвал) (катализатор - хөнгөн цагаан хлорид эсвэл фосфорын хүчил)

Асуудлыг шийдвэрлэх жишээ
ЖИШЭЭ 1
| Дасгал хийх | Бодисын уурын нягт 3.482 г/л байна. Түүний пиролизийн үр дүнд 6 г хөө тортог, 5.6 л устөрөгч гарч ирэв. Энэ бодисын томъёог тодорхойл. |
| Шийдэл | Хөө тортог бодисын хэмжээг (нүүрстөрөгч) олъё: v(C) = m(C)/M(C) v(C) = 6/12 = 0.5 моль Устөрөгчийн бодисын хэмжээг олцгооё. v(H 2) = V(H 2)/V м v(H 2) = 5.6/22.4 = 0.25 моль Тиймээс нэг устөрөгчийн атомын бодисын хэмжээ дараахь хэмжээтэй тэнцүү байна. v(H) = 2×0.25 = 0.5 моль Нүүрс устөрөгчийн молекул дахь нүүрстөрөгчийн атомын тоог х, устөрөгчийн атомын тоог y гэж тэмдэглэвэл молекул дахь эдгээр атомуудын харьцаа дараах байдалтай байна. x:y = 0,5: 0,5 = 1:1 Нүүрс устөрөгчийн хамгийн энгийн томъёо CH Нүүрс устөрөгчийн молекул жин нь: M(C x H y) = ρ×V m = 3.482×22.4 = 78 г/моль CH найрлагатай молекулын молекулын жин нь дараахь хэмжээтэй тэнцүү байна. M(CH) = 13 г/моль n = M(C x H y)/ M(CH) = 78/13 = 6, Тиймээс x ба y коэффициентүүдийг 6-аар үржүүлэх шаардлагатай бол хүссэн нүүрсустөрөгч нь C 6 H 6 найрлагатай болно - энэ бол бензол юм |
Ерөнхий анхаарал.
Үнэрт нүүрсустөрөгч (арен) нь молекулууд нь нэг буюу хэд хэдэн бензолын цагираг агуулсан бодисууд юм - бондын онцгой шинж чанартай нүүрстөрөгчийн атомын циклийн бүлгүүд.
"Бензолын цагираг" гэсэн ойлголт нь нэн даруй декодчилохыг шаарддаг. Үүнийг хийхийн тулд бензолын молекулын бүтцийг дор хаяж товч авч үзэх шаардлагатай. Бензолын анхны бүтцийг 1865 онд Германы эрдэмтэн А.Кекуле санал болгожээ.
Энэ томьёо нь нүүрстөрөгчийн зургаан атомын эквивалентыг зөв тусгасан боловч бензолын хэд хэдэн онцгой шинж чанарыг тайлбарлаагүй болно. Жишээлбэл, ханаагүй боловч бензол нь нэмэлт урвалд орох хандлагатай байдаггүй: энэ нь бромын ус болон калийн перманганатын уусмалыг өнгө алддаггүй. ханаагүй нэгдлүүдэд зориулсан чанарын урвалыг өгдөггүй.
Бензолын бүтцийн онцлог, шинж чанарыг орчин үеийн химийн бондын квант механик онолыг боловсруулсны дараа л бүрэн тайлбарласан. Орчин үеийн ойлголтоор бол бензолын молекул дахь нүүрстөрөгчийн зургаан атом бүгд -эрлийз төлөвт байна. Нүүрстөрөгчийн атом бүр нэг хавтгайд байрлах өөр хоёр нүүрстөрөгчийн атом, нэг устөрөгчийн атомтай холбоо үүсгэдэг. Гурван холболтын хоорондох холбоосын өнцөг нь 120 ° байна. Тиймээс бүх зургаан нүүрстөрөгчийн атомууд нэг хавтгайд байрладаг бөгөөд ердийн зургаан өнцөгт (бензолын молекулын араг яс) үүсгэдэг.
Нүүрстөрөгчийн атом бүр нэг эрлийзжүүлээгүй p орбиталтай байдаг.
Зургаан ийм тойрог зам нь хавтгайд перпендикуляр байрладаг - араг яс, бие биентэйгээ зэрэгцээ (Зураг 21.1, а). Бүх зургаан p-электронууд хоорондоо харилцан үйлчилж, ердийн давхар бонд үүсэхтэй адил хосоороо нутагшдаггүй, харин нэг электрон үүлэнд нэгтгэгддэг -бонд үүсгэдэг. Тиймээс дугуй коньюгаци нь бензолын молекулд үүсдэг (§ 19-ийг үз). Энэхүү коньюгат систем дэх хамгийн өндөр электрон нягт нь араг ясны хавтгайн дээр ба доор байрладаг (Зураг 21.1, b).

Цагаан будаа. 21.1. Бензолын молекулын бүтэц
Үүний үр дүнд бензол дахь нүүрстөрөгчийн атомуудын хоорондох бүх холбоо нь 0.139 нм урттай байна. Энэ утга нь алкан дахь нэг бондын урт (0.154 нм) ба алкен дахь давхар холболтын урт (0.133 нм) хоорондын завсрын утга юм. Холболтын тэнцүү байдлыг ихэвчлэн мөчлөгийн доторх тойрогоор дүрсэлсэн байдаг (Зураг 21.1, в). Дугуй коньюгаци нь 150 кЖ/моль эрчим хүчний өсөлтийг өгдөг. Энэ утга нь коньюгацийн энергийг бүрдүүлдэг - бензолын үнэрт системийг тасалдуулахад зарцуулагдах энергийн хэмжээ (харьцуулаарай - бутадиен дэх коньюгацийн энерги нь ердөө 12 кЖ/моль).
Энэхүү электрон бүтэц нь бензолын бүх шинж чанарыг тайлбарладаг. Ялангуяа бензол яагаад нэмэлт урвалд ороход хэцүү байдаг нь тодорхой байна - энэ нь коньюгацийг зөрчихөд хүргэдэг. Ийм хариу үйлдэл нь зөвхөн маш хүнд нөхцөлд л боломжтой байдаг.
Нэршил ба изомеризм.
Уламжлал ёсоор бол талбайг хоёр эгнээ болгон хувааж болно. Эхнийх нь бензолын деривативууд (жишээлбэл, толуол эсвэл бифенил), хоёрдугаарт конденсацсан (полинуклеар) аренууд (тэдгээрийн хамгийн энгийн нь нафталин) орно.

Бид зөвхөн ерөнхий томъёо бүхий бензолын гомолог цувралыг авч үзэх болно.
Бензолын гомолог цуврал дахь бүтцийн изомеризм нь цөм дэх орлуулагчдын харилцан зохион байгуулалттай холбоотой юм. Бензолын цагираг дахь бүх атомууд тэнцүү байдаг тул моноорлуулсан бензолын деривативууд нь байрлалын изомергүй байдаг. Хоёр орлуулсан деривативууд нь орлуулагчдын харьцангуй байрлалаараа ялгаатай гурван изомер хэлбэрээр байдаг. Орлуулагчдын байрлалыг тоо эсвэл угтвараар тэмдэглэнэ.

Аромат нүүрсустөрөгчийн радикалуудыг арил радикал гэж нэрлэдэг. Радикалыг фенил гэж нэрлэдэг.
Физик шинж чанар.
Бензолын гомологийн цувралын эхний гишүүд (жишээлбэл, толуол, этилбензол гэх мэт) нь өвөрмөц үнэртэй өнгөгүй шингэн юм. Тэд уснаас хөнгөн бөгөөд усанд уусдаггүй. Тэд органик уусгагчид сайн уусдаг. Бензол ба түүний гомологууд нь өөрөө олон органик бодисын сайн уусгагч юм. Бүх талбайнууд нь молекул дахь нүүрстөрөгчийн өндөр агууламжаас болж утаатай дөлөөр шатдаг.
Олж авах аргууд.
1. Алифат нүүрсустөрөгчөөс бэлтгэх. Нэг молекул тутамд дор хаяж 6 нүүрстөрөгчийн атом бүхий шулуун гинжин хэлхээтэй алкануудыг халсан цагаан алт эсвэл хромын исэлд шилжүүлэх үед дегидроциклизаци үүсдэг - устөрөгч ялгарах үед арен үүсдэг.
2. Циклоалканыг усгүйжүүлэх. Циклогексан ба түүний гомологуудын уурыг халсан цагаан алтаар дамжуулснаар урвал явагдана.

3. Ацетиленийг тримержүүлэх замаар бензол бэлтгэх - § 20-г үзнэ үү.
4. Friedel-Crafts урвалыг ашиглан бензолын гомологийг олж авах - доороос үзнэ үү.
5. Үнэрт хүчлийн давсыг шүлттэй нэгтгэх:
Химийн шинж чанар.
Ерөнхий анхаарал. Хөдөлгөөнт зургаан электронтой үнэрт цөм нь электрофил урвалжуудын дайралтанд тохиромжтой объект юм. Үүнийг мөн молекулын хавтгай араг ясны хоёр талд байрлах электрон үүлний орон зайн зохион байгуулалт нь хөнгөвчилдөг (Зураг 21.1, b).
Аренуудын хувьд хамгийн ердийн урвалууд нь электрофил орлуулах механизмаар дамждаг бөгөөд тэмдэгтээр тэмдэглэгдсэн байдаг (Англи хэлээр электрофил орлуулах).
Электрофилийн орлуулалтын механизмыг дараах байдлаар илэрхийлж болно. Электрофилийн урвалж XY (X нь электрофил) электрон үүл рүү довтолж, сул электростатик харилцан үйлчлэлийн улмаас тогтворгүй -комплекс үүсдэг. Ароматик систем хараахан тасраагүй байна. Энэ үе шат хурдан явагдана. Хоёрдахь удаашралтай үе шатанд цагирагийн хоёр электроны улмаас электрофил X ба цагирагийн нүүрстөрөгчийн атомуудын хооронд ковалент холбоо үүсдэг. Энэ нүүрстөрөгчийн атом нь эрлийз төлөвөөс гардаг. Энэ тохиолдолд системийн үнэр тасалддаг. Үлдсэн дөрвөн электрон нь нүүрстөрөгчийн таван атомын дунд хуваагддаг ба бензолын молекул нь карбокатион буюу -комплекс үүсгэдэг.

Ароматик чанарыг зөрчих нь энергийн хувьд тааламжгүй байдаг тул β-цогцолборын бүтэц нь үнэрт бүтэцтэй харьцуулахад тогтвортой биш юм. Ароматик чанарыг сэргээхийн тулд электрофилд холбогдсон нүүрстөрөгчийн атомаас протоныг зайлуулдаг (гурав дахь шат). Энэ тохиолдолд хоёр электрон -системд буцаж ирдэг бөгөөд ингэснээр үнэрт чанар сэргээгддэг.

Бензолын олон деривативыг нийлэгжүүлэхэд электрофил орлуулах урвалыг өргөн ашигладаг.
Бензолын химийн шинж чанар.
1. Галогенжилт. Бензол нь ердийн нөхцөлд хлор, бромтой урвалд ордоггүй. Урвал нь зөвхөн усгүй катализаторын оролцоотойгоор явагдана. Урвалын үр дүнд галогенээр орлуулсан аренууд үүсдэг.

Катализаторын үүрэг нь төвийг сахисан галоген молекулыг туйлшруулж түүнээс электрофил бөөмс үүсгэх явдал юм.
2. Нитратжуулалт. Бензол нь халаахад ч төвлөрсөн азотын хүчилтэй маш удаан урвалд ордог. Гэсэн хэдий ч нитратлах хольц (баяжуулсан азот ба хүхрийн хүчлийн холимог) гэж нэрлэгддэг үйл ажиллагааны дор нитратжуулалтын урвал маш амархан явагддаг.
3. Сульфонжуулалт. Урвал нь хүхрийн хүчлийн (олеум) "утаах" нөлөөн дор амархан явагддаг:
4. Friedel-Crafts алкилизаци. Урвалын үр дүнд бензолын гомологийг үүсгэхийн тулд алкил бүлгийг бензолын цагирагт оруулдаг. Бензол нь катализатор - хөнгөн цагаан галидын дэргэд галоалкантай харьцах үед урвал явагдана. Катализаторын үүрэг нь электрофил бөөмс үүсэх замаар молекулын туйлшрал хүртэл буурдаг.
Галоалкан дахь радикалын бүтцээс хамааран янз бүрийн бензолын гомологуудыг авч болно.
5. Алкенуудтай алкилжих. Эдгээр урвалууд нь этилбензол, изопропилбензол (кумен) үйлдвэрлэхэд өргөн хэрэглэгддэг. Алкилизаци нь катализаторын оролцоотойгоор явагддаг. Урвалын механизм нь өмнөх урвалын механизмтай төстэй:
Дээр дурдсан бүх урвалууд электрофил орлуулах механизмаар явагддаг.
Ареныг нэмэх урвал нь үнэрт системийг устгахад хүргэдэг бөгөөд их хэмжээний энерги шаарддаг тул зөвхөн хатуу ширүүн нөхцөлд л тохиолддог.
6. Устөрөгчжүүлэлт. Арен руу устөрөгч нэмэх урвал нь металлын катализатор (Ni, Pt, Pd) байлцуулан халаалт, өндөр даралтын дор явагддаг. Бензолыг циклогексан болгон хувиргаж, бензолын гомологуудыг циклогексаны дериватив болгон хувиргадаг.

7. Радикал галогенжилт. Бензолын уурын хлортой харилцан үйлчлэл нь зөвхөн хатуу хэт ягаан туяаны нөлөөн дор радикал механизмаар явагддаг. Энэ тохиолдолд бензол нь гурван хлорын молекулыг нэмж, хатуу бүтээгдэхүүн - гексахлорциклогексан үүсгэдэг.

8. Агаар мандлын хүчилтөрөгчөөр исэлдэх. Исэлдүүлэгч бодисуудад тэсвэртэй байдлын хувьд бензол нь алкантай төстэй. Зөвхөн катализаторын оролцоотойгоор бензолын уурыг агаар мандлын хүчилтөрөгчтэй хүчтэй халаахад (400 ° C) малений хүчил ба түүний ангидридын хольцыг олж авна.

Бензолын гомологийн химийн шинж чанар.
Бензолын гомологууд нь бензолын цагирагт алкил радикал харилцан үйлчлэхтэй холбоотой хэд хэдэн тусгай химийн шинж чанартай байдаг ба эсрэгээр.
Хажуугийн гинжин урвал. Алкил радикалуудын химийн шинж чанар нь алкантай төстэй. Тэдгээрийн устөрөгчийн атомууд нь чөлөөт радикал механизмаар галогенээр солигддог. Тиймээс катализатор байхгүй тохиолдолд халаалт эсвэл хэт ягаан туяаны цацрагийн үед хажуугийн гинжин хэлхээнд радикал орлуулалтын урвал явагдана. Бензолын цагирагийн алкил орлуулагчид үзүүлэх нөлөө нь бензолын цагирагтай (а-нүүрстөрөгчийн атом) шууд холбогдсон нүүрстөрөгчийн атом дахь устөрөгчийн атомыг байнга сольж байдаг.

Бензолын цагирагт орлуулах нь зөвхөн катализатор байгаа тохиолдолд л механизмаар боломжтой.
Энэ урвалд хлоротолуены гурван изомерын аль нь үүссэнийг доороос олж мэдэх болно.
Бензолын гомологууд нь калийн перманганат болон бусад хүчтэй исэлдүүлэгч бодисуудад өртөхөд хажуугийн гинж нь исэлддэг. Орлуулагчийн гинж хичнээн нарийн төвөгтэй байсан ч карбоксил бүлэгт исэлддэг нүүрстөрөгчийн атомаас бусад нь устаж үгүй болдог.
Нэг талын гинж бүхий бензолын гомологууд нь бензойн хүчил өгдөг.

Бензолын цагираг дахь чиг баримжаа (орлуулах) дүрэм.
Молекулын химийн шинж чанарыг тодорхойлдог хамгийн чухал хүчин зүйл бол түүний доторх электрон нягтын тархалт юм. Тархалтын шинж чанар нь атомуудын харилцан нөлөөллөөс хамаарна.
Зөвхөн -бондтой молекулуудад атомуудын харилцан нөлөөлөл нь индуктив эффектээр дамждаг (§ 17-г үзнэ үү). Коньюгат систем болох молекулуудад мезомер эффект илэрдэг.
-бондын нэгдмэл системээр дамждаг орлуулагчдын нөлөөг мезомерийн (M) эффект гэнэ.
Бензолын молекул дахь электрон үүл нь коньюгацийн улмаас бүх нүүрстөрөгчийн атомуудад жигд тархдаг.
Хэрэв ямар нэгэн орлуулагчийг бензолын цагирагт оруулбал энэ жигд тархалт эвдэрч, цагираг дахь электрон нягтын дахин хуваарилалт үүснэ. Хоёр дахь орлуулагч бензолын цагирагт орох газрыг одоо байгаа орлуулагчийн шинж чанараар тодорхойлно.
Орлуулагчдыг үзүүлэх нөлөөгөөр нь (мезомер эсвэл индуктив) хоёр бүлэгт хуваадаг: электроныг дэмждэг ба электроныг татдаг.
Электрон хандивлагч орлуулагчид нөлөө үзүүлж, коньюгат систем дэх электроны нягтыг нэмэгдүүлдэг. Эдгээрт гидроксил бүлэг -OH ба амин бүлэг орно. Үүний үр дүнд электрон нягт нь орто ба пара байрлалд төвлөрдөг.

Алкил бүлгүүд ерөнхий коньюгацид оролцох боломжгүй боловч электрон нягтын ижил төстэй дахин хуваарилалт явагдах нөлөө үзүүлдэг.
Электрон татах орлуулагчид -M эффект үзүүлж, коньюгат систем дэх электроны нягтыг бууруулдаг. Үүнд нитро бүлэг, сульфо бүлэг, альдегид-CHO ба карбоксил-COOH бүлгүүд орно. Эдгээр орлуулагчид нь бензолын цагирагтай нийтлэг нэгдмэл системийг үүсгэдэг боловч нийт электрон үүл эдгээр бүлгүүд рүү шилждэг. Тиймээс цагираг дахь нийт электрон нягтрал буурч, мета байрлалд хамгийн бага буурдаг.
Жишээлбэл, эхний төрлийн орлуулагч агуулсан толуолыг пара- болон орто-байрлалд нитратжуулж, бромжуулна.

Хоёр дахь төрлийн орлуулагч агуулсан нитробензолыг мета байрлалд нитратжуулж, бромжуулна.

Орлуулагч нь чиглүүлэх нөлөөнөөс гадна бензолын цагирагийн урвалд нөлөөлдөг: 1-р төрлийн чиглүүлэгчид (галогенээс бусад) хоёр дахь орлуулагчийн нэвтрэлтийг хөнгөвчлөх; 2-р төрлийн чиг баримжаа (болон галоген) нь үүнийг хүндрүүлдэг.