“Математикч зураач, яруу найрагчийн нэгэн адил хэв маягийг бүтээдэг. Мөн түүний хээ нь илүү тогтвортой байвал санаанаас бүрдсэн учраас л... Зураач, яруу найрагчийн хээ шиг математикч хүний хээ ч сайхан байх ёстой; Өнгө, үгийн нэгэн адил санаанууд бие биетэйгээ нийцэх ёстой. Гоо сайхан бол хамгийн эхний шаардлага: энэ дэлхийд муухай математикт газар байхгүй».
G.H.Hardy
Эхний бүлэгт анхдагч зүйлүүд нэлээд байдаг гэж тэмдэглэсэн энгийн функцууд, үүнийг цаашид илэрхийлэх боломжгүй үндсэн функцууд. Үүнтэй холбогдуулан тэдгээрийн эсрэг деривативууд нь анхан шатны функцууд гэж бид үнэн зөв хэлж чадах функцүүдийн ангиуд асар их практик ач холбогдолтой болж байна. Энэ ангиллын функцүүд орно оновчтой функцууд, хоёрын харьцааг илэрхийлнэ алгебрийн олон гишүүнт. Олон асуудал нь рационал бутархайг нэгтгэхэд хүргэдэг. Тиймээс ийм функцуудыг нэгтгэх чадвартай байх нь маш чухал юм.
2.1.1. Бутархай рационал функцууд
Рационал бутархай(эсвэл бутархай рационал функц) хоёр алгебрийн олон гишүүнтийн хамаарал гэж нэрлэгддэг:
хаана ба олон гишүүнт байна.
Үүнийг сануулъя олон гишүүнт (олон гишүүнт, бүхэлд нь оновчтой функц ) n-р зэрэгхэлбэрийн функц гэж нэрлэдэг
Хаана ![]() – бодит тоо. Жишээлбэл,
– бодит тоо. Жишээлбэл,
![]()
- нэгдүгээр зэргийн олон гишүүнт;
– дөрөвдүгээр зэргийн олон гишүүнт гэх мэт.
Рационал бутархай (2.1.1) гэж нэрлэдэг зөв, хэрэв зэрэг нь зэргээс доогуур байвал, i.e. n<м, эс бөгөөс бутархайг дуудна буруу.
Аливаа буруу бутархайг олон гишүүнт (бүхэл хэсэг) ба зөв бутархай (бутархай хэсэг) нийлбэрээр илэрхийлж болно.Бутархай бутархайн бүхэл ба бутархай хэсгүүдийг салгахдаа олон гишүүнтийг "булангаар" хуваах дүрмийн дагуу хийж болно.
Жишээ 2.1.1.Дараах буруу рационал бутархайн бүхэл ба бутархай хэсгүүдийг ол.
A)  , б)
, б)  .
.
Шийдэл . a) "Булангийн" хуваах алгоритмыг ашиглан бид олж авна

Тиймээс бид авдаг
 .
.
б) Энд бид мөн "булангийн" хуваах алгоритмыг ашигладаг.

Үүний үр дүнд бид авдаг
 .
.
Дүгнэж хэлье. Ерөнхий тохиолдолд рационал бутархайн тодорхойгүй интегралыг олон гишүүнт ба зөв рационал бутархайн интегралын нийлбэрээр илэрхийлж болно. Олон гишүүнтийн эсрэг деривативыг олох нь хэцүү биш юм. Тиймээс, дараагийн зүйлд бид зөв рационал бутархайг голчлон авч үзэх болно.
2.1.2. Хамгийн энгийн рационал бутархай ба тэдгээрийн интеграл
Зөв оновчтой бутархайн дотроос дөрвөн төрөл байдаг бөгөөд эдгээрийг дараах байдлаар ангилдаг хамгийн энгийн (анхны) рационал бутархай:
|
3) |
4) |
бүхэл тоо хаана байна, ![]() , өөрөөр хэлбэл квадрат гурвалжин
, өөрөөр хэлбэл квадрат гурвалжин ![]() жинхэнэ үндэс байхгүй.
жинхэнэ үндэс байхгүй.
1 ба 2-р төрлийн энгийн бутархайг нэгтгэх нь тийм ч их бэрхшээл учруулахгүй.
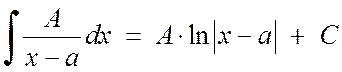 , (2.1.3)
, (2.1.3)
 . (2.1.4)
. (2.1.4)
Одоо 3-р төрлийн энгийн бутархайн интеграцийг авч үзье, гэхдээ бид 4-р төрлийн бутархайг авч үзэхгүй.
Маягтын интегралаас эхэлье
 .
.
Энэ интегралыг ихэвчлэн хуваагчийн төгс квадратыг тусгаарлах замаар тооцдог. Үр дүн нь дараах хэлбэрийн хүснэгтийн интеграл юм
 эсвэл
эсвэл  .
.
Жишээ 2.1.2.Интегралуудыг ол:
A)  , б)
, б) 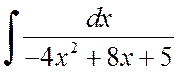 .
.
Шийдэл . a) Квадрат гурвалсан гишүүнээс бүтэн квадратыг сонгоно уу:
Эндээс бид олдог
б) Квадрат гурвалсан гишүүнээс бүрэн квадратыг тусгаарласнаар бид дараахь зүйлийг олж авна.
Тиймээс,
 .
.
Интегралыг олохын тулд
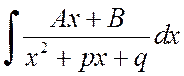
Та хуваагчийн деривативыг тоологч хэсэгт тусгаарлаж, интегралыг хоёр интегралын нийлбэр болгон өргөжүүлж болно: эхнийх нь орлуулах замаар ![]() гадаад үзэмж дээр ирдэг
гадаад үзэмж дээр ирдэг
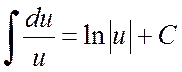 ,
,
ба хоёр дахь нь - дээр дурдсан.
Жишээ 2.1.3.Интегралуудыг ол:
 .
.
Шийдэл
. Үүнийг анхаарна уу 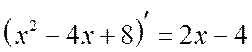 . Тоолуур дахь хуваарийн деривативыг салгая.
. Тоолуур дахь хуваарийн деривативыг салгая.
Эхний интегралыг орлуулах аргыг ашиглан тооцоолно ![]() :
:
Хоёр дахь интегралд бид хуваагч дахь төгс квадратыг сонгоно
Эцэст нь бид авдаг
2.1.3. Зөв оновчтой бутархай тэлэлт
энгийн бутархайн нийлбэрийн хувьд
Аливаа зөв рационал бутархай ![]() энгийн бутархайн нийлбэр хэлбэрээр өвөрмөц байдлаар илэрхийлж болно. Үүнийг хийхийн тулд хуваагчийг хүчин зүйл болгон хуваах шаардлагатай. Дээд алгебраас харахад олон гишүүнт бүр бодит коэффициенттэй байдаг
энгийн бутархайн нийлбэр хэлбэрээр өвөрмөц байдлаар илэрхийлж болно. Үүнийг хийхийн тулд хуваагчийг хүчин зүйл болгон хуваах шаардлагатай. Дээд алгебраас харахад олон гишүүнт бүр бодит коэффициенттэй байдаг
Ийм жижиг бөөмсийг бид шууд хэмжиж чадахгүй нь ойлгомжтой. Бид энгийн тооцоолол хийх замаар молекулуудын хэмжээг тодорхойлох туршилт хийх болно. Та мэдээж газрын тосны бүтээгдэхүүнээс (тосолгооны тос, дизель түлш гэх мэт) үүссэн нимгэн өнгөт хальсыг усны гадаргуу дээр харсан байх. Нимгэн хальсны өнгө нь хальсны дээд ба доод гадаргуугаас туссан гэрлийн цацрагуудын давхцлаас болж үүсдэг бөгөөд үүнийг гэрлийн интерференц гэж нэрлэдэг. Үүнтэй ижил шалтгаанаар савангийн хөөс нь солонгын бүх өнгөөр гялалздаг.
Та физикийн хичээл дээр интерференцийн үзэгдлийг судлах болно. Одоо бид киноны зузааныг сонирхож байна - энэ нь хэр зузаан болохыг та бодож байсан уу? Киноны зузааныг тодорхойлох нь маш энгийн: та түүний эзлэхүүнийг гадаргуугийн талбайд хуваах хэрэгтэй. Эртний далайчид хүртэл ургамлын тос нь усны гадаргуу дээр асгавал энэ нь маш том газар тархдаг болохыг анзаарсан (тэр үед шуурганы үеэр далайг ийм байдлаар "тайвшруулах" боломжтой гэсэн хачирхалтай санаа гарч ирсэн). Усан дээрх тосон толбоны талбайг хэмжсэн анхны хүн бол Америкийн нэрт эрдэмтэн, дипломатч Бенжамин Франклин (1706-1790) байсан бөгөөд түүний дүрс нь зуун долларын дэвсгэрт дээр байдаг. Түүний хамгийн алдартай шинэ бүтээл бол аянгын саваа (эсвэл аянгын саваа) юм. 1774 онд Франклин Англи, АНУ-ын хооронд үүссэн өөр нэг зөрчилдөөнийг шийдвэрлэхээр Европ руу аялав. Хэлэлцээрээс чөлөөт цагаараа тэрээр усны гадаргуу дээр газрын тосны хальсыг туршиж үзсэн. Түүний гайхшралд нэг халбага ургамлын тос жижиг цөөрмийн бүх гадаргуу дээр тархав. Хэрэв та ус руу ургамлын бус тос асгаж, харин наалдамхай биш машины тос байвал толбо нь тийм ч том биш байх болно: нэг дусал нь ойролцоогоор 20 см диаметртэй тойрог үүсгэдэг ойролцоогоор 300 см3, нэг дуслын эзэлхүүн нь ойролцоогоор 0.03 см3 байна. Тиймээс киноны зузаан нь 0.03 см1 / 300 см3 = 0.0001 см = 0.001 мм - 1 микрон байна. Миллиметрийн мянганы нэг нь маш бага утга юм.
Гэхдээ машины тосны молекулууд усан дээгүүр нэг давхаргад тархдаг гэсэн баталгаа бидэнд бий юу? Эцсийн эцэст, зөвхөн энэ тохиолдолд хальсны зузаан нь молекулуудын хэмжээтэй тохирч байх болно. Бидэнд тийм баталгаа байхгүй, яагаад гэдгийг эндээс харж болно. Хөдөлгүүрийн тосыг бүрдүүлдэг молекулуудыг гидрофобик гэж нэрлэдэг (Грек хэлнээс "гидрофобик" - "уснаас айдаг"). Тэд бие биедээ маш сайн "наалддаг" боловч усны молекулуудтай маш дургүй байдаг. Хэрэв машины тостой төстэй бодисыг усны гадаргуу дээр асгавал түүн дээр хэдэн зуун, бүр хэдэн мянган молекулын давхаргаас бүрдэх нэлээд зузаан (молекулын стандартаар) хальс үүсгэдэг. Ийм тооцоолол нь өөрөө сонирхолтой байхаас гадна практик ач холбогдолтой юм. Жишээлбэл, өнөөдрийг хүртэл газрын тос үйлдвэрлэсэн газраас хэдэн мянган километрийн зайд тээвэрлэж буй асар том цистернүүдийн ослоос зайлсхийх боломжгүй юм. Ийм ослын үр дүнд асар их хэмжээний газрын тос далайд асгарч, амьд организмд сөргөөр нөлөөлнө. Газрын тос нь хөдөлгүүрийн тосоос илүү наалдамхай тул усны гадаргуу дээрх хальс нь арай зузаан байж болно. Ийнхүү нэгэн ослын үеэр 500 км3 талбайг хамарсан 120 мянган тонн газрын тос асгарчээ. Энгийн тооцооноос харахад ийм хальсны дундаж зузаан нь 200 микрон байна. Киноны зузаан нь газрын тосны төрөл, усны температураас хамаарна: хүйтэн далайд тос өтгөрч, хальс нь зузаан, дулаан далайд тос нь наалдамхай чанар багатай, нимгэн байдаг. Гэхдээ ямар ч байсан далайд хэдэн арван мянган тонн нефть унасан том танк осолдсон нь гамшиг. Эцсийн эцэст хэрэв бүх асгарсан тос нимгэн давхаргад тархвал асар том талбайн толбо үүсэх бөгөөд ийм хальсыг арилгах нь туйлын хэцүү байдаг.
Зөвхөн нэг давхарга молекул үүсэхээр бодисыг усан дээгүүр тарааж (ийм хальсыг мономолекул гэж нэрлэдэг) боломжтой юу? Энэ нь боломжтой болох нь харагдаж байна, гэхдээ та машины тос эсвэл газрын тосны оронд өөр бодис авах хэрэгтэй. Ийм бодисын молекулууд нь нэг төгсгөлд гидрофилик (өөрөөр хэлбэл "усанд дуртай") бүлэг атомууд, нөгөө төгсгөлд нь гидрофобик байх ёстой. Ийм молекулуудаас бүрдсэн бодисыг усны гадаргуу дээр байрлуулбал юу болох вэ? Усанд уусах гэж оролдсон молекулуудын гидрофил хэсэг нь молекулыг ус руу татдаг бол уснаас "айдаг" гидрофобик хэсэг нь устай харьцахаас зайлсхийх болно. Ийм харилцан "үл ойлголцол" -ын үр дүнд молекулууд (хэрэв банз ашиглан хажуу талаас бага зэрэг "дарагдсан" бол) зурагт үзүүлсэн шиг усны гадаргуу дээр эгнэнэ. 3.1: тэдгээрийн гидрофиль төгсгөлүүд нь усанд орж, гидрофобик төгсгөлүүд нь гадагшаа наалддаг.
\6666666666ы/
Цагаан будаа. 3.1. Гадаргуугийн идэвхт бодисын молекулууд ус-агаарын заагт ингэж чиглэж, 1916 онд ийм давхаргын бүтцийн онолыг бүтээсэн Америкийн химич, физикч Ирвинг Лангмюрын (1881-1957) нэрээр нэрлэгдсэн "Лангмюрийн шон"-ыг бүрдүүлдэг. шингэний гадаргуу
Ийм байдлаар ажилладаг бодисыг гадаргуугийн идэвхт бодис гэж нэрлэдэг. Үүнд, жишээлбэл, саван болон бусад угаалгын нунтаг; наранцэцгийн тосны нэг хэсэг болох олейны хүчил; далдуу модны тос, халимны тосны нэг хэсэг болох пальмитийн спирт. Усны гадаргуу дээр ийм бодис тархах нь машины тосноос хамаагүй нимгэн хальс үүсгэдэг. Энэ үзэгдэл нь удаан хугацааны туршид мэдэгдэж байсан бөгөөд 18-р зуунд ижил төстэй туршилтуудыг хийж байсан. Гэхдээ зөвхөн 19-р зууны төгсгөл - 20-р зууны эхээр Английн физикч Жон Уильям Рэйлей (1842-1919), Германы физикч Вильгельм Конрад Рентген (1845-1923) болон хэд хэдэн туршилтын үр дүнд. Бусад эрдэмтдийн үзэж байгаагаар хальсны зузаан нь бие даасан молекулуудын хэмжээтэй харьцуулж болохуйц жижиг хэмжээтэй байж болохыг харуулсан.
Эдгээр туршилтуудын нэгэнд Английн химич Нейл Кенсингтон Адам бидэнд танил болсон бодисын ихэнх молекулууд 1 нм хэмжээтэй байдаг. Тиймээс устөрөгчийн молекулын диаметр нь ойролцоогоор 0.2 нм, иод - 0.5 нм, этилийн спирт - 0.4 нм; хөнгөн цагааны ионуудын радиус нь 0.06 нм, натри - 0.10 нм, хлорид - 0.13 нм, хлор - 0.18 нм, иод - 0.22 нм. Гэхдээ молекулуудын дунд аварга том биетүүд бас байдаг бөгөөд тэдгээрийн хэмжээ нь молекулын стандартаар үнэхээр одон орон юм. Тиймээс дээд амьтан, ургамлын эсийн цөмд удамшлын молекулууд байдаг - дезоксирибонуклеины хүчил (ДНХ). Тэдний урт нь 2,000,000 нм, өөрөөр хэлбэл 2 мм-ээс хэтэрч болно!
Энэ хэсгийг дуусгахын тулд 1908 онд Францын эрдэмтэн Жан Перриний молекулуудыг "жигнэх" аргыг хэрэглэсэн овсгоотой (хамгийн зөв биш ч) аргын тухай товч түүхийг энд оруулав. Та бүхний мэдэж байгаагаар агаарын нягтрал нь өндрөөр буурдаг. 19-р зууны эхээр Францын эрдэмтэн Пьер Лаплас өөр өөр өндөрт даралтыг тооцоолох томьёог гаргаж авсан. Энэ томьёоны дагуу 6 км тутамд атмосферийн даралт хоёр дахин буурдаг. Энэ утга нь мэдээжийн хэрэг таталцлын хүч, түүнчлэн агаарын молекулуудын массаас хамаарна. Хэрэв агаар нь азот, хүчилтөрөгч биш, харин маш хөнгөн устөрөгчийн молекулуудаас бүрддэг бол (тэдгээр нь хүчилтөрөгчийн молекулуудаас 16 дахин хөнгөн) атмосферийн даралтын хоёр дахин бууралт 6 км-ийн өндөрт биш, харин ойролцоогоор 16 дахин ажиглагдах болно. илүү, өөрөөр хэлбэл 100 орчим км. Эсрэгээр, хэрэв молекулууд маш хүнд байсан бол агаар мандал дэлхийн гадаргуу дээр "дарагдсан" бөгөөд даралт нь өндрөөс хурдан буурах болно.
Ингэж дүгнэж байна. Молекулын оронд Перрин усанд түдгэлзүүлсэн жижиг бөмбөлөг gummigut будагч бодис хэрэглэхээр шийджээ. Тэрээр ойролцоогоор 1 микрон диаметртэй ижил хэмжээтэй бөмбөлөг бүхий суспенз (эмульс) бэлтгэхийг оролдсон. Дараа нь тэр эмульсийн дусал дуслыг микроскопоор байрлуулж, микроскопын боолтыг босоо чиглэлд хөдөлгөж, янз бүрийн өндөрт байгаа бохьны бөмбөгний тоог тоолжээ. Лапласын томъёо нь эмульсийн хувьд нэлээд тохиромжтой болох нь тогтоогдсон: 6 мкм өсөлт тутамд харах талбар дахь бөмбөлгүүдийн тоо хоёр дахин багасдаг. 6 км нь 6 микроноос яг тэрбум дахин том учраас Перрин хүчилтөрөгч, азотын молекулууд бохьноос хэд дахин хөнгөн (мөн тэдгээрийн массыг туршилтаар аль хэдийн тодорхойлох боломжтой) гэж дүгнэжээ.
Шигшүүрийн зарчимд суурилсан орчин үеийн шүүх аргуудыг ерөнхийд нь авч үзсэн дэд хэсэг. Мембран цэвэршүүлэгч нь эдгээр мембран шигшүүр дэх нүх сүв гэж нэрлэгддэг "эсийн" хэмжээнээс хамаардаг янз бүрийн чанар бүхий усыг цэвэршүүлдэг гэж тэд сануулсан. тус тус, усны бичил шүүлтүүр- Энэ бол бидний авч үзэх мембран ус цэвэршүүлэх системийн анхны технологи юм.
Усны бичил шүүлтүүр нь асбестын тоосонцор, будаг, нүүрсний тоос, эгэл биетний уйланхай, бактери, зэв зэрэг том молекулуудын (макромолекулуудын) түвшинд усыг цэвэршүүлэх явдал юм. Харин макро шүүлтүүр (усны) нь элс, лаг шаврын том тоосонцор, зэвний том тоосонцор зэрэгт нөлөөлдөг.
Макро шүүлтүүрээр ялгардаг тоосонцрын хэмжээ нь 1 микрометрээс их хэмжээтэй (тусгай нэг микрон хайрцаг ашигладаг бол) тоосонцор гэж бид ойролцоогоор хэлж чадна. Микрофильтраци арилгадаг ширхэгийн хэмжээ нь 1 микроноос 0.1 микрон хүртэлх тоосонцор.
Та "Гэхдээ 0.1 микрон хүртэлх тоосонцорыг арилгавал 100 микрон тоосонцорыг бичил шүүлтүүрээр барьж авахгүй гэж үү? Яагаад "1 микроноос 0.1 микрон" гэж бичээд байгаа юм бэ? - Энэ бол зөрчил юм уу?"
Үнэн хэрэгтээ онцгой зөрчилдөөн байхгүй. Үнэн хэрэгтээ усны бичил шүүлтүүр нь бактери болон элсний асар том хэсгүүдийг хоёуланг нь устгах болно. Гэхдээ бичил шүүлтүүрийн зорилго нь элсний том хэсгүүдийг зайлуулах явдал биш юм. Микрофильтрацийн зорилго нь "тодорхой хэмжээсийн хүрээнд тоосонцорыг арилгах" юм. Тэгвэл яаж болох юм ОИлүү том тоосонцор нь цэвэршүүлэгчийг зүгээр л бөглөж, нэмэлт зардалд хүргэдэг.
Тиймээс усны бичил шүүлтүүрийн шинж чанарууд руу шилжье.
Микро шүүлтүүр нь 0.1-1 микрон хэмжээтэй тоосонцорыг устгадаг тул бид үүнийг хэлж чадна бичил шүүлтүүрнь 0.1-1 микрон нүх сүвний диаметртэй мембран шигшүүр дээр гардаг ус цэвэршүүлэх зориулалттай мембран технологи юм. Өөрөөр хэлбэл, ийм мембран дээр 0.5-1 микроноос их хэмжээтэй бүх бодисыг зайлуулдаг.
Тэдгээрийг хэрхэн бүрэн арилгах нь нүхний диаметр болон бактерийн бодит хэмжээнээс хамаарна. Тиймээс, хэрэв нян нь урт боловч нимгэн байвал бичил шүүлтүүрийн мембраны нүхэнд амархан ордог. Мөн зузаан бөмбөрцөг хэлбэрийн бактери нь "шигшүүрийн" гадаргуу дээр үлдэх болно.
Микрофильтрацийн хамгийн түгээмэл хэрэглээ бол хүнсний үйлдвэрт(сүү тослох, шүүсийг өтгөрүүлэх) ба анагаах ухаанд(эмийн түүхий эдийг анхан шатны бэлтгэлд зориулж). Мөн бичил шүүлтүүрийг ашигладаг үйлдвэрийн ундны ус цэвэршүүлэхэд- голчлон барууны орнуудад (жишээлбэл, Парист). Хэдийгээр Москва дахь ус цэвэрлэх байгууламжийн нэг нь микро шүүлтүүрийн технологийг ашигладаг гэсэн цуу яриа байдаг. Магадгүй энэ үнэн байх :)
Гэхдээ микро шүүлтүүрт суурилсан гэр ахуйн шүүлтүүрүүд бас байдаг.
Хамгийн түгээмэл жишээ бол бичил шүүлтүүрийн мембраныг хянах. "Мөр" гэсэн үгнээс авсан зам, өөрөөр хэлбэл ул мөр бөгөөд энэ нэр нь энэ төрлийн мембран хэрхэн хийгдсэнтэй холбоотой юм. Уг процедур нь маш энгийн:
- Полимер хальс нь бөөмсөөр бөмбөгддөг бөгөөд энэ нь өөрийн өндөр энергийн улмаас хальсан дээрх ул мөрийг шатаадаг - гадаргууг бөмбөгдөж буй хэсгүүд ижил хэмжээтэй тул ойролцоогоор ижил хэмжээтэй хонхорхой.
- Дараа нь энэ полимер хальсыг уусмалд, жишээлбэл, хүчилд нааж, бөөмийн нөлөөллийн ул мөр арилдаг.
- За, дараа нь субстрат дээр полимер хальсыг хатаах, бэхлэх энгийн процедур - тэгээд л микрофильтрацийн мембран бэлэн боллоо!
Үүний үр дүнд эдгээр мембранууд нь бусад мембран ус цэвэршүүлэх системтэй харьцуулахад тогтмол нүхний диаметртэй, бага сүвэрхэг чанартай байдаг. Дүгнэлт: эдгээр мембранууд нь зөвхөн тодорхой хэмжээний тоосонцорыг арилгах болно.

Өрхийн мембраны бичил шүүлтүүрийн илүү боловсронгуй хувилбар бас бий. идэвхжүүлсэн нүүрсээр бүрсэн бичил шүүлтүүрийн мембран. Өөрөөр хэлбэл, дээр дурдсан алхмууд нь өөр нэг алхамыг багтаасан болно - нимгэн давхаргыг хэрэглэх. Эдгээр мембранууд нь зөвхөн бактери, механик хольцыг төдийгүй бас устгадаг
- үнэр,
- органик бодис,
- гэх мэт.
Микрофильтрацийн мембраны хувьд үүнийг анхаарч үзэх хэрэгтэй аюул бий. Тиймээс мембранаар дамжаагүй бактери Энэ мембран дээр амьдарч эхэлдэгболон асуудал таны амьдралын бүтээгдэхүүнцэвэршүүлсэн ус руу хийнэ. Энэ нь үүсдэг гэсэн үг юм хоёрдогч усны хордлого. Үүнээс зайлсхийхийн тулд мембраныг тогтмол халдваргүйжүүлэх үйлдвэрлэгчийн зааврыг дагаж мөрдөх шаардлагатай.
Хоёр дахь аюул нь тэр юм бактери нь эдгээр мембраныг өөрөө идэж эхэлнэ. Тэд дотор нь асар том нүх гаргах бөгөөд энэ нь мембраныг хадгалах ёстой бодисыг нэвтрүүлэх боломжийг олгоно. Үүнээс урьдчилан сэргийлэхийн тулд та бактерид тэсвэртэй бодис (жишээлбэл, керамик бичил шүүлтүүрийн мембран) дээр суурилсан шүүлтүүр худалдаж авах эсвэл микро шүүлтүүрийн мембраныг байнга солиход бэлэн байх хэрэгтэй.
Микрофильтрацийн мембраныг ойр ойрхон солих нь мөн тэдгээр нь урам зориг өгдөг угаах механизмаар тоноглогдоогүй. Мөн мембраны нүх нь зүгээр л шороогоор бөглөрдөг. Мембранууд бүтэлгүйтдэг.
Зарчмын хувьд бүх зүйл бичил шүүлтүүртэй холбоотой байдаг. Бичил шүүлтүүр нь ус цэвэршүүлэх нэлээд өндөр чанартай арга юм. Гэсэн хэдий ч,
Микрофильтрацийн бодит зорилго нь ундны усыг бэлтгэх (нянгийн бохирдлын аюулаас шалтгаалан) биш харин дараагийн үе шатуудаас өмнө усыг урьдчилан цэвэрлэх явдал юм.
Микрофильтрацийн үе шат нь ус цэвэршүүлэх дараагийн үе шатуудын ихэнх ачааллыг арилгадаг.

Материал дээр үндэслэсэн Усны шүүлтүүрийг хэрхэн сонгох вэ: http://voda.blox.ua/2008/07/Kak-vybrat-filtr-dlya-vody-22.html
« Физик - 10-р анги"
Молекулын физик ямар физик объектуудыг (системийг) судалдаг вэ?
Механик ба дулааны үзэгдлийг хэрхэн ялгах вэ?
Бодисын бүтцийн молекул кинетик онол нь гурван мэдэгдэл дээр суурилдаг.
1) бодис нь бөөмсөөс бүрддэг;
2) эдгээр хэсгүүд санамсаргүй байдлаар хөдөлдөг;
3) бөөмсүүд хоорондоо харилцан үйлчилдэг.
Мэдэгдэл бүр туршилтаар батлагддаг.
Үл хамаарах зүйлгүй бүх биетүүдийн шинж чанар, зан төлөвийг бие биетэйгээ харьцаж буй бөөмсийн хөдөлгөөнөөр тодорхойлдог: молекулууд, атомууд эсвэл бүр жижиг формацууд - энгийн хэсгүүд.
Молекулын хэмжээг тооцоолох. Молекулууд байгаа гэдэгт бүрэн итгэлтэй байхын тулд тэдгээрийн хэмжээг тодорхойлох шаардлагатай. Үүнийг хийх хамгийн хялбар арга бол оливын тос гэх мэт дусал тосыг усны гадаргуу дээгүүр тархахыг ажиглах явдал юм. Хэрэв бид хангалттай өргөн савыг авбал газрын тос хэзээ ч гадаргууг бүхэлд нь эзлэхгүй (Зураг 8.1). 1 мм 2 эзэлхүүнтэй дуслыг хүчээр тарааж, 0.6 м 2-аас дээш талбайг эзлэх боломжгүй. Газрын тос дээд талдаа тархахдаа зөвхөн нэг молекулын зузаантай давхарга буюу "мономолекул давхарга" үүсгэдэг гэж үзье. Энэ давхаргын зузааныг тодорхойлоход хялбар бөгөөд ингэснээр оливын тосны молекулын хэмжээг тооцоолох боломжтой.
Газрын тосны давхаргын V эзэлхүүн нь түүний гадаргуугийн талбайн S ба давхаргын зузаан d-ийн бүтээгдэхүүнтэй тэнцүү, өөрөөр хэлбэл V = Sd. Тиймээс оливын тосны молекулын шугаман хэмжээ нь:

Орчин үеийн багаж хэрэгсэл нь бие даасан атом, молекулуудыг харах, бүр хэмжих боломжийг олгодог. Зураг 8.2-т овойлтууд нь бие даасан цахиурын атомууд болох цахиурын хавтанцарын гадаргуугийн микрографыг үзүүлэв. Ийм зургийг анх 1981 онд нарийн төвөгтэй туннелийн микроскоп ашиглан олж авсан.
Молекулуудын хэмжээ, түүний дотор оливын тос нь атомын хэмжээнээс их байдаг. Аливаа атомын диаметр нь ойролцоогоор 10-8 см байдаг. Эдгээр хэмжээсүүд нь төсөөлөхөд хэцүү байдаг. Ийм тохиолдолд тэд харьцуулалт хийдэг.
Тэдний нэг нь энд байна. Хэрэв та хуруугаа нударгаараа зангидаж, бөмбөрцгийн хэмжээтэй болтол нь томруулж үзвэл атом нь ижил томруулсан үед нударганы хэмжээтэй болно.
Молекулын тоо.
Маш жижиг молекулын хэмжээтэй бол тэдгээрийн тоо макроскопийн аливаа биед асар их байдаг. 1 г масстай, тиймээс 1 см 3 эзэлхүүнтэй усны дусал дахь молекулын ойролцоо тоог тооцоолъё.
Усны молекулын диаметр нь ойролцоогоор 3 10 -8 см байна. Усны молекул бүр нь молекулуудын нягт савлагаатай (3 10 -8 см) 3 эзэлхүүнийг эзэлдэг тул та нэг дусал дахь молекулуудын тоог олох боломжтой. дуслын эзэлхүүнийг (1 см 3) эзлэхүүнд хуваах нь молекул тутамд:
Молекулуудын масс.
Бие даасан молекул ба атомуудын масс маш бага байдаг. 1 г усанд 3.7 10 22 молекул агуулагддаг гэж бид тооцоолсон. Тиймээс нэг усны молекулын масс (H 2 0) нь дараахь хэмжээтэй тэнцүү байна.
Органик бодисын асар том молекулыг эс тооцвол бусад бодисын молекулууд ижил дарааллын масстай; жишээлбэл, уураг нь бие даасан атомуудын массаас хэдэн зуун мянга дахин их масстай байдаг. Гэсэн хэдий ч макроскопийн масштабаар (грамм ба килограмм) тэдний масс маш бага байна.
Харьцангуй молекул жин.
Молекулын масс нь маш бага тул тооцоололд үнэмлэхүй массын утгыг бус харьцангуй утгыг ашиглах нь тохиромжтой.
Олон улсын гэрээний дагуу бүх атом, молекулын массыг нүүрстөрөгчийн атомын масстай (атомын массын нүүрстөрөгчийн масштаб гэж нэрлэдэг) харьцуулдаг.
Бодисын харьцангуй молекул (эсвэл атомын) масс M r нь тухайн бодисын молекулын (эсвэл атомын) m 0 массыг нүүрстөрөгчийн атомын масстай харьцуулсан харьцаа юм.
Бүх химийн элементүүдийн харьцангуй атомын массыг нарийн хэмжсэн. Бодисын молекулыг бүрдүүлдэг элементүүдийн харьцангуй атомын массыг нэмснээр бид бодисын харьцангуй молекулын массыг тооцоолж болно. Жишээлбэл, нүүрстөрөгчийн давхар исэл CO 2-ийн харьцангуй молекул масс нь ойролцоогоор 44-тэй тэнцүү байна, учир нь нүүрстөрөгчийн харьцангуй атомын масс бараг 12, хүчилтөрөгч нь ойролцоогоор 16: 12 + 2 16 = 44 байна.
Атом, молекулыг нүүрстөрөгчийн атомын масстай харьцуулах аргыг 1961 онд баталсан. Ингэж сонгосон гол шалтгаан нь нүүрстөрөгч нь асар олон тооны өөр өөр химийн нэгдлүүдэд агуулагддагт оршино. Атомуудын харьцангуй масс бүхэл тоотой ойролцоо байхаар үржүүлэгчийг нэвтрүүлсэн.
Усны молийн масс:
Хэрэв шингэн дэх молекулууд нягт савлагдаж, тэдгээр нь тус бүр нь шоо дөрвөлжин хэмжээтэй багтах юм бол V 1хавиргатай г, Тэр .
Нэг молекулын эзэлхүүн: , энд: Vmнэг залбирал, Н А- Авогадрогийн дугаар.
Нэг моль шингэний эзэлхүүн: , энд: М-түүний молийн масс нь түүний нягт юм.
Молекулын диаметр:
Тооцоолоход бидэнд: 
Хөнгөн цагааны харьцангуй молекул жин Mr=27. Үндсэн молекулын шинж чанарыг тодорхойлох.
1. Хөнгөн цагааны молийн масс: M=Mr. 10 -3 M = 27 . 10 -3
Хэвийн нөхцөлд (p = 10 5 Па, Т = 273 К) гелийн молекулуудын концентраци (M = 4.10 -3 кг/моль), тэдгээрийн дундаж квадрат хурд, хийн нягтыг ол.Хэмжээ хоёр дахин ихэсвэл агаарын бөмбөлөг усны ямар гүнээс дээш хөвөх вэ? Бөмбөлөг дэх агаарын температур хэвээр байгаа эсэхийг бид мэдэхгүй. Хэрэв энэ нь ижил байвал өгсөх үйл явцыг тэгшитгэлээр тодорхойлно pV=const . Хэрэв энэ нь өөрчлөгдвөл тэгшитгэл болно.
pV/T=const
Температурын өөрчлөлтийг үл тоомсорлож байгаа бол том алдаа гаргасан эсэхээ үнэлье. Бидэнд хамгийн таагүй үр дүн гарсан гэж үзье, цаг агаар маш халуун, усан сангийн гадаргуу дээрх усны температур +25 0 С (298 К) хүрнэ. Доод хэсэгт температур нь +4 0 С (277 К) -аас доош байж болохгүй, учир нь энэ температур нь усны хамгийн их нягттай тохирч байна. Тиймээс температурын зөрүү 21К байна. Анхны температурын хувьд энэ утга нь %%, гадаргуу ба ёроолын хоорондох температурын зөрүү нь нэрлэсэн утгатай тэнцүү устай тулгарах магадлал багатай юм. Нэмж дурдахад бөмбөлөг нэлээд хурдан хөвж, өгсөх явцад бүрэн дулаарах цаг гарах магадлал багатай юм. Тиймээс бодит алдаа нь мэдэгдэхүйц бага байх бөгөөд бид бөмбөлөг дэх агаарын температурын өөрчлөлтийг бүрэн үл тоомсорлож, үйл явцыг тайлбарлахдаа Бойл-Мариотын хуулийг ашиглаж болно., p 1 V 1 =p 2 V 2 Хаана:х 1 - гүн дэх бөмбөлөг дэх агаарын даралт h (p 1 = p atm. + rgh), p 2 - гадаргуугийн ойролцоох бөмбөлөг дэх агаарын даралт.
 |
p 2 = p atm.
|
Дээрээс нь эргүүлсэн шилийг цөөрөмд дүрнэ. Шил ямар гүнд живж эхлэх вэ?
Агаарыг дээрээс нь доош нь эргүүлсэн шилэнд хийнэ. Асуудал нь шил нь зөвхөн тодорхой гүнд живж эхэлдэг болохыг харуулж байна. Хэрэв тодорхой эгзэгтэй гүнээс бага гүнд гарвал дээшээ хөвөх болно (шил нь босоо байрлалд хатуу байрлаж, хазайдаггүй гэж үзвэл).
Шилэн дээш хөвж, доошоо живэх түвшин нь шилэнд янз бүрийн талаас үйлчлэх хүчний тэгш байдалаар тодорхойлогддог.
Шилэн дээр босоо чиглэлд үйлчлэх хүч нь доошоо татах таталцлын хүч ба дээшээ хөвөх хүч юм.
Шилэн дээр үйлчлэх таталцлын хүч нь түүний масстай шууд пропорциональ байна.
Асуудлын агуулгаас харахад шил живэх тусам дээшээ чиглэсэн хүч буурдаг. Шингэн нь бараг шахагдах боломжгүй, гадаргуу болон зарим гүн дэх усны нягт ижил байдаг тул хөвөх хүчний бууралт нь зөвхөн шилжсэн шингэний хэмжээ багассанаас л тохиолдож болно.
Шилэн дэх агаар шахагдсанаас болж нүүлгэн шилжүүлсэн шингэний хэмжээ буурч, улмаар даралт ихэссэнтэй холбоотой байж болно. Хэрэв бид үр дүнгийн хэт өндөр нарийвчлалыг сонирхохгүй бол шилийг дүрэх үед температурын өөрчлөлтийг үл тоомсорлож болно. Холбогдох үндэслэлийг өмнөх жишээнд өгсөн болно.
Тогтмол температурт хийн даралт ба түүний эзэлхүүний хоорондын хамаарлыг Бойл-Мариотын хуулиар илэрхийлдэг.
Шингэний даралт үнэндээ гүн нэмэгдэх тусам бүх чиглэлд, тэр дундаа дээшээ жигд дамждаг.
Гидростатик даралт нь шингэний нягт ба түүний өндөртэй (шивэх гүн) шууд пропорциональ байна.
Шилний тэнцвэрийн төлөвийг тодорхойлсон тэгшитгэлийг анхны тэгшитгэл болгон бичиж, асуудлын дүн шинжилгээ хийх явцад олсон илэрхийлэлүүдийг дарааллаар нь орлуулж, үүссэн тэгшитгэлийг хүссэн гүнд нь шийдээд бид дараах дүгнэлтэд хүрэв. Тоон хариултыг авахын тулд бид усны нягтрал, атмосферийн даралт, массын шил, түүний хэмжээ, чөлөөт уналтын хурдатгалын утгыг мэдэх хэрэгтэй.
Гүйцэтгэсэн бүх аргументуудыг дараах байдлаар харуулж болно.
![]()
![]()

Асуудлын текстэнд өгөгдөл байхгүй тул бид өөрсдөө тохируулах болно.
Өгөгдсөн:
Усны нягт r=10 3 кг/м 3.
Агаар мандлын даралт 10 5 Па.
Шилний хэмжээ 200 мл = 2 00. 10 -3 л = 2. 10 -4 м 3.
Шилний масс 50 г = 5 байна. 10-2 кг.
Таталцлын хурдатгал g = 10 м/с 2 .
Тоон шийдэл:

|
Бөмбөлөг хөөрөх асуудлыг, живэх шилний асуудалтай адил статик асуудал гэж ангилж болно.
Бөмбөлөг нь эдгээр биед хэрэглэж, дээш доош чиглэсэн хүчний тэгш байдал алдагдмагц шил живэхтэй адилаар дээшилж эхэлнэ. Бөмбөлөг яг л шил шиг доош чиглэсэн таталцлын хүч, дээш чиглэсэн хөвөх хүчний нөлөөнд автдаг.
Хөвөх хүч нь бөмбөгийг тойрсон хүйтэн агаарын нягттай холбоотой. Энэ нягтыг Менделеев-Клапейроны тэгшитгэлээс олж болно.
Таталцлын хүч нь бөмбөгний масстай шууд пропорциональ байна. Бөмбөгний масс нь эргээд бүрхүүлийн масс ба доторх халуун агаарын массаас бүрдэнэ. Халуун агаарын массыг Менделеев-Клапейроны тэгшитгэлээс олж болно.
Схемийн хувьд үндэслэлийг дараах байдлаар харуулж болно.
![]()

Тэгшитгэлээс та хүссэн хэмжигдэхүүнийг илэрхийлж, асуудлын тоон шийдлийг олж авахад шаардлагатай хэмжигдэхүүний боломжит утгыг тооцоолж, эдгээр хэмжигдэхүүнийг үүссэн тэгшитгэлд орлуулж, хариултыг тоон хэлбэрээр олох боломжтой.
Хаалттай саванд 200 г гелий агуулагддаг. Хий нь нарийн төвөгтэй процессоор дамждаг. Түүний параметрүүдийн өөрчлөлтийг абсолют температураас эзлэхүүний хамаарлын графикт тусгасан болно.1. Хийн массыг SI-д илэрхийл.
2. Энэ хийн харьцангуй молекул масс хэд вэ?
3. Энэ хийн молийн масс хэд вэ (SI-д)?
4. Саванд агуулагдах бодисын хэмжээ хэд вэ?
5. Саванд хэдэн хийн молекул байдаг вэ?
6. Энэ хийн нэг молекулын масс хэд вэ?
7. 1-2, 2-3, 3-1 дэх хэсгүүдийн процессуудыг нэрлэнэ үү.
8. 1,2, 3, 4 цэгүүд дэх хийн эзэлхүүнийг мл, л, м 3-аар тодорхойлно.
9. Хийн температурыг 1,2, 3, 4 цэгүүдэд 0 С, К температурт тодорхойлно.
10. 1, 2, 3, 4-р цэгүүд дэх хийн даралтыг мм-ээр тодорхойлно. rt. Урлаг. , атм, Па.
11. Энэ үйл явцыг даралт ба үнэмлэхүй температурын график дээр дүрсэл.
12. Энэ үйл явцыг даралт ба эзэлхүүний харьцааны график дээр дүрсэл.
Шийдвэрлэх заавар:
1. Нөхцөл байдлыг харна уу.
2. Элементийн харьцангуй молекул жинг үелэх систем ашиглан тодорхойлно.
3. М=Ноён·10 -3 кг/моль.
7. х=const - изобар; В=const-isochoric; Т=const - изотерм.
8. 1 м 3 = 10 3 л; 1 л = 10 3 мл. 9. T=t+ 273. 10. 1 атм. = 10 5 Па = 760 мм м.у.б. Урлаг.
8-10. Та Менделеев-Клапейроны тэгшитгэл эсвэл Бойл-Мариотт, Гей-Люссак, Чарльз нарын хийн хуулиудыг ашиглаж болно.
Асуудлын хариултууд
| м = 0.2 кг | |||||||
| M r = 4 | |||||||
| M = 4 10 -3 кг / моль | |||||||
| n = 50 моль | |||||||
| N = 3 10 25 | |||||||
| м =6.7 10 -27 кг | |||||||
| 1 - 2 - изобар | |||||||
| 2 - 3 - изохорик | |||||||
| 3 - 1 - изотерм | |||||||
| № | мл | л | м 3 | ||||
| 2 10 5 | 0,2 | ||||||
| 7 10 5 | 0,7 | ||||||
| 7 10 5 | 0,7 | ||||||
| 4 10 5 | 0,4 | ||||||
| № | 0 С | TO | |||||
| № | ммМУБ | атм | Па | ||||
| 7.6 10 3 | 10 6 | ||||||
| 7.6 10 3 | 10 6 | ||||||
| 2.28 10 3 | 0.3 10 6 | ||||||
| 3.8 10 3 | 0.5 10 6 | ||||||
 |
 |
||||||

 ,
, ,
,






