Le phénomène de radioactivité a été découvert en 1896 par A. Becquerel, qui observa l'émission spontanée d'un rayonnement inconnu provenant de sels d'uranium. Bientôt, E. Rutherford et les Curie ont établi que lors de la désintégration radioactive, des noyaux He (particules α), des électrons (particules β) et un rayonnement électromagnétique dur (rayons γ) sont émis.
En 1934, la désintégration avec émission de positons (β + -désintégration) a été découverte, et en 1940, un nouveau type de radioactivité a été découvert - la fission spontanée des noyaux : un noyau fissile se désagrège en deux fragments de masse comparable avec l'émission simultanée de neutrons et γ -quantes. La radioactivité protonique des noyaux a été observée en 1982. Ainsi, il existe les types de désintégration radioactive suivants : désintégration α ; -pourriture; - pourriture; e-capture.
Radioactivité- la capacité de certains noyaux atomiques à se transformer spontanément (spontanément) en d'autres noyaux avec émission de particules.
Les noyaux atomiques sont constitués de protons et neutrons, qui ont un nom général - nucléons. Le nombre de protons dans le noyau détermine les propriétés chimiques de l'atome et est désigné Z(numéro de série de l'article). Nombre de nucléons dans le noyau s'appelle nombre de masse et désigne UN. Noyaux avec le même numéro de série et différents nombres de masse sont appelés isotopes. Tous les isotopes d’un élément chimique ont les mêmes propriétés chimiques, mais les propriétés physiques peuvent varier considérablement. Pour désigner les isotopes, utilisez le symbole d'un élément chimique à deux indices : A Z X. L'index inférieur est le numéro de série, l'index supérieur est le numéro de masse. Souvent, l'indice est omis car il est indiqué par le symbole de l'élément lui-même.
Par exemple, ils écrivent 14 C au lieu de 14 6 C.
La capacité d’un noyau à se désintégrer dépend de sa composition. Le même élément peut contenir des isotopes stables et radioactifs.
Par exemple, l’isotope du carbone 12 C est stable, mais l’isotope 14 C est radioactif.
La désintégration radioactive est un phénomène statistique. La capacité d’un isotope à se désintégrer est caractérisée par la constante de désintégration λ.
La constante de désintégration λ est la probabilité que le noyau d'un isotope donné se désintègre par unité de temps.
Notons le nombre N de noyaux de désintégration radioactive au temps t, dN 1 - le nombre de noyaux se désintégrant pendant le temps dt. Puisque le nombre de noyaux dans la matière est énorme, la loi des grands nombres est satisfaite. La probabilité de désintégration nucléaire en peu de temps dt est trouvée par la formule dP = λdt. La fréquence est égale à la probabilité : d N 1 / N = dP = λdt. d N 1 / N = λdt- une formule qui détermine le nombre de noyaux décomposés.
La solution de l'équation est : , - la formule est appelée loi de la désintégration radioactive : Le nombre de noyaux radioactifs diminue avec le temps selon une loi exponentielle.
Ici, N est le nombre de noyaux non décomposés au temps t ; N o - le nombre initial de noyaux non décomposés ; λ est la constante de désintégration radioactive.
En pratique, ce n’est pas la constante de décroissance qui est utilisée λ , et la quantité appelée demi-vie T.
La demi-vie (T) est le temps pendant lequel la moitié des noyaux radioactifs se désintègrent.
Loi de la désintégration radioactive à travers la période la demi-vie (T) a la forme :
![]()
La relation entre la demi-vie et la constante de désintégration est donnée par la formule : T = ln(2/λ) = 0,69/λ
La demi-vie peut être très longue ou très courte.
Pour évaluer le degré d'activité d'un isotope radioactif, une quantité appelée activité est utilisée.
Nombre d'activités des noyaux d'un médicament radioactif se désintégrant par unité de temps : A = dN désintégration /dt
L'unité SI d'activité est 1 becquerel (Bq) = 1 désintégration/s - l'activité d'un médicament dans lequel 1 désintégration se produit en 1 s. Une plus grande unité d’activité est 1 Rutherford (Rd) = Bq. Une unité d'activité hors système est souvent utilisée - le curie (Ci), égale à l'activité de 1 g de radium : 1 Ci = 3,7 Bq.
Au fil du temps, l'activité diminue selon la même loi exponentielle selon laquelle le radionucléide lui-même se désintègre :
![]() =
.
=
.
En pratique, la formule est utilisée pour calculer l'activité :
UNE = = λN = 0,693 N/T.
Si nous exprimons le nombre d'atomes en masse et en masse, alors la formule de calcul de l'activité prendra la forme : A = = 0,693 (μT)
où est le numéro d'Avogadro ? μ - masse molaire.
Lois de la désintégration radioactive des noyaux
La capacité des noyaux à se désintégrer spontanément en émettant des particules est appelée radioactivité. La désintégration radioactive est un processus statistique. Chaque noyau radioactif peut se désintégrer à tout moment et le phénomène n'est observé qu'en moyenne, dans le cas de la désintégration d'un nombre suffisamment grand de noyaux.
Constante de décroissanceλ est la probabilité de désintégration nucléaire par unité de temps.
S'il y a N noyaux radioactifs dans l'échantillon au temps t, alors le nombre de noyaux dN qui se sont désintégrés pendant le temps dt est proportionnel à N.
dN = -λNdt. (13.1)
En intégrant (1) on obtient la loi de la désintégration radioactive
N(t) = N 0 e -λt . (13.2)
N 0 est le nombre de noyaux radioactifs au temps t = 0.
Durée de vie moyenne τ –
. (13.3)
Demi-vie T 1/2 - temps pendant lequel le nombre initial de noyaux radioactifs diminuera de moitié
T 1/2 = ln2/λ=0,693/λ = τln2. (13.4)
Activité A - nombre moyen de noyaux se désintégrant par unité de temps
A(t) = λN(t). (13.5)
L'activité est mesurée en curies (Ci) et en becquerels (Bq)
1 Ki = 3,7*10 10 désintégrations/s, 1 Bq = 1 désintégration/s.
La désintégration du noyau d'origine 1 en noyau 2, suivie de sa désintégration en noyau 3, est décrite par un système d'équations différentielles
 (13.6)
(13.6)
où N 1 (t) et N 2 (t) sont le nombre de noyaux, et λ 1 et λ 2 sont les constantes de désintégration des noyaux 1 et 2, respectivement. La solution du système (6) avec les conditions initiales N 1 (0) = N 10 ; N 2 (0) = 0 sera
![]() , (13.7a)
, (13.7a)
![]() . (13.7b)
. (13.7b)

| Figure 13.1 |
Le nombre de cœurs 2 atteint la valeur maximale
Si λ 2< λ 1 (), суммарная активностьN 1 (t)λ 1 + N 2 (t)λ 2 будет монотонно уменьшаться.
Si λ 2 >λ 1 ()), l'activité totale augmente initialement en raison de l'accumulation de noyaux 2.
Si λ 2 >> λ 1 , à des temps suffisamment longs, la contribution de la deuxième exponentielle dans (7b) devient négligeable par rapport à la contribution de la première et aux activités de la seconde A 2 = λ 2 N 2 et des premiers isotopes A 1 = λ 1 N 1 sont presque égaux . À l’avenir, les activités des premier et deuxième isotopes évolueront de la même manière au fil du temps.
UNE 1 (t) = N 10 λ 1 = N 1 (t)λ 1 = A 2 (t) = N 2 (t)λ 2 .(13.8)
C'est-à-dire ce qu'on appelle équilibre séculaire, dans lequel le nombre de noyaux isotopiques dans la chaîne de désintégration est lié aux constantes de désintégration (demi-vies) par une relation simple.
 . (13.9)
. (13.9)
Par conséquent, à l'état naturel, tous les isotopes génétiquement apparentés dans les séries radioactives se trouvent généralement dans certains rapports quantitatifs, en fonction de leurs demi-vies.
Dans le cas général, lorsqu'il existe une chaîne de désintégrations 1→2→...n, le processus est décrit par un système d'équations différentielles
dN i /dt = -λ i N i +λ i-1 N i-1 .(13.10)
La solution du système (10) pour les activités avec conditions initiales N 1 (0) = N 10 ; N i (0) = 0 sera
![]() (13.12)
(13.12)
Le premier signifie que dans le produit qui est au dénominateur, le facteur avec i = m est omis.
Isotopes
ISOTOPES– des variétés du même élément chimique qui sont similaires dans leurs propriétés physico-chimiques, mais ont des masses atomiques différentes. Le nom « isotopes » a été proposé en 1912 par le radiochimiste anglais Frederick Soddy, qui l'a formé à partir de deux mots grecs : isos – identique et topos – lieu. Les isotopes occupent la même place dans la cellule du tableau périodique des éléments de Mendeleev.
Un atome de tout élément chimique est constitué d'un noyau chargé positivement et d'un nuage d'électrons chargés négativement qui l'entourent ( cm.Aussi NOYAU DE L'ATOME). La position d'un élément chimique dans le tableau périodique de Mendeleïev (son numéro atomique) est déterminée par la charge du noyau de ses atomes. Les isotopes sont donc appelés variétés d'un même élément chimique, dont les atomes ont la même charge nucléaire (et donc pratiquement les mêmes couches électroniques), mais diffèrent par leurs valeurs de masse nucléaire. Selon l'expression figurative de F. Soddy, les atomes d'isotopes sont les mêmes « à l'extérieur », mais différents « à l'intérieur ».
Le neutron a été découvert en 1932 – une particule sans charge, avec une masse proche de la masse du noyau d'un atome d'hydrogène - un proton , et un modèle proton-neutron du noyau a été créé. En conséquence, la science a établi la définition moderne finale du concept d'isotopes : les isotopes sont des substances dont les noyaux atomiques sont constitués du même nombre de protons et ne diffèrent que par le nombre de neutrons. le noyau . Chaque isotope est généralement désigné par un ensemble de symboles, où X est le symbole de l'élément chimique, Z est la charge du noyau atomique (le nombre de protons), A est le nombre de masse de l'isotope (le nombre total de nucléons - protons et neutrons dans le noyau, A = Z + N). Étant donné que la charge du noyau semble être uniquement associée au symbole de l’élément chimique, la simple notation A X est souvent utilisée pour l’abréviation.
Parmi tous les isotopes que nous connaissons, seuls les isotopes de l’hydrogène ont leur propre nom. Ainsi, les isotopes 2 H et 3 H sont appelés deutérium et tritium et sont désignés respectivement D et T (l'isotope 1 H est parfois appelé protium).
Présent dans la nature sous forme d'isotopes stables , et instable - radioactif, dont les noyaux des atomes sont sujets à une transformation spontanée en d'autres noyaux avec l'émission de diverses particules (ou processus de désintégration dite radioactive). Environ 270 isotopes stables sont maintenant connus, et les isotopes stables ne se trouvent que dans les éléments de numéro atomique Z Ј 83. Le nombre d'isotopes instables dépasse 2000, la grande majorité d'entre eux ont été obtenus artificiellement à la suite de diverses réactions nucléaires. Le nombre d'isotopes radioactifs de nombreux éléments est très important et peut dépasser deux douzaines. Le nombre d'isotopes stables est nettement inférieur. Certains éléments chimiques sont constitués d'un seul isotope stable (béryllium, fluor, sodium, aluminium, phosphore, manganèse, or et plusieurs autres éléments). Le plus grand nombre d'isotopes stables - 10 - a été trouvé dans l'étain, par exemple dans le fer il y en a 4 et dans le mercure - 7.
Découverte des isotopes, contexte historique. En 1808, le scientifique naturaliste anglais John Dalton a introduit pour la première fois la définition d'un élément chimique comme une substance constituée d'atomes du même type. En 1869, le chimiste D.I. Mendeleïev a découvert la loi périodique des éléments chimiques. L'une des difficultés rencontrées pour justifier le concept d'un élément en tant que substance occupant une certaine place dans une cellule du tableau périodique était les poids atomiques non entiers des éléments observés expérimentalement. En 1866, le physicien et chimiste anglais Sir William Crookes a avancé l'hypothèse selon laquelle chaque élément chimique naturel est un certain mélange de substances identiques dans leurs propriétés, mais ayant des masses atomiques différentes, mais à cette époque, une telle hypothèse n'existait pas encore. confirmation expérimentale et n'a donc pas duré longtemps remarqué.
Une étape importante vers la découverte des isotopes a été la découverte du phénomène de radioactivité et l'hypothèse de désintégration radioactive formulée par Ernst Rutherford et Frederick Soddy : la radioactivité n'est rien de plus que la désintégration d'un atome en une particule chargée et un atome d'un autre élément , différent dans ses propriétés chimiques de celui d'origine. De là est née l’idée de séries radioactives ou de familles radioactives. , au début se trouve le premier élément parent, qui est radioactif, et à la fin, le dernier élément stable. L'analyse des chaînes de transformations a montré qu'au cours de leur déroulement, les mêmes éléments radioactifs, ne différant que par leurs masses atomiques, peuvent apparaître dans une cellule du tableau périodique. En fait, cela signifiait l’introduction du concept d’isotopes.
Une confirmation indépendante de l'existence d'isotopes stables d'éléments chimiques a ensuite été obtenue dans les expériences de J. J. Thomson et Aston en 1912-1920 avec des faisceaux de particules chargées positivement (ou faisceaux de canaux). ) émanant du tube à décharge.
En 1919, Aston a conçu un instrument appelé spectrographe de masse (ou spectromètre de masse). . La source d'ions utilisait toujours un tube à décharge, mais Aston a trouvé un moyen par lequel la déviation successive d'un faisceau de particules dans des champs électriques et magnétiques conduisait à la focalisation de particules ayant le même rapport charge/masse (quelle que soit leur vitesse) à le même point sur l'écran. Avec Aston, un spectromètre de masse d'une conception légèrement différente a été créé dans les mêmes années par l'Américain Dempster. Grâce à l'utilisation et à l'amélioration ultérieures des spectromètres de masse grâce aux efforts de nombreux chercheurs, en 1935, un tableau presque complet des compositions isotopiques de tous les éléments chimiques connus à cette époque avait été dressé.
Méthodes de séparation isotopique. Pour étudier les propriétés des isotopes et notamment pour leur utilisation à des fins scientifiques et appliquées, il est nécessaire de les obtenir en quantités plus ou moins notables. Dans les spectromètres de masse conventionnels, une séparation presque complète des isotopes est obtenue, mais leur quantité est négligeable. Par conséquent, les efforts des scientifiques et des ingénieurs visaient à rechercher d’autres méthodes possibles de séparation des isotopes. Tout d'abord, les méthodes physico-chimiques de séparation ont été maîtrisées, basées sur les différences dans les propriétés des isotopes d'un même élément telles que les taux d'évaporation, les constantes d'équilibre, les vitesses de réactions chimiques, etc. Les plus efficaces d'entre elles étaient les méthodes de rectification et d'échange isotopique, largement utilisées dans la production industrielle d'isotopes d'éléments légers : hydrogène, lithium, bore, carbone, oxygène et azote.
Un autre groupe de méthodes est constitué des méthodes dites de cinétique moléculaire : diffusion gazeuse, diffusion thermique, diffusion massique (diffusion dans un flux de vapeur), centrifugation. Les méthodes de diffusion gazeuse, basées sur différents taux de diffusion de composants isotopiques dans des milieux poreux hautement dispersés, ont été utilisées pendant la Seconde Guerre mondiale pour organiser la production industrielle de séparation des isotopes de l'uranium aux États-Unis dans le cadre du projet Manhattan visant à créer la bombe atomique. Pour obtenir les quantités nécessaires d'uranium enrichi à 90 % avec l'isotope léger 235 U, principal composant « combustible » de la bombe atomique, des usines ont été construites, occupant une superficie d'environ quatre mille hectares. Plus de 2 milliards de dollars ont été alloués à la création d'un centre atomique doté d'usines de production d'uranium enrichi. Après la guerre, des usines de production d'uranium enrichi à des fins militaires, également basées sur la méthode de séparation par diffusion, ont été développées. construit en URSS. Ces dernières années, cette méthode a cédé la place à la méthode de centrifugation, plus efficace et moins coûteuse. Dans cette méthode, l'effet de séparation d'un mélange isotopique est obtenu grâce aux différents effets des forces centrifuges sur les composants du mélange isotopique remplissant le rotor de la centrifugeuse, qui est un cylindre à paroi mince limité en haut et en bas, tournant à une vitesse variable. très grande vitesse dans une enceinte à vide. Des centaines de milliers de centrifugeuses connectées en cascade, dont le rotor de chacune fait plus de mille tours par seconde, sont actuellement utilisées dans les usines de séparation modernes en Russie et dans d'autres pays développés du monde. Les centrifugeuses servent non seulement à produire l'uranium enrichi nécessaire à l'alimentation des réacteurs nucléaires des centrales nucléaires, mais également à produire les isotopes d'une trentaine d'éléments chimiques de la partie médiane du tableau périodique. Des unités de séparation électromagnétique dotées de puissantes sources d'ions sont également utilisées pour séparer divers isotopes ; ces dernières années, les méthodes de séparation par laser se sont également généralisées.
Application des isotopes. Divers isotopes d'éléments chimiques sont largement utilisés dans la recherche scientifique, dans divers domaines de l'industrie et de l'agriculture, dans l'énergie nucléaire, la biologie et la médecine modernes, dans les études environnementales et dans d'autres domaines. Dans la recherche scientifique (par exemple, en analyse chimique), de petites quantités d'isotopes rares de divers éléments sont généralement nécessaires, calculées en grammes et même en milligrammes par an. Dans le même temps, pour un certain nombre d'isotopes largement utilisés dans l'énergie nucléaire, la médecine et d'autres industries, les besoins en production peuvent atteindre plusieurs kilogrammes, voire plusieurs tonnes. Ainsi, en raison de l'utilisation d'eau lourde D 2 O dans les réacteurs nucléaires, sa production mondiale au début des années 90 du siècle dernier était d'environ 5 000 tonnes par an. L'isotope de l'hydrogène deutérium, qui fait partie de l'eau lourde, dont la concentration dans le mélange naturel d'hydrogène n'est que de 0,015 %, avec le tritium, deviendra à l'avenir, selon les scientifiques, le principal composant du combustible de l'énergie thermonucléaire. réacteurs fonctionnant sur la base de réactions de fusion nucléaire. Dans ce cas, le besoin de production d’isotopes de l’hydrogène sera énorme.
Dans la recherche scientifique, les isotopes stables et radioactifs sont largement utilisés comme indicateurs isotopiques (étiquettes) dans l'étude d'une grande variété de processus se produisant dans la nature.
En agriculture, les isotopes (atomes « marqués ») sont utilisés, par exemple, pour étudier les processus de photosynthèse, la digestibilité des engrais et pour déterminer l’efficacité de l’utilisation par les plantes de l’azote, du phosphore, du potassium, des oligo-éléments et d’autres substances.
Les technologies isotopiques sont largement utilisées en médecine. Ainsi, aux États-Unis, selon les statistiques, plus de 36 000 interventions médicales et environ 100 millions de tests de laboratoire utilisant des isotopes sont effectués chaque jour. Les procédures les plus courantes impliquent la tomodensitométrie. L'isotope du carbone C13, enrichi à 99 % (teneur naturelle environ 1 %), est activement utilisé dans ce que l'on appelle le « contrôle respiratoire diagnostique ». L'essence du test est très simple. L'isotope enrichi est introduit dans l'alimentation du patient et, après avoir participé au processus métabolique dans divers organes du corps, est libéré sous forme de dioxyde de carbone CO 2 expiré par le patient, qui est collecté et analysé à l'aide d'un spectromètre. Les différences dans les vitesses des processus associés à la libération de différentes quantités de dioxyde de carbone, marqué avec l’isotope C 13, permettent de juger de l’état des différents organes du patient. Aux États-Unis, le nombre de patients qui subiront ce test est estimé à 5 millions par an. Aujourd’hui, les méthodes de séparation laser sont utilisées pour produire à l’échelle industrielle un isotope C13 hautement enrichi.
Informations connexes.
Cours 2. La loi fondamentale de la désintégration radioactive et de l'activité des radionucléides
Le taux de désintégration des radionucléides est différent : certains se désintègrent plus rapidement, d'autres plus lentement. Un indicateur du taux de désintégration radioactive est constante de désintégration radioactive, λ [seconde-1], qui caractérise la probabilité de désintégration d'un atome en une seconde. Pour chaque radionucléide, la constante de désintégration a sa propre valeur ; plus elle est grande, plus les noyaux de la substance se désintègrent rapidement.
Le nombre de désintégrations enregistrées dans un échantillon radioactif par unité de temps est appelé activité (un ), ou la radioactivité de l'échantillon. La valeur d'activité est directement proportionnelle au nombre d'atomes N substance radioactive :
un =λ· N , (3.2.1)
Où λ – constante de désintégration radioactive, [sec-1].
Actuellement, selon l'actuel Système international d'unités SI, l'unité de mesure de la radioactivité est becquerel [BK]. Cette unité tire son nom du scientifique français Henri Becquerel, qui a découvert le phénomène de radioactivité naturelle de l'uranium en 1856. Un becquerel équivaut à une désintégration par seconde 1 BK = 1 .
Cependant, l'unité d'activité non système est encore souvent utilisée – curie [Ki], introduit par les Curie comme mesure du taux de désintégration d'un gramme de radium (dans lequel ~3,7 1010 désintégrations se produisent par seconde), donc
1 Ki= 3,7·1010 BK.
Cet appareil est pratique pour évaluer l'activité de grandes quantités de radionucléides.
La diminution de la concentration des radionucléides au fil du temps suite à la désintégration obéit à une relation exponentielle :
 , (3.2.2)
, (3.2.2)
Où N t– le nombre d'atomes d'un élément radioactif restant après un certain temps t après le début de l'observation ; N 0 – nombre d’atomes à l’instant initial ( t =0 ); λ – constante de désintégration radioactive.
La dépendance décrite est appelée loi fondamentale de la désintégration radioactive .
Le temps pendant lequel la moitié de la quantité totale de radionucléides se désintègre est appelé demi-vie T½ . Après une demi-vie, sur 100 atomes de radionucléides, il n'en reste que 50 (Fig. 2.1). Au cours de la période similaire suivante, il ne reste plus que 25 de ces 50 atomes, et ainsi de suite.
La relation entre la demi-vie et la constante de désintégration est dérivée de l'équation de la loi fondamentale de la désintégration radioactive :
à t=T½ Et
on a https://pandia.ru/text/80/150/images/image006_47.gif" width="67" height="41 src="> Þ ;
https://pandia.ru/text/80/150/images/image009_37.gif" width="76" height="21"> ;
c'est-à-dire.gif" width="81" height="41 src=">.
Par conséquent, la loi de la désintégration radioactive peut s’écrire comme suit :
https://pandia.ru/text/80/150/images/image013_21.gif" width="89" height="39 src=">, (3.2.4)
Où à – activité du médicament au fil du temps t ; un0 – l'activité du médicament au moment initial de l'observation.
Il est souvent nécessaire de déterminer l’activité d’une quantité donnée d’une substance radioactive.
N'oubliez pas que l'unité de quantité d'une substance est la taupe. Une mole est la quantité d'une substance contenant le même nombre d'atomes que celui contenu dans 0,012 kg = 12 g de l'isotope du carbone 12C.
Une mole de n'importe quelle substance contient le nombre d'Avogadro N / A. atomes :
N / A. = 6,02·1023 atomes.
Pour les substances simples (éléments), la masse d'une mole correspond numériquement à la masse atomique UN élément
1mole = UN G.
Par exemple : Pour le magnésium : 1 mol 24Mg = 24 g.
Pour le 226Ra : 1 mol de 226Ra = 226 g, etc.
Compte tenu de ce qui a été dit dans m les grammes de la substance seront N atomes :
https://pandia.ru/text/80/150/images/image015_20.gif" width="156" height="43 src="> (3.2.6)
Exemple : Calculons l'activité de 1 gramme de 226Ra, ce qui λ = 1,38·10-11 sec-1.
un= 1,38·10-11·1/226·6,02·1023 = 3,66·1010 Bq.
Si un élément radioactif fait partie d'un composé chimique, il est nécessaire de prendre en compte sa formule lors de la détermination de l'activité du médicament. Compte tenu de la composition de la substance, la fraction massique est déterminée χ radionucléide dans une substance, qui est déterminé par le rapport :
https://pandia.ru/text/80/150/images/image017_17.gif" width="118" height="41 src=">
Exemple de solution de problème
Condition:
Activité A0 l'élément radioactif 32P par jour d'observation est de 1000 BK. Déterminez l'activité et le nombre d'atomes de cet élément après une semaine. Demi-vie T½ 32P = 14,3 jours.
Solution:
a) Retrouvons l'activité du phosphore-32 après 7 jours :
https://pandia.ru/text/80/150/images/image019_16.gif" width="57" height="41 src=">
Répondre: après une semaine, l'activité du médicament 32P sera de 712 Bk, et le nombre d'atomes de l'isotope radioactif 32P est de 127,14·106 atomes.
Questions de contrôle
1) Quelle est l’activité d’un radionucléide ?
2) Nommez les unités de radioactivité et la relation entre elles.
3) Quelle est la constante de désintégration radioactive ?
4) Définir la loi fondamentale de la désintégration radioactive.
5) Qu’est-ce que la demi-vie ?
6) Quelle est la relation entre l'activité et la masse d'un radionucléide ? Écrivez la formule.
Tâches
1. Calculer l'activité 1 g 226Ra. T½ = 1602 ans.
2. Calculer l'activité 1 g 60Co. T½ = 5,3 ans.
3. Une coque de char M-47 contient 4,3 kg 238U. Т½ = 2,5·109 ans. Déterminez l’activité du projectile.
4. Calculer l'activité du 137Cs après 10 ans, si au moment initial de l'observation elle est égale à 1000 BK. T½ = 30 ans.
5. Calculez l'activité du 90Sr il y a un an si elle est actuellement égale à 500 BK. T½ = 29 ans.
6. Quel genre d’activité vais-je créer ? kg radio-isotope 131I, T½ = 8,1 jours ?
7. À l'aide des données de référence, déterminez l'activité 1 g 238U. Т½ = 2,5·109 ans.
À l'aide des données de référence, déterminez l'activité 1 g 232Th, Т½ = 1,4·1010 ans.
8. Calculez l'activité du composé : 239Pu316O8.
9. Calculer la masse d'un radionucléide d'activité 1 Ki:
9.1. 131I, T1/2=8,1 jours ;
9.2. 90Sr, T1/2=29 ans ;
9.3. 137Cs, Т1/2=30 ans ;
9.4. 239Pu, Т1/2=2,4·104 ans.
10. Déterminer la masse 1 mCi isotope radioactif du carbone 14C, T½ = 5560 ans.
11. Il est nécessaire de préparer une préparation radioactive de phosphore 32P. Au bout de combien de temps restera-t-il 3 % du médicament ? Т½ = 14,29 jours.
12. Le mélange naturel de potassium contient 0,012 % de l'isotope radioactif 40K.
1) Déterminer la masse de potassium naturel, qui contient 1 Ki 40K. Т½ = 1,39·109 ans = 4,4·1018 sec.
2) Calculez la radioactivité du sol en utilisant 40K, si l'on sait que la teneur en potassium dans l'échantillon de sol est de 14 kg/t.
13. Combien de demi-vies sont nécessaires pour que l'activité initiale d'un radio-isotope diminue à 0,001 % ?
14. Pour déterminer l'effet du 238U sur les plantes, les graines ont été trempées dans 100 ml solution UO2(NO3)2 · 6H2O, dans laquelle la masse de sel radioactif était de 6 g. Déterminer l'activité et l'activité spécifique du 238U en solution. Т½ = 4,5·109 années.
15. Identifiez l’activité 1 grammes 232Th, Т½ = 1,4·1010 ans.
16. Déterminer la masse 1 Ki 137Cs, Т1/2=30 ans.
17. Le rapport entre la teneur en isotopes stables et radioactifs du potassium dans la nature est une valeur constante. Le contenu 40K est de 0,01%. Calculez la radioactivité du sol en utilisant 40K, si l'on sait que la teneur en potassium dans l'échantillon de sol est de 14 kg/t.
18. La radioactivité lithogène de l'environnement se forme principalement en raison de trois principaux radionucléides naturels : 40K, 238U, 232Th. La proportion d'isotopes radioactifs dans la somme naturelle des isotopes est respectivement de 0,01, 99,3 et ~100. Calculer la radioactivité 1 T sol, si l'on sait que la teneur relative en potassium dans l'échantillon de sol est de 13 600 g/t, uranium – 1·10-4 g/t, thorium – 6·10-4 g/t.
19. 23 200 ont été trouvés dans les coquilles de mollusques bivalves Bq/kg 90Sr. Déterminer l'activité des échantillons après 10, 30, 50, 100 ans.
20. La principale pollution des réservoirs fermés de la zone de Tchernobyl a eu lieu au cours de la première année après l'accident de la centrale nucléaire. Dans les sédiments du fond du lac. Azbuchin a découvert en 1999 du 137Cs avec une activité spécifique de 1,1,10 Bq/m2. Déterminer la concentration (activité) de 137Cs tombé par m2 de sédiments de fond en 1986-1987. (Il y a 12 ans).
21. 241Am (T½ = 4,32·102 ans) est formé à partir de 241Pu (T½ = 14,4 ans) et est un migrateur géochimique actif. À l'aide de matériaux de référence, calculez avec une précision de 1 % la diminution de l'activité du plutonium-241 au fil du temps, année au cours de laquelle après la catastrophe de Tchernobyl la formation de 241Am dans l'environnement sera maximale.
22. Calculez l'activité du 241Am dans les émissions du réacteur de Tchernobyl en avril
2015, étant entendu qu'en avril 1986 l'activité de 241Am était de 3,82 1012 Bk,Т½ = 4,32·102 ans.
23. 390 ont été trouvés dans des échantillons de sol nCi/kg 137Cs. Calculez l'activité des échantillons après 10, 30, 50, 100 ans.
24. Concentration moyenne de pollution du lit du lac. Glubokoye, situé dans la zone d'exclusion de Tchernobyl, est de 6,3 104 BK 241Am et 7,4·104 238+239+240Pu pour 1 m2. Calculez en quelle année ces données ont été obtenues.
§ 15-g. Loi de la désintégration radioactive
L'avènement des compteurs à scintillation « manuels » et, principalement, des compteurs Geiger-Muller, qui ont permis d'automatiser le comptage des particules (voir § 15), a conduit les physiciens à une conclusion importante. Tout isotope radioactif se caractérise par un affaiblissement spontané de la radioactivité, exprimé par une diminution du nombre de noyaux en décomposition par unité de temps.
Le tracé de graphiques de l'activité de divers isotopes radioactifs a conduit les scientifiques à la même dépendance, exprimée fonction exponentielle(voir le tableau). L'axe horizontal montre le temps d'observation et l'axe vertical montre le nombre de noyaux non décomposés. La courbure des lignes pouvait être différente, mais la fonction elle-même, qui exprimait les dépendances décrites par les graphiques, restait la même :
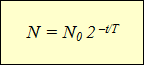
Cette formule exprime loi de la désintégration radioactive : le nombre de noyaux qui ne se sont pas désintégrés au fil du temps est déterminé comme le produit du nombre initial de noyaux par 2 par la puissance égale au rapport du temps d'observation à la demi-vie, pris avec un signe négatif.
Comme il s'est avéré au cours des expériences, diverses substances radioactives peuvent être caractérisées par différents demi-vie– le temps pendant lequel le nombre de noyaux encore intacts est divisé par deux(Voir le tableau).
Demi-vies de certains isotopes de certains éléments chimiques. Les valeurs sont données pour les isotopes naturels et artificiels.
| Iode-129 | 15 Ma | Carbone-14 | 5,7 mille ans | |
| Iode-131 | 8 jours | Uran-235 | 0,7 Ga | |
| Iode-135 | 7 heures | Uran-238 | 4,5 milliards d'années |
La demi-vie est une grandeur physique généralement acceptée caractérisant le taux de désintégration radioactive. De nombreuses expériences montrent que même avec une très longue observation d'une substance radioactive, sa demi-vie est constante, c'est-à-dire qu'elle ne dépend pas du nombre d'atomes déjà désintégrés. Par conséquent, la loi de la désintégration radioactive a trouvé une application dans la méthode de détermination de l'âge des découvertes archéologiques et géologiques.
Méthode de datation au radiocarbone. Le carbone est un élément chimique très courant sur Terre, qui comprend les isotopes stables carbone-12, carbone-13 et l'isotope radioactif carbone-14, qui a une demi-vie de 5,7 mille ans (voir tableau). Les organismes vivants, consommant de la nourriture, accumulent les trois isotopes dans leurs tissus. Après la fin de la vie de l'organisme, l'apport de carbone s'arrête et, avec le temps, sa teneur diminue naturellement, en raison de la désintégration radioactive. Étant donné que seul le carbone 14 se désintègre, le rapport des isotopes du carbone dans les restes fossiles des organismes vivants change au fil des siècles et des millénaires. En mesurant cette « proportion de carbone », on peut juger de l’âge d’une découverte archéologique.
La méthode d'analyse du radiocarbone est applicable aux roches géologiques, ainsi qu'aux objets humains fossiles, mais à condition que le rapport des isotopes dans l'échantillon n'ait pas été perturbé au cours de son existence, par exemple par un incendie ou l'influence d'une source forte. de rayonnement. Le fait de ne pas avoir pris en compte ces raisons immédiatement après la découverte de cette méthode a conduit à des erreurs pendant plusieurs siècles et millénaires. Aujourd’hui, des « échelles d’étalonnage séculaires » sont utilisées pour l’isotope du carbone 14, en fonction de sa répartition dans les arbres à longue durée de vie (par exemple, le séquoia millénaire américain). Leur âge peut être calculé très précisément - par les cernes annuels du bois.
La limite d’application de la méthode de datation au radiocarbone au début du XXIe siècle était de 60 000 ans. Pour mesurer l'âge d'échantillons plus anciens, comme des roches ou des météorites, une méthode similaire est utilisée, mais au lieu du carbone, on examine les isotopes de l'uranium ou d'autres éléments, selon l'origine de l'échantillon étudié.
Javascript est désactivé sur votre navigateur.Pour effectuer des calculs, vous devez activer les contrôles ActiveX !
>> La loi de la désintégration radioactive. Demi-vie
§ 101 LOI DE LA DÉCROISSANCE RADIOACTIVE. DEMI-VIE
La désintégration radioactive obéit à une loi statistique. Rutherford, étudiant les transformations des substances radioactives, a établi expérimentalement que leur activité diminue avec le temps. Cela a été discuté dans le paragraphe précédent. Ainsi, l'activité du radon diminue de 2 fois après 1 minute. L'activité d'éléments comme l'uranium, le thorium et le radium diminue également avec le temps, mais beaucoup plus lentement. Pour chaque substance radioactive, il existe un certain intervalle de temps pendant lequel l'activité diminue de 2 fois. Cet intervalle est appelé demi-vie. La demi-vie T est la durée pendant laquelle la moitié du nombre initial d'atomes radioactifs se désintègre.
La diminution de l'activité, c'est-à-dire le nombre de désintégrations par seconde, en fonction du temps pour l'un des médicaments radioactifs, est illustrée à la figure 13.8. La demi-vie de cette substance est de 5 jours.
Dérivons maintenant la forme mathématique de la loi de la désintégration radioactive. Soit le nombre d'atomes radioactifs à l'instant initial (t= 0) être égal à N 0. Ensuite, après la demi-vie, ce nombre sera égal à
Après un autre intervalle de temps similaire, ce nombre deviendra égal à :









