ARENES
Hidrokarburet aromatike (arene) – hidrokarburet ciklike, të bashkuara nga koncepti i aromatikitetit, i cili përcakton karakteristikat e përbashkëta në strukturë dhe vetitë kimike.
Klasifikimi
Në bazë të numrit të unazave të benzenit në molekulë, arenet ndahen në te:
mononukleare
me shumë bërthama

Nomenklatura dhe izomeria
Paraardhësi strukturor i hidrokarbureve të serisë së benzenit është benzen C 6 H 6 prej nga rrjedhin emrat sistematikë të homologëve.
Për komponimet monociklike, ruhen emrat e mëposhtëm jo-sistematik (të parëndësishëm):

Pozicioni i zëvendësuesve tregohet në numrat më të vegjël (drejtimi i numërimit nuk ka rëndësi),
|
|
|
dhe për komponimet e dy-zëvendësuara mund të përdorni shënimin orto, meta, çift.
|
|
|
|
Nëse ka tre zëvendësues në unazë, ata duhet të marrin numrat më të ulët, d.m.th. rreshti “1,2,4” ka avantazh ndaj “1,3,4”.


1,2-dimetil-4-etilbenzen (emri i saktë) 3,4-dimetil-1-etilbenzen (emri i pasaktë)
Izomerizmi i areneve të monozëvendësuara është për shkak të strukturës së skeletit të karbonit të zëvendësuesit në homologët e benzenit di- dhe polizëvendësues, shtohet izomeria shtesë, e shkaktuar nga rregullimi i ndryshëm i zëvendësuesve në bërthamë.
Izomerizmi i hidrokarbureve aromatike me përbërje C 9 H 12:
|
|
|
|
|
Vetitë fizike
Pikat e vlimit dhe të shkrirjes së areneve janë më të larta se ato të alkaneve, alkeneve, alkineve, ato janë pak polare, të patretshme në ujë dhe shumë të tretshme në tretës organikë jopolarë. Arenat janë lëngje ose lëndë të ngurta që kanë erë specifike. Benzenet dhe shumë arene të kondensuar janë toksike, disa prej tyre shfaqin veti kancerogjene. Produktet e ndërmjetme të oksidimit të areneve të kondensuar në trup janë epoksidet, të cilat ose vetë shkaktojnë drejtpërdrejt kancer ose janë pararendës të kancerogjenëve.
Marrja e arenave
Shumë hidrokarbure aromatike kanë një rëndësi të madhe praktike dhe prodhohen në një shkallë të madhe industriale. Një sërë metodash industriale bazohen në përpunimin e qymyrit dhe naftës.
Vaji përbëhet kryesisht nga hidrokarbure alifatike dhe aliciklike për shndërrimin e hidrokarbureve alifatike ose aciklike në aromatike, janë zhvilluar metoda për aromatizimin e vajit, baza kimike e të cilave është zhvilluar nga N.D. Zelinsky, B.A. Kazanskit.
1. Ciklizim dhe dehidrogjenim:
2. Hidrodesmetilimi:

3. Homologët e benzenit përgatiten me alkilim ose acilim të ndjekur nga reduktimi i grupit karbonil.
a) Alkilimi Friedel-Crafts:

b) Acilimi Friedel-Crafts:

4. Përgatitja e bifenilit me reaksionin Wurtz-Fitting:
5. Përgatitja e difenilmetanit nga reaksioni Friedel-Crafts:
Struktura dhe vetitë kimike.
Kriteret e aromatizimit:
Bazuar në llogaritjet teorike dhe studimet eksperimentale të sistemeve të konjuguara ciklike, u zbulua se një përbërës është aromatik nëse ka:
- Σ-skeleti ciklik i sheshtë;
- Një sistem p-elektronish i mbyllur i konjuguar, që mbulon të gjithë atomet e unazës dhe përmban 4n + 2, ku n = 0, 1, 2, 3, etj. Ky formulim njihet si Rregulli i Hükelit.

Kriteret e aromatikitetit lejojnë që të dallohen sistemet aromatike të konjuguara nga të gjithë të tjerët. Benzeni përmban një sekset elektronesh π dhe ndjek rregullin e Hückel-it në n = 1.
Çfarë jep aromatikiteti:
Pavarësisht shkallës së lartë të pangopurit, komponimet aromatike janë rezistente ndaj agjentëve oksidues dhe temperaturës, dhe ato janë më të prirura për t'iu nënshtruar reaksioneve të zëvendësimit sesa reaksioneve të shtimit. Këto komponime kanë një qëndrueshmëri termodinamike të rritur, gjë që sigurohet nga energjia e lartë e konjugimit të sistemit të unazave aromatike (150 kJ/mol, prandaj, arenat preferohen të hyjnë në reaksione zëvendësimi, si rezultat i të cilave ato ruajnë aromatizmin).
Mekanizmi i reaksioneve të zëvendësimit elektrofilik në unazën aromatike:
Dendësia e elektroneve të sistemit π-konjuguar të unazës së benzenit është një objektiv i përshtatshëm për sulm nga reagentët elektrofilë.
Në mënyrë tipike, reagentët elektrofilë gjenerohen gjatë një reaksioni duke përdorur katalizatorë dhe kushte të përshtatshme.
E – Y → E δ + – Y δ - → E + + Y - Formimi i një kompleksi π. Sulmi fillestar nga elektrofili i resë π-elektronike të unazës çon në koordinimin e reagjentit me sistemin π dhe formimin e një kompleksi të tipit dhurues-pranues i quajturπ-kompleks.

Sistemi i aromave nuk prishet: Formimi i kompleksit σ. Faza kufizuese, në të cilën elektrofili formon një lidhje kovalente me një atom karboni për shkak të dy elektroneve të sistemit π të unazës, e cila shoqërohet me kalimin e këtij atomi karboni nga sp 2 - V sp 3 -

Stabilizimi i kompleksit σ. Ajo kryhet me abstraksion të një protoni nga kompleksi σ duke përdorur një bazë. Në këtë rast, për shkak të dy elektroneve të lidhjes kovalente të thyer C–H, sistemi π i mbyllur i unazës rikthehet, d.m.th. molekula kthehet në gjendjen aromatike:

Efekti i zëvendësuesve në reaktivitetin dhe orientimin e zëvendësimit elektrofilik
Zëvendësuesit në unazën e benzenit prishin uniformitetin e shpërndarjes π- reja elektronike të unazës dhe në këtë mënyrë ndikojnë në reaktivitetin e unazës.
- Zëvendësuesit dhurues të elektroneve (D) rrisin densitetin elektronik të unazës dhe rrisin shpejtësinë e zëvendësimit elektrofilik quhen zëvendësues të tillë; duke aktivizuar.
- Zëvendësuesit që tërheqin elektron (A) zvogëlojnë densitetin elektronik të unazës dhe zvogëlojnë shpejtësinë e reaksionit, i quajtur dekontaminuese.
Hidrokarburet aromatike– komponimet e karbonit dhe hidrogjenit, molekula e të cilave përmban një unazë benzeni. Përfaqësuesit më të rëndësishëm të hidrokarbureve aromatike janë benzeni dhe homologët e tij - produkte të zëvendësimit të një ose më shumë atomeve të hidrogjenit në një molekulë benzeni me mbetje hidrokarbure.
Struktura e molekulës së benzenit
Përbërja e parë aromatike, benzeni, u zbulua në 1825 nga M. Faraday. Formula e tij molekulare u krijua - C 6 H 6. Nëse e krahasojmë përbërjen e tij me përbërjen e një hidrokarburi të ngopur që përmban të njëjtin numër atomesh karboni - heksan (C 6 H 14), atëherë mund të shohim se benzeni përmban tetë atome më pak hidrogjen . Siç dihet, shfaqja e lidhjeve dhe cikleve të shumta çon në një ulje të numrit të atomeve të hidrogjenit në një molekulë hidrokarbure. Në 1865, F. Kekule propozoi formulën e tij strukturore si cikloheksantrien - 1, 3, 5.

Kështu, molekula korrespondon Formula e Kekules, përmban lidhje të dyfishta, prandaj, benzeni duhet të jetë i pangopur, d.m.th., duhet t'i nënshtrohet lehtësisht reaksioneve të shtimit: hidrogjenizimi, brominimi, hidratimi, etj.
Megjithatë, të dhënat nga eksperimentet e shumta kanë treguar se benzeni hyn në reaksione shtesë vetëm në kushte të vështira (në temperatura të larta dhe ndriçim) dhe është rezistent ndaj oksidimit. Reaksionet më karakteristike për të janë reaksionet e zëvendësimit, prandaj, benzeni është më afër hidrokarbureve margjinale.
Duke u përpjekur të shpjegojnë këto mospërputhje, shumë shkencëtarë kanë propozuar opsione të ndryshme për strukturën e benzenit. Struktura e molekulës së benzenit u konfirmua përfundimisht nga reagimi i formimit të saj nga acetilen. Në realitet, lidhjet karbon-karbon në benzen janë ekuivalente dhe vetitë e tyre nuk janë të ngjashme me ato të lidhjeve të vetme ose të dyfishta.
Aktualisht, benzeni shënohet ose me formulën Kekule ose me një gjashtëkëndësh në të cilin përshkruhet një rreth.
![]()
Pra, çfarë është e veçantë për strukturën e benzenit? Bazuar në të dhënat dhe llogaritjet e studiuesve, u arrit në përfundimin se të gjashtë atomet e karbonit janë në një gjendje sp 2 -hibridizimi dhe shtrirja në të njëjtin rrafsh. I pahibridizuar fq-orbitalet e atomeve të karbonit që përbëjnë lidhjet dyfishe (formula Kekule) janë pingul me rrafshin e unazës dhe paralele me njëra-tjetrën.
Ata mbivendosen njëra-tjetrën, duke formuar një sistem të vetëm π. Kështu, sistemi i lidhjeve të dyfishta të alternuara i përshkruar në formulën e Kekule është një sistem ciklik i lidhjeve të konjuguara, të mbivendosura. Ky sistem përbëhet nga dy rajone toroidale (si donut) me densitet elektronik të shtrirë në të dyja anët e unazës së benzenit. Kështu, është më logjike të përshkruhet benzeni si një gjashtëkëndësh i rregullt me një rreth në qendër (π-sistemi) sesa si ciklohekzatrien-1,3,5. 
Shkencëtari amerikan L. Pauling propozoi të përfaqësonte benzenin në formën e dy strukturave kufitare që ndryshojnë në shpërndarjen e densitetit të elektroneve dhe vazhdimisht shndërrohen në njëra-tjetrën, d.m.th., e konsiderojnë atë një përbërje të ndërmjetme, "mesatare" të dy strukturave.
Matjet e gjatësisë së lidhjes konfirmojnë këto supozime. U zbulua se të gjitha lidhjet C-C në benzen kanë të njëjtën gjatësi (0.139 nm). Ato janë pak më të shkurtra se lidhjet e vetme C-C (0,154 nm) dhe më të gjata se lidhjet e dyfishta (0,132 nm).
Ekzistojnë gjithashtu komponime, molekulat e të cilave përmbajnë disa struktura ciklike.

Izomerizmi dhe nomenklatura
Homologët e benzenit karakterizohen nga izomeria e pozicionit të disa zëvendësuesve. Homologu më i thjeshtë i benzenit - tolueni (metilbenzen) - nuk ka izomerë të tillë; homologu i mëposhtëm paraqitet si katër izomerë:

Baza e emrit të një hidrokarburi aromatik me zëvendësues të vegjël është fjala benzenit. Atomet në unazën aromatike numërohen nga zëvendësuesi më i lartë tek ai më i ulët:

Sipas nomenklaturës së vjetër quhen pozicionet 2 dhe 6 ortopozicionet, 4 - çift -, dhe 3 dhe 5 - meta-dispozitat.
Vetitë fizike
Në kushte normale, benzeni dhe homologët e tij më të thjeshtë janë lëngje shumë toksike me një erë karakteristike të pakëndshme. Ato treten dobët në ujë, por mirë në tretës organikë.
Vetitë kimike të benzenit
Reaksionet e zëvendësimit. Hidrokarburet aromatike i nënshtrohen reaksioneve të zëvendësimit.
1. Brominimi. Kur reagon me bromin në prani të një katalizatori, brom hekuri (ΙΙΙ), një nga atomet e hidrogjenit në unazën e benzenit mund të zëvendësohet nga një atom bromi:

2. Nitrimi i benzenit dhe homologëve të tij. Kur një hidrokarbur aromatik ndërvepron me acidin nitrik në prani të acidit sulfurik (një përzierje e acideve sulfurik dhe nitrik quhet një përzierje nitratuese), atomi i hidrogjenit zëvendësohet nga një grup nitro -NO2:

Duke reduktuar nitrobenzenin e formuar në këtë reaksion, përftohet anilina, një substancë që përdoret për të marrë ngjyrat e anilinës:

Ky reagim është emëruar pas kimistit rus Zinin.
Reaksionet e shtimit. Komponimet aromatike gjithashtu mund t'i nënshtrohen reaksioneve të shtimit në unazën e benzenit. Në këtë rast, formohet cikloheksani ose derivatet e tij.
1. Hidrogjenizimi. Hidrogjenizimi katalitik i benzenit ndodh në një temperaturë më të lartë se hidrogjenizimi i alkeneve:
![]()
2. Klorimi. Reagimi ndodh kur ndriçohet me dritë ultravjollcë dhe është radikal i lirë:

Homologët e benzenit
Përbërja e molekulave të tyre korrespondon me formulën C n H 2 n-6. Homologët më të afërt të benzenit janë:
Të gjithë homologët e benzenit pas toluenit kanë izomerë. Izomerizmi mund të shoqërohet si me numrin dhe strukturën e zëvendësuesit (1, 2), ashtu edhe me pozicionin e zëvendësuesit në unazën e benzenit (2, 3, 4). Përbërjet e formulës së përgjithshme C 8 H 10:

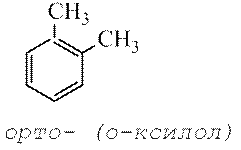
Sipas nomenklaturës së vjetër të përdorur për të treguar vendndodhjen relative të dy zëvendësuesve identikë ose të ndryshëm në unazën e benzenit, përdoren prefikset orto- (shkurtuar o-) - zëvendësuesit janë të vendosur në atomet fqinje të karbonit, meta-(m-) – përmes një atomi karboni dhe çift— (n-) – zëvendësues kundër njëri-tjetrit.
Anëtarët e parë të serisë homologe të benzenit janë lëngje me një erë specifike. Ato janë më të lehta se uji. Ata janë tretës të mirë.
Reagojnë homologët e benzenit zëvendësime ( brominimi, nitrimi). Tolueni oksidohet nga permanganati kur nxehet:

Homologët e benzenit përdoren si tretës për të prodhuar ngjyra, produkte për mbrojtjen e bimëve, plastikë dhe ilaçe.



















Komponimet kimike aromatike, ose arene, janë një grup i madh i përbërjeve karbociklike, molekulat e të cilave përmbajnë një unazë të qëndrueshme prej gjashtë atomesh karboni. Quhet "unaza e benzenit" dhe është përgjegjëse për vetitë e veçanta fizike dhe kimike të areneve.
Hidrokarburet aromatike përfshijnë kryesisht benzenin dhe të gjithë homologët dhe derivatet e tij.
Molekulat arene mund të përmbajnë disa unaza benzeni. Komponime të tilla quhen komponime aromatike polinukleare. Për shembull, naftalina është një ilaç i njohur për mbrojtjen e produkteve të leshit nga tenja.
Benzeni
Ky përfaqësues më i thjeshtë i arenëve përbëhet vetëm nga një unazë benzeni. Formula e saj molekulare është C 6 Η 6. Formula strukturore e molekulës së benzenit më së shpeshti përfaqësohet nga forma ciklike e propozuar nga A. Kekule në 1865.
Avantazhi i kësaj formule është se ajo pasqyron me saktësi përbërjen dhe ekuivalencën e të gjithë atomeve C dhe H në unazë. Megjithatë, ajo nuk mund të shpjegojë shumë nga vetitë kimike të areneve, kështu që pohimi për praninë e tre lidhjeve dyfishe të konjuguara C=C është i gabuar. Kjo u bë e njohur vetëm me ardhjen e teorisë moderne të lidhjes.
Ndërkohë, sot formula për benzenin shkruhet shpesh në mënyrën e propozuar nga Kekule. Së pari, me ndihmën e tij është i përshtatshëm për të shkruar ekuacionet e reaksioneve kimike. Së dyti, kimistët modernë shohin në të vetëm një simbol, dhe jo një strukturë të vërtetë. Struktura e molekulës së benzenit sot përcillet nga lloje të ndryshme formulash strukturore.
Struktura e unazës së benzenit
Tipari kryesor i unazës së benzenit është mungesa e lidhjeve të vetme dhe të dyfishta në të në kuptimin tradicional. Në përputhje me konceptet moderne, molekula e benzenit shfaqet si një gjashtëkëndësh i sheshtë me gjatësi anësore të barabarta me 0,140 nm. Rezulton se gjatësia e lidhjes C-C në benzen është një vlerë e ndërmjetme midis të vetmes (gjatësia e saj është 0,154 nm) dhe dyfishit (0,134 nm). Lidhjet C-H gjithashtu shtrihen në të njëjtin rrafsh, duke formuar një kënd prej 120° me skajet e gjashtëkëndëshit.
Çdo atom C në strukturën e benzenit është në gjendje hibride sp2. Ai është i lidhur përmes tre orbitaleve të tij hibride me dy atome C të vendosura afër dhe një atom H, domethënë, formon tre lidhje s. Një orbital tjetër, por tashmë i pahibridizuar, 2p mbivendoset me të njëjtat orbitale të atomeve fqinje C (djathtas dhe majtas). Boshti i tij është pingul me rrafshin e unazës, që do të thotë se orbitalet mbivendosen mbi dhe nën të. Në këtë rast, formohet një sistem i përbashkët i mbyllur π-elektronish. Për shkak të mbivendosjes së barabartë të orbitaleve 2p të gjashtë atomeve C, ndodh një lloj "barazimi" i lidhjeve C-C dhe C=C.
Rezultati i këtij procesi është ngjashmëria e lidhjeve të tilla "një e gjysmë" me lidhje dyfishe dhe të vetme. Kjo shpjegon faktin që arenet shfaqin veti kimike karakteristike si për alkanet ashtu edhe për alkenet.
Energjia e lidhjes karbon-karbon në unazën e benzenit është 490 kJ/mol. E cila është edhe mesatarja ndërmjet energjive të një lidhjeje dyfishe të vetme dhe të shumëfishtë.

Nomenklatura e arenës
Baza për emrat e hidrokarbureve aromatike është benzeni. Atomet në unazë numërohen nga zëvendësuesi më i lartë. Nëse zëvendësuesit janë ekuivalent, atëherë numërimi kryhet përgjatë rrugës më të shkurtër.
Për shumë homologë të benzenit, shpesh përdoren emra të parëndësishëm: stiren, toluen, ksilen, etj. Për të pasqyruar pozicionin relativ të zëvendësuesve, është zakon të përdoren parashtesat orto-, meta-, para-.
Nëse molekula përmban grupe funksionale, për shembull, karbonil ose karboksil, atëherë molekula arene konsiderohet si një radikal aromatik i lidhur me të. Për shembull, -C 6 Η 5 - fenil, -C 6 Η 4 - fenilen, C 6 Η 5 -CH 2 - benzil.
Vetitë fizike
Përfaqësuesit e parë në serinë homologe të benzenit janë lëngjet pa ngjyrë me një erë specifike. Pesha e tyre është më e lehtë se uji, në të cilin janë praktikisht të pazgjidhshëm, por treten mirë në shumicën e tretësve organikë.
Të gjitha hidrokarburet aromatike digjen me një flakë tymi, e cila shpjegohet me përmbajtjen e lartë të C në molekula. Pikat e tyre të shkrirjes dhe vlimit rriten me rritjen e peshës molekulare në serinë homologe të benzenit.
Vetitë kimike të benzenit
Nga vetitë e ndryshme kimike të areneve, reaksionet e zëvendësimit duhet të përmenden veçmas. Gjithashtu shumë domethënëse janë disa reaksione shtesë që ndodhin në kushte të veçanta dhe procese oksidimi.
Reaksionet e zëvendësimit
Elektrone π mjaft të lëvizshme të unazës së benzenit janë të afta të reagojnë në mënyrë shumë aktive me elektrofilet sulmuese. Ky zëvendësim elektrofilik përfshin vetë unazën e benzenit në benzen dhe zinxhirin hidrokarbur të lidhur në homologët e tij. Mekanizmi i këtij procesi është studiuar në disa detaje nga kimia organike. Vetitë kimike të areneve të lidhura me sulmin elektrofil ndodhin në tre faza.
- Faza e parë. Shfaqja e kompleksit π është për shkak të lidhjes së sistemit π-elektroni të unazës së benzenit me grimcën X +, e cila lidhet me gjashtë p-elektrone.

Brominimi i benzenit në prani të bromeve të hekurit ose aluminit pa ngrohje çon në prodhimin e bromobenzenit:
C 6 Η 6 + Br 2 —> C 6 Η 5 -Br + ΗBr.
Nitrimi me një përzierje të acideve nitrik dhe sulfurik çon në prodhimin e komponimeve me një grup nitro në unazë:
C 6 Η 6 + ΗONO 2 -> C 6 Η 5 -NO 2 + Η 2 O.
Sulfonimi kryhet nga një jon bisulfonium i formuar si rezultat i reagimit:
3Η 2 SO 4 ⇄ SO 3 Η + + Η 3 O + + 2ΗSO 4 - ,
ose trioksid squfuri.
Reaksioni që korrespondon me këtë veti kimike të areneve është:
C 6 H 6 + SO 3 H + —> C 6 H 5 — SO 3 H + H + .
Reaksionet e zëvendësimit të alkilit dhe acilit, ose reaksionet Friedel-Crafts, kryhen në prani të AlCl3 anhidër.

Këto reagime nuk kanë gjasa për benzenin dhe ndodhin me vështirësi. Shtimi i halogjeneve të hidrogjenit dhe ujit në benzen nuk ndodh. Sidoqoftë, në temperatura shumë të larta në prani të platinit, një reaksion hidrogjenizimi është i mundur:
C 6 Η 6 + 3H 2 -> C 6 H 12.
Kur rrezatohen me dritë ultravjollcë, molekulat e klorit mund të bashkohen me një molekulë benzeni:
C 6 Η 6 + 3Cl 2 —> C 6 Η 6 Cl 6 .
Reaksionet e oksidimit
Benzeni është shumë rezistent ndaj agjentëve oksidues. Kështu, ajo nuk e çngjyr zgjidhjen rozë të permanganatit të kaliumit. Sidoqoftë, në prani të oksidit të vanadiumit, ai mund të oksidohet nga oksigjeni atmosferik në acid maleik:
C 6 H 6 + 4O -> COOΗ-CΗ = CΗ-COOΗ.
Në ajër, benzeni digjet me shfaqjen e blozës:
2C 6 Η 6 + 3O2 → 12C + 6 Η 2 O.
Vetitë kimike të areneve
- Zëvendësimi.


Rregullat e orientimit
Cilin pozicion (o-, m- ose p-) do të zërë zëvendësuesi gjatë bashkëveprimit të agjentit elektrofilik me unazën e benzenit përcaktohet nga rregullat:
- nëse tashmë ka ndonjë zëvendësues në unazën e benzenit, atëherë është ky zëvendësues që e drejton grupin hyrës në një pozicion të caktuar;
- të gjithë zëvendësuesit orientues ndahen në dy grupe: orientuesit e llojit të parë drejtojnë grupin hyrës të atomeve në pozicionet orto- dhe para (-NH 2, -OH, -CH 3, -C 2 H 5, halogjenet); orientuesit e llojit të dytë i drejtojnë zëvendësuesit hyrës në pozicionin meta (-NO 2, -SO 3 H, -COHO, -COOH).
Orientimet janë renditur këtu sipas renditjes së forcës së drejtimit në rënie.
Vlen të theksohet se kjo ndarje e zëvendësuesve të grupit është e kushtëzuar, për faktin se në shumicën e reaksioneve vërehet formimi i të tre izomerëve. Orientuesit ndikojnë vetëm se cili nga izomerët do të përftohet në sasi më të madhe.
Marrja e arenave
Burimet kryesore të areneve janë distilimi i thatë i qymyrit dhe rafinimi i naftës. Katrani i qymyrit përmban një sasi të madhe të të gjitha llojeve të hidrokarbureve aromatike. Disa lloje vaji përmbajnë deri në 60% arene, të cilat mund të izolohen lehtësisht me distilim të thjeshtë, pirolizë ose plasaritje.
Metodat e përgatitjes sintetike dhe vetitë kimike të areneve janë shpesh të ndërlidhura. Benzeni, si homologët e tij, përftohet në një nga mënyrat e mëposhtme.
1. Reformimi i produkteve të naftës. Dehidrogjenimi i alkaneve është metoda më e rëndësishme industriale për sintezën e benzenit dhe shumë prej homologëve të tij. Reaksioni kryhet duke kaluar gazra mbi një katalizator të ndezur (oksidet Pt, Cr 2 O 3, Mo dhe V) në t = 350-450 o C:
C 6 H 14 —> C 6 Η 6 + 4 Η 2.
2. Reaksioni Wurtz-Fittig. Ajo kryhet përmes fazës së përftimit të përbërjeve organometrike. Si rezultat i reagimit, mund të merren disa produkte.
3. Trimerizimi i acetilenit. Vetë acetileni, si homologët e tij, është i aftë të formojë arene kur nxehet me një katalizator:
3C 2 Η 2 -> C 6 Η 6.
4. Reagimi Friedel-Crafts. Metoda e marrjes dhe konvertimit të homologëve të benzenit tashmë është diskutuar më lart në vetitë kimike të areneve.
5. Përgatitja nga kripërat përkatëse. Benzeni mund të izolohet duke distiluar kripërat e acidit benzoik me alkali:
C 6 Η 5 —COONa + NaOΗ —> C 6 Η 6 + Na 2 CO 3 .
6. Reduktimi i ketoneve:
C 6 Η 5 -CO-CΗ 3 + Zn + 2ΗCl —> C 6 Η 5 -CΗ 2 -CΗ 3 + Η 2 O + ZnCl 2 ;
CΗ 3 -C 6 Η 5 -CO-CΗ 3 + NΗ 2 -NΗ 2 —> CΗ 3 -C 6 Η 5 -CΗ 2 -CΗ 3 + Η 2 O.
Aplikimi i arenave
Vetitë kimike dhe fushat e aplikimit të areneve janë të lidhura drejtpërdrejt, pasi pjesa më e madhe e përbërjeve aromatike përdoren për sintezë të mëtejshme në prodhimin kimik dhe nuk përdoren në formë të përfunduar. Përjashtim bëjnë substancat që përdoren si tretës.
Benzeni C 6 × 6 përdoret kryesisht në sintezën e etilbenzenit, kumenit dhe cikloheksanit. Mbi bazën e tij, merren produkte të ndërmjetme për prodhimin e polimereve të ndryshëm: goma, plastikë, fibra, ngjyra, surfaktantë, insekticide dhe ilaçe.

Tolueni C 6 H 5 - CH 3 përdoret në prodhimin e ngjyrave, ilaçeve dhe eksplozivëve.
Ksilenet C 6 Η 4 (C 3) 2 në formë të përzier (ksilen teknik) përdoren si tretës ose lëndë fillestare për sintezën e substancave organike.
Izopropilbenzeni (ose kumen) C 6 H 4 -C H (C H 3) 2 është reagenti fillestar për sintezën e fenolit dhe acetonit.
Vinilbenzeni (stiren) C 6 Η 5 -CΗ=CΗ 2 është lënda e parë për prodhimin e materialit polimer më të rëndësishëm - polistirenit.
PËRKUFIZIM
Hidrokarburet aromatike (arene)– substanca molekulat e të cilave përmbajnë një ose më shumë unaza benzeni. Formula e përgjithshme e serisë homologe të benzenit C n H 2 n -6
Përfaqësuesit më të thjeshtë të hidrokarbureve aromatike janë benzeni - C 6 H 6 dhe tolueni - C 6 H 5 - CH 3. Radikalet hidrokarbure të marra nga arenet quhen: C 6 H 5 - - fenil (Ph-) dhe C 6 H 5 -CH 2 - - benzil.
Të gjashtë atomet e karbonit në molekulën e benzenit janë në gjendjen hibride sp 2. Çdo atom karboni formon lidhje 3σ me dy atome të tjera karboni dhe një atom hidrogjeni, të shtrirë në të njëjtin rrafsh. Gjashtë atome karboni formojnë një gjashtëkëndësh të rregullt (σ-skeleti i molekulës së benzenit).
Çdo atom karboni ka një orbital p të pahibridizuar që përmban një elektron. Gjashtë p-elektrone formojnë një re të vetme π-elektroni (sistemi aromatik), i cili përshkruhet si një rreth brenda një unaze me gjashtë anëtarë.
Vetitë kimike të areneve
Benzeni dhe homologët e tij karakterizohen nga reaksione zëvendësimi që ndodhin nëpërmjet një mekanizmi elektrofilik:
- halogjenimi (benzeni reagon me klorin dhe bromin në prani të katalizatorëve - AlCl 3, FeCl 3, AlBr 3 pa ujë)
C 6 H 6 + Cl 2 = C 6 H 5 -Cl + HCl
- nitrimi (benzeni reagon lehtësisht me përzierjen nitratuese - një përzierje e acideve nitrik dhe sulfurik të koncentruar)

- alkilimi me alkene
C 6 H 6 + CH 2 = CH-CH 3 → C 6 H 5 -CH(CH 3) 2
Reagimet e shtimit në benzen çojnë në shkatërrimin e sistemit aromatik dhe ndodhin vetëm në kushte të vështira:
— hidrogjenizimi (reaksioni ndodh kur nxehet, katalizatori është Pt)

- shtimi i klorit (ndodh nën ndikimin e rrezatimit UV me formimin e një produkti të ngurtë - heksaklorocikloheksani (heksaklorani) - C 6 H 6 Cl 6)

Vetitë fizike të arenave
Anëtarët e parë të serisë homologe të benzenit janë lëngje pa ngjyrë me një erë specifike. Ato janë më të lehta se uji dhe praktikisht të pazgjidhshëm në të. Ata treten mirë në tretës organikë dhe janë vetë tretës të mirë.
Marrja e arenave
Metodat kryesore për marrjen e benzenit dhe homologëve të tij:
- dehidrociklizimi i alkaneve (katalizatorët - Pt, Cr 3 O 2)

- dehidrogjenimi i cikloalkaneve (reaksioni ndodh kur nxehet, katalizatori është Pt)

- trimerizimi i acetilenit (reaksioni ndodh kur nxehet në 600 C, katalizatori është karboni i aktivizuar)
3HC≡CH → C6H6
- alkilimi i benzeneve (reaksioni Friedel-Crafts) (katalizator - klorur alumini ose acid fosforik)

Shembuj të zgjidhjes së problemeve
SHEMBULL 1
| Ushtrimi | Dendësia e avullit të substancës është 3,482 g/l. Nga piroliza e tij rezultuan 6 g blozë dhe 5,6 litra hidrogjen. Përcaktoni formulën e kësaj substance. |
| Zgjidhje | Le të gjejmë sasinë e substancës së blozës (karbonit): v(C) = m(C)/M(C) v(C) = 6/12 = 0,5 mol Le të gjejmë sasinë e substancës së hidrogjenit: v(H 2) = V(H 2)/V m v(H 2) = 5,6/22,4 = 0,25 mol Prandaj, sasia e substancës së një atomi hidrogjeni do të jetë e barabartë me: v(H) = 2×0,25 = 0,5 mol Le të shënojmë numrin e atomeve të karbonit në një molekulë hidrokarbure si x dhe numrin e atomeve të hidrogjenit si y, atëherë raporti i këtyre atomeve në molekulë është: x:y = 0,5: 0,5 = 1:1 Formula më e thjeshtë e hidrokarbureve CH Pesha molekulare e hidrokarbureve është: M(C x H y) = ρ×V m = 3,482×22,4 = 78 g/mol Pesha molekulare e një molekule me përbërje CH është e barabartë me: M(CH) = 13 g/mol n = M(C x H y)/ M(CH) = 78/13 = 6, prandaj, koeficientët x dhe y duhet të shumëzohen me 6, atëherë hidrokarburi i dëshiruar ka përbërjen C 6 H 6 - ky është benzen |
Konsiderata e përgjithshme.
Hidrokarburet aromatike (arenet) janë substanca molekulat e të cilave përmbajnë një ose më shumë unaza benzeni - grupe ciklike të atomeve të karbonit me një natyrë të veçantë lidhjesh.
Koncepti i "unazës së benzenit" kërkon menjëherë dekodim. Për ta bërë këtë, është e nevojshme të merret parasysh shkurtimisht struktura e molekulës së benzenit. Struktura e parë e benzenit u propozua në 1865 nga shkencëtari gjerman A. Kekule:
Kjo formulë pasqyron saktë ekuivalencën e gjashtë atomeve të karbonit, por nuk shpjegon një numër të vetive të veçanta të benzenit. Për shembull, pavarësisht se është i pangopur, benzeni nuk shfaq prirje ndaj reaksioneve të shtimit: nuk e çngjyr ujin me brom dhe tretësirën e permanganatit të kaliumit, d.m.th. nuk jep reaksione cilësore tipike për përbërjet e pangopura.
Karakteristikat strukturore dhe vetitë e benzenit u shpjeguan plotësisht vetëm pas zhvillimit të teorisë moderne mekanike kuantike të lidhjeve kimike. Sipas koncepteve moderne, të gjashtë atomet e karbonit në molekulën e benzenit janë në gjendje hibride. Çdo atom karboni formon -lidhje me dy atome të tjera karboni dhe një atom hidrogjeni, të shtrirë në të njëjtin rrafsh. Këndet e lidhjes ndërmjet tre lidhjeve janë 120°. Kështu, të gjashtë atomet e karbonit shtrihen në të njëjtin rrafsh, duke formuar një gjashtëkëndësh të rregullt (skeleti i një molekule benzeni).
Çdo atom karboni ka një orbital p të pahibridizuar.
Gjashtë orbitale të tilla janë të vendosura pingul me skeletin e sheshtë dhe paralel me njëra-tjetrën (Fig. 21.1, a). Të gjashtë p-elektronet ndërveprojnë me njëri-tjetrin, duke formuar lidhje -, jo të lokalizuara në çifte, si në formimin e lidhjeve të zakonshme të dyfishta, por të kombinuara në një re të vetme-elektroni. Kështu, konjugimi rrethor ndodh në molekulën e benzenit (shih § 19). Dendësia më e lartë e elektroneve në këtë sistem të konjuguar ndodhet sipër dhe poshtë planit të skeletit (Fig. 21.1, b).

Oriz. 21.1. Struktura e molekulës së benzenit
Si rezultat, të gjitha lidhjet midis atomeve të karbonit në benzen janë të rreshtuara dhe kanë një gjatësi prej 0,139 nm. Kjo vlerë është e ndërmjetme midis gjatësisë së një lidhjeje të vetme në alkane (0,154 nm) dhe gjatësisë së një lidhje dyfishe në alkene (0,133 nm). Ekuivalenca e lidhjeve zakonisht përshkruhet me një rreth brenda ciklit (Fig. 21.1, c). Konjugimi rrethor jep një fitim energjie prej 150 kJ/mol. Kjo vlerë përbën energjinë e konjugimit - sasinë e energjisë që duhet shpenzuar për të prishur sistemin aromatik të benzenit (krahaso - energjia e konjugimit në butadien është vetëm 12 kJ/mol).
Kjo strukturë elektronike shpjegon të gjitha tiparet e benzenit. Në veçanti, është e qartë pse benzeni është i vështirë për t'u futur në reaksione shtesë - kjo do të çonte në një shkelje të konjugimit. Reagime të tilla janë të mundshme vetëm në kushte shumë të vështira.
Nomenklatura dhe izomeria.
Në mënyrë konvencionale, arenat mund të ndahen në dy rreshta. E para përfshin derivatet e benzenit (për shembull, toluen ose bifenil), e dyta përfshin arene të kondensuar (polinukleare) (më e thjeshta prej tyre është naftaleni):

Do të shqyrtojmë vetëm serinë homologe të benzenit me formulën e përgjithshme.
Izomerizmi strukturor në serinë homologe të benzenit është për shkak të rregullimit të ndërsjellë të zëvendësuesve në bërthamë. Derivatet e benzenit të monozëvendësuar nuk kanë izomerë pozicionalë, pasi të gjithë atomet në unazën e benzenit janë ekuivalente. Derivatet e pazëvendësuar ekzistojnë në formën e tre izomerëve, që ndryshojnë në rregullimin relativ të zëvendësuesve. Pozicioni i zëvendësuesve tregohet me numra ose parashtesa:

Radikalet e hidrokarbureve aromatike quhen radikale aril. Radikali quhet fenil.
Vetitë fizike.
Anëtarët e parë të serisë homologe të benzenit (për shembull, tolueni, etilbenzeni, etj.) janë lëngje pa ngjyrë me një erë specifike. Ato janë më të lehta se uji dhe të patretshme në ujë. Ata treten mirë në tretës organikë. Benzeni dhe homologët e tij janë vetë tretës të mirë për shumë substanca organike. Të gjitha arenat digjen me një flakë tymi për shkak të përmbajtjes së lartë të karbonit në molekulat e tyre.
Metodat e marrjes.
1. Përgatitja nga hidrokarburet alifatike. Kur alkanet me zinxhir të drejtë me të paktën 6 atome karboni për molekulë kalohen mbi platinin e ndezur ose oksidin e kromit, ndodh dehidrociklimi - formimi i një arene me lëshimin e hidrogjenit:
2. Dehidrogjenimi i cikloalkaneve. Reagimi ndodh duke kaluar avujt e cikloheksanit dhe homologëve të tij mbi platinin e ndezur:

3. Përgatitja e benzenit me anë të trimerizimit të acetilenit - shih § 20.
4. Marrja e homologëve të benzenit duke përdorur reaksionin Friedel-Crafts - shih më poshtë.
5. Shkrirja e kripërave të acideve aromatike me alkalin:
Vetitë kimike.
Konsiderata e përgjithshme. Duke pasur një gjashtë-elektrone të lëvizshme, bërthama aromatike është një objekt i përshtatshëm për sulm nga reagentët elektrofilë. Kjo lehtësohet edhe nga rregullimi hapësinor i resë elektronike në të dy anët e skeletit të sheshtë të molekulës (Fig. 21.1, b)
Reaksionet më tipike për arenët janë ato që zhvillohen përmes mekanizmit të zëvendësimit elektrofilik, të shënuar me simbolin (nga zëvendësimi anglez electrophilic).
Mekanizmi i zëvendësimit elektrofilik mund të përfaqësohet si më poshtë. Reagenti elektrofilik XY (X është një elektrofil) sulmon renë elektronike dhe për shkak të ndërveprimit të dobët elektrostatik, formohet një kompleks i paqëndrueshëm. Sistemi aromatik ende nuk është ndërprerë. Kjo fazë vazhdon shpejt. Në fazën e dytë, më të ngadaltë, formohet një lidhje kovalente midis elektrofilit X dhe një prej atomeve të karbonit të unazës për shkak të dy elektroneve të unazës. Ky atom karboni shkon nga gjendja -hibride. Në këtë rast, aroma e sistemit prishet. Katër -elektronet e mbetura ndahen midis pesë atomeve të tjera të karbonit, dhe molekula e benzenit formon një karbokacion, ose -kompleks.

Prishja e aromatizmit është energjikisht e pafavorshme, prandaj struktura e kompleksit β është më pak e qëndrueshme se struktura aromatike. Për të rivendosur aromatizmin, një proton hiqet nga atomi i karbonit i lidhur me elektrofilin (faza e tretë). Në këtë rast, dy elektrone kthehen në sistem, dhe në këtë mënyrë aromaticiteti rikthehet:

Reaksionet e zëvendësimit elektrofil përdoren gjerësisht për sintezën e shumë derivateve të benzenit.
Vetitë kimike të benzenit.
1. Halogjenimi. Benzeni nuk reagon me klorin ose bromin në kushte normale. Reaksioni mund të zhvillohet vetëm në prani të katalizatorëve anhidrë. Si rezultat i reagimit, formohen arene të zëvendësuara me halogjen:

Roli i katalizatorit është të polarizojë një molekulë halogjene neutrale për të formuar një grimcë elektrofile prej saj:
2. Nitrimi. Benzeni reagon shumë ngadalë me acidin nitrik të koncentruar edhe kur nxehet. Sidoqoftë, nën veprimin e të ashtuquajturës përzierje nitratuese (një përzierje e acideve nitrik dhe sulfurik të përqendruar), reagimi i nitrimit ndodh mjaft lehtë:
3. Sulfonimi. Reagimi zhvillohet lehtësisht nën ndikimin e acidit sulfurik "tymues" (oleum):
4. Friedel-Crafts alkilimi. Si rezultat i reaksionit, një grup alkil futet në unazën e benzenit për të prodhuar homologë të benzenit. Reaksioni ndodh kur benzeni ekspozohet ndaj haloalkaneve në prani të katalizatorëve - halideve të aluminit. Roli i katalizatorit reduktohet në polarizimin e molekulës me formimin e një grimce elektrofile:
Në varësi të strukturës së radikalit në haloalkan, mund të merren homologë të ndryshëm të benzenit:
5. Alkilimi me alkene. Këto reaksione përdoren gjerësisht industrialisht për të prodhuar etilbenzen dhe izopropilbenzen (kumen). Alkilimi kryhet në prani të një katalizatori. Mekanizmi i reagimit është i ngjashëm me mekanizmin e reagimit të mëparshëm:
Të gjitha reaksionet e diskutuara më sipër zhvillohen përmes mekanizmit të zëvendësimit elektrofilik.
Reaksionet e shtimit të areneve çojnë në shkatërrimin e sistemit aromatik dhe kërkojnë sasi të mëdha energjie, kështu që ato ndodhin vetëm në kushte të vështira.
6. Hidrogjenizimi. Reagimi i shtimit të hidrogjenit në arene ndodh nën ngrohje dhe presion të lartë në prani të katalizatorëve metalikë (Ni, Pt, Pd). Benzeni shndërrohet në cikloheksan, dhe homologët e benzenit shndërrohen në derivate të cikloheksanit:

7. Halogjenizimi radikal. Ndërveprimi i avullit të benzenit me klorin ndodh nëpërmjet një mekanizmi radikal vetëm nën ndikimin e rrezatimit të fortë ultravjollcë. Në këtë rast, benzeni shton tre molekula klori dhe formon një produkt të ngurtë - heksaklorocikloheksan:

8. Oksidimi nga oksigjeni atmosferik. Për sa i përket rezistencës ndaj agjentëve oksidues, benzeni i ngjan alkaneve. Vetëm me ngrohje të fortë (400 °C) të avullit të benzenit me oksigjen atmosferik në prani të një katalizatori, përftohet një përzierje e acidit maleik dhe anhidritit të tij:

Vetitë kimike të homologëve të benzenit.
Homologët e benzenit kanë një numër të vetive kimike të veçanta që lidhen me ndikimin e ndërsjellë të radikalit alkil në unazën e benzenit dhe anasjelltas.
Reaksionet e zinxhirit anësor. Vetitë kimike të radikaleve alkil janë të ngjashme me alkanet. Atomet e hidrogjenit në to zëvendësohen me halogjen nga një mekanizëm radikal i lirë. Prandaj, në mungesë të një katalizatori, pas ngrohjes ose rrezatimit UV, ndodh një reaksion zëvendësimi radikal në zinxhirin anësor. Ndikimi i unazës së benzenit në zëvendësuesit e alkilit çon në faktin se atomi i hidrogjenit në atomin e karbonit i lidhur drejtpërdrejt me unazën e benzenit (atom karboni) zëvendësohet gjithmonë.

Zëvendësimi në unazën e benzenit është i mundur vetëm nga mekanizmi në prani të një katalizatori:
Më poshtë do të zbuloni se cilët nga tre izomerët e klorotoluenit formohen në këtë reaksion.
Kur homologët e benzenit ekspozohen ndaj permanganatit të kaliumit dhe agjentëve të tjerë të fortë oksidues, zinxhirët anësor oksidohen. Pavarësisht se sa kompleks është zinxhiri i zëvendësuesit, ai shkatërrohet, me përjashtim të atomit të karbonit, i cili oksidohet në një grup karboksil.
Homologët e benzenit me një zinxhir anësor japin acid benzoik:

Rregullat për orientimin (zëvendësimin) në unazën e benzenit.
Faktori më i rëndësishëm që përcakton vetitë kimike të një molekule është shpërndarja e densitetit të elektroneve në të. Natyra e shpërndarjes varet nga ndikimi i ndërsjellë i atomeve.
Në molekulat që kanë vetëm lidhje, ndikimi i ndërsjellë i atomeve ndodh nëpërmjet efektit induktiv (shih § 17). Në molekulat që janë sisteme të konjuguara, efekti mesomerik manifestohet.
Ndikimi i zëvendësuesve të transmetuar përmes një sistemi të konjuguar lidhjesh quhet efekti mezomerik (M).
Në një molekulë benzeni, reja e elektroneve shpërndahet në mënyrë të barabartë mbi të gjithë atomet e karbonit për shkak të konjugimit.
Nëse ndonjë zëvendësues futet në unazën e benzenit, kjo shpërndarje uniforme prishet dhe ndodh një rishpërndarje e densitetit të elektronit në unazë. Vendi ku zëvendësuesi i dytë hyn në unazën e benzenit përcaktohet nga natyra e zëvendësuesit ekzistues.
Zëvendësuesit ndahen në dy grupe në varësi të efektit që shfaqin (mesomerik ose induktiv): elektron-mbështetës dhe elektron-tërheqës.
Zëvendësuesit elektron-dhurues kanë një efekt dhe rrisin densitetin e elektroneve në sistemin e konjuguar. Këto përfshijnë grupin hidroksil -OH dhe grupin amino. Çifti i vetëm i elektroneve në këto grupe hyn në konjugim të përgjithshëm me sistemin -elektronik të unazës së benzenit dhe rrit gjatësinë e sistemit të konjuguar. Si rezultat, densiteti i elektronit është i përqendruar në pozicionet ortho dhe para:

Grupet alkile nuk mund të marrin pjesë në konjugimin e përgjithshëm, por ato shfaqin një efekt nën të cilin ndodh një rishpërndarje e ngjashme e densitetit të elektroneve.
Zëvendësuesit që tërheqin elektron shfaqin një efekt -M dhe zvogëlojnë densitetin e elektroneve në sistemin e konjuguar. Këto përfshijnë grupin nitro, grupin sulfo, grupet aldehid -CHO dhe karboksil -COOH. Këta zëvendësues formojnë një sistem të përbashkët të konjuguar me unazën e benzenit, por reja e përgjithshme e elektroneve zhvendoset drejt këtyre grupeve. Kështu, densiteti total i elektroneve në unazë zvogëlohet dhe zvogëlohet më së paku në pozicionet meta:
Për shembull, tolueni që përmban një zëvendësues të llojit të parë nitrohet dhe brominohet në pozicione para dhe orto:

Nitrobenzeni që përmban një zëvendësues të llojit të dytë nitrohet dhe brominohet në pozicionin meta:

Përveç efektit orientues, zëvendësuesit ndikojnë gjithashtu në reaktivitetin e unazës së benzenit: orientuesit e llojit të parë (përveç halogjeneve) lehtësojnë hyrjen e zëvendësuesit të dytë; Orientuesit e llojit të dytë (dhe halogjenët) e bëjnë të vështirë.