Волновую функцию (7), описывающую состояние электрона, называют атомной орбиталью (АО).
Квантовые числа. В квантовой механике каждая АО определяется тремя квантовыми числами.
Главное квантовое число n . Может принимать целочисленные значения от 1 до ∞. Главное квантовое число определяет:
номер энергетического уровня;
интервал энергий электронов, находящихся на данном уровне;
размеры орбиталей;
число подуровней данного энергетического уровня (первый уровень состоит из одного подуровня, второй – из двух, третий – из трех и т.д.);
В Периодической системе элементов максимальному значению главного квантового числа соответствует номер периода.
Орбитальное квантовое число l .Определяет орбитальный момент количества движения (импульс) электрона, точное значение его энергии и форму орбиталей. Может принимать значения 0, 1, 2, 3, …, (n -1).
Атомная орбиталь – геометрический образ одноэлектронной волновой функции ψ, представляющий собой область наиболее вероятного пребывания электрона в атоме. Она ограничивает область пространства, в которой вероятность нахождения электрона имеет определенное значение (90 …99 %). Иногда орбиталью называют граничную поверхность этой области, а на рисунках, как правило, изображают сечение этой области плоскостью, проходящей через начало координат и лежащей в плоскости рисунка. В начало координат помещают центр ядра атома. Понятие «орбиталь», в отличие от «орбита», не подразумевает знания точных координат электрона. Орбитальное квантовое число определяет форму атомной орбитали. При l =0 это сфера, при l =1 – объемная восьмерка (гантель), при l =2 – четырехлепестковая розетка.
Каждому значению главного квантового числа соответствует n значений орбитального квантового числа l (табл. 1). Например, если n =1, то l принимает только одно значение (l =0), n =2 – два значения: 0 и 1 и т.д. Каждому численному значению l соответствует определенная геометрическая форма орбиталей и приписывается буквенное обозначение. Первые четыре буквы обозначения имеют историческое происхождение и связаны с характером спектральных линий. s , p , d , f – первые буквы английских слов, использованных для названия спектральных линий: sharp (резкий), principal (главный), diffuse (диффузный), fundamental (основной). Обозначения других орбиталей приведены в алфавитном порядке: g , h , …
Таблица 1
Значения главного и орбитального квантовых чисел
| Орбитальное квантовое число l | Главное квантовое число n | ||||||||||||||
| Значение Буквенное обозначение | s | s | p | s | p | d | s | p | d | f | s | p | d | f | g |
Обозначение любого подуровня определяется двумя квантовыми числами – главным (при записи указывается численное значение) и орбитальным (при записи указывается буквенное обозначениеорбитальным ()ается численное значение двумя квантовыми числами - главным). Например, энергетический подуровень, для которого n =2 и l =1, следует обозначить так: 2р -подуровень. Все орбитали с одинаковым значением l имеют одинаковую геометрическую формулу и в зависимости от значений главного квантового числа различаются размерами. Например, все орбитали, для которых l =0 (s -орбитали) являются сферически симметричными, различаются размерами в зависимости от значения главного квантового числа. Чем выше значение n , тем больше размеры орбиталей.
Магнитное квантовое число m l .Определяет возможные значения проекции орбитального момента количества движения электрона на фиксированное направление в пространстве (например, на ось z ). Оно принимает отрицательные и положительные значения l , включая нуль. Общее число значений равно 2l +1:
От значения магнитного квантового числа зависит взаимодействие магнитного поля, создаваемого электроном, с внешним магнитным полем. Если нет внешнего магнитного поля, то энергия электрона в атоме не зависит от m l . В этом случае электроны с одинаковыми значениями n и l , но с разными значениями m l обладают одинаковой энергией. Если существует внешнее магнитное поле – энергия электронов с разными m l различается.
В общем случае магнитное квантовое число характеризует ориентацию АО в пространстве относительно внешней силы. Магнитное квантовое число определяет ориентацию орбитального углового момента относительно некоторого фиксированного направления.
Общее число возможных значений m l соответствует числу способов расположения орбиталей данного подуровня в пространстве, то есть общему числу орбиталей на данном подуровне (табл. 2).
Таблица 2
Число орбиталей на подуровне
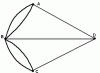
Орбитальному квантовому числу l =0 отвечает единственное значение магнитного квантового числа m l =0. Эти значения l и m l характеризуют все s -орбитали, которые имеют форму сферы. Так как в этом случае магнитное квантовое число принимает только одно значение, то каждый s-подуровень состоит только из одной орбитали. Рассмотрим любой р -подуровень. При l =1 орбитали имеют форму гантелей (объемные восьмерки), магнитное квантовое число принимает следующие значения: m l = -1, 0, +1. Следовательно, р -подуровень состоит из трех АО, которые располагаются вдоль осей координат, их обозначают p x , p y , p z соответственно (рис. 1).

Рис. 1. Пространственная форма s- и р-атомных орбиталей.
Для d
-подуровня l
=2, m l
= -2, -1, 0, +1, +2 (всего 5 значений), и любой d
-подуровень состоит из пяти атомных орбиталей, которые определенным образом расположены в пространстве (рис. 2), и обозначаются ![]() соответственно.
соответственно.

Рис. 2. Пространственная форма d-атомных орбиталей.
Четыре из пяти d- орбиталей имеют форму четырехлепестковых розеток, каждая из которых образована двумя гантелями, пятая АО представляет собой гантель с тором в экваториальной плоскости (-орбиталь) и расположена вдоль оси z . Лепестки орбитали расположены вдоль осей x и y. Лепестки орбиталей расположены симметрично между соответствующими осями.
Четвертый энергетический уровень состоит из четырех подуровней – s , p , d и f . Первые три из них аналогичны описанным выше, а четвертый f -подуровень состоит из семи АО, пространственная форма которых достаточно сложна и в данном разделе не рассматривается.
С. Гаудсмит и Дж. Уленбек для описания некоторых тонких эффектов в спектре атома водорода в 1925 г. выдвинули гипотезу о наличии собственного момента импульса электрона, который назвали спином . Спин нельзя выразить через координаты и импульсы, у него нет аналога в классической механике. Спиновое число s электрона принимает только одно значение, равное Проекция вектора спина на определенное направление внешнего поля (например, на ось z ) определяется спиновым квантовым числом m S , которое может принимать два значения: m S =
Понятие «спин» введено для характеристики специфического квантового свойства электрона. Спин – это проявление релятивистских эффектов на микроскопическом уровне.
Электрон имеет четыре степени свободы. Спиновое квантовое число принимает только дискретные значения: Таким образом, состояние электрона в атоме определяется набором значений четырех квантовых чисел: n , l , m l , m S .
Обозначение и структура электронных энергетических уровней . Определим некоторые термины, которые используются для разъяснения физического смысла квантовых чисел. Группа орбиталей, имеющих одинаковое значение орбитального квантового числа, образует энергетический подуровень . Совокупность всех орбиталей с одинаковым значением главного квантового числа образует энергетический уровень .
Структуру атомных электронных уровней можно изобразить двояко: в виде электронных формул и электронографических диаграмм. При написании электронных формул используют два квантовых числа n и l: первый уровень – 1s ; второй – 2s , 2p ; третий – 3s , 3p , 3d ; четвертый – 4s , 4p , 4d , 4f и т.д. (табл.3).
Таблица 3
Структура электронных энергетических уровней атома
Более полно строение электронных уровней описывается с использованием трех квантовых чисел: n , l , m l . Каждая АО условно изображается в виде квантовых ячеек, около которой ставится номер уровня и символ подуровня.
Орбитали существуют независимо от того, находится на них электрон (занятые орбитали), или отсутствует (вакантные орбитали). Атом каждого элемента, начиная с водорода и заканчивая последним полученным на сегодня элементом, имеет полный набор всех орбиталей на всех электронных уровнях. Их заполнение электронами происходит по мере увеличения порядкового номера, то есть, заряда ядра.
s -Орбитали, как было показано выше, имеют сферическую форму и, следовательно, одинаковую электронную плотность в направлении каждой оси трехмерных координат:
На первом электронном уровне каждого атома находится только одна s- орбиталь. Начиная со второго электронного уровня помимо s- орбитали появляются также три р -орбитали. Они имеют форму объемных восьмерок, именно так выглядит область наиболее вероятного местонахождения р -электрона в районе атомного ядра. Каждая р -орбиталь расположена вдоль одной из трех взаимоперпендикулярных осей, в соответствии с этим в названии р -орбитали указывают с помощью соответствующего индекса ту ось, вдоль которой располагается ее максимальная электронная плотность:
В современной химии орбиталь – определяющее понятие, позволяющее рассматривать процессы образования химических связей и анализировать их свойства, при этом внимание сосредотачивают на орбиталях тех электронов, которые участвуют в образовании химических связей, то есть, валентных электронов, обычно это электроны последнего уровня.
У атома углерода в исходном состоянии на втором (последнем) электронном уровне находится два электрона на s -орбитали (отмечены синим цветом) и по одному электрону на двух р -орбиталях (отмечены красным и желтым цветом), третья орбиталь – р z -вакантная:
Гибридизация.
В том случае, когда атом углерода участвует в образовании насыщенных соединений (не содержащих кратных связей), одна s- орбиталь и три р -орбитали объединяются, образуя новые орбитали, представляющие собой гибриды исходных орбиталей (процесс называют гибридизацией). Количество гибридных орбиталей всегда равно количеству исходных, в данном случае, четыре. Получившиеся орбитали-гибриды одинаковы по форме и внешне напоминают асимметричные объемные восьмерки:
Вся конструкция оказывается как бы вписанной в правильный тетраэдр – призма, собранная из правильных треугольников. При этом орбитали-гибриды располагаются вдоль осей такого тетраэдра, угол между любыми двумя осями – 109°. Четыре валентных электрона углерода располагаются на этих гибридных орбиталях:
Участие орбиталей в образовании простых химических связей.
Свойства электронов, разместившихся на четырех одинаковых орбиталях, эквивалентны, соответственно, будут эквивалентны химические связи, образованные с участием этих электронов при взаимодействии с атомами одного типа.
Взаимодействие атома углерода с четырьмя атомами водорода сопровождается взаимоперекрыванием вытянутых гибридных орбиталей углерода со сферическими орбиталями водородов. На каждой орбитали находится по одному электрону, в результате перекрывания каждая пара электронов начинает перемещаться по объединенной – молекулярной орбитали.
Гибридизация приводит лишь к изменению формы орбиталей внутри одного атома, а перекрывание орбиталей двух атомов(гибридных или обычных)приводит к образованию химической связи между ними. В данном случае (см . рисунок, помещенный ниже) максимальная электронная плотность располагается вдоль линии, связывающей два атома. Такую связь называют s -связью.
В традиционном написании структуры образовавшегося метана вместо перекрывающихся орбиталей используют символ валентной черты. Для объемного изображения структуры валентность, направленную от плоскости чертежа к зрителю показывают в виде сплошной клиновидной линии, а валентность, уходящую за плоскость рисунка – в виде штриховой клиновидной линии:
Таким образом, структура молекулы метана определяется геометрией гибридных орбиталей углерода:
Образование молекулы этана аналогично показанному выше процессу, отличие состоит в том, что при взаимоперекрывании гибридных орбиталей двух атомов углерода происходит образование С-С – связи:
Геометрия молекулы этана напоминает метан, валентные углы 109°, что определяется пространственным расположением гибридных орбиталей углерода:
Участие орбиталей в образовании кратных химических связей.
Молекула этилена образована также с участием орбиталей-гибридов, однако в гибридизации участвуют одна s -орбиталь и только две р -орбитали (р х и р у ), третья орбиталь – p z , направленная вдоль оси z , в образовании гибридов не участвует. Из исходных трех орбиталей возникают три гибридных орбитали, которые располагаются в одной плоскости, образуя трехлучевую звезду, углы между осями – 120°:
Два атома углерода присоединяют четыре атома водорода, а также соединяются между собой, образуя s -связь С-С:
Две орбитали p z , не участвовавшие в гибридизации, взаимоперекрываются, их геометрия такова, что перекрывание происходит не по линии связи С-С, а выше и ниже ее. В результате образуются две области с повышенной электронной плотностью, где помещаются два электрона (отмечены синим и красным цветом), участвующие в образовании этой связи. Таким образом, образуется одна молекулярная орбиталь, состоящая из двух областей, разделенных в пространстве. Связь, у которой максимальная электронная плотность расположена вне линии, связывающей два атома, называют p -связью:
Вторая валентная черта в обозначении двойной связи, широко используемая для изображения ненасыщенных соединений уже не одно столетие, в современном понимании подразумевает наличие двух областей с повышенной электронной плотностью, расположенных по разные стороны линии связи С-С.
Структура молекулы этилена задана геометрией гибридных орбиталей, валентный угол Н-С-Н – 120°:
При образовании ацетилена в гибридизации участвует одна одна s -орбиталь и одна р x -орбиталь (орбитали p y и p z , в образовании гибридов не участвуют). Две образовавшиеся гибридные орбитали располагаются на одной линии, вдоль оси х :
Взаимоперекрывание орбиталей-гибридов друг с другом и с орбиталями атомов водорода приводит к образованию s -связей С-С и С-Н, изображаемых с помощью простой валентной черты:
Две пары оставшихся орбиталей p y и p z взаимоперекрываются. На рисунке, приведенном ниже, цветными стрелками показано, что из чисто пространственных соображений наиболее вероятно перекрывание орбиталей с одинаковыми индексами х-х и у-у . В результате образуются две p -связи, окружающие простую s -связь С-С:
В итоге молекула ацетилена имеет палочкообразную форму:
У бензола остов молекулы собран из атомов углерода, имеющих гибридные орбитали, составленные из одной s - и двух р -орбиталей, расположенные в форме трехлучевой звезды (как у этилена), р -орбитали, не участвующие в гибридизации, показаны полупрозрачными:
В образовании химических связей могут также участвовать вакантные, то есть, не содержащие электронов орбитали ().
Орбитали высоких уровней.
Начиная с четвертого электронного уровня, у атомов появляются пять d -орбиталей, их заполнение электронами происходит у переходных элементов, начиная со скандия. Четыре d -орбитали имеют форму объемных четырехлистников, называемых иногда «клеверным листом», они отличаются лишь ориентацией в пространстве, пятая d -орбиталь представляет собой объемную восьмерку, продетую в кольцо:
d -Орбитали могут образовывать гибриды с s- и p- орбиталями. Параметры d -орбиталей обычно используют при анализе строения и спектральных свойств в комплексах переходных металлов.
Начиная с шестого электронного уровня, у атомов появляются семь f -орбиталей, их заполнение электронами происходит в атомах лантаноидов и актиноидов. f -Орбитали имеют довольно сложную конфигурацию, ниже на рисунке показана форма трех из семи таких орбиталей, имеющих одинаковую форму и ориентированных в пространстве различным образом:
f -Орбитали весьма редко используют при обсуждении свойств различных соединений, поскольку расположенные на них электроны практически не принимают участия в химических превращениях..
Перспективы.
На восьмом электронном уровне находится девять g -орбиталей. Элементы, содержащие электроны на этих орбиталях, должны появится в восьмом периоде, пока они недоступны (в ближайшее время ожидается получение элемента № 118, последнего элемента седьмого периода Периодической системы, его синтез проводят в Объединенном институте ядерных исследований в Дубне).
Форма g -орбиталей, вычисленная методами квантовой химии, еще более сложная, чем у f -орбиталей, область наиболее вероятного местонахождения электрона в данном случае выглядит весьма причудливо. Ниже показан внешний вид одной из девяти таких орбиталей:
В современной химии представления об атомных и молекулярных орбиталях широко используют при описании строения и реакционных свойств соединений, также при анализе спектров различных молекул, в некоторых случаях – для прогнозирования возможности протекания реакций.
Михаил Левицкий
m квантовыми числами.Волновая функция рассчитывается по волновому уравнению Шрёдингера в рамках одноэлектронного приближения (метод Хартри - Фока) как волновая функция электрона, находящегося в самосогласованном поле, создаваемым ядром атома со всеми остальными электронами атома.
Сам Э.Шрёдингер рассматривал электрон в атоме как отрицательно заряженное облако, плотность которого пропорциональна квадрату значения волновой функции в соответствующей точке атома. В таком виде понятие электронного облака было воспринято и в теоретической химии.
Однако большинство физиков не разделяли убеждений Э.Шрёдингера - доказательства существования электрона как «отрицательно заряженного облака» не было. Макс Борн обосновал вероятностную трактовку квадрата волновой функции. В 1950 г. Э.Шрёдингер в статье «Что такое элементарная частица?» вынужден согласиться с доводами М.Борна, которому в 1954 году присуждена Нобелевская премия по физике с формулировкой «За фундаментальное исследование в области квантовой механики, особенно за статистическую интерпретацию волновой функции ».
Квантовые числа и номенклатура орбиталей
Радиальное распределение плотности вероятности для атомных орбиталей при различных n и l .
- Главное квантовое число n может принимать любые целые положительные значения, начиная с единицы (n = 1,2,3, … ∞) и определяет общую энергию электрона на данной орбитали (энергетический уровень) :
- Орбитальное квантовое число (называемое также азимутальным или дополнительным квантовым числом) определяет момент импульса электрона и может принимать целые значения от 0 до n - 1 (l = 0,1, …, n - 1). Момент импульса при этом задаётся соотношением
Буквенные обозначения атомных орбиталей произошли от описания спектральных линий в атомных спектрах: s (sharp ) - резкая серия в атомных спектрах, p (principal )- главная, d (diffuse ) - диффузная, f (fundamental ) - фундаментальная.
- Магнитное квантовое число m l определяет проекцию орбитального момента импульса на направление магнитного поля и может принимать целые значения в диапазоне от -l до l , включая 0 (m l = -l … 0 … l ):
В литературе орбитали обозначают комбинацией квантовых чисел, при этом главное квантовое число обозначают цифрой, орбитальное квантовое число - соответствующей буквой (см. таблицу ниже) и магнитное квантовое число - выражением в нижнем индексе, показывающем проекцию орбитали на декартовы оси x, y, z, например 2p x , 3d xy , 4f z(x²-y²) . Для орбиталей внешней электронной оболочки, то есть в случае описания валентных электронов, главное квантовое число в записи орбитали, как правило, опускают.
Геометрическое представление
Геометрическое представление атомной орбитали - область пространства, ограниченная поверхностью равной плотности (эквиденситной поверхностью) вероятности или заряда . Плотность вероятности на граничной поверхности выбирают исходя из решаемой задачи, но, обычно, таким образом, чтобы вероятность нахождения электрона в ограниченной области лежала в диапазоне значений 0,9-0,99.
Поскольку энергия электрона определяется кулоновским взаимодействием и, следовательно, расстоянием от ядра, то главное квантовое число n задаёт размер орбитали.
Форма и симметрия орбитали задаются орбитальными квантовыми числами l и m : s -орбитали являются сферически симметричными, p , d и f -орбитали имеют более сложную форму, определяемую угловыми частями волновой функции - угловыми функциями. Угловые функции Y lm (φ , θ) - собственные функции оператора квадрата углового момента L², зависящие от квантовых чисел l и m (см. Сферические функции), являются комплексными и описывают в сферических координатах (φ , θ) угловую зависимость вероятности нахождения электрона в центральном поле атома. Линейная комбинация этих функций определяет положение орбиталей относительно декартовых осей координат.
Для линейных комбинаций Y lm приняты следующие обозначения:
| Значение орбитального квантового числа | 0 | 1 | 1 | 1 | 2 | 2 | 2 | 2 | 2 |
|---|---|---|---|---|---|---|---|---|---|
| Значение магнитного квантового числа | 0 | 0 | 0 | ||||||
| Линейная комбинация | |||||||||
| Обозначение |
Дополнительным фактором, иногда учитываемым в геометрическом представлении, является знак волновой функции (фаза). Этот фактор существеннен для орбиталей с орбитальным квантовым числом l , отличным от нуля, то есть не обладающих сферической симметрией: знак волновой функции их «лепестков», лежащих по разные стороны узловой плоскости, противоположен. Знак волновой функции учитывается в методе молекулярных орбиталей МО ЛКАО (молекулярные орбитали как линейная комбинация атомных орбиталей). Сегодня науке известны математические уравнения, описывающие геометрические фигуры, представляющие орбитали (зависимотси координаты электрона от времени). Это уравнения гармонических колебаний отражающие вращение частиц по всем доступным степеням свободы - орбитальное вращение, спин,... Гибридизация орбиталей представляется как интерференция колебаний.
Заполнение орбиталей электронами и электронная конфигурация атома
На каждой орбитали может быть не более двух электронов, отличающихся значением спинового квантового числа s (спина). Этот запрет определён принципом Паули . Порядок заполнения электронами орбиталей одного уровня (орбиталей с одинаковым значением главного квантового числа n ) определяется правилом Клечковского , порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l ) определяется Правилом Хунда .
Краткую запись распределения электронов в атоме по различным электронным оболочкам атома с учётом их главного и орбитального квантовых чисел n и l называют
ОРБИТАЛЬ
ОРБИТАЛЬ , в ФИЗИКЕ ЭЛЕМЕНТАРНЫХ ЧАСТИЦ - поверхность пространства вокруг атомного ЯДРА, в которой могут двигаться ЭЛЕКТРОНЫ. Есть большая вероятность присутствия электрона на такой орбитали. Она может содержать один или два электрона. Орбиталь имеет форму и энергию, соответствующую КВАНТОВОМУ ЧИСЛУ атома. В молекулах электроны связи двигаются в объединенном электрическом поле всех ядер. В этом случае атомные орбитали становятся молекулярными орбиталями, областями, которые окружают два ядра, имеющих характерную энергию и содержащих два электрона. Эти молекулярные орбитали, образующиеся из атомных орбиталей, составляют ХИМИЧЕСКИЕ СВЯЗИ.
Атомные орбитали описывают поверхность вокруг ядра атома, в которой скорее всего находятся электроны. Их можно также назвать «энергетическими облаками». Их существованием объясняются химические связи. Электроны содержатся внутри атомных или молекулярных структур, выстраивающихся в энергетические уровни. Для первого уровня характерен только один тип электронов: на нем имеется одна s-орбиталь (А), показанная относительно осей атома х, у и z. Максимальное количество электронов,которые могут находиться на этом энергетическом уровне, равно двум. У второго типа элек тронов орбиталь имеет форму двух соединенных сфер, расположенных симметрично относительно ядра. Такая орбиталь называется р-орбиталью (В) V атома три таких орбитали, и расположены они под прямым углом друг к другу (1,2, 3) Орбитали, которые имеют правильные сферические очертания, для большей ясности картины принято условно обозначать в виде грушевидных облаков. Кроме того, существует также пять d-орбиталей (C-G), каждая из которых состоит из четырех грушевидных долей на двух перпендикулярных осях, пересекающихся в ядре G - комбинация двух р-орбиталей.
Научно-технический энциклопедический словарь .
Смотреть что такое "ОРБИТАЛЬ" в других словарях:
Орбиталь: Атомная орбиталь. Молекулярная орбиталь. Список значений слова или словосочетания со ссылками на соответствующие статьи. Если вы попали сюда из … Википедия
орбиталь - – полный набор волновых функций электрона, находящегося в поле нуклидов и усредненном поле всех остальных электронов, взаимодействующих с теми же нуклидами. Атомная орбиталь – разрешенное состояние электрона в атоме, геометрический образ,… … Химические термины
Ф ция пространственныхпеременных одного электрона, имеющая смысл волновой ф ции электрона, находящегосяв поле атомного или молекулярного остова. Если такая ф ция учитывает спинэлектрона, то она наз. спин О. Подробнее см. Молекулярная орбиталъ.… … Физическая энциклопедия
орбиталь - orbitale. физ. Атомные и и молекулярные волновые функции электрона, находящегося в поле одного или нескольких атомных ядер и в усредненном поле всех остальных электронов рассматриваемого атома или молекулы. НЭС 2000 … Исторический словарь галлицизмов русского языка
- (от лат. orbita путь, колея), волновая ф ция, описывающая состояние одного электрона в атоме, молекуле или др. квантовой системе. В общем случае квантовохим. термин О. используется для любой ф ции, зависящей от переменных х, у, z одного… … Химическая энциклопедия
орбиталь - orbitalė statusas T sritis chemija apibrėžtis Banginė funkcija, apibūdinanti elektrono judėjimą atome arba molekulėje; erdvė, kurioje elektrono buvimas labiausiai tikėtinas. atitikmenys: angl. orbital rus. орбиталь … Chemijos terminų aiškinamasis žodynas
орбиталь - orbitalė statusas T sritis fizika atitikmenys: angl. orbital vok. Orbital, n rus. орбиталь, f pranc. orbitale, f … Fizikos terminų žodynas
орбиталь - орбит аль, и … Русский орфографический словарь
орбиталь - с. Орбита буенча башкарыла торган. Орбита буенча хәрәкәт итә торган яки шуның өчен билгеләнгән … Татар теленең аңлатмалы сүзлеге
орбиталь - Функция, пространственных переменных одного электрона, имеющая смысл волновой функции отдельного электрона в поле эффективного атомного или молекулярного остова … Политехнический терминологический толковый словарь
Книги
- Комплект таблиц. Химия. Строение вещества (10 таблиц) , . Учебный альбом из 10 листов. Строение атома. Электронная орбиталь. Модели атомов некоторых элементов. Кристаллы. Химическая связь. Валентность. Степень окисления. Изометрия. Гомология. Арт.…
Атомная орбиталь - одноэлектронная волновая функция, полученная решением уравнения Шрёдингера для данного атома; задаётся: главным n, орбитальным l, и магнитным m - квантовыми числами. Единственный электрон атома водорода образует вокруг ядра сферическую орбиталь - шарообразное электронное облако, вроде неплотно намотанного клубка пушистой шерсти или ватного шарика.
Сферическую атомную орбиталь ученые договорились называть s-орбиталью . Она самая устойчивая и располагается довольно близко к ядру. Чем больше энергия электрона в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания и наконец превращается в гантелеобразную p-орбиталь :
Гибридизация орбиталей - гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
5.Тетраэдрическая модель атома углерода. Теория строения Бутлерова
Теория химического строения органических веществ была сформулирована А. М. Бутлеровым в 1861 году.
Основные положения теории строения сводятся к следующему:
1) в молекулах атомы соединены друг с другом в определенной последовательности в соответствии с их валентностью. Порядок связи атомов называется химическим строением;
2) свойства вещества зависят не только от того, какие атомы и в каком количестве входят в состав его молекулы, но и от того, в каком порядке они соединены между собой, т. е. от химического строения молекулы;
3) атомы или группы атомов, образовавшие молекулу, взаимно влияют друг на друга.
Основные представления о химическом строении, заложенные Бутлеровым, были дополнены Вант-Гоффом И Ле-Белем (1874), которые развили идею о пространственном расположении атомов в молекуле органич. в-ва и поставили вопрос о пространственной конфигурации и конформации молекул. Работа Вант-Гоффа положила начало направлению орг. Химии – стереохимии – учению о пространственном строении.Вант-Гофф предлоил тетраэдрическую модель атома углерода – четыре валентности атома в углерода в метане направлены к четырем углам тетраэдра, в центре которого находится углеродный атом, а на вершинах – атомы водорода.
Непредельные карбоновые кислоты
Химические свойства.
Химические свойства непредельных карбоновых кислот обусловлены как свойствами карбоксильной группы, так и свойствами двойной связи. Специфическими свойствами обладают кислоты с близко расположенной от карбоксильной группы двойной связью - альфа, бета-непредельные кислоты. У этих кислот присоединение галогеноводородов и гидратация идут против правила Марковникова:
СН 2 =СН-СООН + НВr -> СН 2 Вr-СН 2 -СООН
При осторожном окислении образуются диоксикислоты:
СН 2 =СН-СООН + [О] + Н 2 0 -> НО-СН 2 -СН(ОН)-СООН
При энергичном окислении происходит разрыв двойной связи и образуется смесь разных продуктов, по которым можно установить положение двойной связи. Олеиновая кислота С 17 Н 33 СООН - одна из важнейших высших непредельных кислот. Это - бесцветная жидкость, затвердевает на холоде. Ее структурная формула: СН 3 -(СН 2) 7 -СН=СН-(СН 2) 7 -СООН.
Производные карбоновых кислот
Производные карбоновых кислот - это соединения, в которых гидроксильная группа карбоновой кислоты замещена другой функциональной группой.


Просты́е эфи́ры - органические вещества, имеющие формулу R-O-R", где R и R" - углеводородные радикалы. Следует, однако, учитывать, что такая группа может входить в состав других функциональных групп соединений, не являющихся простыми эфирами
Сло́жные эфи́ры (или эсте́ры ) - производные оксокислот (как карбоновых, так и неорганических) с общей формулой R k E(=O) l (OH) m , где l ≠ 0, формально являющиеся продуктами замещения атомов водорода гидроксилов -OH кислотной функции на углеводородный остаток (алифатический, алкенильный, ароматический или гетероароматический); рассматриваются также как ацилпроизводные спиртов. В номенклатуре IUPAC к сложным эфирам относят также ацилпроизводные халькогенидных аналогов спиртов (тиолов, селенолов и теллуролов) .
Отличаются от простых эфиров (этеров), у которых два углеводородных радикала соединены атомом кислорода (R 1 -O-R 2)

Ами́ды - производные оксокислот (как карбоновых, так и минеральных) R k E(=O) l (OH) m , (l ≠ 0), формально являющиеся продуктами замещения гидроксильных групп -OH кислотной функции на аминогруппу (незамещенную и замещенную); рассматриваются также как ацилпроизводные аминов. Соединения с одним, двумя или тремя ацильными заместителями у атома азота называются первичными, вторичными и третичными амидами, вторичные амиды именуются также имидами.
Амиды карбоновых кислот - карбоксамиды RCO-NR 1 R 2 (где R 1 и R 2 - водород, ацил либо алкильный, арильный или другой углеводородный радикал) обычно именуются амидами, в случае других кислот в соответствии с рекомендациями IUPAC при именовании амида в качестве префикса указывается название кислотного остатка, например, амиды сульфокислот RS(=O 2 NH 2 именуются сульфамидами.
Хлорангидри́д карбо́новой кислоты́ (ацилхлорид) - производное карбоновой кислоты, в которой гидроксильная группа -OH в карбоксильной группе -COOH заменена на атом хлора. Общая формула R-COCl. Первый представитель с R=H (хлористый формил) не существует, хотя смесь CO и HCl в реакции Гаттермана - Коха ведёт себя подобно хлорангидриду муравьиной кислоты.
Получение
R-COOH + SOCl 2 → R-COCl + SO 2 + HCl
Нитри́лы - органические соединения общей формулы R-C≡N, формально являющиеся C-замещенными производными синильной кислоты HC≡N

Капрон (поли-ε-капроамид, найлон-6, полиамид 6)- синтетическое полиамидное волокно, получаемое из нефти, продукт поликонденсации капролактама
[-HN(CH 2) 5 CO-] n
В промышленности его получают путем полимеризации производного

Нейло́н (англ. nylon ) - семейство синтетических полиамидов, используемых преимущественно в производстве волокон.
Наиболее распространены два вида нейлона: полигексаметиленадипинамид (анид (СССР/Россия), найлон 66 (США)), часто называемый собственно нейлоном и поли-ε-капроамид (капрон (СССР/Россия), найлон 6 (США)). Известны также другие виды, например, поли-ω-энантоамид (энант (СССР/Россия), найлон 7 (США)) и поли-ω-ундеканамид (ундекан (СССР/Россия), найлон 11 (США), рильсан (Франция, Италия)
Формула волокна из анида: [-HN(CH 2) 6 NHOC(CH 2) 4 CO-] n . Анид синтезируется поликонденсацией адипиновой кислоты и гексаметилендиамина. Для обеспечения стехиометрического отношения реагентов 1:1, необходимого для получения полимера с максимальной молекулярной массой, используется соль адипиновой кислоты и гексаметилендиамина (АГ-соль ):
R = (CH 2) 4 , R" = (CH 2) 6
Формула волокна из капрона (найлона-6): [-HN(CH 2) 5 CO-] n . Синтез капрона из капролактама проводится гидролитической полимеризацией капролактама по механизму «раскрытие цикла - присоединение»:

Пластмассовые изделия могут изготавливаться из жёсткого нейлона - эколона, путём впрыскивания в форму жидкого нейлона под большим давлением, чем достигается бо́льшая плотность материала.

Классификафия









КЕТОКИСЛОТЫ - органические вещества, в состав молекул которых входят карбоксильные (COOH-) и карбонильные (-CO-) группы; служат предшественниками многих соединений, выполняющих важные биологические функции в организме. Существенные нарушения обмена веществ, имеющие место при ряде патологических состояний, сопровождаются повышением концентрации в организме человека тех или иных кетокислот
кето енольная таутомерия

Методы получения Альфа и Бета кетокислот
α-Кетокислоты получают окислением α-гидроксикислот.
β-Кетокислоты ввиду своей неустойчивости получают из сложных эфиров конденсацией Кляйзена.
В органической химии термин «реакция окисления» подразумевает, что окисляется именно органическое соединение, при этом окислителем в большинстве случаев является неорганический реагент.
Алкены
KMnO 4 и H 2 O (нейтральная среда)
3СH2=CH2 + 2KMnO 4 + 4H 2 O = 3C 2 H 4 (OH) 2 + 2MnO 2 + 2KOH - полное уравнение
(кислая среда)
идет разрыв двойной связи:
R-СH 2 =CH 2 -R + [O] → 2R-COOH - схематичное уравнение
Алкиларены
Эитлбензол- алкиларен


Кетоны
Кетоны к действию окислителей весьма устойчивы и окисляюся лишь сильными окислителями при нагревании. В процессе окисления происходит разрыв связей C-C по обе стороны карбонильной группы и в общем случае получается смесь четырех карбоновых кислот:
Окислению кетона предшествует его енолизация, которая может проходить как в щелочной, так и в кислой среде:


Ви́нная кислота́ (диоксиянтарная кислота, тартаровая кислота, 2, 3-дигидроксибутандиовая кислота) НООС-СН(ОН)-СН(ОН)-СООН - двухосновная оксикислота. Соли и анионы винной кислоты называют тартратами.
Известны три стереоизомерные формы винной кислоты: D-(-)-энантиомер (слева вверху), L-(+)-энантиомер (справа вверху) и мезо -форма (мезовинная кислота):


Диастереомеры - стереоизомеры, не являющиеся зеркальными отражениями друг друга . Диастереомерия возникает, когда соединение имеет несколько стереоцентров. Если два стереоизомера имеют противоположные конфигурации всех соответствующих стереоцентров, то они являются энантиомерами.

©2015-2019 сайт
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование.
Дата создания страницы: 2017-07-13