UNRENÉS
Hydrocarbures aromatiques (arènes) – les hydrocarbures cycliques, unis par la notion d’aromaticité, qui détermine des caractéristiques communes de structure et de propriétés chimiques.
Classification
En fonction du nombre de cycles benzéniques dans la molécule, les arènes sont divisées en sur le:
mononucléaire
multicœur

Nomenclature et isomérie
L'ancêtre structurel des hydrocarbures de la série benzénique est benzène C 6 H 6 d'où dérivent les noms systématiques des homologues.
Pour les composés monocycliques, les noms non systématiques (triviaux) suivants sont retenus :

La position des substituants est indiquée par les plus petits nombres (le sens de numérotation n'a pas d'importance),
|
|
|
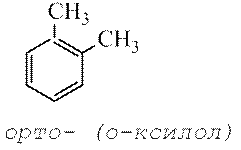
et pour les composés disubstitués vous pouvez utiliser la notation ortho, méta, paire.
|
|
|
|
S'il y a trois substituants dans le cycle, ils doivent recevoir les nombres les plus bas, c'est-à-dire la ligne « 1,2,4 » a un avantage sur « 1,3,4 ».


1,2-diméthyl-4-éthylbenzène (nom correct) 3,4-diméthyl-1-éthylbenzène (nom incorrect)
L'isomérie des arènes monosubstitués est due à la structure du squelette carboné du substituant ; dans les homologues du benzène di- et polysubstitués, une isomérie supplémentaire est ajoutée, causée par la disposition différente des substituants dans le noyau.
Isomérie des hydrocarbures aromatiques de composition C 9 H 12 :
|
|
|
|
|
Propriétés physiques
Les points d'ébullition et de fusion des arènes sont supérieurs à ceux des alcanes, alcènes, alcynes, ils sont légèrement polaires, insolubles dans l'eau et hautement solubles dans les solvants organiques non polaires. Les arènes sont des liquides ou des solides qui ont des odeurs spécifiques. Les benzènes et de nombreux arènes condensés sont toxiques, certains d'entre eux présentent des propriétés cancérigènes. Les produits intermédiaires de l'oxydation des arènes condensés dans l'organisme sont des époxydes, qui soit provoquent directement le cancer, soit sont des précurseurs de substances cancérigènes.
Obtenir des arènes
De nombreux hydrocarbures aromatiques revêtent une grande importance pratique et sont produits à grande échelle industrielle. Un certain nombre de méthodes industrielles reposent sur la transformation du charbon et du pétrole.
Le pétrole est principalement constitué d'hydrocarbures aliphatiques et alicycliques ; pour convertir les hydrocarbures aliphatiques ou acycliques en hydrocarbures aromatiques, des méthodes d'aromatisation de l'huile ont été développées, dont la base chimique a été développée par N.D. Zelinsky, B.A. Kazanski.
1. Cyclisation et déshydrogénation :
2. Hydrodéméthylation :

3. Les homologues du benzène sont préparés par alkylation ou acylation suivie d'une réduction du groupe carbonyle.
a) Alkylation de Friedel-Crafts :

b) Acylation de Friedel-Crafts :

4. Préparation du biphényle par la réaction de Wurtz-Fitting :
5. Préparation du diphénylméthane par la réaction de Friedel-Crafts :
Structure et propriétés chimiques.
Critères d'aromaticité :
Sur la base de calculs théoriques et d'études expérimentales de systèmes conjugués cycliques, il a été constaté qu'un composé est aromatique s'il possède :
- Squelette σ cyclique plat ;
- Un système d'électrons π fermé conjugué, couvrant tous les atomes de l'anneau et contenant 4n + 2, où n = 0, 1, 2, 3, etc. Cette formulation est connue sous le nom La règle de Hückel.

Les critères d'aromaticité permettent de distinguer les systèmes aromatiques conjugués de tous les autres. Le benzène contient un sextuor d'électrons π et suit la règle de Hückel à n = 1.
Que donne l'aromaticité :
Malgré le degré élevé d'insaturation, les composés aromatiques résistent aux agents oxydants et à la température, et ils sont plus susceptibles de subir des réactions de substitution plutôt que des réactions d'addition. Ces composés ont une stabilité thermodynamique accrue, qui est assurée par l'énergie de conjugaison élevée du système de noyaux aromatiques (150 kJ/mol), c'est pourquoi les arènes entrent de préférence dans des réactions de substitution, ce qui leur permet de conserver leur caractère aromatique.
Mécanisme des réactions de substitution électrophile dans le cycle aromatique :
La densité électronique du système π-conjugué du cycle benzénique est une cible pratique pour l’attaque par des réactifs électrophiles.
Généralement, les réactifs électrophiles sont générés lors d’une réaction utilisant des catalyseurs et des conditions appropriées.
E – Oui → E δ + – Oui δ - → E + + Oui - Formation d'un complexe π. L'attaque initiale par l'électrophile du nuage d'électrons π de l'anneau conduit à la coordination du réactif avec le système π et à la formation d'un complexe de type donneur-accepteur appeléπ-complexe.

Le système aromatique n’est pas perturbé : Formation du complexe σ. L'étape limite, dans laquelle l'électrophile forme une liaison covalente avec un atome de carbone grâce à deux électrons du système π de l'anneau, qui s'accompagne de la transition de cet atome de carbone deépisode 2 - Vépisode 3 -

Stabilisation du complexe σ. Elle est réalisée par abstraction d'un proton du complexe σ à l'aide d'une base. Dans ce cas, en raison de la rupture des deux électrons de la liaison covalente C – H, le système π fermé de l'anneau est restauré, c'est-à-dire la molécule revient à l'état aromatique :

Effet des substituants sur la réactivité et l'orientation de la substitution électrophile
Les substituants sur le cycle benzénique perturbent l'uniformité de la distribution π- nuage électronique de l'anneau et influencent ainsi la réactivité de l'anneau.
- Les substituants donneurs d'électrons (D) augmentent la densité électronique du cycle et augmentent le taux de substitution électrophile. Ces substituants sont appelés ; activation.
- Les substituants attracteurs d'électrons (A) réduisent la densité électronique du cycle et réduisent la vitesse de réaction, appelée décontaminant.
Hydrocarbures aromatiques– les composés du carbone et de l’hydrogène dont la molécule contient un cycle benzénique. Les représentants les plus importants des hydrocarbures aromatiques sont le benzène et ses homologues - produits du remplacement d'un ou plusieurs atomes d'hydrogène dans une molécule de benzène par des résidus d'hydrocarbures.
La structure de la molécule de benzène
Le premier composé aromatique, le benzène, fut découvert en 1825 par M. Faraday. Sa formule moléculaire a été établie - C 6 H 6. Si l'on compare sa composition avec la composition d'un hydrocarbure saturé contenant le même nombre d'atomes de carbone - l'hexane (C 6 H 14), alors on peut voir que le benzène contient huit atomes d'hydrogène de moins . Comme on le sait, l'apparition de liaisons et de cycles multiples entraîne une diminution du nombre d'atomes d'hydrogène dans une molécule d'hydrocarbure. En 1865, F. Kekule a proposé sa formule développée comme cyclohexanthriene - 1, 3, 5.

Ainsi, la molécule correspondant La formule de Kekule, contient des doubles liaisons, le benzène doit donc être insaturé, c'est-à-dire qu'il doit facilement subir des réactions d'addition : hydrogénation, bromation, hydratation, etc.
Cependant, les données de nombreuses expériences ont montré que le benzène n'entre dans les réactions d'addition que dans des conditions difficiles (à températures et éclairage élevés) et résiste à l'oxydation. Les réactions les plus caractéristiques sont les réactions de substitution ; le benzène est donc plus proche des hydrocarbures marginaux.
En essayant d'expliquer ces divergences, de nombreux scientifiques ont proposé diverses options pour la structure du benzène. La structure de la molécule de benzène a finalement été confirmée par la réaction de sa formation à partir de l'acétylène. En réalité, les liaisons carbone-carbone du benzène sont équivalentes et leurs propriétés ne sont pas similaires à celles des liaisons simples ou doubles.
Actuellement, le benzène est désigné soit par la formule de Kekule, soit par un hexagone dans lequel un cercle est représenté.
![]()
Alors, quelle est la particularité de la structure du benzène ? Sur la base des données et des calculs des chercheurs, il a été conclu que les six atomes de carbone sont dans un état sp 2 -hybridation et se situent dans le même plan. Non hybridé p-les orbitales des atomes de carbone qui composent les doubles liaisons (formule de Kekule) sont perpendiculaires au plan de l'anneau et parallèles entre elles.
Ils se chevauchent, formant un seul système π. Ainsi, le système de doubles liaisons alternées représenté dans la formule de Kekulé est un système cyclique de liaisons conjuguées qui se chevauchent. Ce système se compose de deux régions toroïdales (en forme de beignet) de densité électronique situées de chaque côté du cycle benzénique. Ainsi, il est plus logique de représenter le benzène comme un hexagone régulier avec un cercle au centre (système π) plutôt que comme un cyclohexatriène-1,3,5. 
Le scientifique américain L. Pauling a proposé de représenter le benzène sous la forme de deux structures limites qui diffèrent par la répartition de la densité électronique et se transforment constamment l'une dans l'autre, c'est-à-dire le considérer comme un composé intermédiaire, « faisant la moyenne » de deux structures.
Les mesures de longueur de liaison confirment ces hypothèses. Il a été constaté que toutes les liaisons C-C du benzène ont la même longueur (0,139 nm). Elles sont légèrement plus courtes que les liaisons simples C-C (0,154 nm) et plus longues que les doubles liaisons (0,132 nm).
Il existe également des composés dont les molécules contiennent plusieurs structures cycliques.

Isomérie et nomenclature
Les homologues du benzène sont caractérisés par isomérie de la position de plusieurs substituants. L'homologue le plus simple du benzène - le toluène (méthylbenzène) - ne possède pas de tels isomères ; l'homologue suivant se présente sous la forme de quatre isomères :

La base du nom d'un hydrocarbure aromatique avec de petits substituants est le mot benzène. Les atomes du cycle aromatique sont numérotés du substituant le plus élevé au plus petit :

Selon l'ancienne nomenclature, les positions 2 et 6 sont appelées orthopositions, 4 - paire-, et 3 et 5 - méta-dispositions.
Propriétés physiques
Dans des conditions normales, le benzène et ses homologues les plus simples sont des liquides très toxiques avec une odeur désagréable caractéristique. Ils se dissolvent mal dans l'eau, mais bien dans les solvants organiques.
Propriétés chimiques du benzène
Réactions de substitution. Les hydrocarbures aromatiques subissent des réactions de substitution.
1. Bromation. Lors d'une réaction avec le brome en présence d'un catalyseur, le bromure de fer (ΙΙΙ), l'un des atomes d'hydrogène du cycle benzénique peut être remplacé par un atome de brome :

2. Nitration du benzène et de ses homologues. Lorsqu'un hydrocarbure aromatique interagit avec l'acide nitrique en présence d'acide sulfurique (un mélange d'acides sulfurique et nitrique est appelé mélange nitrant), l'atome d'hydrogène est remplacé par un groupe nitro -NO2 :

En réduisant le nitrobenzène formé dans cette réaction, on obtient l'aniline, une substance utilisée pour obtenir des colorants anilines :

Cette réaction porte le nom du chimiste russe Zinin.
Réactions d'addition. Les composés aromatiques peuvent également subir des réactions d’addition au cycle benzénique. Dans ce cas, il se forme du cyclohexane ou ses dérivés.
1. Hydrogénation. L'hydrogénation catalytique du benzène se produit à une température plus élevée que l'hydrogénation des alcènes :
![]()
2. Chloration. La réaction se produit lorsqu’elle est éclairée par une lumière ultraviolette et est un radical libre :

Homologues du benzène
La composition de leurs molécules correspond à la formule C n H 2 n-6. Les homologues les plus proches du benzène sont :
Tous les homologues du benzène après le toluène ont des isomères. L'isomérie peut être associée à la fois au nombre et à la structure du substituant (1, 2), ainsi qu'à la position du substituant dans le cycle benzénique (2, 3, 4). Composés de formule générale C 8 H 10 :

Selon l'ancienne nomenclature utilisée pour indiquer la localisation relative de deux substituants identiques ou différents sur le cycle benzénique, les préfixes sont utilisés ortho- (en abrégé o-) - les substituants sont situés au niveau des atomes de carbone voisins, méta-(m-) – à travers un atome de carbone et paire— (P.-) – substituants les uns contre les autres.
Les premiers membres de la série homologue du benzène sont des liquides ayant une odeur spécifique. Ils sont plus légers que l'eau. Ce sont de bons solvants.
Les homologues du benzène réagissent substitutions ( bromation, nitration). Le toluène est oxydé par le permanganate lorsqu'il est chauffé :

Les homologues du benzène sont utilisés comme solvants pour produire des colorants, des produits phytopharmaceutiques, des plastiques et des médicaments.



















Les composés chimiques aromatiques, ou arènes, constituent un grand groupe de composés carbocycliques dont les molécules contiennent un anneau stable de six atomes de carbone. Il est appelé « cycle benzénique » et est responsable des propriétés physiques et chimiques particulières des arènes.
Les hydrocarbures aromatiques comprennent principalement le benzène et tous ses homologues et dérivés.
Les molécules d'arène peuvent contenir plusieurs cycles benzéniques. Ces composés sont appelés composés aromatiques polynucléaires. Par exemple, le naphtalène est un médicament bien connu pour protéger les produits en laine contre les mites.
Benzène
Ce représentant le plus simple des arènes est constitué uniquement d'un cycle benzénique. Sa formule moléculaire est C 6 Η 6. La formule développée de la molécule de benzène est le plus souvent représentée par la forme cyclique proposée par A. Kekule en 1865.
L’avantage de cette formule est qu’elle reflète avec précision la composition et l’équivalence de tous les atomes de C et H du cycle. Cependant, cela ne pouvait pas expliquer bon nombre des propriétés chimiques des arènes, donc l’affirmation sur la présence de trois doubles liaisons C=C conjuguées est erronée. Cela n’est devenu connu qu’avec l’avènement de la théorie moderne des connexions.
Aujourd’hui, la formule du benzène est souvent écrite de la manière proposée par Kekule. Premièrement, avec son aide, il est pratique d'écrire des équations de réactions chimiques. Deuxièmement, les chimistes modernes n’y voient qu’un symbole et non une structure réelle. La structure de la molécule de benzène est aujourd’hui véhiculée par différents types de formules développées.
Structure du cycle benzénique
La principale caractéristique du cycle benzénique est l'absence de liaisons simples et doubles au sens traditionnel du terme. Conformément aux concepts modernes, la molécule de benzène apparaît comme un hexagone plat dont les côtés mesurent 0,140 nm. Il s'avère que la longueur de la liaison C-C dans le benzène est une valeur intermédiaire entre simple (sa longueur est de 0,154 nm) et double (0,134 nm). Les liaisons C-H se situent également dans le même plan, formant un angle de 120° avec les bords de l'hexagone.
Chaque atome de C de la structure benzénique est dans l’état hybride sp2. Il est connecté via ses trois orbitales hybrides avec deux atomes de C situés à proximité et un atome de H, c'est-à-dire qu'il forme trois liaisons s. Une autre orbitale 2p, mais déjà non hybridée, chevauche les mêmes orbitales des atomes C voisins (à droite et à gauche). Son axe est perpendiculaire au plan de l'anneau, ce qui signifie que les orbitales se chevauchent au-dessus et en dessous de celui-ci. Dans ce cas, un système fermé commun d’électrons π est formé. En raison du chevauchement égal des orbitales 2p des six atomes de C, une sorte d’« égalisation » des liaisons C-C et C=C se produit.
Le résultat de ce processus est la similitude de ces liaisons « un et demi » avec des liaisons doubles et simples. Ceci explique le fait que les arènes présentent des propriétés chimiques caractéristiques à la fois des alcanes et des alcènes.
L'énergie de la liaison carbone-carbone dans le cycle benzénique est de 490 kJ/mol. C'est aussi la moyenne entre les énergies d'une double liaison simple et multiple.

Nomenclature des arènes
La base des noms d'hydrocarbures aromatiques est le benzène. Les atomes du cycle sont numérotés à partir du substituant le plus élevé. Si les substituants sont équivalents, alors la numérotation s'effectue selon le chemin le plus court.
Pour de nombreux homologues du benzène, des noms triviaux sont souvent utilisés : styrène, toluène, xylène, etc. Pour refléter la position relative des substituants, il est d'usage d'utiliser les préfixes ortho-, méta-, para-.
Si la molécule contient des groupes fonctionnels, par exemple carbonyle ou carboxyle, alors la molécule d'arène est considérée comme un radical aromatique qui lui est lié. Par exemple, -C 6 Η 5 - phényle, -C 6 Η 4 - phénylène, C 6 Η 5 -CH 2 - benzyle.
Propriétés physiques
Les premiers représentants de la série homologue du benzène sont des liquides incolores ayant une odeur spécifique. Leur poids est plus léger que l'eau, dans laquelle ils sont pratiquement insolubles, mais ils se dissolvent bien dans la plupart des solvants organiques.
Tous les hydrocarbures aromatiques brûlent avec une flamme enfumée, ce qui s'explique par la teneur élevée en C des molécules. Leurs points de fusion et d'ébullition augmentent avec l'augmentation du poids moléculaire dans la série homologue du benzène.
Propriétés chimiques du benzène
Parmi les différentes propriétés chimiques des arènes, les réactions de substitution doivent être mentionnées séparément. Certaines réactions d'addition qui se produisent dans des conditions et des processus d'oxydation particuliers sont également très importantes.
Réactions de substitution
Les électrons π assez mobiles du cycle benzénique sont capables de réagir très activement avec les électrophiles attaquants. Cette substitution électrophile implique le cycle benzénique lui-même dans le benzène et la chaîne hydrocarbonée associée chez ses homologues. Le mécanisme de ce processus a été étudié en détail par la chimie organique. Les propriétés chimiques des arènes associées à l’attaque électrophile se déroulent en trois étapes.
- Première étape. L'apparition du complexe π est due à la liaison du système d'électrons π du cycle benzénique à la particule X +, qui se lie à six électrons π.

La bromation du benzène en présence de bromures de fer ou d'aluminium sans chauffage conduit à la production de bromobenzène :
C 6 Η 6 + Br 2 —> C 6 Η 5 -Br + ΗBr.
La nitration avec un mélange d'acides nitrique et sulfurique conduit à la production de composés avec un groupe nitro dans le cycle :
C 6 Η 6 + ΗONO 2 -> C 6 Η 5 -NO 2 + Η 2 O.
La sulfonation est réalisée par un ion bisulfonium formé à la suite de la réaction :
3Η 2 SO 4 ⇄ SO 3 Η + + Η 3 O + + 2ΗSO 4 - ,
ou du trioxyde de soufre.
La réaction correspondant à cette propriété chimique des arènes est :
C 6 H 6 + SO 3 H + —> C 6 H 5 — SO 3 H + H + .
Les réactions de substitution alkyle et acyle, ou réactions de Friedel-Crafts, sont réalisées en présence d'AlCl 3 anhydre.

Ces réactions sont peu probables pour le benzène et se produisent difficilement. L'ajout d'halogénures d'hydrogène et d'eau au benzène ne se produit pas. Cependant, à très haute température en présence de platine, une réaction d'hydrogénation est possible :
C 6 Η 6 + 3H 2 -> C 6 H 12.
Lorsqu'elles sont irradiées par la lumière ultraviolette, les molécules de chlore peuvent rejoindre une molécule de benzène :
C 6 Η 6 + 3Cl 2 —> C 6 Η 6 Cl 6 .
Réactions d'oxydation
Le benzène est très résistant aux agents oxydants. Ainsi, il ne décolore pas la solution rose de permanganate de potassium. Cependant, en présence d'oxyde de vanadium, il peut être oxydé par l'oxygène de l'air en acide maléique :
C 6 H 6 + 4O -> COOΗ-CΗ = CΗ-COOΗ.
Dans l'air, le benzène brûle avec apparition de suie :
2C 6 Η 6 + 3O2 → 12C + 6 Η 2 O.
Propriétés chimiques des arènes
- Substitution.


Règles d'orientation
La position (o-, m- ou p-) que le substituant occupera lors de l'interaction de l'agent électrophile avec le cycle benzénique est déterminée par les règles suivantes :
- s'il y a déjà un substituant dans le cycle benzénique, alors c'est ce substituant qui dirige le groupe entrant vers une certaine position ;
- tous les substituants orienteurs sont divisés en deux groupes : les orientants du premier type dirigent le groupe d'atomes entrant vers les positions ortho et para (-NH 2, -OH, -CH 3, -C 2 H 5, halogènes) ; les orientants du deuxième type dirigent les substituants entrants vers la position méta (-NO 2, -SO 3 H, -COHO, -COOH).
Les orientations sont répertoriées ici par ordre de force directionnelle décroissante.
Il convient de noter que cette division des substituants de groupe est conditionnelle, car dans la plupart des réactions, la formation des trois isomères est observée. Les orientants influencent uniquement lequel des isomères sera obtenu en plus grande quantité.
Obtenir des arènes
Les principales sources d'arènes sont la distillation sèche du charbon et le raffinage du pétrole. Le goudron de houille contient une énorme quantité d’hydrocarbures aromatiques de toutes sortes. Certains types d’huile contiennent jusqu’à 60 % d’arènes, qui peuvent être facilement isolés par simple distillation, pyrolyse ou craquage.
Les méthodes de préparation synthétique et les propriétés chimiques des arènes sont souvent liées. Le benzène, comme ses homologues, est obtenu de l'une des manières suivantes.
1. Reformage des produits pétroliers. La déshydrogénation des alcanes est la méthode industrielle la plus importante pour la synthèse du benzène et de plusieurs de ses homologues. La réaction est réalisée en faisant passer des gaz sur un catalyseur chauffé (oxydes de Pt, Cr 2 O 3, Mo et V) à t = 350-450 o C :
C 6 H 14 —> C 6 Η 6 + 4 Η 2.
2. Réaction de Wurtz-Fittig. Elle s'effectue à travers l'étape d'obtention de composés organométalliques. A la suite de la réaction, plusieurs produits peuvent être obtenus.
3. Trimérisation de l'acétylène. L'acétylène lui-même, comme ses homologues, est capable de former des arènes lorsqu'il est chauffé avec un catalyseur :
3C 2 Η 2 -> C 6 Η 6.
4. Réaction de Friedel-Crafts. La méthode d'obtention et de conversion des homologues du benzène a déjà été discutée ci-dessus dans les propriétés chimiques des arènes.
5. Préparation à partir des sels correspondants. Le benzène peut être isolé en distillant des sels d'acide benzoïque avec un alcali :
C 6 Η 5 -COONa + NaOΗ —> C 6 Η 6 + Na 2 CO 3 .
6. Réduction des cétones :
C 6 Η 5 -CO-CΗ 3 + Zn + 2ΗCl —> C 6 Η 5 -CΗ 2 -CΗ 3 + Η 2 O + ZnCl 2 ;
CΗ 3 -C 6 Η 5 -CO-CΗ 3 + NΗ 2 -NΗ 2 —> CΗ 3 -C 6 Η 5 -CΗ 2 -CΗ 3 + Η 2 O.
Application des arènes
Les propriétés chimiques et les domaines d'application des arènes sont directement liés, puisque la majeure partie des composés aromatiques est utilisée pour une synthèse ultérieure dans la production chimique et n'est pas utilisée sous forme finie. L'exception concerne les substances utilisées comme solvants.
Le benzène C 6 × 6 est principalement utilisé dans la synthèse de l'éthylbenzène, du cumène et du cyclohexane. Sur cette base, des produits intermédiaires sont obtenus pour la production de divers polymères : caoutchoucs, plastiques, fibres, colorants, tensioactifs, insecticides et médicaments.

Le toluène C 6 H 5 -CH 3 est utilisé dans la production de colorants, de médicaments et d'explosifs.
Les xylènes C 6 Η 4 (C 3) 2 sous forme mixte (xylène technique) sont utilisés comme solvant ou matière première pour la synthèse de substances organiques.
L'isopropylbenzène (ou cumène) C 6 H 4 -C H (C H 3) 2 est le réactif de départ pour la synthèse du phénol et de l'acétone.
Le vinylbenzène (styrène) C 6 Η 5 -CΗ=CΗ 2 est la matière première pour la production du matériau polymère le plus important - le polystyrène.
DÉFINITION
Hydrocarbures aromatiques (arènes)– les substances dont les molécules contiennent un ou plusieurs cycles benzéniques. Formule générale de la série homologue du benzène C n H 2 n -6
Les représentants les plus simples des hydrocarbures aromatiques sont le benzène - C 6 H 6 et le toluène - C 6 H 5 -CH 3. Les radicaux hydrocarbonés obtenus à partir des arènes sont appelés : C 6 H 5 - - phényle (Ph-) et C 6 H 5 -CH 2 - - benzyle.
Les six atomes de carbone de la molécule de benzène sont à l'état hybride sp 2 . Chaque atome de carbone forme des liaisons 3σ avec deux autres atomes de carbone et un atome d'hydrogène, situés dans le même plan. Six atomes de carbone forment un hexagone régulier (σ-squelette de la molécule de benzène).
Chaque atome de carbone possède une orbitale p non hybridée contenant un électron. Six électrons p forment un seul nuage d'électrons π (système aromatique), représenté par un cercle à l'intérieur d'un anneau à six chaînons.
Propriétés chimiques des arènes
Le benzène et ses homologues sont caractérisés par des réactions de substitution qui se produisent via un mécanisme électrophile :
- halogénation (le benzène réagit avec le chlore et le brome en présence de catalyseurs - AlCl 3 anhydre, FeCl 3, AlBr 3)
C 6 H 6 + Cl 2 = C 6 H 5 -Cl + HCl
- nitration (le benzène réagit facilement avec le mélange nitrant - un mélange d'acides nitrique et sulfurique concentrés)

- alkylation avec des alcènes
C 6 H 6 + CH 2 = CH-CH 3 → C 6 H 5 -CH(CH 3) 2
Les réactions d'addition au benzène entraînent la destruction du système aromatique et ne se produisent que dans des conditions difficiles :
— hydrogénation (la réaction se produit lorsqu'elle est chauffée, le catalyseur est du Pt)

- ajout de chlore (se produit sous l'influence du rayonnement UV avec formation d'un produit solide - hexachlorocyclohexane (hexachlorane) - C 6 H 6 Cl 6)

Propriétés physiques des arènes
Les premiers membres de la série homologue du benzène sont des liquides incolores ayant une odeur spécifique. Ils sont plus légers que l’eau et pratiquement insolubles. Ils se dissolvent bien dans les solvants organiques et sont eux-mêmes de bons solvants.
Obtenir des arènes
Les principales méthodes d'obtention du benzène et de ses homologues :
— déshydrocyclisation des alcanes (catalyseurs – Pt, Cr 3 O 2)

— déshydrogénation des cycloalcanes (la réaction se produit lorsqu'il est chauffé, le catalyseur est du Pt)

— trimérisation de l'acétylène (la réaction se produit lorsqu'il est chauffé à 600C, le catalyseur est du charbon actif)
3HC≡CH → C6H6
- alkylation des benzènes (réaction de Friedel-Crafts) (catalyseur - chlorure d'aluminium ou acide phosphorique)

Exemples de résolution de problèmes
EXEMPLE 1
| Exercice | La densité de vapeur de la substance est de 3,482 g/l. Sa pyrolyse a donné 6 g de suies et 5,6 l d'hydrogène. Déterminez la formule de cette substance. |
| Solution | Trouvons la quantité de suie (carbone) : v(C) = m(C)/M(C) v(C) = 6/12 = 0,5 mole Trouvons la quantité de substance hydrogène : v(H 2) = V(H 2)/V m v(H 2) = 5,6/22,4 = 0,25 mole Par conséquent, la quantité de substance d'un atome d'hydrogène sera égale à : v(H) = 2×0,25 = 0,5 mole Notons le nombre d'atomes de carbone dans une molécule d'hydrocarbure par x et le nombre d'atomes d'hydrogène par y, alors le rapport de ces atomes dans la molécule est : x:y = 0,5 : 0,5 = 1:1 La formule la plus simple de l'hydrocarbure CH Le poids moléculaire d'un hydrocarbure est : M(C x H y) = ρ×V m = 3,482×22,4 = 78 g/mol Le poids moléculaire d'une molécule de composition CH est égal à : M(CH) = 13 g/mol n = M(C x H y)/ M(CH) = 78/13 = 6, par conséquent, les coefficients x et y doivent être multipliés par 6, alors l'hydrocarbure souhaité a la composition C 6 H 6 - c'est le benzène |
Considération générale.
Les hydrocarbures aromatiques (arènes) sont des substances dont les molécules contiennent un ou plusieurs cycles benzéniques - des groupes cycliques d'atomes de carbone avec une nature particulière de liaisons.
La notion de « cycle benzénique » nécessite immédiatement un décodage. Pour ce faire, il est nécessaire de considérer au moins brièvement la structure de la molécule de benzène. La première structure du benzène a été proposée en 1865 par le scientifique allemand A. Kekule :
Cette formule reflète correctement l'équivalence de six atomes de carbone, mais n'explique pas un certain nombre de propriétés particulières du benzène. Par exemple, bien qu'insaturé, le benzène ne présente pas de tendance aux réactions d'addition : il ne décolore pas l'eau bromée et une solution de permanganate de potassium, c'est-à-dire ne donne pas de réactions qualitatives typiques des composés insaturés.
Les caractéristiques structurelles et les propriétés du benzène n'ont été pleinement expliquées qu'après le développement de la théorie moderne de la mécanique quantique des liaisons chimiques. Selon les concepts modernes, les six atomes de carbone de la molécule de benzène sont à l’état hybride. Chaque atome de carbone forme des liaisons avec deux autres atomes de carbone et un atome d'hydrogène, situés dans le même plan. Les angles de liaison entre les trois liaisons sont de 120°. Ainsi, les six atomes de carbone se trouvent dans le même plan, formant un hexagone régulier (le squelette d'une molécule de benzène).
Chaque atome de carbone possède une orbitale p non hybridée.
Six de ces orbitales sont situées perpendiculairement au squelette plat et parallèles les unes aux autres (Fig. 21.1, a). Les six électrons p interagissent les uns avec les autres, formant des liaisons qui ne sont pas localisées par paires, comme dans la formation de doubles liaisons ordinaires, mais sont combinées en un seul nuage d'électrons. Ainsi, une conjugaison circulaire se produit dans la molécule de benzène (voir § 19). La densité d'électrons la plus élevée dans ce système conjugué est située au-dessus et en dessous du plan du squelette (Fig. 21.1, b).

Riz. 21.1. La structure de la molécule de benzène
En conséquence, toutes les liaisons entre les atomes de carbone du benzène sont alignées et ont une longueur de 0,139 nm. Cette valeur est intermédiaire entre la longueur d'une simple liaison dans les alcanes (0,154 nm) et la longueur d'une double liaison dans les alcènes (0,133 nm). L'équivalence des connexions est généralement représentée par un cercle à l'intérieur du cycle (Fig. 21.1, c). La conjugaison circulaire donne un gain d'énergie de 150 kJ/mol. Cette valeur constitue l'énergie de conjugaison - la quantité d'énergie qui doit être dépensée pour perturber le système aromatique du benzène (à comparer - l'énergie de conjugaison dans le butadiène n'est que de 12 kJ/mol).
Cette structure électronique explique toutes les caractéristiques du benzène. En particulier, il est clair pourquoi le benzène entre difficilement dans les réactions d'addition - cela conduirait à une violation de la conjugaison. De telles réactions ne sont possibles que dans des conditions très difficiles.
Nomenclature et isomérie.
Classiquement, les arènes peuvent être divisées en deux rangées. Le premier comprend les dérivés du benzène (par exemple le toluène ou le biphényle), le second comprend les arènes condensées (polynucléaires) (le plus simple d'entre eux est le naphtalène) :

Nous ne considérerons que la série homologue du benzène de formule générale.
L'isomérie structurelle dans la série homologue du benzène est due à la disposition mutuelle des substituants dans le noyau. Les dérivés du benzène monosubstitués n'ont pas d'isomères de position, puisque tous les atomes du cycle benzénique sont équivalents. Les dérivés disubstitués existent sous la forme de trois isomères, différant par la disposition relative des substituants. La position des substituants est indiquée par des chiffres ou des préfixes :

Les radicaux des hydrocarbures aromatiques sont appelés radicaux aryles. Le radical s'appelle phényle.
Propriétés physiques.
Les premiers membres de la série homologue du benzène (par exemple le toluène, l'éthylbenzène, etc.) sont des liquides incolores ayant une odeur spécifique. Ils sont plus légers que l'eau et insolubles dans l'eau. Ils se dissolvent bien dans les solvants organiques. Le benzène et ses homologues sont eux-mêmes de bons solvants pour de nombreuses substances organiques. Toutes les arènes brûlent avec une flamme enfumée en raison de la teneur élevée en carbone de leurs molécules.
Modalités d'obtention.
1. Préparation à partir d'hydrocarbures aliphatiques. Lorsque des alcanes à chaîne droite contenant au moins 6 atomes de carbone par molécule sont passés sur du platine ou de l'oxyde de chrome chauffé, une déshydrocyclisation se produit - la formation d'un arène avec libération d'hydrogène :
2. Déshydrogénation des cycloalcanes. La réaction se produit en faisant passer des vapeurs de cyclohexane et de ses homologues sur du platine chauffé :

3. Préparation du benzène par trimérisation de l'acétylène - voir § 20.
4. Obtention d'homologues du benzène à l'aide de la réaction de Friedel-Crafts - voir ci-dessous.
5. Fusion de sels d'acides aromatiques avec des alcalis :
Propriétés chimiques.
Considération générale. Possédant six électrons mobiles, le noyau aromatique est un objet pratique pour l'attaque des réactifs électrophiles. Ceci est également facilité par la disposition spatiale du nuage électronique des deux côtés du squelette plat de la molécule (Fig. 21.1, b)
Les réactions les plus typiques pour les arènes sont celles qui se déroulent par le mécanisme de substitution électrophile, désigné par le symbole (de l'anglais substitution électrophile).
Le mécanisme de substitution électrophile peut être représenté comme suit. Le réactif électrophile XY (X est un électrophile) attaque le nuage électronique et, en raison d'une faible interaction électrostatique, un complexe instable se forme. Le système aromatique n’est pas encore perturbé. Cette étape se déroule rapidement. Dans la deuxième étape, plus lente, une liaison covalente se forme entre l'électrophile X et l'un des atomes de carbone du cycle grâce à deux électrons du cycle. Cet atome de carbone passe de l’état hybride. Dans ce cas, l'arôme du système est perturbé. Les quatre électrons restants sont partagés entre cinq autres atomes de carbone et la molécule de benzène forme un carbocation, ou complexe.

La perturbation de l'aromaticité est énergétiquement défavorable, donc la structure du complexe β est moins stable que la structure aromatique. Pour restaurer l'aromaticité, un proton est retiré de l'atome de carbone lié à l'électrophile (troisième étape). Dans ce cas, deux électrons reviennent au système -, et ainsi l'aromaticité est restaurée :

Les réactions de substitution électrophile sont largement utilisées pour la synthèse de nombreux dérivés du benzène.
Propriétés chimiques du benzène.
1. Halogénation. Le benzène ne réagit pas avec le chlore ou le brome dans des conditions normales. La réaction ne peut avoir lieu qu'en présence de catalyseurs anhydres. À la suite de la réaction, des arènes halogènes se forment :

Le rôle du catalyseur est de polariser une molécule halogène neutre pour en former une particule électrophile :
2. Nitration. Le benzène réagit très lentement avec l'acide nitrique concentré, même lorsqu'il est chauffé. Cependant, sous l'action du mélange dit nitrant (un mélange d'acides nitrique et sulfurique concentrés), la réaction de nitration se produit assez facilement :
3. Sulfonation. La réaction s'effectue facilement sous l'influence de l'acide sulfurique « fumant » (oléum) :
4. Alkylation de Friedel-Crafts. À la suite de la réaction, un groupe alkyle est introduit dans le cycle benzénique pour produire des homologues du benzène. La réaction se produit lorsque le benzène est exposé à des haloalcanes en présence de catalyseurs - les halogénures d'aluminium. Le rôle du catalyseur se réduit à la polarisation de la molécule avec formation d'une particule électrophile :
Selon la structure du radical dans l'haloalcane, différents homologues du benzène peuvent être obtenus :
5. Alkylation avec des alcènes. Ces réactions sont largement utilisées industriellement pour produire de l'éthylbenzène et de l'isopropylbenzène (cumène). L'alkylation est réalisée en présence d'un catalyseur. Le mécanisme de la réaction est similaire au mécanisme de la réaction précédente :
Toutes les réactions discutées ci-dessus se déroulent par le mécanisme de substitution électrophile.
Les réactions d'addition aux arènes conduisent à la destruction du système aromatique et nécessitent de grandes quantités d'énergie, elles ne se produisent donc que dans des conditions difficiles.
6. Hydrogénation. La réaction d'addition d'hydrogène aux arènes se produit sous chauffage et haute pression en présence de catalyseurs métalliques (Ni, Pt, Pd). Le benzène est converti en cyclohexane et les homologues du benzène sont convertis en dérivés du cyclohexane :

7. Halogénation radicale. L'interaction des vapeurs de benzène avec le chlore se produit via un mécanisme radicalaire uniquement sous l'influence d'un rayonnement ultraviolet dur. Dans ce cas, le benzène ajoute trois molécules de chlore et forme un produit solide - l'hexachlorocyclohexane :

8. Oxydation par l'oxygène de l'air. En termes de résistance aux agents oxydants, le benzène ressemble aux alcanes. Ce n'est qu'en chauffant fortement (400 °C) de la vapeur de benzène avec l'oxygène de l'air en présence d'un catalyseur qu'on obtient un mélange d'acide maléique et de son anhydride :

Propriétés chimiques des homologues du benzène.
Les homologues du benzène ont un certain nombre de propriétés chimiques particulières associées à l'influence mutuelle du radical alkyle sur le cycle benzénique, et vice versa.
Réactions en chaîne secondaire. Les propriétés chimiques des radicaux alkyles sont similaires à celles des alcanes. Les atomes d'hydrogène qu'ils contiennent sont remplacés par des halogènes par un mécanisme de radicaux libres. Par conséquent, en l’absence de catalyseur, lors d’un chauffage ou d’une irradiation UV, une réaction de substitution radicalaire se produit dans la chaîne latérale. L'influence du cycle benzénique sur les substituants alkyle conduit au fait que l'atome d'hydrogène au niveau de l'atome de carbone directement lié au cycle benzénique (atome de carbone a) est toujours remplacé.

La substitution dans le cycle benzénique n'est possible que par le mécanisme en présence d'un catalyseur :
Vous découvrirez ci-dessous lesquels des trois isomères du chlorotoluène se forment lors de cette réaction.
Lorsque les homologues du benzène sont exposés au permanganate de potassium et à d’autres agents oxydants puissants, les chaînes latérales sont oxydées. Quelle que soit la complexité de la chaîne du substituant, elle est détruite, à l'exception de l'atome de carbone -, qui est oxydé en un groupe carboxyle.
Les homologues du benzène avec une chaîne latérale donnent l'acide benzoïque :

Règles d'orientation (substitution) dans le cycle benzénique.
Le facteur le plus important déterminant les propriétés chimiques d’une molécule est la répartition de la densité électronique. La nature de la distribution dépend de l'influence mutuelle des atomes.
Dans les molécules qui n'ont que des liaisons -, l'influence mutuelle des atomes se produit par effet inductif (voir § 17). Dans les molécules qui sont des systèmes conjugués, l'effet mésomère se manifeste.
L'influence des substituants transmis par un système conjugué de liaisons - est appelée effet mésomère (M).
Dans une molécule de benzène, le nuage électronique est réparti uniformément sur tous les atomes de carbone en raison de la conjugaison.
Si un substituant est introduit dans le cycle benzénique, cette distribution uniforme est perturbée et une redistribution de la densité électronique dans le cycle se produit. L'endroit où le deuxième substituant entre dans le cycle benzénique est déterminé par la nature du substituant existant.
Les substituants sont divisés en deux groupes selon l'effet qu'ils présentent (mésomère ou inductif) : supporteur d'électrons et attracteur d'électrons.
Les substituants donneurs d'électrons ont un effet et augmentent la densité électronique dans le système conjugué. Ceux-ci incluent le groupe hydroxyle -OH et le groupe amino. La paire libre d'électrons de ces groupes entre en conjugaison générale avec le système électronique du cycle benzénique et augmente la longueur du système conjugué. En conséquence, la densité électronique est concentrée dans les positions ortho et para :

Les groupes alkyle ne peuvent pas participer à la conjugaison générale, mais ils présentent un effet sous lequel une redistribution similaire de la densité électronique se produit.
Les substituants attracteurs d'électrons présentent un effet -M et réduisent la densité électronique dans le système conjugué. Ceux-ci incluent le groupe nitro, le groupe sulfo, les groupes aldéhyde -CHO et carboxyle -COOH. Ces substituants forment un système conjugué commun avec le cycle benzénique, mais le nuage électronique global se déplace vers ces groupes. Ainsi, la densité électronique totale dans l’anneau diminue, et elle diminue le moins aux positions méta :
Par exemple, le toluène contenant un substituant du premier type est nitré et bromé en positions para et ortho :

Le nitrobenzène contenant un substituant du deuxième type est nitré et bromé en position méta :

En plus de l'effet orienteur, les substituants influencent également la réactivité du cycle benzénique : les orientants de la 1ère sorte (sauf les halogènes) facilitent l'entrée du deuxième substituant ; Les orientants du 2ème type (et les halogènes) rendent la tâche difficile.