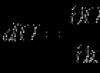O.S.ZAYTSEV
LIVRE DE CHIMIE
POUR LES ENSEIGNANTS DU SECONDAIRE,
ÉTUDIANTS DES UNIVERSITÉS PÉDAGOGIQUES ET ÉCOLIERS DE 9 À 10 ANNÉES,
QUI A DÉCIDÉ DE SE CONSACTER À LA CHIMIE ET AUX SCIENCES NATURELLES
MANUEL DE TÂCHES DE LABORATOIRE HISTOIRES SCIENTIFIQUES PRATIQUES À LIRE
Continuation. Voir n° 4-14, 16-28, 30-34, 37-44, 47, 48/2002 ;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44 , 46, 47/2003;
1, 2, 3, 4, 5, 7, 11, 13, 14, 16, 17, 20, 22, 24/2004
§8.1. Réactions redox
RECHERCHE EN LABORATOIRE
(continuation)
2. L'ozone est un agent oxydant.
L'ozone est la substance la plus importante pour la nature et l'homme.
L'ozone crée une ozonosphère autour de la Terre à une altitude de 10 à 50 km avec une teneur maximale en ozone à une altitude de 20 à 25 km. Situé dans les couches supérieures de l'atmosphère, l'ozone ne permet pas à la plupart des rayons ultraviolets du soleil, qui ont un effet néfaste sur les humains, les animaux et les plantes, d'atteindre la surface de la Terre. Ces dernières années, des zones de l'ozonosphère avec une teneur en ozone considérablement réduite, appelées trous d'ozone, ont été découvertes. On ne sait pas si des trous dans la couche d’ozone se sont déjà formés. Les raisons de leur apparition ne sont pas non plus claires. On pense que les fréons contenant du chlore provenant des réfrigérateurs et des pots de parfum, sous l'influence du rayonnement ultraviolet du Soleil, libèrent des atomes de chlore qui réagissent avec l'ozone et réduisent ainsi sa concentration dans les couches supérieures de l'atmosphère. Les scientifiques sont extrêmement préoccupés par le danger que représentent les trous d’ozone dans l’atmosphère.
Dans les couches inférieures de l'atmosphère, l'ozone se forme à la suite d'une série de réactions séquentielles entre l'oxygène atmosphérique et les oxydes d'azote émis par les moteurs des voitures mal réglés et les rejets des lignes électriques à haute tension.
L'ozone est très nocif pour la respiration : il détruit les tissus des bronches et des poumons. L'ozone est extrêmement toxique (plus puissant que le monoxyde de carbone). La concentration maximale admissible dans l'air est de 10 à 5 %.
L'ozone, ainsi que le chlore, sont utilisés pour traiter l'eau afin de décomposer les impuretés organiques et de tuer les bactéries. Cependant, la chloration et l’ozonation de l’eau présentent toutes deux des avantages et des inconvénients. Lorsque l'eau est chlorée, les bactéries sont presque complètement détruites, mais des substances organiques de nature cancérigène nocives pour la santé (favorisent le développement du cancer) se forment - dioxines et composés similaires. Lorsque l'eau est ozonisée, de telles substances ne se forment pas, mais l'ozone ne tue pas toutes les bactéries, et les bactéries vivantes restantes se multiplient abondamment après un certain temps, absorbant les restes des bactéries tuées, et l'eau devient encore plus contaminée par la flore bactérienne. Par conséquent, l’ozonation de l’eau potable est mieux utilisée lorsqu’elle est utilisée rapidement. L'ozonation de l'eau des piscines est très efficace lorsque l'eau circule en permanence dans l'ozoniseur. L'ozone est également utilisé pour la purification de l'air. C'est l'un des agents oxydants respectueux de l'environnement qui ne laisse pas de produits nocifs issus de sa décomposition.
L'ozone oxyde presque tous les métaux à l'exception des métaux du groupe de l'or et du platine.
Les méthodes chimiques de production d'ozone sont inefficaces ou trop dangereuses. Nous vous conseillons donc de vous procurer de l'ozone mélangé à l'air dans un ozoniseur (effet d'une faible décharge électrique sur l'oxygène) disponible dans le laboratoire de physique de l'école.
L'ozone est le plus souvent obtenu en agissant sur l'oxygène gazeux avec une décharge électrique silencieuse (sans lueur ni étincelles), qui se produit entre les parois des récipients internes et externes de l'ozonateur. L'ozoniseur le plus simple peut être facilement fabriqué à partir de tubes de verre munis de bouchons. Vous comprendrez comment procéder à partir de la Fig. 8.4. L'électrode intérieure est une tige métallique (clou long), l'électrode extérieure est une spirale métallique. L'air peut être soufflé avec une pompe à air d'aquarium ou une poire en caoutchouc provenant d'un flacon pulvérisateur. Sur la fig. 8.4 L'électrode interne est située dans un tube de verre ( Pourquoi penses-tu ?), mais vous pouvez assembler un ozoniseur sans cela.
 |
Les bouchons en caoutchouc sont rapidement corrodés par l'ozone.
Il est pratique d'obtenir une haute tension de la bobine d'induction du système d'allumage de la voiture en ouvrant continuellement la connexion à une source basse tension (batterie ou redresseur 12 V).
L'ozone peut être détecté qualitativement à l'aide d'une solution d'amidon d'iodure de potassium. Une bande de papier filtre peut être trempée dans cette solution, ou la solution peut être ajoutée à de l'eau ozonisée, et de l'air contenant de l'ozone peut passer à travers la solution dans un tube à essai. L'oxygène ne réagit pas avec l'ion iodure.
Équation de réaction :
2I – + O 3 + H 2 O = I 2 + O 2 + 2OH – .
Écrivez les équations des réactions de gain et de perte d’électrons.
Apportez une bande de papier filtre imbibée de cette solution à l'ozoniseur. (Pourquoi la solution d’iodure de potassium doit-elle contenir de l’amidon ?) Le peroxyde d'hydrogène interfère avec la détermination de l'ozone à l'aide de cette méthode. (Pourquoi?).
Calculez la FEM de la réaction à l'aide des potentiels d'électrode :
3. Propriétés réductrices du sulfure d’hydrogène et des ions sulfure.
Le sulfure d'hydrogène est un gaz incolore à l'odeur d'œuf pourri (certaines protéines contiennent du soufre).
Pour mener des expériences avec le sulfure d'hydrogène, vous pouvez utiliser du sulfure d'hydrogène gazeux, en le faisant passer à travers une solution contenant la substance étudiée, ou ajouter de l'eau sulfurée d'hydrogène pré-préparée aux solutions étudiées (c'est plus pratique). De nombreuses réactions peuvent être réalisées avec une solution de sulfure de sodium (réactions avec l'ion sulfure S 2–).
Travaillez avec du sulfure d'hydrogène uniquement sous courant d'air ! Les mélanges de sulfure d'hydrogène avec l'air brûlent de manière explosive.
Le sulfure d'hydrogène est généralement produit dans un appareil Kipp en faisant réagir 25 % d'acide sulfurique (dilué 1:4) ou 20 % d'acide chlorhydrique (dilué 1:1) sur du sulfure de fer sous forme de morceaux de 1 à 2 cm. Équation de réaction :
FeS (cr.) + 2H + = Fe 2+ + H 2 S (g.).
De petites quantités de sulfure d'hydrogène peuvent être obtenues en plaçant du sulfure de sodium cristallin dans un flacon bouché à travers lequel sont passés une ampoule à brome avec un robinet et un tube de sortie. Verser lentement 5 à 10 % d'acide chlorhydrique de l'entonnoir (pourquoi pas du soufre ?), le flacon est constamment secoué pour éviter l'accumulation locale d'acide n'ayant pas réagi. Si cela n'est pas fait, un mélange inattendu des composants peut entraîner une réaction violente, l'expulsion du bouchon et la destruction du flacon.
Un flux uniforme de sulfure d'hydrogène est obtenu en chauffant des composés organiques riches en hydrogène, comme la paraffine, avec du soufre (1 partie de paraffine pour 1 partie de soufre, 300°C).
Pour obtenir de l'eau sulfurée d'hydrogène, le sulfure d'hydrogène est passé dans de l'eau distillée (ou bouillie). Environ trois volumes de sulfure d’hydrogène gazeux se dissolvent dans un volume d’eau. Lorsqu'elle est dans l'air, l'eau sulfurée d'hydrogène devient progressivement trouble. (Pourquoi?).
Le sulfure d'hydrogène est un agent réducteur puissant : il réduit les halogènes en halogénures d'hydrogène et l'acide sulfurique en dioxyde de soufre et en soufre.
Le sulfure d'hydrogène est toxique. La concentration maximale admissible dans l'air est de 0,01 mg/l. Même à faible concentration, le sulfure d'hydrogène irrite les yeux et les voies respiratoires et provoque des maux de tête. Des concentrations supérieures à 0,5 mg/l mettent la vie en danger. À des concentrations plus élevées, le système nerveux est affecté. L'inhalation de sulfure d'hydrogène peut provoquer un arrêt cardiaque et respiratoire. Parfois, le sulfure d'hydrogène s'accumule dans les grottes et les puits d'égout, et une personne piégée là-bas perd instantanément connaissance et meurt.
Dans le même temps, les bains d'hydrogène sulfuré ont un effet cicatrisant sur le corps humain.
3a. Réaction du sulfure d'hydrogène avec le peroxyde d'hydrogène.
Étudiez l’effet de la solution de peroxyde d’hydrogène sur l’eau sulfurée d’hydrogène ou la solution de sulfure de sodium.
Sur la base des résultats des expériences, composez des équations de réaction. Calculez la FEM de la réaction et tirez une conclusion sur la possibilité de son passage.

3b. Réaction du sulfure d'hydrogène avec l'acide sulfurique.
Versez goutte à goutte de l'acide sulfurique concentré dans un tube à essai avec 2 à 3 ml d'eau sulfurée d'hydrogène (ou une solution de sulfure de sodium). (soigneusement!) jusqu'à ce que la turbidité apparaisse. Quelle est cette substance ? Quels autres produits pourraient être produits dans cette réaction ?
Écrivez les équations de réaction. Calculez la FEM de la réaction à l'aide des potentiels d'électrode :

4. Dioxyde de soufre et ion sulfite.
Le dioxyde de soufre, dioxyde de soufre, est le polluant atmosphérique le plus important émis par les moteurs d'automobiles lors de l'utilisation d'essence mal purifiée et par les fours dans lesquels sont brûlés du charbon, de la tourbe ou du fioul contenant du soufre.
Chaque année, des millions de tonnes de dioxyde de soufre sont rejetées dans l’atmosphère en raison de la combustion du charbon et du pétrole.
Le dioxyde de soufre est présent naturellement dans les gaz volcaniques. Le dioxyde de soufre est oxydé par l'oxygène atmosphérique en trioxyde de soufre qui, en absorbant l'eau (vapeur), se transforme en acide sulfurique. Les pluies acides détruisent les parties en ciment des bâtiments, les monuments architecturaux et les sculptures taillées dans la pierre. Les pluies acides ralentissent la croissance des plantes, voire entraînent leur mort, et tuent les organismes vivants dans les plans d'eau. De telles pluies éliminent les engrais phosphorés, peu solubles dans l'eau, des terres arables, qui, lorsqu'ils sont rejetés dans les plans d'eau, entraînent une prolifération rapide d'algues et un envahissement rapide des étangs et des rivières.
Le dioxyde de soufre peut être obtenu en plaçant 5 à 10 g de sulfite de sodium dans un flacon fermé par un bouchon muni d'un tube de sortie et d'un entonnoir compte-gouttes. À partir d'une ampoule à brome avec 10 ml d'acide sulfurique concentré (extrême prudence !) versez-le goutte à goutte sur les cristaux de sulfite de sodium. Au lieu du sulfite de sodium cristallin, vous pouvez utiliser sa solution saturée.
Le dioxyde de soufre peut également être produit par la réaction entre le cuivre métallique et l'acide sulfurique. Dans un ballon muni d'un bouchon avec tube de sortie de gaz et d'une ampoule à brome, déposer des copeaux ou des morceaux de fil de cuivre et verser un peu d'acide sulfurique par l'ampoule à goutte (on prélève environ 6 ml d'acide sulfurique concentré pour 10 g de cuivre). Pour démarrer la réaction, réchauffez légèrement le ballon. Après cela, ajoutez l'acide goutte à goutte. Écrivez les équations d’acceptation et de perte d’électrons ainsi que l’équation totale.
Les propriétés du dioxyde de soufre peuvent être étudiées en faisant passer le gaz dans une solution réactive, ou sous forme de solution aqueuse (acide sulfureux). Les mêmes résultats sont obtenus en utilisant des solutions acidifiées de sulfites de sodium Na 2 SO 3 et de sulfites de potassium K 2 SO 3. Jusqu'à quarante volumes de dioxyde de soufre sont dissous dans un volume d'eau (une solution d'environ 6 % est obtenue).
Le dioxyde de soufre est toxique. En cas d'intoxication légère, une toux commence, un nez qui coule, des larmes apparaissent et des vertiges commencent. L'augmentation de la dose entraîne un arrêt respiratoire.
4a. Interaction de l'acide sulfureux avec le peroxyde d'hydrogène.
Prédire les produits de réaction de l’acide sulfureux et du peroxyde d’hydrogène. Testez votre hypothèse avec l’expérience.
Ajoutez la même quantité de solution de peroxyde d’hydrogène à 3 % à 2 à 3 ml d’acide sulfureux. Comment prouver la formation des produits de réaction attendus ?
Répétez la même expérience avec des solutions acidifiées et alcalines de sulfite de sodium.
Écrivez les équations de réaction et calculez la force électromotrice du processus.
Sélectionnez les potentiels d'électrode dont vous avez besoin :

4b. Réaction entre le dioxyde de soufre et le sulfure d'hydrogène.
Cette réaction a lieu entre le SO 2 gazeux et le H 2 S et sert à produire du soufre. La réaction est également intéressante car les deux polluants atmosphériques se détruisent mutuellement.
Cette réaction a-t-elle lieu entre des solutions de sulfure d'hydrogène et de dioxyde de soufre ? Répondez à cette question avec expérience.

Essayez d'effectuer un calcul thermodynamique de la possibilité de réactions.
Les caractéristiques thermodynamiques des substances permettant de déterminer la possibilité d'une réaction entre substances gazeuses sont les suivantes :
Dans quel état de substances - gazeux ou en solution - les réactions sont-elles les plus préférables ?Soufre volcanique
 Les propriétés physiques du soufre dépendent directement de la modification allotropique. Par exemple, la modification la plus connue du soufre est le rhombique, S₈. C'est une substance cristalline jaune assez fragile.
Les propriétés physiques du soufre dépendent directement de la modification allotropique. Par exemple, la modification la plus connue du soufre est le rhombique, S₈. C'est une substance cristalline jaune assez fragile.
Structure de la molécule de soufre rhombique S₈
En plus de la modification rhombique, il existe de nombreuses autres modifications dont le nombre, selon diverses sources, atteint trois douzaines.
Propriétés chimiques de l'élément
À températures normales, l’activité chimique du soufre est assez faible. Mais lorsqu'il est chauffé, le soufre interagit souvent avec toutes les substances simples, métaux et non-métaux.
S + O₂ → SO₂
Le soufre est un élément essentiel à la vie et aux animaux et est largement utilisé dans des industries allant de la médecine aux dispositifs pyrotechniques.

Acide sulfurique
L'acide sulfurique a la formule H₂SO₄ et est l'acide dibasique le plus fort. Auparavant, cette substance était appelée huile de vitriol car l’acide concentré a une consistance épaisse et huileuse.
L'acide sulfurique se mélange facilement avec l'eau, mais de telles solutions doivent être préparées avec prudence : l'acide concentré doit être soigneusement versé dans l'eau, et en aucun cas l'inverse.
L'acide sulfurique est une substance caustique et peut en dissoudre certaines. Par conséquent, il est souvent utilisé dans l’extraction du minerai. L'acide laisse de graves brûlures sur la peau, il est donc extrêmement important de suivre les précautions de sécurité lorsque vous travaillez avec.
Obtention de "l'huile de vitriol" L'industrie utilise une méthode par contact pour produire du SO₂ (dioxyde de soufre) par oxydation du dioxyde de soufre, formé lors de la combustion du soufre. Ensuite, le trioxyde de soufre SO₃ est obtenu à partir du dioxyde de soufre, qui est ensuite dissous dans l'acide sulfurique le plus concentré. La solution résultante s’appelle oléum
. Pour obtenir « l’huile de vitriol », l’oléum est dilué avec de l’eau.
Propriétés chimiques de l'acide sulfurique
Lorsqu'il interagit avec les métaux, ainsi qu'avec le carbone et le soufre, l'acide sulfurique concentré les oxyde :
Сu + 2H₂SO₄ (conc.) → CuSO₄ + SO₂ + 2H₂O.
C(graphite) + 2H₂SO₄ (conc., horizontal) → CO₂ + 2SO₂ + 2H₂O
L'acide dilué est capable de réagir avec tous les métaux qui se trouvent à gauche de l'hydrogène dans la série de tensions :
Fe + H₂SO₄ (dil.) → FeSO₄ + H₂
Zn + H₂SO₄ (dil.) → ZnSO₄ + H₂
Dans les réactions avec les bases, le H₂SO₄ dilué forme des sulfates et des hydrosulfates :
H₂SO₄ + NaOH → NaHSO₄ + H₂O;
H₂SO₄ + 2NaOH → Na₂SO₄ + 2H₂O.
Cet acide peut également réagir avec des oxydes basiques, conduisant à des sulfates :
CaO + H₂SO₄ → CaSO₄↓ + H₂O.
L'acide sulfureux est un acide dibasique inorganique instable de force moyenne. Un composé instable, connu uniquement dans des solutions aqueuses à une concentration ne dépassant pas six pour cent. Lorsqu’on tente d’isoler l’acide sulfureux pur, il se décompose en oxyde de soufre (SO2) et en eau (H2O). Par exemple, lorsque l'acide sulfurique concentré (H2SO4) réagit avec le sulfite de sodium (Na2SO3), de l'oxyde de soufre (SO2) est libéré à la place de l'acide sulfureux. Voici à quoi ressemble la réaction :
Na2SO3 (sulfite de sodium) + H2SO4 (acide sulfurique) = Na2SO4 (sulfate de sodium) + SO2 (dioxyde de soufre) + H2O (eau)
Solution d'acide sulfureux
Lors du stockage, il est nécessaire d'exclure l'accès à l'air. Sinon, l'acide sulfureux, absorbant lentement l'oxygène (O2), se transformera en acide sulfurique.
2H2SO3 (acide sulfurique) + O2 (oxygène) = 2H2SO4 (acide sulfurique)
Les solutions d'acide sulfureux ont une odeur assez particulière (rappelant celle qui persiste après l'allumage d'une allumette), dont la présence peut s'expliquer par la présence d'oxyde de soufre (SO2), qui n'est pas chimiquement lié à l'eau.
Propriétés chimiques de l'acide sulfureux
1. H2SO3) peut être utilisé comme agent réducteur ou agent oxydant.
H2SO3 est un bon agent réducteur. Avec son aide, il est possible d'obtenir des halogénures d'hydrogène à partir d'halogènes libres. Par exemple:
H2SO3 (acide sulfurique) + Cl2 (chlore, gaz) + H2O (eau) = H2SO4 (acide sulfurique) + 2HCl (acide chlorhydrique)
Mais lorsqu’il interagit avec des agents réducteurs puissants, cet acide agira comme un agent oxydant. Un exemple est la réaction de l'acide sulfureux avec le sulfure d'hydrogène :
H2SO3 (acide sulfurique) + 2H2S (sulfure d'hydrogène) = 3S (soufre) + 3H2O (eau)
2. Le composé chimique que nous considérons forme deux sulfites (moyens) et hydrosulfites (acides). Ces sels sont des agents réducteurs, tout comme l'acide sulfureux (H2SO3). Lorsqu'ils sont oxydés, des sels d'acide sulfurique se forment. Lorsque les sulfites de métaux actifs sont calcinés, des sulfates et des sulfures se forment. Il s’agit d’une réaction d’auto-oxydation-auto-guérison. Par exemple:
4Na2SO3 (sulfite de sodium) = Na2S + 3Na2SO4 (sulfite de sodium)
Les sulfites de sodium et de potassium (Na2SO3 et K2SO3) sont utilisés dans la teinture des tissus dans l'industrie textile, dans le blanchiment des métaux et en photographie. L'hydrosulfite de calcium (Ca(HSO3)2), qui existe uniquement en solution, est utilisé pour transformer le bois en une pâte au sulfite spéciale. Il est ensuite utilisé pour fabriquer du papier.
Application d'acide sulfureux
L'acide sulfureux est utilisé :
Pour blanchir la laine, la soie, la pâte de bois, le papier et autres substances similaires qui ne résistent pas au blanchiment avec des agents oxydants plus puissants (par exemple le chlore) ;
Comme conservateur et antiseptique, par exemple pour empêcher la fermentation des céréales lors de la production d'amidon ou pour empêcher le processus de fermentation dans les fûts de vin ;
Pour conserver les aliments, par exemple lors de la mise en conserve de légumes et de fruits ;
Transformé en pâte au sulfite, à partir de laquelle du papier est ensuite produit. Dans ce cas, une solution d'hydrosulfite de calcium (Ca(HSO3)2) est utilisée, qui dissout la lignine, une substance spéciale qui lie les fibres de cellulose.
Acide sulfureux : préparation
Cet acide peut être produit en dissolvant du dioxyde de soufre (SO2) dans de l'eau (H2O). Vous aurez besoin d'acide sulfurique concentré (H2SO4), de cuivre (Cu) et d'un tube à essai. Algorithme d'actions :
1. Versez délicatement de l'acide sulfurique concentré dans un tube à essai, puis placez-y un morceau de cuivre. Chauffer. La réaction suivante se produit :
Cu (cuivre) + 2H2SO4 (acide sulfurique) = CuSO4 (sulfate de soufre) + SO2 (dioxyde de soufre) + H2O (eau)
2. Le flux de dioxyde de soufre doit être dirigé dans un tube à essai contenant de l'eau. Lorsqu'il se dissout, il se produit partiellement avec l'eau, entraînant la formation d'acide sulfureux :
SO2 (dioxyde de soufre) + H2O (eau) = H2SO3
Ainsi, en faisant passer du dioxyde de soufre dans l’eau, vous pouvez obtenir de l’acide sulfureux. Il convient de noter que ce gaz a un effet irritant sur les membranes des voies respiratoires, peut provoquer une inflammation ainsi qu'une perte d'appétit. L'inhalation prolongée peut entraîner une perte de conscience. Ce gaz doit être manipulé avec une extrême prudence et précaution.
Le soufre est un élément du sixième groupe de la troisième période du tableau périodique de Mendeleïev. Par conséquent, la structure de l’atome de soufre est représentée comme suit :
La structure de l’atome de soufre indique qu’il s’agit d’un non-métal, c’est-à-dire que l’atome de soufre est capable à la fois de recevoir et d’émettre des électrons :

Tâche 15.1. Créez des formules pour les composés soufrés contenant des atomes de soufre avec des états d'oxydation donnés.
Substance simple " soufre» est un minéral dur, cassant, jaune, insoluble dans l'eau. Dans la nature, on trouve à la fois du soufre natif et ses composés : sulfures, sulfates. Le soufre, en tant que non-métal actif, réagit facilement avec l'hydrogène, l'oxygène et presque tous les métaux et non-métaux :

Tâche 15.2. Nommez les composés obtenus. Déterminez les propriétés (agent oxydant ou agent réducteur) que le soufre présente dans ces réactions.
En tant que non-métal typique, la substance simple soufre peut être à la fois un agent oxydant et un agent réducteur :

Parfois, ces propriétés apparaissent dans une seule réaction :

Puisque l’atome oxydant et l’atome réducteur sont identiques, ils peuvent être « ajoutés », c’est-à-dire que les deux processus nécessitent trois atome de soufre.
Tâche 15.3. Définissez les coefficients restants dans cette équation.
Le soufre peut réagir avec les acides - agents oxydants forts :
Ainsi, étant un non-métal actif, le soufre forme de nombreux composés. Considérons les propriétés du sulfure d'hydrogène, des oxydes de soufre et de leurs dérivés.

Sulfure d'hydrogène
Le H 2 S est du sulfure d'hydrogène, un gaz hautement toxique qui dégage une odeur désagréable d'œuf pourri. Il serait plus correct de dire que lorsque les blancs d'œufs pourrissent, ils se décomposent en libérant du sulfure d'hydrogène.
Tâche 15.4. En vous basant sur l’état d’oxydation de l’atome de soufre dans le sulfure d’hydrogène, prédisez les propriétés que cet atome présentera dans les réactions redox.
Puisque le sulfure d'hydrogène est un agent réducteur (l'atome de soufre a le plus basétat d'oxydation), il s'oxyde facilement. L'oxygène de l'air oxyde le sulfure d'hydrogène même à température ambiante :
Le sulfure d'hydrogène brûle :
Le sulfure d'hydrogène est légèrement soluble dans l'eau et sa solution présente les propriétés très faible acide (sulfure d'hydrogène H2S). Il forme des sels sulfures:
Question. Comment pouvez-vous obtenir du sulfure d’hydrogène si vous avez du sulfure ?
Le sulfure d'hydrogène est produit en laboratoire en agissant sur des sulfures plus forts (que H2S) acides, par exemple :

Dioxyde de soufre et acide sulfureux
DONC 2- du dioxyde de soufre avec une odeur âcre et suffocante. Toxique. Se dissout dans l'eau pour former de l'acide sulfureux :
Cet acide est de force moyenne, mais très instable, n'existant qu'en solution. Par conséquent, en agissant sur ses sels - sulf il s- d'autres acides peuvent produire du dioxyde de soufre :

Lorsque la solution obtenue est bouillie, cet acide se décompose complètement.
Tâche 15.5. Déterminer le degré d'oxydation du soufre dans le dioxyde de soufre, l'acide sulfureux, le sulfite de sodium.
Depuis l'état d'oxydation +4 car le soufre est intermédiaire, tous les composés répertoriés peuvent être à la fois des agents oxydants et des réducteurs :

Par exemple:

Tâche 15.6. Disposez les coefficients dans ces schémas en utilisant la méthode de la balance électronique. Indiquez les propriétés que présente un atome de soufre avec un état d'oxydation +4 dans chacune des réactions.
Les propriétés réductrices du dioxyde de soufre sont utilisées dans la pratique. Ainsi, lors de la réduction, certains composés organiques perdent leur couleur, c'est pourquoi l'oxyde de soufre IV et les sulfites sont utilisés dans le blanchiment. Le sulfite de sodium, dissous dans l'eau, ralentit la corrosion des canalisations, car il absorbe facilement l'oxygène de l'eau, et c'est l'oxygène qui est le « coupable » de la corrosion :
S'oxydant en présence d'un catalyseur, le dioxyde de soufre se transforme en anhydride sulfurique DONC 3:

Anhydride sulfurique et acide sulfurique
Anhydride sulfurique DONC 3- liquide incolore réagissant violemment avec l'eau :
Acide sulfurique H2SO4- un acide fort qui concentré la forme absorbe activement l'humidité de l'air (cette propriété est utilisée lors du séchage de divers gaz) et de certaines substances complexes :

Diapositive 2
Soufre
Le soufre est un chalcogène, un non-métal assez réactif. Il existe trois modifications allotropiques du soufre : orthorhombique S8 plastique monoclinique
Diapositive 3
Caractéristiques du soufre
Serav PSHE : position (période, groupe) propriétés de la structure atomique de l'élément par période / dans l'ensemble p/g oxyde supérieur hydroxyde supérieur LVS
Diapositive 4
Reçu
Lors de la vidange de solutions d'hydrogène sulfuré et d'acides sulfureux : H2SO3 + 2H2S = 3S + 3H2O Lorsque l'hydrogène sulfuré est incomplètement brûlé (avec manque d'air) : 2H2S + O2 = 2S + 2H2O
Diapositive 5
Propriétés chimiques
Ne mouille pas et ne réagit pas avec l'eau. L'agent oxydant réagit avec : les métaux (sauf l'or) Hg + S = HgS (neutralisation du mercure déversé) l'hydrogène et les non-métaux, dont s.o. moins (carbone, phosphore, etc.)
Diapositive 6
Comment réagit un agent réducteur avec : l'oxygène, le chlore, le fluor
Diapositive 7
S-2(avec moi, C, P, H2) : C + 2S = CS2 H2 + S = H2S S0 S S+2 S + Cl2 = SCl2 S+4 S + O2 = SO2H2SO3 S+6 S + 3F2 = SF6H2SO4 renforcer la capacité oxydante des ions
Diapositive 8
Sulfure d'hydrogène
H2S – sulfure d’hydrogène. Sa solution dans l'eau est appelée acide hydrosulfure. L'acide est faiblement dibasique, il se dissocie donc par étapes : I : H2S ↔ H+ + HS– II : HS– ↔ H+ + S–
Diapositive 9
Montre toutes les propriétés des acides. Réagit avec : oxydes basiques : H2S + CaO = CaS + H2O bases : H2S + KOH ↔ KHS + H2O H2S + OH– ↔ HS– + H2O H2S + 2KOH ↔ K2S + H2O H2S + 2OH– ↔ S2– + H2O
Diapositive 10
sels : CuCO3 + H2S = CuS + H2CO3 métaux : Ca + H2S = CaS + H2
Diapositive 11
Propriétés des sels
Les sels acides d'acide hydrosulfure - les hydrosulfures (KHS, NaHS) sont hautement solubles dans l'eau. Les sulfures de métaux alcalins et alcalino-terreux sont également solubles. Les sulfures d'autres métaux sont insolubles dans l'eau et les sulfures de cuivre, de plomb, d'argent, de mercure et d'autres métaux lourds sont insolubles même dans les acides (sauf nitrique).
Diapositive 12
Oxydation du sulfure d'hydrogène
Le sulfure d'hydrogène est facilement oxydé par l'oxygène (comme avec un excès d'O2 et un déficit ?). Eau bromée Br2 : H2S + Br2 = 2HBr + S↓ jaune-orange incolore
Diapositive 13
Oxyde de soufre (IV)
SO2 – gazeux dioxyde de soufre. Réagit avec l'eau pour former H2SO3. Oxyde d'acide typique. Réagit avec les bases (sel (sulfite ou hydrosulfite) et eau se forment) et les oxydes basiques (seul se forme du sel).
Diapositive 14
Obtenu par : combustion du soufre, grillage de la pyrite, action des acides sur les sulfites, interaction des conc. acide sulfurique et méthamphétamine lourde
Diapositive 15
Oxyde de soufre (VI)
Le SO3 est un oxyde acide. Il réagit avec l'eau pour former du H2SO4, avec des bases (un sel (sulfate ou hydrosulfate) et de l'eau se forment) et des oxydes basiques. Obtenu par oxydation du dioxyde de soufre. Se dissout dans l'acide sulfurique pour former de l'oléum : H2SO4 + nSO3 = H2SO4 nSO3 oléum
Diapositive 16
Le soufre est un élément essentiel à la vie et aux animaux et est largement utilisé dans des industries allant de la médecine aux dispositifs pyrotechniques.
L'acide sulfurique H2SO4 est un liquide huileux lourd, inodore et incolore. À une concentration > 70 %, l'acide sulfurique est dit concentré, à moins de 70 % - dilué. La dissociation de l'acide sulfurique est exprimée par l'équation : H2SO4 ↔ 2H++ SO42–
Diapositive 17
L'acide réagit avec les oxydes et hydroxydes amophotères et basiques, les sels : H2SO4 + BaCl2 = BaSO4↓ + HCl. Cette dernière réaction est qualitative pour l'ion SO42 (un précipité blanc insoluble se forme).
Diapositive 18
H2SO4 H2SO4 +1 +6 -2 H2SO4 +1 +6 -2 concentré dilué H+ ― oxydant 2H+ + 2e– = H2 S+6 ― oxydant S+6 +8e– +6e– +2e– S-2 (H2S ) S0 (S)S+4 (SO2)
Diapositive 19
Tous les métaux de la série d'activités jusqu'à l'hydrogène réagissent avec l'acide sulfurique dilué. Au cours de la réaction, du sulfate métallique se forme et de l'hydrogène est libéré : H2SO4 + Zn = ZnSO4 + H2 Les métaux après l'hydrogène ne réagissent pas avec l'acide dilué : Cu + H2SO4 ≠
Diapositive 20
Acide sulfurique concentré
Les métaux de la série d'activités après l'hydrogène interagissent avec l'acide sulfurique concentré selon le schéma suivant : H2SO4 (conc.) + Me = MeSO4 + SO2 + H2O C'est-à-dire formé : sulfate métallique, oxyde de soufre(IV) - dioxyde de soufre SO2 eau
Diapositive 21
L'acide sulfurique plus actif, dans certaines conditions, peut être réduit en soufre pur ou en sulfure d'hydrogène. Dans le froid conc. l'acide sulfurique passive le fer et l'aluminium, ils sont donc transportés dans des cuves en fer : H2SO4 (conc.) + Fe ≠ (au froid)
Diapositive 22
Préparation de l'acide sulfurique
obtention de SO2 (généralement par grillage de pyrite), oxydation de SO2 en SO3 en présence d'un catalyseur - dissolution de l'oxyde de vanadium (V) dans l'acide sulfurique pour obtenir de l'oléum ;
Diapositive 23
Sulfates
Les sels d'acide sulfurique possèdent toutes les propriétés des sels. Leur relation avec la chaleur est particulière : les sulfates métalliques actifs (Na, K, Ba) ne se décomposent pas même à t > 1000˚C, les autres (Cu, Al, Fe) même avec un léger chauffage se décomposent en oxyde de soufre (VI) et oxyde métallique
Diapositive 24
Questions
Dans quelles réactions le soufre joue-t-il le rôle d'agent oxydant ? agent réducteur ? quels diplômes présente-t-il ? Qu’est-ce qui cause la différence dans les propriétés de l’acide sulfurique concentré et dilué ? écrire les équations de la réaction de conc. et diluez les acides avec du cuivre et du zinc. comment distinguer les solutions d'iodure de sodium et de sulfate de sodium ? proposer deux méthodes et écrire les équations de réaction sous formes moléculaire et ionique.
Diapositive 25
Quêtes
Quelle quantité de dioxyde de soufre peut-on obtenir à partir de 10 kg de minerai contenant 48 % de pyrite ? Quel volume est occupé par : a) 4 moles de SO2 ? b) 128 g de SO3 ? Réaliser les réactions : O2 → S → SO2 → SO3 → H2SO4 → Na2SO4 → BaSO4
Afficher toutes les diapositives