Pojav radioaktivnosti je leta 1896 odkril A. Becquerel, ki je opazoval spontano emisijo neznanega sevanja uranovih soli. Kmalu sta E. Rutherford in zakonca Curie ugotovila, da se med radioaktivnim razpadom oddajajo jedra He (α-delci), elektroni (β-delci) in trdo elektromagnetno sevanje (γ-žarki).
Leta 1934 so odkrili razpad z emisijo pozitronov (β + -razpad), leta 1940 pa so odkrili novo vrsto radioaktivnosti - spontano cepitev jeder: cepitveno jedro razpade na dva fragmenta primerljive mase ob hkratni emisiji nevtronov in γ -kvanti. Protonsko radioaktivnost jeder so opazili leta 1982. Tako obstajajo naslednje vrste radioaktivnega razpada: α-razpad; - razpad; - razpadanje; e - zajem.
radioaktivnost- sposobnost nekaterih atomskih jeder, da se spontano (spontano) spremenijo v druga jedra z emisijo delcev.
Atomska jedra so sestavljena iz protoni in nevtroni, ki imajo splošno ime - nukleoni.Število protonov v jedru določa kemijske lastnosti atoma in je označeno Z(serijska številka artikla). Število nukleonov v jedru se imenuje masno število in označujejo A. Jedra z isto serijsko številko in imenujemo različna masna števila izotopi. Vsi izotopi enega kemijskega elementa imajo enake kemijske lastnosti, fizikalne lastnosti pa se lahko zelo razlikujejo. Za označevanje izotopov uporabite simbol kemijskega elementa z dvema indeksoma: A Z X. Spodnji indeks je serijska številka, zgornji indeks pa masno število. Indeks je pogosto izpuščen, ker je označen s samim simbolom elementa.
Na primer, pišejo 14 C namesto 14 6 C.
Sposobnost jedra, da razpade, je odvisna od njegove sestave. Isti element ima lahko stabilne in radioaktivne izotope.
Na primer, izotop ogljika 12 C je stabilen, izotop 14 C pa je radioaktiven.
Radioaktivni razpad je statistični pojav. Sposobnost izotopa za razpad je označena s konstanto razpada λ.
Razpadna konstanta λ je verjetnost, da bo jedro danega izotopa razpadlo na časovno enoto.
Označimo število N radioaktivnih razpadnih jeder v času t, dN 1 - število jeder, ki razpadejo v času dt. Ker je število jeder v snovi ogromno, je zakon velikih števil izpolnjen. Verjetnost razpada jedra v kratkem času dt dobimo s formulo dP = λdt Frekvenca je enaka verjetnosti: d N 1 / N = dP = λdt. d N 1 / N = λdt- formula, ki določa število razpadlih jeder.
Rešitev enačbe je: , - formula se imenuje zakon radioaktivnega razpada: Število radioaktivnih jeder se s časom zmanjšuje po eksponentnem zakonu.
Tukaj je N število nerazpadlih jeder v času t; N o - začetno število nerazpadlih jeder; λ je konstanta radioaktivnega razpada.
V praksi se ne uporablja razpadna konstanta λ , in zahtevana količina razpolovna doba T.
Razpolovna doba (T) je čas, v katerem razpade polovica radioaktivnih jeder.
Zakon radioaktivnega razpada skozi periodo razpolovna doba (T) ima obliko:
![]()
Razmerje med razpolovno dobo in konstanto razpada je podano s formulo: T = ln(2/λ) = 0,69/λ
Razpolovna doba je lahko zelo dolga ali zelo kratka.
Za oceno stopnje aktivnosti radioaktivnega izotopa se uporablja količina, imenovana aktivnost.
Aktivno število jeder radioaktivnega zdravila, ki razpadejo na časovno enoto: A = dN razpad /dt
Enota SI za aktivnost je 1 bekerel (Bq) = 1 razpad/s – aktivnost zdravila, pri kateri pride do 1 razpada v 1 s. Večja enota aktivnosti je 1 rutherford (Rd) = Bq. Pogosto se uporablja zunajsistemska enota aktivnosti - curie (Ci), ki je enak aktivnosti 1 g radija: 1 Ci = 3,7 Bq.
Sčasoma se aktivnost zmanjšuje po istem eksponentnem zakonu, po katerem razpada sam radionuklid:
![]() =
.
=
.
V praksi se za izračun aktivnosti uporablja formula:
A = = λN = 0,693 N/T.
Če izrazimo število atomov skozi maso in maso, potem bo formula za izračun aktivnosti v obliki: A = = 0,693 (μT)
kje je Avogadrova številka; μ - molska masa.
Zakoni radioaktivnega razpada jeder
Sposobnost jeder, da spontano razpadejo in oddajajo delce, imenujemo radioaktivnost. Radioaktivni razpad je statističen proces. Vsako radioaktivno jedro lahko razpade v vsakem trenutku in vzorec opazimo le v povprečju, pri razpadu dovolj velikega števila jeder.
Konstanta razpadaλ je verjetnost jedrskega razpada na enoto časa.
Če je v vzorcu v času t N radioaktivnih jeder, potem je število jeder dN, ki so razpadla v času dt, sorazmerno z N.
dN = -λNdt. (13.1)
Z integracijo (1) dobimo zakon radioaktivnega razpada
N(t) = N 0 e -λt. (13.2)
N 0 je število radioaktivnih jeder v času t = 0.
Povprečna življenjska doba τ –
. (13.3)
Polovično življenje T 1/2 - čas, v katerem se začetno število radioaktivnih jeder zmanjša za polovico
T 1/2 = ln2/λ=0,693/λ = τln2. (13.4)
dejavnost A - povprečno število razpadlih jeder na enoto časa
A(t) = λN(t). (13.5)
Aktivnost se meri v kiriju (Ci) in bekerelu (Bq).
1 Ki = 3,7*10 10 razpadov/s, 1 Bq = 1 razpad/s.
Razpad prvotnega jedra 1 v jedro 2, ki mu sledi njegov razpad v jedro 3, je opisan s sistemom diferencialnih enačb
 (13.6)
(13.6)
kjer sta N 1 (t) in N 2 (t) število jeder, λ 1 in λ 2 sta razpadni konstanti jeder 1 oziroma 2. Rešitev sistema (6) z začetnimi pogoji N 1 (0) = N 10 ; N 2 (0) = 0 bo
![]() , (13.7a)
, (13.7a)
![]() . (13.7b)
. (13.7b)

| Slika 13. 1 |
Število jeder 2 doseže največjo vrednost
Če je λ 2< λ 1 (), суммарная активностьN 1 (t)λ 1 + N 2 (t)λ 2 будет монотонно уменьшаться.
Če je λ 2 > λ 1 ()), se skupna aktivnost sprva poveča zaradi kopičenja jeder 2.
Če je λ 2 >> λ 1, postane pri dovolj dolgih časih prispevek druge eksponente v (7b) zanemarljiv v primerjavi s prispevkom prve in aktivnostmi druge A 2 = λ 2 N 2 in prvih izotopov A 1 = λ 1 N 1 sta skoraj enaka. V prihodnosti se bodo aktivnosti tako prvega kot drugega izotopa skozi čas spreminjale na enak način.
A 1 (t) = N 10 λ 1 = N 1 (t)λ 1 = A 2 (t) = N 2 (t)λ 2 .(13.8)
Se pravi t.i staro ravnovesje, pri katerem je število izotopskih jeder v razpadni verigi povezano s konstantami razpada (razpolovnimi dobami) s preprostim razmerjem.
 . (13.9)
. (13.9)
Zato se v naravnem stanju vsi izotopi, ki so genetsko povezani v radioaktivnih serijah, običajno nahajajo v določenih količinskih razmerjih, odvisno od njihove razpolovne dobe.
V splošnem primeru, ko obstaja veriga razpadov 1→2→...n, je proces opisan s sistemom diferencialnih enačb
dN i /dt = -λ i N i +λ i-1 N i-1 .(13.10)
Rešitev sistema (10) za aktivnosti z začetnimi pogoji N 1 (0) = N 10 ; N i (0) = 0 bo
![]() (13.12)
(13.12)
Praštevilka pomeni, da je v zmnožku, ki je v imenovalcu, faktor z i = m izpuščen.
Izotopi
IZOTOPI– sorte istega kemijskega elementa, ki so podobne fizikalno-kemijskim lastnostim, vendar imajo različne atomske mase. Ime "izotopi" je leta 1912 predlagal angleški radiokemik Frederick Soddy, ki ga je oblikoval iz dveh grških besed: isos - enako in topos - mesto. Izotopi zavzemajo isto mesto v celici Mendelejevega periodnega sistema elementov.
Atom katerega koli kemičnega elementa je sestavljen iz pozitivno nabitega jedra in oblaka negativno nabitih elektronov, ki ga obdajajo ( cm.tudi ATOMSKO JEDRO). Položaj kemičnega elementa v periodnem sistemu Mendelejeva (njegova serijska številka) je določen z nabojem jedra njegovih atomov. Izotopi se torej imenujejo različice istega kemičnega elementa, katerih atomi imajo enak jedrski naboj (in s tem praktično enake elektronske lupine), vendar se razlikujejo po vrednostih jedrske mase. Po figurativnem izrazu F. Soddyja so atomi izotopov enaki "zunaj", vendar različni "znotraj".
Nevtron je bil odkrit leta 1932 – delec brez naboja, z maso blizu mase jedra atoma vodika - proton , in nastal je protonsko-nevtronski model jedra. Kot rezultat je znanost vzpostavila končno sodobno definicijo pojma izotopi: izotopi so snovi, katerih atomska jedra so sestavljena iz enakega števila protonov in se razlikujejo le po številu nevtronov v njih. jedro . Vsak izotop je običajno označen z nizom simbolov, kjer je X simbol kemijskega elementa, Z je naboj atomskega jedra (število protonov), A je masno število izotopa (skupno število nukleonov). - protoni in nevtroni v jedru, A = Z + N). Ker se zdi, da je naboj jedra edinstveno povezan s simbolom kemičnega elementa, se za okrajšavo pogosto uporablja preprosto zapis A X.
Od vseh nam znanih izotopov imajo samo izotopi vodika svoja imena. Tako se izotopa 2 H in 3 H imenujeta devterij in tritij in sta označena z D oziroma T (izotop 1 H se včasih imenuje protij).
V naravi se pojavlja kot stabilni izotopi , in nestabilno - radioaktivno, katerega jedra atomov so podvržena spontani pretvorbi v druga jedra z emisijo različnih delcev (ali procesi tako imenovanega radioaktivnega razpada). Zdaj je znanih približno 270 stabilnih izotopov, stabilne izotope pa najdemo le v elementih z atomskim številom Z Ј 83. Število nestabilnih izotopov presega 2000, velika večina jih je bila pridobljena umetno kot posledica različnih jedrskih reakcij. Število radioaktivnih izotopov mnogih elementov je zelo veliko in lahko preseže dva ducata. Število stabilnih izotopov je bistveno manjše. Nekateri kemijski elementi so sestavljeni samo iz enega stabilnega izotopa (berilij, fluor, natrij, aluminij, fosfor, mangan, zlato in številni drugi elementi). Največ stabilnih izotopov - 10 - so našli v kositru, na primer v železu so 4, v živem srebru pa 7.
Odkritje izotopov, zgodovinsko ozadje. Leta 1808 je angleški znanstvenik naravoslovec John Dalton prvič uvedel definicijo kemičnega elementa kot snovi, sestavljene iz atomov iste vrste. Leta 1869 je kemik D.I. Mendelejev je odkril periodični zakon kemijskih elementov. Ena od težav pri utemeljitvi koncepta elementa kot snovi, ki zavzema določeno mesto v celici periodnega sistema, so bile eksperimentalno opažene necele atomske mase elementov. Leta 1866 je angleški fizik in kemik sir William Crookes postavil hipotezo, da je vsak naravni kemijski element določena mešanica snovi, ki so enake po svojih lastnostih, vendar imajo različne atomske mase, vendar takrat taka predpostavka še ni imela eksperimentalno potrditev in zato ni bil dolgo opažen.
Pomemben korak k odkritju izotopov je bilo odkritje pojava radioaktivnosti in hipoteze o radioaktivnem razpadu, ki sta jo oblikovala Ernst Rutherford in Frederick Soddy: radioaktivnost ni nič drugega kot razpad atoma v nabit delec in atom drugega elementa. , ki se po svojih kemičnih lastnostih razlikuje od prvotnega. Posledično se je pojavila ideja o radioaktivnih serijah ali radioaktivnih družinah , na začetku katerega je prvi starševski element, ki je radioaktiven, na koncu pa zadnji stabilni element. Analiza verig transformacij je pokazala, da se lahko med njihovim potekom v eni celici periodičnega sistema pojavijo isti radioaktivni elementi, ki se razlikujejo le po atomskih masah. Pravzaprav je to pomenilo uvedbo koncepta izotopov.
Neodvisna potrditev obstoja stabilnih izotopov kemijskih elementov je bila nato pridobljena v poskusih J. J. Thomsona in Astona v letih 1912–1920 s snopi pozitivno nabitih delcev (ali t. i. kanalski snopi ) ki izhaja iz izpustne cevi.
Leta 1919 je Aston oblikoval instrument, imenovan masni spektrograf (ali masni spektrometer). . Vir ionov je še vedno uporabljal razelektritveno cev, vendar je Aston našel način, po katerem je zaporedno odklon žarka delcev v električnem in magnetnem polju vodil do fokusiranja delcev z enakim razmerjem naboja in mase (ne glede na njihovo hitrost) pri isto točko na zaslonu. Skupaj z Astonom je masni spektrometer nekoliko drugačne zasnove v istih letih ustvaril ameriški Dempster. Kot rezultat kasnejše uporabe in izboljšave masnih spektrometrov s prizadevanji številnih raziskovalcev je bila do leta 1935 sestavljena skoraj popolna tabela izotopskih sestav vseh do takrat znanih kemičnih elementov.
Metode za ločevanje izotopov. Za preučevanje lastnosti izotopov in zlasti za njihovo uporabo v znanstvene in uporabne namene jih je potrebno pridobiti v bolj ali manj opaznih količinah. Pri običajnih masnih spektrometrih dosežemo skoraj popolno ločitev izotopov, vendar je njihova količina zanemarljivo majhna. Zato so bila prizadevanja znanstvenikov in inženirjev usmerjena v iskanje drugih možnih metod za ločevanje izotopov. Najprej so obvladali fizikalno-kemijske metode ločevanja, ki so temeljile na razlikah v lastnostih izotopov istega elementa, kot so hitrosti izhlapevanja, ravnotežne konstante, hitrosti kemičnih reakcij itd. Najučinkovitejše med njimi so bile metode rektifikacije in izmenjave izotopov, ki se pogosto uporabljajo v industrijski proizvodnji izotopov lahkih elementov: vodika, litija, bora, ogljika, kisika in dušika.
Drugo skupino metod sestavljajo tako imenovane molekularno kinetične metode: plinska difuzija, toplotna difuzija, masna difuzija (difuzija v toku pare), centrifugiranje. Metode plinske difuzije, ki temeljijo na različnih stopnjah difuzije izotopskih komponent v visoko razpršenih poroznih medijih, so bile med drugo svetovno vojno uporabljene za organizacijo industrijske proizvodnje ločevanja izotopov urana v ZDA kot del tako imenovanega projekta Manhattan za ustvarjanje atomska bomba. Za pridobitev potrebnih količin urana, obogatenega do 90% z lahkim izotopom 235 U, glavno "gorljivo" komponento atomske bombe, so zgradili tovarne, ki zavzemajo površino približno štiri tisoč hektarjev. Za oblikovanje atomskega centra z obrati za proizvodnjo obogatenega urana so namenili več kot 2 milijardi dolarjev. zgrajena v ZSSR. V zadnjih letih se je ta metoda umaknila učinkovitejši in cenejši metodi centrifugiranja. Pri tej metodi je učinek ločevanja zmesi izotopov dosežen zaradi različnih učinkov centrifugalnih sil na sestavine zmesi izotopov, ki polnijo rotor centrifuge, ki je tankostenski valj, omejen zgoraj in spodaj, ki se vrti na zelo visoka hitrost v vakuumski komori. V sodobnih separacijskih obratih tako v Rusiji kot v drugih razvitih državah sveta se trenutno uporablja več sto tisoč centrifug, povezanih v kaskade, od katerih rotor vsake naredi več kot tisoč vrtljajev na sekundo. Centrifuge se uporabljajo ne samo za proizvodnjo obogatenega urana, potrebnega za napajanje jedrskih reaktorjev jedrskih elektrarn, temveč tudi za proizvodnjo izotopov približno tridesetih kemičnih elementov v srednjem delu periodnega sistema. Za ločevanje različnih izotopov se uporabljajo tudi elektromagnetne ločevalne enote z močnimi ionskimi viri;
Uporaba izotopov. Različni izotopi kemijskih elementov se pogosto uporabljajo v znanstvenih raziskavah, na različnih področjih industrije in kmetijstva, v jedrski energiji, sodobni biologiji in medicini, v okoljskih študijah in na drugih področjih. V znanstvenih raziskavah (na primer pri kemijski analizi) so praviloma potrebne majhne količine redkih izotopov različnih elementov, izračunane v gramih in celo miligramih na leto. Hkrati lahko za številne izotope, ki se pogosto uporabljajo v jedrski energiji, medicini in drugih industrijah, potreba po njihovi proizvodnji znaša veliko kilogramov in celo ton. Tako je zaradi uporabe težke vode D 2 O v jedrskih reaktorjih njena svetovna proizvodnja do začetka devetdesetih let prejšnjega stoletja znašala okoli 5000 ton na leto. Vodikov izotop devterij, ki je del težke vode, katere koncentracija v naravni mešanici vodika je le 0,015%, skupaj s tritijem, bo po mnenju znanstvenikov v prihodnosti postal glavna sestavina goriva termonuklearne energije. reaktorji, ki delujejo na osnovi reakcij jedrske fuzije. V tem primeru bo potreba po proizvodnji vodikovih izotopov ogromna.
V znanstvenih raziskavah se stabilni in radioaktivni izotopi široko uporabljajo kot izotopski indikatorji (oznake) pri preučevanju najrazličnejših procesov, ki se dogajajo v naravi.
V kmetijstvu se izotopi ("označeni" atomi) uporabljajo na primer za preučevanje procesov fotosinteze, prebavljivosti gnojil in za določanje učinkovitosti rastlinske uporabe dušika, fosforja, kalija, elementov v sledovih in drugih snovi.
Izotopske tehnologije se pogosto uporabljajo v medicini. Tako se v ZDA po statističnih podatkih dnevno izvede več kot 36 tisoč medicinskih posegov in približno 100 milijonov laboratorijskih testov z uporabo izotopov. Najpogostejši postopki vključujejo računalniško tomografijo. Izotop ogljika C13, obogaten na 99% (naravna vsebnost približno 1%), se aktivno uporablja v tako imenovanem "diagnostičnem nadzoru dihanja". Bistvo testa je zelo preprosto. Obogateni izotop se vnese v pacientovo hrano in se po sodelovanju v presnovnem procesu v različnih telesnih organih sprosti v obliki ogljikovega dioksida CO 2, ki ga bolnik izdihne, ta pa se zbere in analizira s spektrometrom. Razlika v hitrosti procesov, povezanih s sproščanjem različnih količin ogljikovega dioksida, označenega z izotopom C 13, omogoča presojo stanja različnih bolnikovih organov. V ZDA je število bolnikov, ki bodo opravili ta test, ocenjeno na 5 milijonov na leto. Zdaj se metode laserskega ločevanja uporabljajo za proizvodnjo visoko obogatenega izotopa C13 v industrijskem obsegu.
Povezane informacije.
Predavanje 2. Osnovna zakonitost radioaktivnega razpada in aktivnost radionuklidov
Hitrost razpada radionuklidov je različna – nekateri razpadajo hitreje, drugi počasneje. Indikator hitrosti radioaktivnega razpada je konstanta radioaktivnega razpada, λ [sek-1], ki označuje verjetnost razpada enega atoma v eni sekundi. Za vsak radionuklid ima razpadna konstanta svojo vrednost; večja kot je, hitreje razpadajo jedra snovi.
Imenuje se število razpadov, zabeleženih v radioaktivnem vzorcu na enoto časa dejavnost (a ) ali radioaktivnost vzorca. Vrednost aktivnosti je neposredno sorazmerna s številom atomov n radioaktivna snov:
a =λ· n , (3.2.1)
Kje λ – konstanta radioaktivnega razpada, [sek-1].
Trenutno je v skladu z veljavnim mednarodnim sistemom enot SI merska enota radioaktivnosti bekerel [kk]. Ta enota je dobila ime v čast francoskega znanstvenika Henrija Becquerela, ki je leta 1856 odkril pojav naravne radioaktivnosti urana. En bekerel je enak enemu razpadu na sekundo 1 kk = 1 .
Še vedno pa se pogosto uporablja nesistemska enota dejavnosti – curie [Ki], ki sta ga zakonca Curie uvedla kot merilo za stopnjo razpada enega grama radija (v katerem se pojavi ~3,7 1010 razpadov na sekundo), torej
1 Ki= 3,7·1010 kk.
Ta enota je primerna za ocenjevanje aktivnosti velikih količin radionuklidov.
Zmanjšanje koncentracije radionuklidov skozi čas kot posledica razpada je podrejeno eksponentnemu razmerju:
 , (3.2.2)
, (3.2.2)
Kje n t– število atomov radioaktivnega elementa, ki ostane po določenem času t po začetku opazovanja; n 0 – število atomov v začetnem trenutku ( t =0 ); λ – konstanta radioaktivnega razpada.
Opisana odvisnost se imenuje osnovni zakon radioaktivnega razpada .
Imenuje se čas, v katerem razpade polovica celotne količine radionuklidov polovično življenje T½ . Po eni razpolovni dobi od 100 radionuklidnih atomov ostane le še 50 (slika 2.1). V naslednjem podobnem obdobju od teh 50 atomov ostane le še 25 itd.
Razmerje med razpolovno dobo in konstanto razpada je izpeljano iz enačbe temeljnega zakona radioaktivnega razpada:
pri t=T½ in
dobimo https://pandia.ru/text/80/150/images/image006_47.gif" width="67" height="41 src="> Þ ;
https://pandia.ru/text/80/150/images/image009_37.gif" width="76" height="21">;
tj..gif" width="81" height="41 src=">.
Zato lahko zakon radioaktivnega razpada zapišemo takole:
https://pandia.ru/text/80/150/images/image013_21.gif" width="89" height="39 src=">, (3.2.4)
Kje pri – aktivnost drog skozi čas t ; a0 – aktivnost zdravila v začetnem trenutku opazovanja.
Pogosto je treba določiti aktivnost določene količine katere koli radioaktivne snovi.
Ne pozabite, da je količinska enota snovi mol. En mol je količina snovi, ki vsebuje enako število atomov, kot jih vsebuje 0,012 kg = 12 g izotopa ogljika 12C.
En mol katere koli snovi vsebuje Avogadrovo število N.A. atomi:
N.A. = 6,02·1023 atomov.
Pri enostavnih snoveh (elementih) masa enega mola številčno ustreza atomski masi A element
1 mol = A G.
Na primer: za magnezij: 1 mol 24Mg = 24 g.
Za 226Ra: 1 mol 226Ra = 226 g itd.
Upoštevajoč povedano v m gramov snovi bo n atomi:
https://pandia.ru/text/80/150/images/image015_20.gif" width="156" height="43 src="> (3.2.6)
Primer: Izračunajmo aktivnost 1 grama 226Ra, ki ima λ = 1,38·10-11 s-1.
a= 1,38·10-11·1/226·6,02·1023 = 3,66·1010 Bq.
Če je radioaktivni element del kemične spojine, je treba pri določanju aktivnosti zdravila upoštevati njegovo formulo. Ob upoštevanju sestave snovi se določi masni delež χ radionuklid v snovi, ki je določen z razmerjem:
https://pandia.ru/text/80/150/images/image017_17.gif" width="118" height="41 src=">
Primer rešitve problema
Pogoj:
dejavnost A0 radioaktivni element 32P na dan opazovanja je 1000 kk. Po enem tednu določite aktivnost in število atomov tega elementa. Polovično življenje T½ 32P = 14,3 dni.
rešitev:
a) Ugotovimo aktivnost fosforja-32 po 7 dneh:
https://pandia.ru/text/80/150/images/image019_16.gif" width="57" height="41 src=">
odgovor: po enem tednu bo aktivnost zdravila 32P 712 Bk, in število atomov radioaktivnega izotopa 32P je 127,14·106 atomov.
Kontrolna vprašanja
1) Kakšna je aktivnost radionuklida?
2) Poimenujte enote za radioaktivnost in razmerje med njimi.
3) Kakšna je konstanta radioaktivnega razpada?
4) Opredelite osnovni zakon radioaktivnega razpada.
5) Kaj je razpolovna doba?
6) Kakšno je razmerje med aktivnostjo in maso radionuklida? Napišite formulo.
Naloge
1. Izračunajte dejavnost 1 G 226Ra. T½ = 1602 leti.
2. Izračunajte dejavnost 1 G 60Co. T½ = 5,3 leta.
3. Ena tankovska granata M-47 vsebuje 4.3 kg 238U. Т½ = 2,5·109 let. Določite aktivnost izstrelka.
4. Izračunajte aktivnost 137Cs po 10 letih, če je v začetnem trenutku opazovanja enaka 1000 kk. T½ = 30 let.
5. Izračunajte aktivnost 90Sr pred letom dni, če je trenutno enaka 500 kk. T½ = 29 let.
6. Kakšno dejavnost bo 1 ustvaril? kg radioizotop 131I, T½ = 8,1 dni?
7. S pomočjo referenčnih podatkov določite dejavnost 1 G 238U. Т½ = 2,5·109 let.
S pomočjo referenčnih podatkov določite dejavnost 1 G 232Th, Т½ = 1,4·1010 let.
8. Izračunajte aktivnost spojine: 239Pu316O8.
9. Izračunajte maso radionuklida z aktivnostjo 1 Ki:
9.1. 131I, T1/2=8,1 dni;
9.2. 90Sr, T1/2=29 let;
9.3. 137Cs, Т1/2=30 let;
9.4. 239Pu, Т1/2=2,4·104 leta.
10. Določite maso 1 mCi radioaktivni ogljikov izotop 14C, T½ = 5560 let.
11. Potrebno je pripraviti radioaktivni pripravek fosforja 32P. Po kolikšnem času bo ostalo 3 % zdravila? Т½ = 14,29 dni.
12. Naravna mešanica kalija vsebuje 0,012 % radioaktivnega izotopa 40K.
1) Določite maso naravnega kalija, ki vsebuje 1 Ki 40K. Т½ = 1,39·109 let = 4,4·1018 sek.
2) Izračunajte radioaktivnost tal z uporabo 40K, če je znano, da je vsebnost kalija v vzorcu tal 14 kg/t.
13. Koliko razpolovnih dob je potrebnih, da se začetna aktivnost radioizotopa zmanjša na 0,001 %?
14. Da bi ugotovili učinek 238U na rastline, so bila semena namočena v 100 ml raztopina UO2(NO3)2 · 6H2O, v kateri je bila masa radioaktivne soli 6 G. Določite aktivnost in specifično aktivnost 238U v raztopini. Т½ = 4,5·109 leta.
15. Prepoznajte dejavnost 1 gramov 232Th, Т½ = 1,4·1010 let.
16. Določite maso 1 Ki 137Cs, Т1/2=30 let.
17. Razmerje med vsebnostjo stabilnih in radioaktivnih izotopov kalija v naravi je stalna vrednost. Vsebnost 40K je 0,01 %. Izračunajte radioaktivnost tal z uporabo 40K, če je znano, da je vsebnost kalija v vzorcu tal 14 kg/t.
18. Litogeno radioaktivnost okolja tvorijo predvsem trije glavni naravni radionuklidi: 40K, 238U, 232Th. Delež radioaktivnih izotopov v naravni vsoti izotopov je 0,01, 99,3 oziroma ~100. Izračunajte radioaktivnost 1 T tla, če je znano, da je relativna vsebnost kalija v vzorcu zemlje 13600 g/t, uran – 1·10-4 g/t, torij – 6·10-4 g/t.
19. 23.200 so jih našli v lupinah školjk Bq/kg 90Sr. Določite aktivnost vzorcev po 10, 30, 50, 100 letih.
20. Glavno onesnaženje zaprtih rezervoarjev na območju Černobila je prišlo v prvem letu po nesreči v jedrski elektrarni. V pridnenih usedlinah jezera. Azbuchin je leta 1999 odkril 137Cs s specifično aktivnostjo 1,1·10 Bq/m2. Določite koncentracijo (aktivnost) padlega 137Cs na m2 pridnenih usedlin v letih 1986-1987. (pred 12 leti).
21. 241Am (T½ = 4,32·102 leta) nastane iz 241Pu (T½ = 14,4 leta) in je aktivni geokemični migrant. Z uporabo referenčnih materialov z natančnostjo 1 % izračunajte zmanjšanje aktivnosti plutonija-241 skozi čas, v katerem letu po černobilski katastrofi bo tvorba 241Am v okolju največja.
22. Izračunajte aktivnost 241Am v emisijah černobilskega reaktorja od aprila
2015, pod pogojem, da je bila aprila 1986 aktivnost 241Am 3,82 1012 Bk,Т½ = 4,32·102 leta.
23. 390 so našli v vzorcih zemlje nCi/kg 137Cs. Izračunajte aktivnost vzorcev po 10, 30, 50, 100 letih.
24. Povprečna koncentracija onesnaženja jezerskega dna. Glubokoye, ki se nahaja v izključenem območju Černobila, je 6,3 104 kk 241Am in 7,4·104 238+239+240Pu na 1 m2. Izračunajte, v katerem letu so bili ti podatki pridobljeni.
§ 15-g. Zakon radioaktivnega razpada
Pojav »ročnih« scintilacijskih števcev in predvsem Geiger-Mullerjevih števcev, ki so pomagali avtomatizirati štetje delcev (glej § 15), je fizike pripeljal do pomembnega zaključka. Za vsak radioaktivni izotop je značilna spontana oslabitev radioaktivnosti, izražena v zmanjšanju števila razpadajočih jeder na enoto časa.
Risanje grafov aktivnosti različnih radioaktivnih izotopov je znanstvenike pripeljalo do enake odvisnosti, izražene eksponentna funkcija(glej grafikon). Na vodoravni osi je prikazan čas opazovanja, na navpični osi pa število nerazpadlih jeder. Ukrivljenost črt je lahko drugačna, sama funkcija, ki je izražala odvisnosti, ki jih opisujejo grafi, pa je ostala enaka:
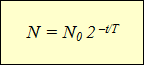
Ta formula izraža zakon radioaktivnega razpada:število jeder, ki s časom niso razpadla, se določi kot zmnožek začetnega števila jeder z 2 na potenco, ki je enaka razmerju med časom opazovanja in razpolovno dobo, vzeto z negativnim predznakom.
Kot se je izkazalo med poskusi, je mogoče različne radioaktivne snovi različno označiti polovično življenje– čas, v katerem se število še nerazpadlih jeder prepolovi(glej tabelo).
Razpolovne dobe nekaterih izotopov nekaterih kemičnih elementov. Vrednosti so podane tako za naravne kot za umetne izotope.
| jod-129 | 15 Ma | Ogljik-14 | 5,7 tisoč let | |
| jod-131 | 8 dni | Uran-235 | 0,7 Ga | |
| jod-135 | 7 ura | Uran-238 | 4,5 milijarde let |
Razpolovna doba je splošno sprejeta fizikalna količina, ki označuje hitrost radioaktivnega razpada. To dokazujejo številni poskusi tudi pri zelo dolgem opazovanju radioaktivne snovi je njen razpolovni čas konstanten, torej ni odvisen od števila atomov, ki so že razpadli. Zato je zakon radioaktivnega razpada našel uporabo pri metodi določanja starosti arheoloških in geoloških najdb.
Radiokarbonska metoda datiranja. Ogljik je zelo pogost kemični element na Zemlji, ki vključuje stabilne izotope ogljik-12, ogljik-13 in radioaktivni izotop ogljik-14, katerega razpolovna doba je 5,7 tisoč let (glej tabelo). Živi organizmi, ki uživajo hrano, kopičijo vse tri izotope v svojih tkivih. Po koncu življenjske dobe organizma se dobava ogljika ustavi, sčasoma pa se njegova vsebnost naravno, zaradi radioaktivnega razpada, zmanjšuje. Ker razpada le ogljik-14, se razmerje izotopov ogljika v fosilnih ostankih živih organizmov skozi stoletja in tisočletja spreminja. Z merjenjem tega »deleža ogljika« lahko ocenimo starost arheološke najdbe.
Metoda radiokarbonske analize je uporabna za geološke kamnine, pa tudi za fosilne človeške objekte, vendar pod pogojem, da razmerje izotopov v vzorcu med njegovim obstojem ni bilo porušeno, na primer zaradi požara ali vpliva močnega vira. sevanja. Neupoštevanje takih razlogov takoj po odkritju te metode je povzročilo napake za več stoletij in tisočletij. Danes se za izotop ogljik-14 uporabljajo "sekularne kalibracijske lestvice", ki temeljijo na njegovi porazdelitvi v dolgoživih drevesih (na primer ameriška tisočletna sekvoja). Njihovo starost je mogoče izračunati zelo natančno - po letnih obročih lesa.
Meja uporabe radiokarbonske metode datiranja je bila na začetku 21. stoletja 60.000 let. Za merjenje starosti starejših vzorcev, kot so kamnine ali meteoriti, se uporablja podobna metoda, vendar namesto ogljika gledamo na izotope urana ali drugih elementov, odvisno od izvora preučevanega vzorca.
Javascript je onemogočen v vašem brskalniku.Za izvajanje izračunov morate omogočiti kontrolnike ActiveX!
>> Zakon radioaktivnega razpada. Polovično življenje
§ 101 ZAKON RADIOAKTIVNEGA RAZPADA. POLOVIČNO ŽIVLJENJE
Radioaktivni razpad je podrejen statističnemu zakonu. Rutherford, ki je preučeval transformacije radioaktivnih snovi, je eksperimentalno ugotovil, da se njihova aktivnost sčasoma zmanjšuje. O tem je bilo govora v prejšnjem odstavku. Tako se aktivnost radona po 1 minuti zmanjša za 2-krat. Tudi aktivnost elementov, kot so uran, torij in radij, s časom upada, vendar veliko počasneje. Za vsako radioaktivno snov obstaja določen časovni interval, v katerem se aktivnost zmanjša za 2-krat. Ta interval se imenuje razpolovna doba. Razpolovna doba T je čas, v katerem razpade polovica začetnega števila radioaktivnih atomov.
Padec aktivnosti, to je število razpadov na sekundo, odvisno od časa za eno od radioaktivnih zdravil je prikazano na sliki 13.8. Razpolovna doba te snovi je 5 dni.
Izpeljimo zdaj matematično obliko zakona radioaktivnega razpada. Naj bo število radioaktivnih atomov v začetnem trenutku (t = 0) enako N 0. Potem bo po razpolovni dobi to število enako
Po drugem podobnem časovnem intervalu bo to število postalo enako:









