ARENES
Aromatski ogljikovodiki (areni) – ciklični ogljikovodiki, združeni s konceptom aromatičnosti, ki določa skupne značilnosti strukture in kemijskih lastnosti.
Razvrstitev
Glede na število benzenskih obročev v molekuli delimo arene na na:
mononuklearno
večjedrni

Nomenklatura in izomerija
Strukturni prednik benzenskih ogljikovodikov je benzen C 6 H 6 iz katerega izhajajo sistematična imena homologov.
Za monociklične spojine se ohranijo naslednja nesistematična (trivialna) imena:

Položaj substituentov je označen z najmanjšimi številkami (smer oštevilčenja ni pomembna),
|
|
|
in za di-substituirane spojine lahko uporabite zapis orto, meta, par.
|
|
|
|
Če so v obroču trije substituenti, morajo dobiti najnižje številke, tj. vrstica "1,2,4" ima prednost pred "1,3,4".


1,2-dimetil-4-etilbenzen (pravilno ime) 3,4-dimetil-1-etilbenzen (nepravilno ime)
Izomerija monosubstituiranih arenov je posledica zgradbe ogljikovega ogrodja substituenta; pri di- in polisubstituiranih homologih benzena je dodana dodatna izomerija, ki jo povzroča različna razporeditev substituentov v jedru.
Izomerija aromatskih ogljikovodikov s sestavo C 9 H 12:
|
|
|
|
|
Fizične lastnosti
Vrelišče in tališče arenov je višje kot pri alkanih, alkenih, alkinih, so rahlo polarni, netopni v vodi in dobro topni v nepolarnih organskih topilih. Arene so tekočine ali trdne snovi, ki imajo posebne vonjave. Benzeni in številni kondenzirani areni so strupeni, nekateri od njih imajo rakotvorne lastnosti. Vmesni produkti oksidacije kondenziranih arenov v telesu so epoksidi, ki sami neposredno povzročajo raka ali pa so predhodniki rakotvornih snovi.
Pridobivanje aren
Številni aromatski ogljikovodiki so velikega praktičnega pomena in se proizvajajo v velikem industrijskem obsegu. Številne industrijske metode temeljijo na predelavi premoga in nafte.
Nafta je sestavljena predvsem iz alifatskih in alicikličnih ogljikovodikov; razvite so bile metode za aromatiziranje olj, katerih kemijske osnove je razvil N.D. Zelinsky, B.A. Kazansky.
1. Ciklizacija in dehidrogenacija:
2. Hidrodemetilacija:

3. Homologe benzena pripravimo z alkilacijo ali acilacijo, ki ji sledi redukcija karbonilne skupine.
a) Friedel-Craftsova alkilacija:

b) Friedel-Craftsovo aciliranje:

4. Priprava bifenila z Wurtz-Fittingovo reakcijo:
5. Priprava difenilmetana s Friedel-Craftsovo reakcijo:
Zgradba in kemijske lastnosti.
Merila aromatičnosti:
Na podlagi teoretičnih izračunov in eksperimentalnih študij cikličnih konjugiranih sistemov je bilo ugotovljeno, da je spojina aromatska, če ima:
- Ploščati ciklični σ-skelet;
- Konjugiran zaprt sistem π-elektronov, ki pokriva vse atome obroča in vsebuje 4n + 2, kjer je n = 0, 1, 2, 3 itd. Ta formulacija je znana kot Hücklovo pravilo. Merila aromatičnosti omogočajo razlikovanje konjugiranih aromatičnih sistemov od vseh drugih. Benzen vsebuje sekstet π elektronov in sledi Hücklovemu pravilu pri n = 1.

Kaj daje aromatičnost:
Kljub visoki stopnji nenasičenosti so aromatične spojine odporne na oksidante in temperaturo ter so bolj nagnjene k reakcijam substitucije kot k reakcijam dodajanja. Te spojine imajo povečano termodinamično stabilnost, ki jo zagotavlja visoka energija konjugacije aromatskega obročnega sistema (150 kJ/mol); zato areni prednostno vstopajo v substitucijske reakcije, zaradi česar ohranijo aromatičnost.
Mehanizem elektrofilnih substitucijskih reakcij v aromatskem obroču:
Elektronska gostota π-konjugiranega sistema benzenskega obroča je primerna tarča za napad elektrofilnih reagentov.
Običajno elektrofilni reagenti nastanejo med reakcijo z uporabo katalizatorjev in ustreznih pogojev.
E – Y → E δ + – Y δ - → E + + Y -
Tvorba π-kompleksa. Začetni napad elektrofila π-elektronskega oblaka obroča vodi do koordinacije reagenta s π-sistemom in tvorbe kompleksa donorsko-akceptorskega tipa, imenovanega π-kompleks. Sistem arome ni moten:

Tvorba σ-kompleksa. Mejna stopnja, v kateri elektrofil tvori kovalentno vez z atomom ogljika zaradi dveh elektronov π-sistema obroča, ki ga spremlja prehod tega atoma ogljika iz sp 2 - V sp 3 - hibridnem stanju in aromatski motnji se molekula spremeni v karbokation.

Stabilizacija σ-kompleksa. Izvede se z abstrakcijo protona iz σ-kompleksa z uporabo baze. V tem primeru se zaradi dveh elektronov prekinitve kovalentne vezi C–H obnovi zaprti π-sistem obroča, t.j. molekula se vrne v aromatično stanje:

Vpliv substituentov na reaktivnost in usmerjenost elektrofilne substitucije
Substituenti na benzenovem obroču motijo enakomernost porazdelitve π- elektronski oblak obroča in s tem vplivajo na reaktivnost obroča.
- Substituenti, ki dajejo elektrone (D), povečajo elektronsko gostoto obroča in povečajo hitrost elektrofilne substitucije; aktiviranje.
- Substituenti, ki odvzemajo elektrone (A), zmanjšajo elektronsko gostoto obroča in zmanjšajo hitrost reakcije, t.i. dekontaminacijo.
Aromatski ogljikovodiki– spojine ogljika in vodika, katerih molekula vsebuje benzenov obroč. Najpomembnejši predstavniki aromatskih ogljikovodikov so benzen in njegovi homologi - produkti zamenjave enega ali več atomov vodika v molekuli benzena z ostanki ogljikovodikov.
Zgradba molekule benzena
Prvo aromatsko spojino, benzen, je leta 1825 odkril M. Faraday. Ugotovljena je bila njegova molekulska formula - C 6 H 6. Če primerjamo njegovo sestavo s sestavo nasičenega ogljikovodika, ki vsebuje enako število ogljikovih atomov - heksana (C 6 H 14), potem lahko vidimo, da benzen vsebuje osem manj atomov vodika . Kot je znano, pojav večkratnih vezi in ciklov vodi do zmanjšanja števila vodikovih atomov v molekuli ogljikovodika. Leta 1865 je F. Kekule predlagal njegovo strukturno formulo kot cikloheksantrien - 1, 3, 5.

Tako ustrezna molekula Kekulejeva formula, vsebuje dvojne vezi, zato mora biti benzen nenasičen, to pomeni, da mora zlahka prestati adicijske reakcije: hidrogeniranje, bromiranje, hidratacija itd.
Vendar pa podatki iz številnih poskusov kažejo, da benzen vstopa v adicijske reakcije le v težkih pogojih (pri visokih temperaturah in osvetlitvi) in je odporen proti oksidaciji. Zanj so najbolj značilne reakcije substitucije, zato je benzen bližje mejnim ogljikovodikom.
Mnogi znanstveniki so poskušali razložiti ta neskladja in predlagali različne možnosti za strukturo benzena. Strukturo molekule benzena je dokončno potrdila reakcija njenega nastanka iz acetilena. V resnici so vezi ogljik-ogljik v benzenu enakovredne in njihove lastnosti niso podobne lastnostim enojnih ali dvojnih vezi.
Trenutno je benzen označen s formulo Kekule ali s šesterokotnikom, v katerem je upodobljen krog.
![]()
Kaj je torej posebnega v strukturi benzena? Na podlagi podatkov in izračunov raziskovalcev je bilo ugotovljeno, da je vseh šest ogljikovih atomov v stanju sp 2 -hibridizacijo in ležijo v isti ravnini. Nehibridizirano str-orbitale ogljikovih atomov, ki tvorijo dvojne vezi (Kekulejeva formula) so pravokotne na ravnino obroča in med seboj vzporedne.
Med seboj se prekrivajo in tvorijo en sam π-sistem. Tako je sistem izmeničnih dvojnih vezi, prikazan v Kekulejevi formuli, cikličen sistem konjugiranih, prekrivajočih se vezi. Ta sistem je sestavljen iz dveh toroidnih (krofu podobnih) območij elektronske gostote, ki ležita na obeh straneh benzenskega obroča. Tako je bolj logično benzen prikazati kot pravilen šesterokotnik s krogom v središču (π-sistem) kot kot cikloheksatrien-1,3,5. 
Ameriški znanstvenik L. Pauling je predlagal, da se benzen predstavi v obliki dveh mejnih struktur, ki se razlikujeta po porazdelitvi elektronske gostote in se nenehno preoblikujejo drug v drugega, t.j. obravnavajte ga kot vmesno spojino, "povprečje" dveh struktur.
Meritve dolžine vezi potrjujejo te domneve. Ugotovljeno je bilo, da imajo vse C-C vezi v benzenu enako dolžino (0,139 nm). So nekoliko krajše od enojnih C-C vezi (0,154 nm) in daljše od dvojnih vezi (0,132 nm).
Obstajajo tudi spojine, katerih molekule vsebujejo več cikličnih struktur.

Izomerija in nomenklatura
Za homologe benzena je značilno izomerija položaja več substituentov. Najenostavnejši homolog benzena - toluen (metilbenzen) - nima takih izomerov; naslednji homolog je predstavljen kot štirje izomeri:

Osnova imena aromatskega ogljikovodika z majhnimi substituenti je beseda benzen. Atomi v aromatskem obroču so oštevilčeni od najvišjega do najnižjega substituenta:

Po stari nomenklaturi se imenujeta poziciji 2 in 6 ortopozicije, 4 - par-, ter 3 in 5 - metadoločbe.
Fizične lastnosti
V normalnih pogojih so benzen in njegovi najpreprostejši homologi zelo strupene tekočine z značilnim neprijetnim vonjem. V vodi se topijo slabo, v organskih topilih pa dobro.
Kemijske lastnosti benzena
Nadomestne reakcije. Aromatski ogljikovodiki so podvrženi substitucijskim reakcijam.
1. Bromiranje. Pri reakciji z bromom v prisotnosti katalizatorja, železovega bromida (ΙΙΙ), lahko enega od vodikovih atomov v benzenovem obroču zamenjamo z atomom broma:

2. Nitriranje benzena in njegovih homologov. Ko aromatski ogljikovodik medsebojno deluje z dušikovo kislino v prisotnosti žveplove kisline (mešanica žveplove in dušikove kisline se imenuje nitrirna zmes), se atom vodika nadomesti z nitro skupino -NO2:

Z redukcijo nitrobenzena, ki nastane pri tej reakciji, dobimo anilin, snov, ki se uporablja za pridobivanje anilinskih barvil:

Ta reakcija je dobila ime po ruskem kemiku Zininu.
Adicijske reakcije. Aromatske spojine so lahko tudi podvržene adicijskim reakcijam na benzenski obroč. V tem primeru nastane cikloheksan ali njegovi derivati.
1. Hidrogeniranje. Katalitično hidrogeniranje benzena poteka pri višji temperaturi kot hidrogeniranje alkenov:
![]()
2. Kloriranje. Reakcija se pojavi ob osvetlitvi z ultravijolično svetlobo in je prosti radikal:

Homologi benzena
Sestava njihovih molekul ustreza formuli C n H 2 n-6. Najbližji homologi benzena so:
Vsi homologi benzena, ki sledijo toluenu, imajo izomere. Izomerija je lahko povezana s številom in strukturo substituenta (1, 2) ter s položajem substituenta v benzenovem obroču (2, 3, 4). Spojine s splošno formulo C 8 H 10:

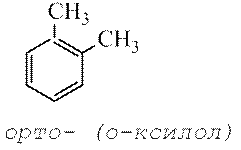
V skladu s staro nomenklaturo, ki se uporablja za označevanje relativne lokacije dveh enakih ali različnih substituentov na benzenovem obroču, se uporabljajo predpone orto- (skrajšano o-) - substituenti se nahajajo na sosednjih ogljikovih atomih, meta-(m-) – skozi en ogljikov atom in par— (p-) – substituenti drug proti drugemu.
Prvi člani homologne serije benzena so tekočine s posebnim vonjem. So lažji od vode. So dobra topila.
Homologi benzena reagirajo zamenjave ( bromiranje, nitriranje). Toluen pri segrevanju oksidira permanganat:

Homologi benzena se uporabljajo kot topila za proizvodnjo barvil, fitofarmacevtskih sredstev, plastike in zdravil.



















Aromatske kemične spojine ali areni so velika skupina karbocikličnih spojin, katerih molekule vsebujejo stabilen obroč šestih ogljikovih atomov. Imenuje se "benzenski obroč" in je odgovoren za posebne fizikalne in kemijske lastnosti arenov.
Aromatski ogljikovodiki vključujejo predvsem benzen in vse njegove homologe in derivate.
Molekule arena lahko vsebujejo več benzenskih obročev. Take spojine imenujemo polinuklearne aromatske spojine. Naftalin je na primer znano zdravilo za zaščito volnenih izdelkov pred molji.
Benzen
Ta najpreprostejši predstavnik arenov je sestavljen le iz benzenskega obroča. Njegova molekulska formula je C6H6. Strukturno formulo molekule benzena najpogosteje predstavlja ciklična oblika, ki jo je predlagal A. Kekule leta 1865.
Prednost te formule je, da natančno odraža sestavo in enakovrednost vseh atomov C in H v obroču. Vendar pa ni mogel pojasniti številnih kemijskih lastnosti arenov, zato je trditev o prisotnosti treh konjugiranih C=C dvojnih vezi napačna. To je postalo znano šele s pojavom moderne teorije povezav.
Medtem je danes formula za benzen pogosto zapisana na način, ki ga predlaga Kekule. Prvič, z njegovo pomočjo je priročno zapisati enačbe kemijskih reakcij. Drugič, sodobni kemiki v njem vidijo le simbol in ne prave strukture. Strukturo molekule benzena danes predstavljajo različne vrste strukturnih formul.
Zgradba benzenskega obroča
Glavna značilnost benzenskega obroča je odsotnost enojnih in dvojnih vezi v njem v tradicionalnem smislu. V skladu s sodobnimi koncepti je molekula benzena videti kot ploščat šesterokotnik z dolžino stranic 0,140 nm. Izkazalo se je, da je dolžina C-C vezi v benzenu vmesna vrednost med enojno (njena dolžina je 0,154 nm) in dvojno (0,134 nm). Tudi C-H vezi ležijo v isti ravnini in z robovi šesterokotnika tvorijo kot 120°.
Vsak atom C v strukturi benzena je v hibridnem stanju sp2. Povezan je s svojimi tremi hibridnimi orbitalami z dvema atomoma C, ki se nahajata v bližini, in enim atomom H, kar pomeni, da tvori tri s-vezi. Druga, a že nehibridizirana 2p orbitala se prekriva z istimi orbitalami sosednjih C atomov (desno in levo). Njegova os je pravokotna na ravnino obroča, kar pomeni, da se orbitale prekrivajo nad in pod njim. V tem primeru nastane skupen zaprt sistem π-elektronov. Zaradi enakega prekrivanja 2p orbital šestih atomov C pride do neke vrste »izenačitve« vezi C-C in C=C.
Rezultat tega procesa je podobnost takih "ena in pol" vezi z dvojnimi in enojnimi vezmi. To pojasnjuje dejstvo, da imajo areni kemične lastnosti, značilne za alkane in alkene.
Energija vezi ogljik-ogljik v benzenovem obroču je 490 kJ/mol. Kar je tudi povprečje med energijama enojne in večkratne dvojne vezi.

Nomenklatura arene
Osnova za imena aromatskih ogljikovodikov je benzen. Atomi v obroču so oštevilčeni od najvišjega substituenta. Če so substituenti enakovredni, se oštevilčenje izvede po najkrajši poti.
Za številne homologe benzena se pogosto uporabljajo trivialna imena: stiren, toluen, ksilen itd. Za prikaz relativnega položaja substituentov je običajno uporabiti predpone orto-, meta-, para-.
Če molekula vsebuje funkcionalne skupine, na primer karbonil ali karboksil, se molekula arena obravnava kot aromatski radikal, povezan z njo. Na primer, -C6H5-fenil, -C6H4-fenilen, C6H5-CH2-benzil.
Fizične lastnosti
Prvi predstavniki v homolognem nizu benzena so brezbarvne tekočine s specifičnim vonjem. Njihova teža je lažja od vode, v kateri so praktično netopni, vendar se dobro topijo v večini organskih topil.
Vsi aromatski ogljikovodiki gorijo z dimljenim plamenom, kar je razloženo z visoko vsebnostjo C v molekulah. Njihovo tališče in vrelišče narašča z naraščajočo molekulsko maso v homolognem nizu benzena.
Kemijske lastnosti benzena
Od različnih kemijskih lastnosti arenov je treba posebej omeniti substitucijske reakcije. Zelo pomembne so tudi nekatere adicijske reakcije, ki nastanejo pod posebnimi pogoji in oksidacijski procesi.
Nadomestne reakcije
Precej mobilni π-elektroni benzenskega obroča so sposobni zelo aktivno reagirati z napadajočimi elektrofili. Ta elektrofilna substitucija vključuje sam benzenov obroč v benzenu in povezano verigo ogljikovodikov v njegovih homologih. Mehanizem tega procesa je dokaj podrobno preučila organska kemija. Kemične lastnosti arenov, povezane z napadom elektrofilov, potekajo v treh fazah.
- Prva stopnja. Pojav π-kompleksa je posledica vezave π-elektronskega sistema benzenovega obroča na X + delec, ki se veže na šest π-elektronov.

Bromiranje benzena v prisotnosti železovih ali aluminijevih bromidov brez segrevanja povzroči nastanek bromobenzena:
C 6 Η 6 + Br 2 —> C 6 Η 5 -Br + ΗBr.
Nitriranje z mešanico dušikove in žveplove kisline povzroči nastanek spojin z nitro skupino v obroču:
C 6 Η 6 + ΗONO 2 -> C 6 Η 5 -NO 2 + Η 2 O.
Sulfoniranje poteka z bisulfonijevim ionom, ki nastane kot posledica reakcije:
3Η 2 SO 4 ⇄ SO 3 Η + + Η 3 O + + 2ΗSO 4 - ,
ali žveplov trioksid.
Reakcija, ki ustreza tej kemični lastnosti arenov, je:
C 6 H 6 + SO 3 H + —> C 6 H 5 —SO 3 H + H + .
Alkilne in acilne substitucijske reakcije ali Friedel-Craftsove reakcije izvajamo v prisotnosti brezvodnega AlCl 3 .

Te reakcije so malo verjetne za benzen in potekajo s težavo. Ne pride do adicije vodikovih halogenidov in vode k benzenu. Vendar pa je pri zelo visokih temperaturah v prisotnosti platine možna reakcija hidrogeniranja:
C 6 Η 6 + 3H 2 -> C 6 H 12.
Pri obsevanju z ultravijolično svetlobo se lahko molekule klora pridružijo molekuli benzena:
C 6 Η 6 + 3Cl 2 —> C 6 Η 6 Cl 6 .
Oksidacijske reakcije
Benzen je zelo odporen na oksidante. Tako ne razbarva rožnate raztopine kalijevega permanganata. Vendar pa se lahko v prisotnosti vanadijevega oksida z atmosferskim kisikom oksidira v maleinsko kislino:
C 6 H 6 + 4O -> COOΗ-CΗ = CΗ-COOΗ.
V zraku benzen gori s pojavom saj:
2C 6 Η 6 + 3O2 → 12C + 6 Η 2 O.
Kemijske lastnosti arenov
- Zamenjava.


Pravila orientacije
Kateri položaj (o-, m- ali p-) bo substituent zasedel med interakcijo elektrofilnega sredstva z benzenskim obročem, določajo naslednja pravila:
- če je v benzenovem obroču že kakšen substituent, potem je ta substituent tisti, ki usmerja prihajajočo skupino na določen položaj;
- vsi orientacijski substituenti so razdeljeni v dve skupini: orientanti prve vrste usmerjajo vhodno skupino atomov v orto- in para-pozicije (-NH 2, -OH, -CH 3, -C 2 H 5, halogeni); orientanti druge vrste usmerjajo vstopne substituente v meta položaj (-NO 2, -SO 3 H, -COHO, -COOH).
Orientacije so tukaj navedene v padajočem vrstnem redu smerne sile.
Treba je omeniti, da je ta delitev substituentov skupine pogojna, ker v večini reakcij opazimo tvorbo vseh treh izomerov. Orientanti le vplivajo na to, kateri izmed izomerov bo pridobljen v večjih količinah.
Pridobivanje aren
Glavna vira arenov sta suha destilacija premoga in rafinacija nafte. Premogov katran vsebuje ogromno vseh vrst aromatskih ogljikovodikov. Nekatere vrste olja vsebujejo do 60 % arenov, ki jih je mogoče enostavno izolirati s preprosto destilacijo, pirolizo ali krekingom.
Metode sintetične priprave in kemijske lastnosti arenov so pogosto povezane. Benzen, tako kot njegove homologe, se pridobiva na enega od naslednjih načinov.
1. Reforming naftnih derivatov. Dehidrogenacija alkanov je najpomembnejša industrijska metoda za sintezo benzena in mnogih njegovih homologov. Reakcija poteka s prehajanjem plinov preko segretega katalizatorja (Pt, Cr 2 O 3, Mo in V oksidi) pri t = 350-450 o C:
C 6 H 14 —> C 6 H 6 + 4 H 2.
2. Wurtz-Fittigova reakcija. Izvaja se skozi stopnjo pridobivanja organokovinskih spojin. Kot rezultat reakcije lahko dobimo več produktov.
3. Trimerizacija acetilena. Sam acetilen, tako kot njegovi homologi, je sposoben tvoriti arene pri segrevanju s katalizatorjem:
3C 2 Η 2 -> C 6 Η 6.
4. Friedel-Craftsova reakcija. Metoda pridobivanja in pretvorbe homologov benzena je bila že obravnavana zgoraj v kemijskih lastnostih arenov.
5. Priprava iz ustreznih soli. Benzen lahko izoliramo z destilacijo soli benzojske kisline z alkalijami:
C 6 Η 5 —COONa + NaOΗ —> C 6 Η 6 + Na 2 CO 3 .
6. Zmanjšanje ketonov:
C6Η 5 -CO-CΗ 3 + Zn + 2ΗCl -> C 6 Η 5 -CΗ 2 -CΗ 3 + Η 2 O + ZnCl2;
CΗ 3 -C 6 Η 5 -CO-CΗ 3 + NΗ 2 -NΗ 2 —> CΗ 3 -C 6 Η 5 -CΗ 2 -CΗ 3 + Η 2 O.
Uporaba aren
Kemične lastnosti in področja uporabe arenov so neposredno povezani, saj se večina aromatskih spojin uporablja za nadaljnjo sintezo v kemični proizvodnji in se ne uporablja v končni obliki. Izjema so snovi, ki se uporabljajo kot topila.
Benzen C 6 × 6 se uporablja predvsem pri sintezi etilbenzena, kumena in cikloheksana. Na njegovi osnovi se pridobivajo vmesni proizvodi za proizvodnjo različnih polimerov: gume, plastike, vlaken, barvil, površinsko aktivnih snovi, insekticidov in zdravil.

Toluen C 6 H 5 -CH 3 se uporablja pri proizvodnji barvil, zdravil in eksplozivov.
Ksileni C 6 Η 4 (C 3) 2 v mešani obliki (tehnični ksilen) se uporabljajo kot topilo ali začetni pripravek za sintezo organskih snovi.
Izopropilbenzen (ali kumen) C 6 H 4 -C H (CH 3) 2 je začetni reagent za sintezo fenola in acetona.
Vinilbenzen (stiren) C 6 Η 5 -CΗ=CΗ 2 je surovina za proizvodnjo najpomembnejšega polimernega materiala - polistirena.
OPREDELITEV
Aromatski ogljikovodiki (areni)– snovi, katerih molekule vsebujejo enega ali več benzenskih obročev. Splošna formula homologne serije benzena C n H 2 n -6
Najenostavnejša predstavnika aromatskih ogljikovodikov sta benzen - C 6 H 6 in toluen - C 6 H 5 -CH 3. Ogljikovodične radikale, pridobljene iz arenov, imenujemo: C 6 H 5 - - fenil (Ph-) in C 6 H 5 -CH 2 - - benzil.
Vseh šest ogljikovih atomov v molekuli benzena je v sp 2 hibridnem stanju. Vsak atom ogljika tvori vezi 3σ z dvema drugima atomoma ogljika in enim atomom vodika, ki ležijo v isti ravnini. Šest ogljikovih atomov tvori pravilen šesterokotnik (σ-skelet molekule benzena).
Vsak atom ogljika ima eno nehibridizirano p orbitalo, ki vsebuje en elektron. Šest p-elektronov tvori en sam oblak π-elektronov (aromatski sistem), ki je upodobljen kot krog znotraj šestčlenskega obroča.
Kemijske lastnosti arenov
Za benzen in njegove homologe so značilne substitucijske reakcije, ki potekajo preko elektrofilnega mehanizma:
- halogeniranje (benzen reagira s klorom in bromom v prisotnosti katalizatorjev - brezvodni AlCl 3, FeCl 3, AlBr 3)
C6H6 + Cl2 = C6H5-Cl + HCl
- nitriranje (benzen zlahka reagira z nitrirno mešanico - mešanico koncentrirane dušikove in žveplove kisline)

- alkiliranje z alkeni
C 6 H 6 + CH 2 = CH-CH 3 → C 6 H 5 -CH(CH 3) 2
Adicijske reakcije na benzen vodijo do uničenja aromatskega sistema in se pojavljajo le v težkih pogojih:
— hidrogeniranje (reakcija poteka pri segrevanju, katalizator je Pt)

- dodajanje klora (pojavi se pod vplivom UV sevanja s tvorbo trdnega produkta - heksaklorocikloheksan (heksakloran) - C 6 H 6 Cl 6)

Fizikalne lastnosti aren
Prvi člani homologne vrste benzena so brezbarvne tekočine s specifičnim vonjem. So lažji od vode in v njej praktično netopni. Dobro se topijo v organskih topilih in so sama po sebi dobra topila.
Pridobivanje aren
Glavne metode za pridobivanje benzena in njegovih homologov:
— dehidrociklizacija alkanov (katalizatorji – Pt, Cr 3 O 2)

— dehidrogenacija cikloalkanov (reakcija poteka pri segrevanju, katalizator je Pt)

— trimerizacija acetilena (reakcija poteka pri segrevanju na 600C, katalizator je aktivno oglje)
3HC≡CH → C6H6
- alkiliranje benzenov (Friedel-Craftsova reakcija) (katalizator - aluminijev klorid ali fosforjeva kislina)

Primeri reševanja problemov
PRIMER 1
| telovadba | Parna gostota snovi je 3,482 g/l. Pri njegovi pirolizi je nastalo 6 g saj in 5,6 l vodika. Določite formulo te snovi. |
| rešitev | Poiščimo količino sajaste snovi (ogljika): v(C) = m(C)/M(C) v(C) = 6/12 = 0,5 mol Poiščimo količino vodikove snovi: v(H 2) = V(H 2)/V m v(H 2) = 5,6/22,4 = 0,25 mol Zato bo količina snovi enega atoma vodika enaka: v(H) = 2×0,25 = 0,5 mol Označimo število ogljikovih atomov v molekuli ogljikovodika z x, število vodikovih atomov pa z y, potem je razmerje teh atomov v molekuli: x:y = 0,5: 0,5 = 1:1 Najenostavnejša formula ogljikovodika CH Molekulska masa ogljikovodika je: M(C x H y) = ρ×V m = 3,482×22,4 = 78 g/mol Molekulska masa molekule sestave CH je enaka: M(CH) = 13 g/mol n = M(C x H y)/ M(CH) = 78/13 = 6, zato je treba koeficienta x in y pomnožiti s 6, potem ima želeni ogljikovodik sestavo C 6 H 6 - to je benzen |
Splošna obravnava.
Aromatski ogljikovodiki (areni) so snovi, katerih molekule vsebujejo enega ali več benzenskih obročev - ciklične skupine ogljikovih atomov s posebno naravo vezi.
Koncept "benzenskega obroča" takoj zahteva dekodiranje. Da bi to naredili, je treba vsaj na kratko razmisliti o strukturi molekule benzena. Prvo strukturo benzena je leta 1865 predlagal nemški znanstvenik A. Kekule:
Ta formula pravilno odraža enakovrednost šestih ogljikovih atomov, vendar ne pojasni številnih posebnih lastnosti benzena. Na primer, benzen kljub nenasičenosti ne kaže nagnjenosti k adicijskim reakcijam: ne razbarva bromove vode in raztopine kalijevega permanganata, tj. ne daje kvalitativnih reakcij, značilnih za nenasičene spojine.
Strukturne značilnosti in lastnosti benzena so bile v celoti pojasnjene šele po razvoju sodobne kvantnomehanske teorije kemijskih vezi. Po sodobnih konceptih je vseh šest ogljikovih atomov v molekuli benzena v -hibridnem stanju. Vsak atom ogljika tvori -vezi z dvema drugima atomoma ogljika in enim atomom vodika, ki ležita v isti ravnini. Vezni koti med tremi -vezmi so 120°. Tako leži vseh šest ogljikovih atomov v isti ravnini in tvori pravilen šestkotnik (skelet molekule benzena).
Vsak ogljikov atom ima eno nehibridizirano p orbitalo.
Šest takšnih orbital se nahaja pravokotno na ravno okostje in vzporedno drug z drugim (slika 21.1, a). Vseh šest p-elektronov medsebojno deluje in tvori -vezi, ki niso lokalizirane v parih, kot pri tvorbi navadnih dvojnih vezi, ampak so združene v en sam -elektronski oblak. Tako pride do krožne konjugacije v molekuli benzena (glej § 19). Največja gostota -elektronov v tem konjugiranem sistemu se nahaja nad in pod ravnino -skeleta (slika 21.1, b).

riž. 21.1. Zgradba molekule benzena
Posledično so vse vezi med ogljikovimi atomi v benzenu poravnane in imajo dolžino 0,139 nm. Ta vrednost je vmesna med dolžino enojne vezi v alkanih (0,154 nm) in dolžino dvojne vezi v alkenih (0,133 nm). Enakovrednost povezav je običajno prikazana s krogom znotraj cikla (slika 21.1, c). Krožna konjugacija daje energijski dobiček 150 kJ/mol. Ta vrednost predstavlja konjugacijsko energijo - količino energije, ki jo je treba porabiti za motnjo aromatskega sistema benzena (primerjaj - konjugacijska energija v butadienu je samo 12 kJ/mol).
Ta elektronska struktura pojasnjuje vse lastnosti benzena. Zlasti je jasno, zakaj je benzen težko vstopiti v adicijske reakcije - to bi povzročilo kršitev konjugacije. Takšne reakcije so možne le v zelo težkih pogojih.
Nomenklatura in izomerija.
Običajno lahko arene razdelimo v dve vrsti. Prvi vključuje derivate benzena (na primer toluen ali bifenil), drugi vključuje kondenzirane (polinuklearne) arene (najenostavnejši med njimi je naftalen):

Upoštevali bomo samo homologne serije benzena s splošno formulo.
Strukturna izomerija v homolognem nizu benzena je posledica medsebojne razporeditve substituentov v jedru. Monosubstituirani derivati benzena nimajo položajnih izomerov, saj so vsi atomi v benzenovem obroču enakovredni. Disubstituirani derivati obstajajo v obliki treh izomerov, ki se razlikujejo po relativni razporeditvi substituentov. Položaj substituentov je označen s številkami ali predponami:

Radikali aromatskih ogljikovodikov se imenujejo arilni radikali. Radikal se imenuje fenil.
Fizične lastnosti.
Prvi člani homologne serije benzena (na primer toluen, etilbenzen itd.) So brezbarvne tekočine s posebnim vonjem. So lažji od vode in v vodi netopni. Dobro se topijo v organskih topilih. Benzen in njegovi homologi so sami po sebi dobra topila za številne organske snovi. Vse arene gorijo z dimljenim plamenom zaradi visoke vsebnosti ogljika v njihovih molekulah.
Metode pridobivanja.
1. Priprava iz alifatskih ogljikovodikov. Če ravnoverižne alkane z vsaj 6 atomi ogljika na molekulo prepeljemo preko segretega platinovega ali kromovega oksida, pride do dehidrociklizacije - tvorbe arena s sproščanjem vodika:
2. Dehidrogenacija cikloalkanov. Reakcija poteka s prehajanjem hlapov cikloheksana in njegovih homologov čez segreto platino:

3. Priprava benzena s trimerizacijo acetilena - glej § 20.
4. Pridobivanje homologov benzena z uporabo Friedel-Craftsove reakcije - glej spodaj.
5. Fuzija soli aromatskih kislin z alkalijami:
Kemijske lastnosti.
Splošna obravnava. Aromatično jedro, ki ima mobilnih šest elektronov, je primeren predmet za napad z elektrofilnimi reagenti. To olajša tudi prostorska razporeditev elektronskega oblaka na obeh straneh ravnega okostja molekule (slika 21.1, b)
Najbolj značilne reakcije za arene so tiste, ki potekajo po mehanizmu elektrofilne substitucije, označene s simbolom (iz angleške substitution electrophilic).
Mehanizem elektrofilne substitucije je mogoče predstaviti na naslednji način. Elektrofilni reagent XY (X je elektrofil) napade elektronski oblak in zaradi šibke elektrostatične interakcije nastane nestabilen -kompleks. Aromatični sistem še ni moten. Ta stopnja poteka hitro. V drugi, počasnejši stopnji nastane kovalentna vez med elektrofilom X in enim od ogljikovih atomov obroča zaradi dveh -elektronov obroča. Ta atom ogljika gre iz -hibridnega stanja. V tem primeru je aroma sistema motena. Štirje preostali -elektroni so razdeljeni med pet drugih ogljikovih atomov, molekula benzena pa tvori karbokation ali -kompleks.

Motnja aromatičnosti je energijsko neugodna, zato je struktura β-kompleksa manj stabilna kot aromatska struktura. Za ponovno vzpostavitev aromatičnosti se iz ogljikovega atoma, vezanega na elektrofil (tretja stopnja), odstrani proton. V tem primeru se dva elektrona vrneta v -sistem in s tem se obnovi aromatičnost:

Reakcije elektrofilne substitucije se pogosto uporabljajo za sintezo številnih derivatov benzena.
Kemijske lastnosti benzena.
1. Halogeniranje. Benzen v normalnih pogojih ne reagira s klorom ali bromom. Reakcija lahko poteka samo v prisotnosti brezvodnih katalizatorjev. Kot rezultat reakcije nastanejo s halogenom substituirani areni:

Vloga katalizatorja je, da polarizira nevtralno molekulo halogena, da iz nje tvori elektrofilni delec:
2. Nitriranje. Benzen zelo počasi reagira s koncentrirano dušikovo kislino tudi pri segrevanju. Vendar pa se pod delovanjem tako imenovane nitrirne mešanice (mešanice koncentrirane dušikove in žveplove kisline) reakcija nitracije pojavi precej enostavno:
3. Sulfoniranje. Reakcija zlahka poteka pod vplivom "dimeče" žveplove kisline (oleum):
4. Friedel-Craftsova alkilacija. Kot rezultat reakcije se v benzenski obroč uvede alkilna skupina, da nastanejo benzenovi homologi. Reakcija se pojavi, ko je benzen izpostavljen haloalkanom v prisotnosti katalizatorjev - aluminijevih halogenidov. Vloga katalizatorja se zmanjša na polarizacijo molekule s tvorbo elektrofilnega delca:
Glede na strukturo radikala v haloalkanu lahko dobimo različne homologe benzena:
5. Alkilacija z alkeni. Te reakcije se industrijsko pogosto uporabljajo za proizvodnjo etilbenzena in izopropilbenzena (kumen). Alkiliranje poteka v prisotnosti katalizatorja. Mehanizem reakcije je podoben mehanizmu prejšnje reakcije:
Vse zgoraj obravnavane reakcije potekajo po mehanizmu elektrofilne substitucije.
Reakcije adicije na arene vodijo do uničenja aromatskega sistema in zahtevajo velike količine energije, zato se pojavljajo le v težkih pogojih.
6. Hidrogeniranje. Reakcija adicije vodika na arene poteka pri segrevanju in visokem tlaku v prisotnosti kovinskih katalizatorjev (Ni, Pt, Pd). Benzen se pretvori v cikloheksan, homologi benzena pa v derivate cikloheksana:

7. Radikalno halogeniranje. Interakcija benzenskih hlapov s klorom poteka po radikalnem mehanizmu le pod vplivom močnega ultravijoličnega sevanja. V tem primeru benzen doda tri molekule klora in tvori trden produkt - heksaklorocikloheksan:

8. Oksidacija s kisikom zraka. Po odpornosti na oksidante je benzen podoben alkanom. Šele z močnim segrevanjem (400 °C) benzenovih hlapov z atmosferskim kisikom v prisotnosti katalizatorja dobimo zmes maleinske kisline in njenega anhidrida:

Kemijske lastnosti homologov benzena.
Homologi benzena imajo številne posebne kemijske lastnosti, povezane z medsebojnim vplivom alkilnega radikala na benzenski obroč in obratno.
Stranske verižne reakcije. Kemične lastnosti alkilnih radikalov so podobne alkanom. Atome vodika v njih zamenja halogen s prostim radikalskim mehanizmom. Zato v odsotnosti katalizatorja, pri segrevanju ali UV obsevanju pride do radikalne substitucijske reakcije v stranski verigi. Vpliv benzenskega obroča na alkilne substituente vodi do dejstva, da je vodikov atom pri ogljikovem atomu, ki je neposredno vezan na benzenov obroč (a-ogljikov atom), vedno zamenjan.

Substitucija v benzenovem obroču je mogoča le z mehanizmom v prisotnosti katalizatorja:
Spodaj boste izvedeli, kateri od treh izomerov klorotoluena nastane pri tej reakciji.
Ko so homologi benzena izpostavljeni kalijevemu permanganatu in drugim močnim oksidantom, se stranske verige oksidirajo. Ne glede na to, kako kompleksna je veriga substituenta, se uniči, z izjemo -ogljikovega atoma, ki se oksidira v karboksilno skupino.
Homologi benzena z eno stransko verigo dajejo benzojsko kislino:

Pravila za orientacijo (substitucijo) v benzenovem obroču.
Najpomembnejši dejavnik, ki določa kemijske lastnosti molekule, je porazdelitev elektronske gostote v njej. Narava porazdelitve je odvisna od medsebojnega vpliva atomov.
V molekulah, ki imajo samo -vezi, pride do medsebojnega vpliva atomov preko induktivnega učinka (glej § 17). V molekulah, ki so konjugirani sistemi, se kaže mezomerni učinek.
Vpliv substituentov, ki se prenašajo preko konjugiranega sistema -vezi, imenujemo mezomerni (M) učinek.
V molekuli benzena je elektronski oblak zaradi konjugacije enakomerno porazdeljen po vseh ogljikovih atomih.
Če v benzenski obroč vnesemo kateri koli substituent, se ta enotna porazdelitev poruši in pride do prerazporeditve elektronske gostote v obroču. Mesto, kjer drugi substituent vstopi v benzenov obroč, je določeno z naravo obstoječega substituenta.
Substituente delimo glede na učinek, ki ga izkazujejo (mezomerni ali induktivni), v dve skupini: elektronopodporne in elektronoprivlačne.
Elektrodonatorski substituenti vplivajo in povečajo elektronsko gostoto v konjugiranem sistemu. Ti vključujejo hidroksilno skupino -OH in osamljeni par elektronov v teh skupinah vstopijo v skupno konjugacijo z -elektronskim sistemom benzenskega obroča in povečajo dolžino konjugiranega sistema. Posledično je elektronska gostota koncentrirana v orto in para položajih:

Alkilne skupine ne morejo sodelovati pri splošni konjugaciji, vendar imajo učinek, pri katerem pride do podobne prerazporeditve elektronske gostote.
Substituenti, ki odvzemajo elektrone, imajo učinek -M in zmanjšujejo gostoto elektronov v konjugiranem sistemu. Sem spadajo nitro skupina, sulfo skupina, aldehidne -CHO in karboksilne -COOH skupine. Ti substituenti tvorijo skupen konjugiran sistem z benzenskim obročem, vendar se celoten elektronski oblak premakne proti tem skupinam. Tako se skupna gostota elektronov v obroču zmanjša, najmanj pa se zmanjša na meta pozicijah:
Na primer, toluen, ki vsebuje substituent prve vrste, je nitriran in bromiran v para- in orto-položajih:

Nitrobenzen, ki vsebuje substituent druge vrste, je nitriran in bromiran v meta položaju:

Poleg orientacijskega učinka vplivajo substituenti tudi na reaktivnost benzenovega obroča: orientanti 1. vrste (razen halogenov) olajšajo vstop drugega substituenta; Orientanti 2. vrste (in halogeni) otežujejo.