Appartient au groupe des métaux alcalins, symbole K, at. n. 19 ; à. m. 39, 098. Métal doux blanc argenté. Agent réducteur chimiquement très actif et puissant, facilement oxydé à l’air. Découvert par le chimiste anglais G. Davy en 1807. Densité 0,856. Température de fusion 63,55 ? C, point d'ébullition 760 ? C. Dureté Brinell 400 kPa. Le métal K. se coupe facilement avec un couteau. K. est l'un des éléments pétrogéniques les plus courants de la croûte terrestre - 2,5 % (en masse). Les minéraux les plus importants : sylvite, carnallite, kainite, langbéinite. Contenu K en ultrabasique rochers 0,03%, basique 0,83%, moyen 2,3%, acide 3,34%. Les concentrations maximales de potassium (jusqu'à 7 %) ont été trouvées dans les roches alcalines de la série agpaïtique. Les principaux minéraux potassiques présents dans ces roches sont les feldspaths alcalins, le mica, la néphéline et la leucite. Lorsque l'eau de mer s'évapore, les minéraux suivants précipitent : la sylvinite, la carnallite, la kainite et la polyhalite. En raison de l'intense évaporation de la mer. les eaux dans le passé époques géologiques, surtout au Permien, se sont formés gros dépôts sels de potassium.
1. Histoire
2. Répartition dans la nature
Le potassium est un élément chimique assez courant, représentant 2,6 % de la masse de la croûte terrestre. En raison de sa forte activité chimique à l’état libre, on ne le trouve pas dans la nature, mais uniquement sous forme de divers composés. Certains d’entre eux, comme le chlorure de potassium, forment de puissants dépôts.
Les gisements les plus riches au monde de sels de potassium sous forme de minéraux sylvinite KCl, sylvinite KCl ? NaCl, carnallite KCl ? MgCl2 ? 6H 2 O et kainites KCl ? MgSO4 ? 3H 2 O sont situés près de la ville de Solikamsk. En outre, d'importants gisements de composés de potassium ont été découverts en Biélorussie (Soligorsk) et en Ukraine (Kalush et Stebnik dans la région des Carpates).
3. Propriétés physiques
À l’état libre, le potassium est un métal léger blanc argenté. Densité - 0,856 g/cm3. Le métal est très mou et peut être facilement coupé avec un couteau. Points de fusion - 63,38 ? AVEC.
4. Propriétés chimiques
Le potassium appartient à sous-groupe principal premier groupe tableau périodique Mendeleïev. ses atomes ont à l'extérieur couche électronique un électron à la fois, qu'ils perdent facilement et deviennent des ions avec un charge positive. Par conséquent, dans ses composés, le potassium n’est que positivement monovalent. Potassium - très métal actif. Perdre facilement le vôtre électrons de valence, c'est un agent réducteur très puissant. DANS série électrochimique tension, il se classe premier à gauche de l’hydrogène. Dans l'air sec, le potassium interagit vigoureusement avec l'oxygène de l'air et se transforme en superoxyde :
- 4K + O2 -> 2KO2
Par conséquent, il est stocké sous une couche de kérosène ou d’huile minérale.
Il réagit très violemment avec l'eau, voire de manière explosive. Réagit encore plus violemment avec les acides (également de manière explosive). Dans l'air humide, le métal se transforme facilement en hydroxyde :
- 2K + 2H2O -> 2KOH + H2
et ce dernier, interagissant avec gaz carbonique air, - en carbonate :
- 2KOH + CO 2 -> K 2 CO 3 + H 2 O
À haute température le potassium peut réduire les oxydes d'aluminium, de silicium, etc. en éléments libres :
- SiO 2 + 4K -> Si + 2K 2 O
5. Réception
A l'état libre, le potassium est obtenu par électrolyse de chlorures ou d'hydroxydes fondus. Pendant l'électrolyse des alcalis caustiques fondus, les ions métalliques chargés positivement sont attirés vers la cathode chargée négativement, ajoutent chacun un électron (réduit) et se transforment en atomes de métaux libres, et les ions hydroxyles chargés négativement sont attirés vers l'anode chargée positivement, lui donnent un électron chacun et se transforment en électrons groupes OH neutres, qui se décomposent pour former de l'eau et de l'oxygène libérés à l'anode.
La production de potassium métallique par électrolyse du KCl fondu peut être représentée par les équations suivantes :
KCl ↓ - Cathode Anode + K + + e = K ? Cl - e = Cl ?
6. Demande
Le potassium métallique sert de catalyseur dans la production de certains types de caoutchouc synthétique.
Les composés K. sont utilisés dans agriculture comme engrais, pour fabriquer du verre, explosifs, en médecine, génie nucléaire, etc.
Le potassium algitum est utilisé pour traiter les maladies des lèvres chez les enfants.
7. Sels de potassium
Le potassium forme des sels avec tous les acides. Les sels de potassium ont des propriétés très similaires à celles des sels de sodium. Les plus importants d'entre eux :
POTASSIUM (latin Kalium), K, élément chimique du groupe I de la forme courte (groupe 1 de la forme longue) du système périodique ; numéro atomique 19; masse atomique 39.0983 ; fait référence aux métaux alcalins. Le potassium naturel se compose de trois isotopes : 39 K (93,2581 %), 40 K (0,0117 % ; faiblement radioactif, T 1/2 1,277 10 9 ans, désintégration β jusqu'à 40 Ca), 41 K (6,7302 %). Des radio-isotopes de numéros de masse 32 à 54 ont été obtenus artificiellement.
Référence historique. Certains composés de potassium étaient connus dans l'Antiquité, par exemple, le carbonate de potassium K 2 CO 3 (appelé alcali végétal) était isolé de la cendre de bois et utilisé dans la fabrication du savon. Le potassium métallique a été obtenu pour la première fois par G. Davy en 1807 par électrolyse de hydroxyde solide KOH et l'appelait potassium (potassium anglais de potasse anglaise - le nom du carbonate de potassium). En 1809, le nom « potassium » (de l'arabe al-kali - potasse) fut proposé. Le nom « potassium » a été conservé en Grande-Bretagne, aux États-Unis, en France et dans d'autres pays. En Russie, depuis 1840, on utilise le nom « potassium », qui est également adopté en Allemagne, en Autriche et dans les pays scandinaves.
Prévalence dans la nature. Teneur en potassium dans la croûte terrestre est de 2,6 % en poids. Le potassium n’est pas présent à l’état libre dans la nature. DANS quantités importantes le potassium se trouve dans les silicates de néphéline et de leucite, les feldspaths (par exemple l'orthose), les micas (par exemple la muscovite). Propres minéraux de potassium - sylvite, sylvinite, carnallite, kainite, langbeinite K 2 SO 4 ∙2MgSO 4 forment de grandes accumulations de sels de potassium naturels. Sous l'action de l'eau et du dioxyde de carbone, le potassium se transforme en composés solubles, qui sont en partie transportés dans les mers et en partie retenus par le sol. Les sels de potassium se trouvent également dans la saumure des lacs salés et dans les saumures souterraines.
Propriétés. Configuration externe couche électronique atome de potassium 4s 1; dans les composés présente un état d'oxydation de +1 ; les énergies d'ionisation K 0 → K + → K 2+ sont respectivement de 4,3407 et 31,8196 eV ; Électrégativité de Pauling 0,82 ; rayon atomique 220 pm, rayon ionique K + 152 pm ( numéro de coordination 6).
Potassium - blanc argenté métal mou; cellule de cristal corps cubique centré; t fondre 63,38 °C, bouillir t 759 °C, densité 856 kg/m 3 (20 °C) ; capacité thermique 29,60 J/(mol K) à 298 K.
Le potassium peut être pressé et roulé, facilement coupé avec un couteau et conserve sa plasticité lorsqu'il est utilisé. basses températures; Dureté Brinell 0,4 MPa.
Le potassium est un métal à haute activité chimique (le potassium est stocké sous une couche d'essence, de kérosène ou d'huile minérale). À conditions normales le potassium interagit avec l'oxygène (l'oxyde K 2 O, le peroxyde K 2 O 2 se forme, le superoxyde KO 2 est le produit principal), les halogènes (halogénures de potassium correspondants), lorsqu'il est chauffé - avec le soufre (sulfure K 2 S), le sélénium (séléniure K 2 Se ), du tellure (tellure K 2 Te), avec du phosphore dans une atmosphère d'azote (phosphures K 3 P et K 2 P5), du carbone (composés en couches de composition KS 8 - KS 60), de l'hydrogène (hydrure KN). Le potassium n'interagit avec l'azote que lorsqu'il est exposé à decharge electrique(V. Pas grandes quantités l'azide KN 3 et le nitrure K 3 N sont formés). Le potassium réagit avec certains métaux, formant des composés intermétalliques ou des solutions solides(alliages de potassium). Les alliages avec du sodium, caractérisés par une activité chimique élevée, sont de la plus grande importance pratique ; obtenu par alliage de métaux sous atmosphère inerte ou par action du sodium métallique sur l'hydroxyde de KOH ou le chlorure de KCl.
Le potassium métallique est un agent réducteur puissant : il réagit vigoureusement (dans des conditions normales avec explosion et inflammation du métal) avec l'eau (il se forme de l'hydroxyde de potassium KOH), réagit violemment (parfois avec explosion) avec les acides (forme sels correspondants, par exemple, le dichromate de potassium, le nitrate de potassium, le permanganate de potassium, les phosphates de potassium, le cyanure de potassium), réduit les oxydes de B, Si, Al, Ag, Bi, Co, Cr, Cu, Hg, Ni, Pb, Sn, Ti en éléments; sulfates, sulfites, nitrates, nitrites, carbonates et phosphates d'autres métaux - aux oxydes des métaux correspondants. Le potassium métallique se dissout lentement dans l'ammoniac liquide pour former une solution bleu foncé avec une conductivité métallique ; le métal dissous réagit progressivement avec l'ammoniac pour former un amide : 2K + 2NH 3 = 2KNH 2 + H 2. Le potassium interagit avec divers composés organiques: alcools (des alcoolates se forment, par exemple éthyle C 2 H 5 OK), acétylène (acétyléniures KS≡CH et KS≡SK), halogénures d'alkyle (alkyles de potassium, par exemple éthylpotassium C 2 H 5 K) et halogénures d'aryle (aryles de potassium , par exemple phénylpotassium C 6 H 5 TO). Le potassium métallique initie les réactions de polymérisation des alcènes et des diènes. Avec les ligands polycycliques donneurs N et O (éthers couronnes, cryptands et autres ionophores), le potassium forme des composés complexes.
Lorsque l'on travaille avec du potassium, il est nécessaire de prendre en compte sa grande réactivité, notamment sa capacité à s'enflammer au contact de l'eau. Pour des raisons de sécurité, vous devez utiliser des gants en caoutchouc, des lunettes de sécurité ou un masque. De grandes quantités de potassium doivent être travaillées dans des chambres spéciales sous atmosphère inerte (argon, azote). Le potassium est utilisé pour éteindre les incendies sel de table NaCl ou carbonate de sodium Na 2 CO 3.
Rôle biologique . Le potassium est un élément biogénique. Besoin quotidien le potassium humain est d'environ 2 g. Dans les organismes vivants, les ions potassium jouent rôle important dans les processus de régulation du métabolisme, en particulier le transport des ions à travers membranes cellulaires(voir par exemple l'article Pompes à ions).
Reçu. Dans l'industrie, le potassium est obtenu par réduction de l'hydroxyde de KOH ou du chlorure de KCl fondu avec du sodium métallique dans une colonne à contre-courant, suivie d'une condensation de vapeur de potassium. Prometteur méthodes thermiques sous vide production de potassium basée sur la réduction du chlorure de KCl par chauffage avec un mélange d'aluminium ou de silicium avec de l'oxyde de calcium (6KCl + 2Al + 4CaO = 6K + 3CaCl 2 + CaO Al 2 O 3 ou 4Kl + Si + 4CaO = 4K + 2CaCl 2 + 2CaO∙SiO 2), ainsi qu'un procédé basé sur la production d'un alliage potassium-plomb par électrolyse du carbonate de K 2 CO 3 ou du chlorure de KCl avec une cathode de plomb fondu et distillation ultérieure de l'alliage de potassium. Le volume de production mondiale de potassium est d'environ 28 tonnes/an (2004).
Application. Le potassium métal est le matériau des électrodes dans sources chimiques actuel, catalyseur dans les processus de production de caoutchouc synthétique. Divers composés de potassium sont largement utilisés : peroxyde K 2 O 2 et superoxyde KO 2 - composants de compositions pour la régénération de l'oxygène (sur sous-marins, vaisseaux spatiaux et dans d'autres à l'intérieur), l'hydrure de KH est un agent réducteur dans synthèse chimique, un alliage de potassium et de sodium (10-60 % Na en poids, liquide à température ambiante) - liquide de refroidissement dans réacteurs nucléaires, un agent réducteur dans la production de titane, un réactif pour purifier les gaz de l'oxygène et de la vapeur d'eau ; Les sels de potassium sont utilisés comme engrais potassiques et composants de détergents. Les complexes de potassium avec ionophores sont des modèles pour étudier le transport des ions potassium à travers les membranes cellulaires. Le radio-isotope 42 K (T 1/2 12,36 h) est utilisé comme traceur radioactif en chimie, médecine et biologie.
Lit. : Sodium et potassium. L., 1959 ; Stepin B.D., Tsvetkov A.A. Chimie inorganique. M., 1994 ; Chimie inorganique : chimie des éléments / Edité par Yu. D. Tretyakov. M., 2004. T. 2.
Potassium - métal alcalin, qui est assez répandu sur Terre. Les composés du potassium sont familiers aux humains depuis longtemps. L’élément a été découvert en 1807 et s’appelait à l’origine potassium. Cependant, le nom n’est pas resté et un peu plus tard, l’élément a été nommé potassium.
Depuis l’Antiquité, les gens obtiennent de la potasse (carbonate de potassium) à partir des produits de combustion. Il était utilisé comme détergent et, un peu plus tard, il a commencé à être utilisé pour la production de divers engrais agricoles, pour la production de verre et à d'autres fins. Aujourd’hui, la potasse est même un additif alimentaire officiellement enregistré.
Caractéristiques du potassium
Propriétés physiques

L'élément a une couleur argent pâle. Un éclat caractéristique apparaît sur la surface nouvellement formée. Le potassium est un métal léger. Fond facilement. Il peut être dissous dans le mercure, processus qui produit des amalgames. Brûle avec une flamme rouge-violet.
Propriétés chimiques

Le potassium est un métal et possède tout propriétés correspondantes. L'élément appartient également au groupe alcalin. Ceci explique son activité chimique accrue. Le potassium, lorsqu'il réagit avec d'autres substances, donne des électrons et est un puissant agent réducteur.
- Réagit violemment avec l'oxygène pour former du superoxyde de potassium.
- Lorsqu'il est chauffé, il réagit avec l'hydrogène.
- Réagit bien avec tout le monde éléments non métalliques, formant des nitrures, des phosphures, des sulfures et d'autres composés.
- Réagit avec beaucoup substances complexes: sels, oxydes, et également avec de l'eau. La réaction avec l'eau se déroule très violemment, avec une explosion.

Les composés du potassium sont assez courants dans la nature. Le potassium ne peut pas être trouvé sous sa forme pure. La raison en est son activité chimique accrue.
Où peut-on trouver du potassium dans la nature ?
- Premièrement, il y a suffisamment de potassium grandes quantités trouvé dans la croûte terrestre. Sa teneur est estimée à environ 2,4 %. Le potassium est un composant important du sol et des roches.
- Deuxièmement, d'importants dépôts de sels de potassium ont été enregistrés sur les sites d'évaporation des mers anciennes.
- Les eaux de l'océan mondial contiennent également une quantité importante de potassium. Dans les eaux de l'océan mondial, la concentration de potassium est d'environ 0,06 %. Dans certaines masses d'eau (par exemple la mer Morte), la concentration en potassium peut descendre jusqu'à 1,5 %. Tel concentration accrue rend l’extraction du potassium économiquement rentable. Ainsi, en Jordanie, il existe une usine d'extraction du potassium de eaux des morts mers.
Domaines d'application du potassium
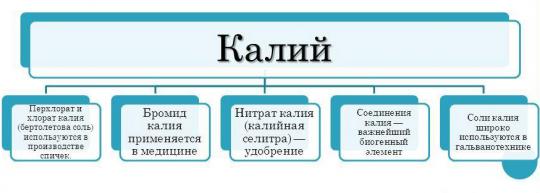
Le champ d'application du potassium est nettement plus restreint que celui du même sodium. Cela est dû au fait que le potassium a une plus grande activité chimique. De plus, le potassium est un métal plus cher. Cependant, le potassium est toujours utilisé dans diverses industries industrie.
- Le potassium est le plus activement utilisé dans industrie chimique pour la production d'engrais. Le potassium est un élément important pour les plantes. Très souvent, les plantes souffrent d’une carence en potassium, ce qui les empêche d’utiliser tout leur potentiel de croissance. La plante s'affaiblit, pousse plus lentement, la tige s'affaiblit, les feuilles jaunissent et tombent et les graines deviennent moins viables. Dans de tels cas, la carence en potassium est compensée par des engrais. Les engrais potassiques sont les principaux produits pour lesquels le potassium est utilisé. L'engrais potassique le plus courant est le chlorure de potassium (KCl).
- De plus, l'élément et ses composés sont utilisés en génie mécanique. L'hydroxyde de potassium - élément essentiel pour la fabrication de batteries.
- Les composés de potassium sont également utilisés dans Industrie alimentaire. Un exemple frappant- nitrate de potassium. La substance est un additif alimentaire. Utilisé comme conservateur.
Page 1
Le potassium pur est un métal blanc argenté d'une densité de 0,86, doux, fond à une température de 63°55 C, point d'ébullition 760 C. Chimiquement, le potassium est très actif. A l'air, il s'oxyde rapidement.
Le potassium pur est un métal blanc argenté d'une densité de 0,86, doux, fond à une température de 63°55 C, point d'ébullition 760 C. Chimiquement, le potassium est très actif.
| Isotherme d'équilibre dans le système KX Na K NaX en fonction de l'anion (X (données Rink. |
Pour obtenir du potassium pur, la vapeur est soumise à une rectification. Le produit fini contient 99,5 % de potassium. Pour 1 tonne de potassium produite, 3,2 tonnes de KC1, 0,73 tonne de sodium, 620 m3 d'azote purifié et 8000 kWh d'électricité sont consommées.
| Courbe de dépendance du coefficient d'émission secondaire o sur la vitesse des électrons primaires (en volts o / (. /. |
Pour les métaux alcalins purs, 8 est petit (potassium pur 8 1), malgré peu de travail sortie.
Sur le chantier avec centres artificiels vaporisation, des expériences ont d'abord été réalisées sur du potassium pur, puis sur un alliage sodium-potassium à des concentrations allant jusqu'à -63 en poids.
Dans un ballon d'une contenance de 500 ml, équipé d'un agitateur à joint au mercure, d'un réfrigérateur à neige carbonique, fermé par un tube de chaux sodée (tous les composés sont broyés), on distille 150 ml d'ammoniaque et 7,8 g (0,2 g d'atomes) sont ajoutés en petits morceaux sous agitation de potassium pur, qui est transformé en amide de potassium par l'ajout d'un petit morceau de fer rouillé. Le bouchon en verre rodé est remplacé par un entonnoir compte-gouttes.
Malgré la différence significative entre les valeurs de pression de vapeur du potassium et du plomb, il est impossible d'obtenir du potassium pur sans plomb dans le condensat avec une seule distillation. Pour obtenir du potassium pur sans plomb, une distillation secondaire ou une conception de procédé permettant un reflux partiel des vapeurs métalliques est nécessaire.
Wehler (il a utilisé du potassium pur pour la réaction), il possède également la description propriétés chimiques aluminium
Le potassium fond à une température de 63 7 C. Avec une solubilité aussi élevée de l'oxygène près du point de solidification, le potassium pur ne peut pas être purifié de manière satisfaisante de l'oxygène dans des pièges froids. Dans les alliages potassium-sodium, l’oxygène est lié au sodium ; la solubilité de Na O dans l'alliage et le potassium métallique est la même que dans le sodium. Cela vous permet d'utiliser des pièges froids pour nettoyer le métal. Cependant, l’ajout spécial de sodium au potassium pour le purifier de l’oxygène nécessite d’envisager une autre méthode, appelée méthode de purification getter. Elle consiste à introduire dans la partie chaude du circuit un additif qui forme une liaison avec l'oxygène plus forte que le métal à nettoyer.
Comment expliquer qu'à des températures supérieures à 700 °C, le sodium métallique (un métal moins actif) soit capable de déplacer le potassium (un métal plus actif) de ses composés. Un tel processus peut-il trouver utilisation pratique lors de l'obtention de potassium pur.
La synthèse est réalisée dans un ballon tricol équipé d'un agitateur Gershberg, d'un réfrigérant à reflux et d'un bouchon en verre. Après séchage de l'appareil, le méthylate de potassium est préparé en ajoutant du méthanol absolu à 0,9 g (0,23 mole) de potassium pur sous une couche de benzène. Les solvants sont éliminés sous pression réduite et 1,180 g (0,0197 mol) de M O-chevina - N 5 dans 4 ml de méthanol absolu sont ajoutés au résidu sec. 4,3 g (0,02 mole) d'éther d'acétamidomalone sont dissous dans 8 ml de méthanol et la solution obtenue est versée immédiatement en une seule fois sur la solution d'urée. Le mélange est chauffé à reflux et agité pendant 4 heures.
Le potassium (K) est un élément chimique avec numéro atomique 19. Le potassium pur est un métal alcalin blanc argenté, très similaire à l’aluminium, mais beaucoup plus mou.
Le potassium est un métal chimiquement extrêmement actif. Dans l'air, il s'oxyde très rapidement en oxyde et hydroxyde en raison de l'interaction avec l'oxygène de l'air et la vapeur d'eau qu'il contient. Si un morceau de potassium est placé dans l’eau, il brûle avec une flamme violette ou même explose. Par conséquent, le potassium pur n’est pas présent dans la nature.
Cependant, le potassium est un élément chimique assez courant sur Terre, présent sous forme de sels hydrosolubles dans eau de mer, ainsi que dans un grand nombre d'autres minéraux (mica, feldspath, sylvinite, carnallite, kainite, etc.). La concentration moyenne de potassium dans l'eau de mer est de 380 mg/l. En général, parmi tous éléments chimiques il se classe au 7ème rang en termes de prévalence et au 5ème rang parmi tous les métaux. La terre contient 2,4% de potassium.
DANS chimiquement le potassium est très similaire au sodium, bien qu'un peu plus actif que ce dernier. Mais en termes biologiques, le potassium est un antagoniste du sodium, mais nous y reviendrons plus tard.
Les gens connaissent les composés du potassium depuis des temps immémoriaux. Ainsi, la potasse bien connue (un mélange de carbonate, de chlorure et de sulfate de potassium et de soude) a été utilisée comme détergent au 11ème siècle. Ils l'extrayaient de cette façon : ils brûlaient de la paille ou du bois, puis le mélangeaient avec de l'eau et le secouaient, puis le filtrissaient puis l'évaporaient.
Le potassium élémentaire a été isolé pour la première fois en 1807 par électrolyse de l'hydroxyde de potassium (potasse caustique). La découverte du potassium revient au chimiste anglais Davy.
L'importance du potassium pour le corps humain
Le potassium, sans exagération, élément biogénique. On le trouve en quantités variables dans presque tous les organismes vivants : plantes, champignons et animaux. Toutes les plantes sont très sensibles au manque de potassium dans le sol, et c'est presque la principale raison de la pauvreté des sols. Ce n'est pas un hasard si près de 90 % de tous les minéraux de potassium extraits du sous-sol sont utilisés comme engrais potassiques, et les plantes qui les extraient occupent toujours des positions de leader dans l'économie. Compte tenu de la population toujours croissante de la planète, le besoin en engrais potassiques ne fera qu'augmenter.
Dans les organismes vivants, le potassium se trouve principalement dans liquide intercellulaire. Dans les cellules elles-mêmes, sa concentration est environ 40 fois inférieure.
La fonction principale du potassium dans tout organisme vivant est de fournir pression osmotique entre la cellule et le cytoplasme. Le mécanisme lui-même d'un tel équilibre eau-minéral a été bien étudié : au cours de la vie de la cellule, les ions potassium en excès pénètrent au-delà du cytoplasme, et afin de maintenir la concentration requise, ils doivent réintégrer le cytoplasme cellulaire, ce qui est assuré par la dite. pompe sodium-potassium.
Un autre fonction la plus importante potassium - créant les conditions pour la présence d'un potentiel membranaire, qui assure la transmission contractions musculaires Et influx nerveux, ainsi que le maintien de l’équilibre acido-basique.
Le potassium active également le système enzymatique du corps, assurant le métabolisme des glucides et des protéines (il est nécessaire à la synthèse des protéines et à la conversion du glucose en glycogène), améliore l'activité intestinale et est nécessaire au maintien de la fonction rénale en éliminant l'excès d'humidité du corps ainsi que les produits métaboliques. .
Chaque jour, un adulte a besoin de 1,8 à 5,0 g de potassium, la dose d'un enfant (selon l'âge) de 0,6 à 1,7 g. Le besoin en potassium dépend en grande partie du poids corporel, de l'état physiologique, activité physique, conditions climatiques.
Sources de potassium
Dans les aliments d'origine animale, la concentration de potassium est à peu près la même que dans les aliments d'origine végétale, mais la préférence doit être donnée aux aliments d'origine animale, car dans ce cas, une personne reçoit une teneur équilibrée en potassium et en sodium. Lorsque vous mangez des aliments végétaux, la concentration de potassium dans le corps augmentera et le sodium diminuera, ce qui peut entraîner conséquences indésirables. Il convient de garder à l’esprit qu’en raison de la forte solubilité des composés de potassium, la quasi-totalité (95 %) est absorbée lors de son entrée dans l’organisme. La majeure partie du potassium est absorbée dans l’intestin grêle.
- bœuf (241 mg%);
- poisson (à partir de 200 mg%);
- lait (127 mg%).
Produits végétaux riche en potassium :
- soja (1800 mg%);
- haricots (1050 mg%);
- pois (900 mg%);
- pommes de terre (429 mg%);
- pain (240 mg%);
- betteraves (155 mg%);
- chou (149 mg% ; );
- carottes (129 mg%);
- chocolat;
- épinards, pastèque, melon, pommes, abricots (y compris abricots et abricots secs), kiwi, bananes, agrumes (notamment pomelo), raisins (y compris raisins secs), avocats.
Manque de potassium dans le corps humain
Le manque de potassium dans l'organisme est un phénomène assez courant. Les causes typiques d’une carence en potassium sont :
- apport alimentaire insuffisant;
- troubles du métabolisme du potassium;
- maladies de l'excréteur et systèmes digestifs(intestins, foie, reins, poumons) ;
- vomissements, utilisation de laxatifs et de diurétiques, diarrhée prolongée, transpiration abondante et autres déshydratations ;
- surcharge neuropsychique, fatigue chronique;
- apport excessif d'antagonistes du potassium (sodium, rubidium, césium, thallium) dans l'organisme.
Symptômes de carence en potassium dans l'organisme :
- épuisement neuropsychique, fatigue chronique, dépression ;
- diminution de l'immunité;
- faiblesse musculaire (myasthénie grave) ;
- détérioration de la fonction surrénale et rénale, mictions fréquentes;
- hypertension;
- nausées, vomissements, constipation atonique ;
- arythmie cardiaque, dysfonctionnement myocardique, insuffisance cardiaque, crise cardiaque ;
- perturbation système respiratoire(respiration rapide et superficielle) ;
- cheveux et ongles cassants, peau sèche ;
- ulcères gastroduodénaux du système digestif, gastrite;
- maladies des organes génitaux, infertilité, érosion cervicale.
Il faut également savoir que lors de la cuisson, notamment lors de l’ébullition, les aliments perdent une part importante de potassium. La raison en est la même solubilité élevée des composés de potassium. Par conséquent, en cas de manque de potassium, il est préférable de préparer les aliments au four ou à l'étouffée. Vous pouvez augmenter l’absorption du potassium en équilibrant la consommation d’aliments qui en contiennent avec de la vitamine B6 ou des aliments riches en cette vitamine.
La consommation d'alcool réduit considérablement l'absorption du potassium. D'ailleurs, le plus façon rapide provoquer un manque de potassium dans l'organisme - boire systématiquement de la bière avec des cornichons (poisson séché et fumé, chips, noix, crackers, etc.).
Excès de potassium dans le corps humain
Tout est bon avec modération. Par conséquent, avant de compter sur des aliments contenant du potassium, vous devez vous assurer que le dosage est correct. Ainsi, même une dose unique de 6 g de potassium (naturellement, dans la composition des sels) peut provoquer des symptômes d'excès, et 14 g sont considérés comme une dose mortelle.
Cause de l'excès de potassium dans le corps peut devenir :
- consommation excessive d'aliments végétaux riches en potassium (par exemple, un régime constant de pommes de terre) ;
- prendre des compléments alimentaires et des complexes minéraux à haute teneur en potassium ;
- perturbation du métabolisme du potassium;
- état déficient d'insulite;
- altération de la fonction rénale, y compris insuffisance rénale ;
- dysfonctionnement du système sympatho-surrénalien, etc.
Symptômes d'un excès de potassium:
- nervosité, hyperactivité, anxiété accrue, transpiration ;
- faiblesse musculaire et autres troubles neuromusculaires ;
- cardiopsychonévrose;
- arythmie;
- dysfonctionnement intestinal (coliques dans l'intestin grêle);
- paralysie des muscles squelettiques;
- augmentation de la diurèse;
- risque accru de développer un diabète.








