I përket grupit të metaleve alkaline, simboli K, at. n. 19; në. m 39, 098. Metal i butë argjend-bardhë. Kimikisht shumë aktiv, agjent i fortë reduktues, lehtësisht i oksiduar në ajër. Zbuluar nga kimisti anglez G. Davy në 1807. Dendësia 0,856. Temperatura e shkrirjes 63.55? C, pika e vlimit 760? C. Fortësia e Brinelit 400 kPa. Metali K. pritet lehtësisht me thikë. K. është një nga elementët petrogjenë më të zakonshëm të kores së tokës - 2.5% (në masë). Mineralet më të rëndësishme: sylviti, karnaliti, kainiti, langbeiniti. Përmbajtja e K në ultrabazike shkëmbinj 0,03%, bazë 0,83%, e mesme 2,3%, acid 3,34%. Përqendrimet maksimale të kaliumit (deri në 7%) u gjetën në shkëmbinjtë alkaline të serisë agpaitike. Mineralet kryesore të kaliumit në këta shkëmbinj janë feldspatët alkali, mika, nefelina dhe leuciti. Kur uji i detit avullon, mineralet e mëposhtëm precipitojnë: silviniti, karnaliti, kainiti dhe polihaliti. Për shkak të avullimit intensiv të detit. ujërat në të kaluarën epokat gjeologjike, veçanërisht në periudhën Permian, u formuan depozitat e mëdha kripërat e kaliumit.
1. Historia
2. Shpërndarja në natyrë
Kaliumi është një element kimik mjaft i zakonshëm, që përbën 2.6% të masës së kores së tokës. Për shkak të aktivitetit të lartë kimik në gjendje të lirë, nuk gjendet në natyrë, por vetëm në formën e përbërjeve të ndryshme. Disa prej tyre, si kloruri i kaliumit, formojnë depozita të fuqishme.
Depozitat më të pasura në botë të kripërave të kaliumit në formën e mineraleve sylvinite KCl, sylvinite KCl? NaCl, karnalit KCl ? MgCl2? 6H 2 O dhe kainitet KCl ? MgSO 4 ? 3H 2 O ndodhen pranë qytetit të Solikamsk. Për më tepër, depozita të konsiderueshme të përbërjeve të kaliumit u gjetën në Bjellorusi (Soligorsk) dhe Ukrainë (Kalush dhe Stebnik në rajonin e Karpateve).
3. Vetitë fizike
Në gjendjen e tij të lirë, kaliumi është një metal i lehtë argjendi-bardhë. Dendësia - 0,856 g/cm3 Metali është shumë i butë dhe mund të pritet lehtësisht me thikë. Pikat e shkrirjes - 63.38? ME.
4. Vetitë kimike
Kaliumi i përket nëngrupi kryesor grupi i parë tabela periodike Mendelejevi. atomet e tij kanë në pjesën e jashtme shtresë elektronike një elektron në një kohë, të cilin e humbasin lehtësisht dhe me një shndërrohen në jone ngarkesë pozitive. Prandaj, në përbërjet e tij, kaliumi është vetëm pozitivisht monovalent. Kaliumi - shumë metal aktiv. Duke humbur lehtësisht tuajën elektronet e valencës, është një agjent reduktues shumë i fortë. NË seri elektrokimike tensioni, ai renditet i pari në të majtë të hidrogjenit. Në ajrin e thatë, kaliumi ndërvepron fuqishëm me oksigjenin në ajër dhe shndërrohet në superoksid:
- 4K + O 2 -> 2KO 2
Prandaj, ruhet nën një shtresë vajguri ose vaji mineral.
Ai reagon shumë dhunshëm me ujin, madje edhe në mënyrë shpërthyese. Reagon edhe më dhunshëm me acidet (edhe në mënyrë shpërthyese). Në ajër të lagësht, metali shndërrohet lehtësisht në hidroksid:
- 2K + 2H 2 O -> 2KOH + H 2
dhe kjo e fundit, duke ndërvepruar me dioksid karboni ajër, - në karbonat:
- 2KOH + CO 2 -> K 2 CO 3 + H 2 O
Në temperaturë të lartë kaliumi mund të reduktojë oksidet e aluminit, silikonit, etj. në elementë të lirë:
- SiO 2 + 4K -> Si + 2K 2 O
5. Dëftesa
Në gjendje të lirë, kaliumi fitohet nga elektroliza e klorureve ose hidroksideve të shkrira. Gjatë elektrolizës së alkaleve kaustike të shkrirë, jonet e metalit të ngarkuar pozitivisht tërhiqen në katodën e ngarkuar negativisht, shtoni një elektron secili (reduktuar) dhe shndërrohen në atome të metaleve të lira, dhe jonet hidroksil të ngarkuar negativisht tërhiqen në anodin e ngarkuar pozitivisht, jepini nga një elektron dhe kthehen në grupe OH neutrale që zbërthehen për të formuar ujë dhe oksigjen të çliruar në anodë.
Prodhimi i metalit të kaliumit nga elektroliza e KCl të shkrirë mund të përfaqësohet nga ekuacionet e mëposhtme:
KCl ↓ - Anodë katodë + K + + e = K ? Cl-e = Cl?
6. Aplikimi
Metali i kaliumit shërben si katalizator në prodhimin e disa llojeve të gomës sintetike.
Komponimet K. përdoren në bujqësia si pleh, për të bërë qelq, eksplozivëve, në mjekësi, inxhinieri bërthamore, etj.
Kaliumi algitum përdoret për të trajtuar sëmundjen e buzëve tek fëmijët.
7. Kripërat e kaliumit
Kaliumi formon kripëra me të gjitha acidet. Kripërat e kaliumit janë shumë të ngjashme në veti me kripërat e natriumit. Më e rëndësishmja prej tyre:
KALIUM (latinisht Kalium), K, element kimik i grupit I të formës së shkurtër (grupi 1 i formës së gjatë) të sistemit periodik; numri atomik 19; masë atomike 39.0983; i referohet metaleve alkaline. Kaliumi natyror përbëhet nga tre izotope: 39 K (93,2581%), 40 K (0,0117%; radioaktiv i dobët, T 1/2 1,277 10 9 vjet, β-zbërthimi deri në 40 Ca), 41 K (6,7302 %). Radioizotopet me numra masiv 32-54 janë marrë artificialisht.
Informacion historik. Disa komponime të kaliumit ishin të njohura në kohët e lashta, për shembull, karbonati i kaliumit K 2 CO 3 (i ashtuquajturi alkali i bimëve) u izolua nga hiri i drurit dhe u përdor në prodhimin e sapunit. Kaliumi metalik u përftua për herë të parë nga G. Davy në 1807 nga elektroliza e lagësht hidroksid të ngurtë KOH dhe e quajti atë potassium (anglisht potassium nga anglishtja potash - emri i karbonatit të kaliumit). Në 1809, u propozua emri "kalium" (nga arabishtja al-kali - potas). Emri "kalium" është ruajtur në Britaninë e Madhe, SHBA, Francë dhe vende të tjera. Në Rusi, që nga viti 1840, është përdorur emri "kalium", i cili është adoptuar edhe në Gjermani, Austri dhe vendet skandinave.
Prevalenca në natyrë. Përmbajtja e kaliumit në kores së tokësështë 2.6% ndaj peshës. Kaliumi nuk gjendet në gjendje të lirë në natyrë. NË sasi të konsiderueshme kaliumi gjendet në silikate nefelinë dhe leucit, feldspat (për shembull, ortoklase), mika (për shembull, muskovit). Mineralet vetanake të kaliumit - sylviti, sylviniti, karnaliti, kainiti, langbeiniti K 2 SO 4 ∙2 MgSO 4 formojnë akumulime të mëdha të kripërave natyrale të kaliumit. Si rezultat i veprimit të ujit dhe dioksidit të karbonit, kaliumi shndërrohet në komponime të tretshme, të cilat pjesërisht barten në dete dhe pjesërisht mbahen nga toka. Kripërat e kaliumit gjenden gjithashtu në shëllirën e liqeneve të kripës dhe në shëllirë nëntokësore.
Vetitë. Konfigurimi i jashtëm guaskë elektronike atomi i kaliumit 4s 1; në komponimet shfaq një gjendje oksidimi +1; energjitë e jonizimit K 0 →K + →K 2+ janë përkatësisht 4,3407 dhe 31,8196 eV; Elektronegativiteti Pauling 0,82; rrezja atomike 220 pm, rrezja jonike K + 152 pm ( numri i koordinimit 6).
Kaliumi - i bardhë argjendtë metal i butë; rrjetë kristali kub në qendër të trupit; t shkrirja 63,38 °C, t vlimi 759 °C, dendësia 856 kg/m 3 (20 °C); kapaciteti i nxehtësisë 29,60 J/(mol K) në 298 K.
Kaliumi mund të shtypet dhe rrotullohet, pritet lehtësisht me thikë dhe ruan plasticitetin e tij kur përdoret. temperaturat e ulëta; Fortësia e Brinelit 0,4 MPa.
Kaliumi është një metal me aktivitet të lartë kimik (kaliumi ruhet nën një shtresë benzine, vajguri ose vaji mineral). Në kushte normale kaliumi ndërvepron me oksigjenin (formohet oksidi K 2 O, peroksidi K 2 O 2, superoksidi KO 2 është produkti kryesor), halogjenet (halogjenet përkatëse të kaliumit), kur nxehet - me squfur (sulfid K 2 S), selen (selenid K 2 Se ), teluri (K 2 Te telurid), me fosfor në atmosferë azoti (fosfidet K 3 P dhe K 2 P5), karbon (përbërje me shtresa të përbërjes KS 8 - KS 60), hidrogjen (hidrid KH). Kaliumi ndërvepron me azotin vetëm kur ekspozohet ndaj tij shkarkimi elektrik(V Jo sasi të mëdha formohen azidi KN 3 dhe nitridi K 3 N). Kaliumi reagon me disa metale, duke formuar komponime ndërmetalike ose zgjidhje të ngurta(lidhjet e kaliumit). Lidhjet me natrium, të karakterizuara nga aktivitet i lartë kimik, kanë rëndësinë më të madhe praktike; përftohen nga aliazhimi i metaleve në një atmosferë inerte ose nga veprimi i natriumit metalik në hidroksid KOH ose klorur KCl.
Metali i kaliumit është një agjent i fortë reduktues: ai reagon fuqishëm (në kushte normale me shpërthimin dhe ndezjen e metalit) me ujin (formohet hidroksidi i kaliumit KOH), reagon dhunshëm (nganjëherë me shpërthim) me acidet (formohet kripërat përkatëse për shembull, dikromati i kaliumit, nitrati i kaliumit, permanganati i kaliumit, fosfatet e kaliumit, cianidi i kaliumit), redukton oksidet e B, Si, Al, Ag, Bi, Co, Cr, Cu, Hg, Ni, Pb, Sn, Ti në elemente; sulfatet, sulfitet, nitratet, nitritet, karbonatet dhe fosfatet e metaleve të tjera - në oksidet e metaleve përkatëse. Metali i kaliumit tretet ngadalë në amoniak të lëngshëm për të formuar një zgjidhje blu të errët me përçueshmëri metalike; metali i tretur gradualisht reagon me amoniak për të formuar një amid: 2K + 2NH 3 = 2KNH 2 + H 2. Kaliumi ndërvepron me të ndryshme komponimet organike: alkoolet (formohen alkolatet, p.sh. etilati C 2 H 5 OK), acetileni (acetilenidet KS≡CH dhe KS≡SK), halidet alkilet (alkilet e kaliumit, p.sh. etilkaliumi C 2 H 5 K) dhe halidet aril (arilet e kaliumit. , për shembull fenilkalium C 6 H 5 TO). Metali i kaliumit fillon reaksionet e polimerizimit të alkeneve dhe dieneve. Me ligandët policiklikë dhurues N- dhe O (eteret e kurorës, kriptandet dhe jonoforet e tjera), kaliumi formon komponime komplekse.
Kur punoni me kalium, është e nevojshme të merret parasysh reaktiviteti i tij i lartë, duke përfshirë aftësinë për t'u ndezur pas kontaktit me ujin. Për arsye sigurie, duhet të përdorni doreza gome, syze sigurie ose maskë. Sasi të mëdha kaliumi duhen punuar në dhoma të veçanta në një atmosferë inerte (argon, azot). Kaliumi përdoret për të shuar zjarret kripë tryezë NaCl ose hiri i sodës Na 2 CO 3.
Roli biologjik . Kaliumi është një element biogjen. Kërkesa ditore kaliumi i njeriut është rreth 2 g në organizmat e gjallë, jonet e kaliumit luajnë rol të rëndësishëm në proceset e rregullimit të metabolizmit, në veçanti, transporti i joneve përmes membranat qelizore(shih, për shembull, artikullin Pompat e joneve).
Fatura. Në industri, kaliumi përftohet duke reduktuar hidroksidin e shkrirë të KOH ose klorurin KCl me metal natriumi në një kolonë kundërrryme, e ndjekur nga kondensimi i avullit të kaliumit. Premtuese metodat vakum-termike prodhimi i kaliumit bazuar në reduktimin e klorurit KCl duke ngrohur me një përzierje alumini ose silikoni me oksid kalciumi (6KCl + 2Al + 4CaO = 6K + 3CaCl 2 + CaO Al 2 O 3 ose 4Kl + Si + 4CaO2 = 4KaCl + 2CaO∙SiO 2), si dhe një metodë e bazuar në prodhimin e një aliazhi të plumbit të kaliumit me elektrolizë të karbonatit K 2 CO 3 ose klorurit KCl me një katodë plumbi të shkrirë dhe distilimit të mëvonshëm të aliazhit të kaliumit. Vëllimi i prodhimit global të kaliumit është rreth 28 ton/vit (2004).
Aplikimi. Metali i kaliumit është materiali i elektrodave në burimet kimike rrymë, katalizator në proceset e prodhimit të gomës sintetike. Komponime të ndryshme të kaliumit përdoren gjerësisht: peroksid K 2 O 2 dhe superoksid KO 2 - përbërës të përbërjeve për rigjenerimin e oksigjenit (në nëndetëset, anije kozmike dhe në të tjerat në ambiente të mbyllura), Hidridi KH është një agjent reduktues në sinteza kimike, një aliazh kaliumi me natrium (10-60% Na ndaj peshës, i lëngët në temperaturën e dhomës) - ftohës në reaktorët bërthamorë, një agjent reduktues në prodhimin e titanit, një reagent për pastrimin e gazeve nga oksigjeni dhe avujt e ujit; Kripërat e kaliumit përdoren si plehra kaliumi dhe përbërës të detergjenteve. Komplekset e kaliumit me jonoforet janë modele për studimin e transportit të joneve të kaliumit nëpër membranat qelizore. Radioizotopi 42 K (T 1/2 12,36 h) përdoret si tregues radioaktiv në kimi, mjekësi dhe biologji.
Lit.: Natriumi dhe kaliumi. L., 1959; Stepin B. D., Tsvetkov A. A. Kimi inorganike. M., 1994; Kimi inorganike: kimia e elementeve / Redaktuar nga Yu D. Tretyakov. M., 2004. T. 2.
kalium - metal alkali, e cila është mjaft e përhapur në Tokë. Përbërjet e kaliumit kanë qenë të njohura për njerëzit për një kohë të gjatë. Elementi u zbulua në 1807 dhe fillimisht u quajt kalium. Megjithatë, emri nuk u ngjit dhe pak më vonë elementi u emërua kalium.
Që nga kohërat e lashta, njerëzit kanë marrë potas (karbonat kaliumi) nga produktet e djegies. Përdorej si detergjent dhe pak më vonë filloi të përdoret për prodhimin e plehrave të ndryshme bujqësore, për prodhimin e qelqit dhe qëllime të tjera. Sot, potasi është madje një aditiv ushqimor i regjistruar zyrtarisht.
Karakteristikat e kaliumit
Vetitë fizike

Elementi ka një ngjyrë argjendi të zbehtë. Në sipërfaqen e sapoformuar shfaqet një shkëlqim karakteristik. Kaliumi është një metal i lehtë. Shkrihet lehtë. Mund të shpërndahet në merkur, një proces që prodhon amalgame. Digjet me flakë të kuqërremtë-vjollcë.
Vetitë kimike

Kaliumi është një metal dhe i ka të gjitha vetitë përkatëse. Elementi gjithashtu i përket grupit alkalik. Kjo shpjegon rritjen e aktivitetit të tij kimik. Kaliumi, kur reagon me substanca të tjera, dhuron elektrone dhe është një agjent i fortë reduktues.
- Reagon dhunshëm me oksigjenin, duke formuar superoksid kaliumi.
- Kur nxehet, ai reagon me hidrogjen.
- Reagon mirë me të gjithë elemente jo metalike, duke formuar nitride, fosfide, sulfide dhe komponime të tjera.
- Reagon me shumë substanca komplekse: kripërat, oksidet, dhe gjithashtu me ujë. Reagimi me ujin vazhdon shumë vrullshëm, me një shpërthim.

Përbërjet e kaliumit janë mjaft të zakonshme në natyrë. Kaliumi nuk mund të gjendet në formën e tij të pastër. Arsyeja për këtë është rritja e aktivitetit të saj kimik.
Ku mund të gjeni kalium në natyrë?
- Së pari, ka mjaft kalium sasi të mëdha gjendet në koren e Tokës. Përmbajtja e tij vlerësohet në rreth 2.4%. Kaliumi është një komponent i rëndësishëm i tokës dhe shkëmbinjve.
- Së dyti, depozita të mëdha të kripërave të kaliumit janë regjistruar në vendet e avullimit të deteve antike.
- Ujërat e Oqeanit Botëror përmbajnë gjithashtu një sasi të konsiderueshme kaliumi. Në ujërat e Oqeanit Botëror, përqendrimi i kaliumit është afërsisht 0.06%. Në disa trupa ujorë (për shembull, Deti i Vdekur), përqendrimi i kaliumit mund të jetë deri në 1.5%. Të tillë përqendrim i rritur e bën minierën e kaliumit ekonomikisht fitimprurës. Kështu, në Jordani ekziston një fabrikë për nxjerrjen e kaliumit nga ujërat e të vdekurve detet.
Fushat e aplikimit të kaliumit
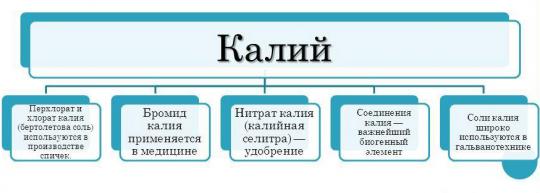
Shtrirja e përdorimit të kaliumit është dukshëm më e ngushtë në krahasim me të njëjtin natrium. Kjo për faktin se kaliumi ka aktivitet më të madh kimik. Përveç kësaj, kaliumi është një metal më i shtrenjtë. Megjithatë, kaliumi përdoret ende në industri të ndryshme industrisë.
- Kaliumi përdoret më aktivisht në industria kimike për prodhimin e plehrave. Kaliumi është një element i rëndësishëm për bimët. Shumë shpesh, bimët kanë mungesë të kaliumit, gjë që rezulton që bima të mos jetë në gjendje të përdorë potencialin e saj të plotë të rritjes. Bima dobësohet, rritet më ngadalë, kërcelli dobësohet, gjethet zverdhen dhe bien, dhe farat bëhen më pak të qëndrueshme. Mungesa e kaliumit në raste të tilla kompensohet me ndihmën e plehrave. Plehrat me potasikë janë produktet kryesore për të cilat përdoret kaliumi. Plehrat më të zakonshme të potasës janë klorur kaliumi (KCl).
- Përveç kësaj, elementi dhe komponimet e tij përdoren në inxhinierinë mekanike. Hidroksidi i kaliumit - element thelbësor për prodhimin e baterive.
- Përbërjet e kaliumit përdoren gjithashtu në industria ushqimore. Një shembull i mrekullueshëm- nitrat kaliumi. Substanca është një shtesë ushqimore. Përdoret si ruajtës.
Faqe 1
Kaliumi i pastër është një metal i bardhë argjendi me densitet 0 86, i butë, shkrihet në temperaturën 63 55 C, pika e vlimit 760 C. Kimikisht, kaliumi është shumë aktiv. Në ajër oksidohet shpejt.
Kaliumi i pastër është një metal i bardhë argjendi me densitet 0 86, i butë, shkrihet në temperaturën 63 55 C, pika e vlimit 760 C. Kimikisht, kaliumi është shumë aktiv.
| Izotermia e ekuilibrit në sistemin KX Na K NaX në varësi të anionit (X (Të dhënat e sheshit. |
Për të marrë kalium të pastër, avulli i nënshtrohet korrigjimit. Produkti i përfunduar përmban 99 5% kalium. Për 1 ton kalium të prodhuar, konsumohen 3 2 ton KC1, 0 73 ton natrium, 620 m3 azot i pastruar dhe 8000 kWh energji elektrike.
| Kurba e varësisë së koeficientit të emetimit sekondar o nga shpejtësia e elektroneve parësore (në volt o / (. /. |
Për metalet e pastra alkali 8 është i vogël (kalium i pastër 8 1), pavarësisht punë e vogël dalje.
Në vendin e punës me qendrat artificiale avullimi, eksperimentet u kryen fillimisht në kalium të pastër, dhe më pas në një aliazh natrium-kalium në përqendrime deri në -63 wt.
Në një balonë me fund të rrumbullakët me një kapacitet 500 ml, të pajisur me një përzierës me vulë merkuri, një frigorifer me akull të thatë, të mbyllur me një tub sode gëlqereje (të gjitha përbërjet janë bluar), 150 ml amoniak distilohen dhe 7 8 g (0 2 g atome) shtohen në copa të vogla me përzierje kaliumi i pastër, i cili shndërrohet në amid kaliumi duke shtuar një copë të vogël hekuri të ndryshkur. Tapa e qelqit të bluar zëvendësohet me një gyp pikues.
Pavarësisht ndryshimit të rëndësishëm në vlerat e presionit të avullit të kaliumit dhe plumbit, është e pamundur të merret kalium i pastër pa plumb në kondensat me një distilim të vetëm. Për të marrë kalium të pastër pa plumb, është i nevojshëm ose distilimi dytësor ose një dizajn procesi që do të siguronte refluks të pjesshëm të avujve metalikë.
Wehler (ai përdori kalium të pastër për reagimin), ai gjithashtu zotëron përshkrimin vetitë kimike alumini
Kaliumi shkrihet në një temperaturë prej 63 7 C. Me një tretshmëri kaq të lartë të oksigjenit pranë pikës së ngurtësimit, kaliumi i pastër nuk mund të pastrohet në mënyrë të kënaqshme nga oksigjeni në kurthe të ftohta. Në lidhjet kalium-natrium, oksigjeni është i lidhur me natriumin; tretshmëria e Na O në aliazhin dhe metalin e kaliumit është e njëjtë me atë të natriumit. Kjo ju lejon të përdorni kurthe të ftohta për të pastruar metalin. Megjithatë, shtimi i posaçëm i natriumit në kalium për ta pastruar atë nga oksigjeni kërkon shqyrtimin e një metode tjetër, të quajtur metoda e pastrimit të marrjes. Ai konsiston në futjen e një aditiv në pjesën e nxehtë të qarkut, i cili formon një lidhje më të fortë me oksigjenin sesa metali që pastrohet.
Si mund ta shpjegojmë se në temperaturat mbi 700 C, metali i natriumit (një metal më pak aktiv) është në gjendje të zhvendosë kaliumin (një metal më aktiv) nga përbërjet e tij. A mund të gjendet një proces i tillë aplikim praktik kur merret kaliumi i pastër.
Sinteza kryhet në një balonë me tre qafa të pajisur me një përzierës Gershberg, një kondensator refluks dhe një tapë xhami. Pas tharjes së aparatit, metoksidi i kaliumit përgatitet duke shtuar metanol absolut në 0,9 g (0,23 mol) kalium të pastër nën një shtresë benzeni. Tretësit hiqen nën presion të reduktuar dhe mbetjes së thatë i shtohen 1,180 g (0,0197 mol) M O-chevina - N 5 në 4 ml metanol absolut. 4 3 g (0 02 mol) eter acetamidomalone treten në 8 ml metanol dhe tretësira që rezulton derdhet menjëherë në një porcion në tretësirën e uresë. Përzierja zihet me refluks dhe përzihet për 4 orë.
Kaliumi (K) është një element kimik me numri atomik 19. Kaliumi i pastër është një metal alkali i bardhë argjendi, shumë i ngjashëm me aluminin, vetëm shumë më i butë.
Kaliumi është një metal jashtëzakonisht aktiv kimikisht. Në ajër, ai oksidohet shumë shpejt në oksid dhe hidroksid për shkak të ndërveprimit me oksigjenin e ajrit dhe avujt e ujit që përmbahen në të. Nëse një copë kaliumi vendoset në ujë, digjet me flakë vjollce ose edhe shpërthen. Prandaj, kaliumi i pastër nuk gjendet në natyrë.
Megjithatë, kaliumi është një element kimik mjaft i zakonshëm në Tokë, i cili shfaqet në formën e kripërave të tretshme në ujë në uji i detit, si dhe në një numër të madh mineralesh të tjera (mika, feldspat, silviniti, karnaliti, kainiti etj.). Përqendrimi mesatar i kaliumit në ujin e detit është 380 mg/l. Në përgjithësi, ndër të gjitha elementet kimike ai renditet i 7-ti për nga prevalenca dhe i 5-ti ndër të gjitha metalet. Toka përbëhet nga 2.4% kalium.
NË kimikisht kaliumi është shumë i ngjashëm me natriumin, megjithëse disi më aktiv se ky i fundit. Por në aspektin biologjik, kaliumi është një antagonist i natriumit, por më shumë për këtë më vonë.
Njerëzit janë njohur me përbërjet e kaliumit që nga kohra të lashta. Kështu, potasi i njohur (një përzierje e karbonatit, klorurit të kaliumit dhe sulfatit dhe sodës) u përdor si detergjent në shekullin e 11-të. Ata e nxirrnin në këtë mënyrë: digjnin kashtë ose dru, pastaj e përzienin me ujë dhe e tundnin, pastaj e filtronin dhe pastaj e avullonin.
Kaliumi elementar u izolua për herë të parë në 1807 nga elektroliza e hidroksidit të kaliumit (potas kaustik). Zbulimi i kaliumit shkon tek kimisti anglez Davy.
Rëndësia e kaliumit për trupin e njeriut
Kaliumi, pa ekzagjerim, element biogjen. Mund të gjendet në sasi të ndryshme në pothuajse të gjithë organizmat e gjallë: bimë, kërpudha dhe kafshë. Të gjitha bimët janë shumë të ndjeshme ndaj mungesës së kaliumit në tokë, dhe kjo është pothuajse arsyeja kryesore e varfërisë së tokës. Nuk është rastësi që pothuajse 90% e të gjitha mineraleve të kaliumit të nxjerra nga nëntoka përdoren si plehra potasike dhe bimët që i nxjerrin ato zënë gjithmonë pozicione drejtuese në ekonomi. Duke marrë parasysh popullsinë gjithnjë në rritje të planetit, nevoja për plehra potasi vetëm do të rritet.
Në organizmat e gjallë, kaliumi gjendet kryesisht në lëngu ndërqelizor. Në vetë qelizat, përqendrimi i tij është afërsisht 40 herë më i ulët.
Funksioni kryesor i kaliumit në çdo organizëm të gjallë është të sigurojë presioni osmotik ndërmjet qelizës dhe citoplazmës. Vetë mekanizmi i një ekuilibri të tillë ujë-mineral është studiuar mirë: gjatë jetës së qelizës, jonet e tepërta të kaliumit depërtojnë përtej citoplazmës dhe për të ruajtur përqendrimin e kërkuar ata duhet të hyjnë përsëri në citoplazmën e qelizës, gjë që sigurohet nga të ashtuquajturat. pompë natriumi-kaliumi.
Edhe një funksioni më i rëndësishëm kalium - krijimi i kushteve për praninë e potencialit të membranës, i cili siguron transmetimin kontraktimet e muskujve Dhe impulset nervore, si dhe ruajtjen e ekuilibrit acido-bazik.
Kaliumi gjithashtu aktivizon sistemin enzimë të trupit, duke siguruar metabolizmin e karbohidrateve dhe proteinave (është i nevojshëm për sintezën e proteinave dhe për shndërrimin e glukozës në glikogjen), përmirëson aktivitetin e zorrëve dhe është i nevojshëm për të ruajtur funksionin e veshkave në largimin e lagështisë së tepërt nga trupi së bashku me produktet metabolike. .
Çdo ditë një i rritur ka nevojë për 1,8-5,0 g kalium, doza e një fëmije (në varësi të moshës) - 0,6-1,7 g Nevoja për marrjen e kaliumit varet shumë nga pesha trupore, gjendja fiziologjike. aktivitet fizik, kushtet klimatike.
Burimet e kaliumit
Në ushqimet shtazore, përqendrimi i kaliumit është afërsisht i njëjtë si në ushqimet bimore, por preferenca duhet t'i jepet ushqimeve shtazore, pasi në këtë rast një person merr një përmbajtje të ekuilibruar të kaliumit dhe natriumit. Kur hani ushqime bimore, përqendrimi i kaliumit në trup do të rritet dhe natriumi do të ulet, gjë që mund të çojë në pasoja të padëshirueshme. Duhet të kihet parasysh se për shkak të tretshmërisë së lartë të përbërjeve të kaliumit, pothuajse i gjithë ai (95%) absorbohet kur hyn në trup. Pjesa kryesore e kaliumit absorbohet në zorrën e hollë.
- viçi (241 mg%);
- peshk (nga 200 mg%);
- qumësht (127 mg%).
Produktet bimore me përmbajtje të lartë kaliumi:
- sojë (1800 mg%);
- fasule (1050 mg%);
- bizele (900 mg%);
- patate (429 mg%);
- bukë (240 mg%);
- panxhar (155 mg%);
- lakër (149 mg%;);
- karota (129 mg%);
- çokollatë;
- spinaq, shalqi, pjepër, mollë, kajsi (duke përfshirë kajsitë dhe kajsitë e thata), kivi, banane, agrume (veçanërisht pomelo), rrush (përfshirë rrushin e thatë), avokado.
Mungesa e kaliumit në trupin e njeriut
Mungesa e kaliumit në trup është një fenomen mjaft i zakonshëm. Shkaqet tipike të mungesës së kaliumit janë:
- marrja e pamjaftueshme nga ushqimi;
- çrregullime të metabolizmit të kaliumit;
- sëmundjet e sekretimit dhe sistemet e tretjes(zorrët, mëlçia, veshkat, mushkëritë);
- të vjella, përdorimi i laksativëve dhe diuretikëve, diarre e zgjatur, djersitje e madhe dhe dehidratim të tjerë;
- mbingarkesë neuropsikike, lodhje kronike;
- marrja e tepërt e antagonistëve të kaliumit (natrium, rubidium, cezium, talium) në trup.
Simptomat e mungesës së kaliumit në trup:
- lodhje neuropsikike, lodhje kronike, depresion;
- imuniteti i ulur;
- dobësi e muskujve (myasthenia gravis);
- përkeqësimi i funksionit të veshkave dhe veshkave, urinim i shpeshtë;
- hipertensioni;
- nauze, të vjella, kapsllëk atonik;
- aritmia kardiake, mosfunksionimi i miokardit, dështimi i zemrës, sulmi në zemër;
- përçarje sistemi i frymëmarrjes(frymëmarrje e shpejtë e cekët);
- flokë dhe thonjtë e brishtë, lëkurë e thatë;
- ulcerat peptike të sistemit të tretjes, gastrit;
- sëmundjet e organeve gjenitale, infertiliteti, erozioni i qafës së mitrës.
Duhet të dini gjithashtu se gjatë procesit të gatimit, sidomos kur ziejnë, ushqimet humbasin një pjesë të konsiderueshme të kaliumit. Arsyeja për këtë është e njëjta tretshmëri e lartë e përbërjeve të kaliumit. Prandaj, nëse ka mungesë kaliumi, preferohet përgatitja e ushqimit me pjekje ose zierje. Ju mund të rrisni përthithjen e kaliumit duke balancuar konsumin e ushqimeve që e përmbajnë atë me vitaminë B6 ose ushqime të larta në këtë vitaminë.
Konsumimi i alkoolit ul ndjeshëm përthithjen e kaliumit. Nga rruga, më mënyrë e shpejtë shkaktojnë mungesë të kaliumit në trup - pini sistematikisht birrë me turshi (peshk të tharë dhe të tymosur, patate të skuqura, arra, krisur, etj.).
Kaliumi i tepërt në trupin e njeriut
Çdo gjë është e mirë në moderim. Prandaj, përpara se të mbështeteni në ushqimet që përmbajnë kalium, duhet të siguroheni që doza është e saktë. Kështu, edhe një dozë e vetme prej 6 g kalium (natyrisht, si pjesë e kripërave) mund të shkaktojë simptoma të tepricës, dhe 14 g konsiderohet një dozë vdekjeprurëse.
Shkaku i kaliumit të tepërt në trup mund të bëhet:
- konsumi i tepërt i ushqimeve bimore me përmbajtje të lartë kaliumi (për shembull, një dietë e vazhdueshme me patate);
- marrja e suplementeve ushqimore dhe komplekseve minerale me përmbajtje të lartë kaliumi;
- shqetësim i metabolizmit të kaliumit;
- gjendja e mungesës së insulitit;
- funksioni i dëmtuar i veshkave, duke përfshirë dështimin e veshkave;
- mosfunksionimi i sistemit simpatoadrenal etj.
Simptomat e kaliumit të tepërt:
- nervozizëm, hiperaktivitet, ankthi i shtuar, djersitje;
- dobësi e muskujve dhe çrregullime të tjera neuromuskulare;
- dystonia neurocirkuluese;
- aritmia;
- mosfunksionim i zorrëve (kolika në zorrën e vogël);
- paraliza e muskujve skeletorë;
- rritje e diurezës;
- rrezik i shtuar për të zhvilluar diabetin.








