Termasuk golongan logam alkali, lambang K, di. N. 19; pada. m.39, 098. Logam lunak berwarna putih keperakan. Secara kimia sangat aktif, zat pereduksi kuat, mudah teroksidasi di udara. Ditemukan oleh ahli kimia Inggris G. Davy pada tahun 1807. Massa jenis 0,856. Suhu leleh 63,55? C, titik didih 760? C.Kekerasan Brinell 400 kPa. Logam K. mudah dipotong dengan pisau. K. adalah salah satu unsur petrogenik yang paling tersebar luas di kerak bumi - 2,5% (berdasarkan massa). Mineral terpenting: sylvite, karnalit, kainite, langbeinite. Konten K dalam ultrabasic batu 0,03%, basa 0,83%, sedang 2,3%, asam 3,34%. Konsentrasi kalium maksimum (hingga 7%) ditemukan pada batuan basa seri agpaitik. Mineral kalium utama pada batuan ini adalah alkali feldspar, mika, nepheline, dan leucite. Ketika air laut menguap, mineral-mineral berikut mengendap: sylvinite, karnalit, kainite, dan polihalit. Karena penguapan laut yang intens. perairan di masa lalu zaman geologis, khususnya pada masa Permian, terbentuk deposito besar garam kalium.
1. Sejarah
2. Sebarannya di alam
Kalium adalah unsur kimia yang cukup umum, menyumbang 2,6% massa kerak bumi. Karena aktivitas kimianya yang tinggi dalam keadaan bebas, maka tidak ditemukan di alam, melainkan hanya dalam bentuk berbagai senyawa. Beberapa di antaranya, seperti kalium klorida, membentuk endapan yang kuat.
Deposit garam kalium terkaya di dunia dalam bentuk mineral sylvinite KCl, sylvinite KCl? NaCl, karnalit KCl ? MgCl2? 6H 2 O dan kainit KCl ? MgSO4? 3H 2 O terletak di dekat kota Solikamsk. Selain itu, deposit senyawa kalium yang signifikan ditemukan di Belarus (Soligorsk) dan Ukraina (Kalush dan Stebnik di wilayah Carpathian).
3. Sifat fisik
Dalam keadaan bebas, kalium adalah logam ringan berwarna putih keperakan. Massa jenis - 0,856 g/cm3. Logam ini sangat lunak dan mudah dipotong dengan pisau. Titik lebur - 63,38? DENGAN.
4. Sifat kimia
Kalium milik subgrup utama kelompok pertama tabel periodik Mendeleev. atom-atomnya ada di bagian luar lapisan elektronik satu elektron pada satu waktu, yang mudah hilang dan menjadi ion dengan satu elektron muatan positif. Oleh karena itu, dalam senyawanya, kalium hanya bersifat monovalen positif. Kalium - sangat logam aktif. Kehilangan milikmu dengan mudah elektron valensi, ini adalah zat pereduksi yang sangat kuat. DI DALAM seri elektrokimia tegangan, ia menempati urutan pertama di sebelah kiri hidrogen. Di udara kering, kalium berinteraksi kuat dengan oksigen di udara dan berubah menjadi superoksida:
- 4K + O 2 -> 2KO 2
Oleh karena itu disimpan di bawah lapisan minyak tanah atau minyak mineral.
Ia bereaksi sangat keras dengan air, bahkan meledak. Bereaksi lebih hebat lagi dengan asam (juga bersifat eksplosif). Di udara lembab, logam mudah berubah menjadi hidroksida:
- 2K + 2H 2 O -> 2KOH + H 2
dan yang terakhir, berinteraksi dengan karbon dioksida udara, - menjadi karbonat:
- 2KOH + CO 2 -> K 2 CO 3 + H 2 O
Pada suhu tinggi kalium dapat mereduksi oksida aluminium, silikon, dll. dalam elemen gratis:
- SiO 2 + 4K -> Si + 2K 2 O
5. Tanda terima
Dalam keadaan bebas, kalium diperoleh dengan elektrolisis lelehan klorida atau hidroksida. Selama elektrolisis alkali kaustik cair, ion logam bermuatan positif tertarik ke katoda bermuatan negatif, masing-masing menambahkan satu elektron (tereduksi) dan berubah menjadi atom logam bebas, dan ion hidroksil bermuatan negatif tertarik ke anoda bermuatan positif, berikan itu masing-masing satu elektron dan berubah menjadi elektron. gugus OH netral yang terurai membentuk air dan oksigen yang dilepaskan di anoda.
Produksi logam kalium melalui elektrolisis lelehan KCl dapat direpresentasikan dengan persamaan berikut:
KCl ↓ - Anoda Katoda + K + + e = K ? Cl - e = Cl ?
6. Aplikasi
Logam kalium berfungsi sebagai katalis dalam produksi karet sintetis jenis tertentu.
Senyawa K. digunakan dalam pertanian sebagai pupuk, untuk membuat kaca, bahan peledak, dalam bidang kedokteran, teknik nuklir, dll.
Potassium algitum digunakan untuk mengobati penyakit bibir pada anak-anak.
7. Garam kalium
Kalium membentuk garam dengan semua asam. Garam kalium memiliki sifat yang sangat mirip dengan garam natrium. Yang paling penting di antaranya:
POTASSIUM (Latin Kalium), K, unsur kimia golongan I bentuk pendek (golongan 1 bentuk panjang) sistem periodik; nomor atom 19; massa atom 39.0983; mengacu pada logam alkali. Kalium alami terdiri dari tiga isotop: 39 K (93,2581%), 40 K (0,0117%; radioaktif lemah, T 1/2 1,277 10 9 tahun, peluruhan β hingga 40 Ca), 41 K (6,7302%). Radioisotop dengan nomor massa 32-54 telah diperoleh secara artifisial.
Informasi sejarah. Beberapa senyawa kalium telah dikenal pada zaman dahulu, misalnya kalium karbonat K 2 CO 3 (disebut alkali tumbuhan) diisolasi dari abu kayu dan digunakan dalam pembuatan sabun. Kalium logam pertama kali diperoleh oleh G. Davy pada tahun 1807 dengan cara elektrolisis basah hidroksida padat KOH dan menyebutnya potasium (kalium bahasa Inggris dari bahasa Inggris potash - nama potasium karbonat). Pada tahun 1809, nama "kalium" (dari bahasa Arab al-kali - kalium) diusulkan. Nama "kalium" telah dipertahankan di Inggris, Amerika Serikat, Perancis dan negara-negara lain. Di Rusia, sejak tahun 1840, nama “kalium” telah digunakan, juga diadopsi di Jerman, Austria, dan negara-negara Skandinavia.
Prevalensi di alam. Kandungan kalium dalam kerak bumi adalah 2,6% berat. Kalium tidak terdapat dalam keadaan bebas di alam. DI DALAM jumlah yang signifikan kalium ditemukan dalam silikat nepheline dan leucite, feldspar (misalnya ortoklas), mika (misalnya muskovit). Mineral kalium sendiri - silvit, silvinit, karnalit, kainit, langbeinit K 2 SO 4 ∙2MgSO 4 membentuk akumulasi besar garam kalium alami. Akibat aksi air dan karbon dioksida, kalium berubah menjadi senyawa larut, yang sebagian terbawa ke laut dan sebagian lagi tertahan oleh tanah. Garam kalium juga ditemukan di air garam danau garam dan air garam bawah tanah.
Properti. Konfigurasi eksternal kulit elektron atom kalium 4s 1; dalam senyawa menunjukkan bilangan oksidasi +1; energi ionisasi K 0 →K + →K 2+ masing-masing sebesar 4,3407 dan 31,8196 eV; Keelektronegatifan Pauling 0,82; jari-jari atom 220 pm, jari-jari ion K + 152 pm ( nomor koordinasi 6).
Kalium - putih keperakan logam lunak; kisi kristal berpusat pada badan kubik; t meleleh 63,38 °C, t mendidih 759 °C, massa jenis 856 kg/m 3 (20 °C); kapasitas panas 29,60 J/(mol K) pada 298 K.
Kalium dapat ditekan dan digulung, mudah dipotong dengan pisau dan tetap mempertahankan plastisitasnya saat digunakan. suhu rendah; Kekerasan Brinell 0,4 MPa.
Kalium adalah logam dengan aktivitas kimia tinggi (kalium disimpan di bawah lapisan bensin, minyak tanah atau minyak mineral). Pada kondisi normal kalium berinteraksi dengan oksigen (oksida K 2 O, peroksida K 2 O 2 terbentuk, superoksida KO 2 adalah produk utama), halogen (kalium halida yang sesuai), ketika dipanaskan - dengan belerang (sulfida K 2 S), selenium (selenida K 2 Se ), telurium (K 2 Te telurida), dengan fosfor dalam atmosfer nitrogen (fosfida K 3 P dan K 2 P5), karbon (senyawa berlapis dengan komposisi KS 8 - KS 60), hidrogen (KN hidrida). Kalium berinteraksi dengan nitrogen hanya jika terkena pelepasan listrik(V Bukan jumlah besar azida KN 3 dan nitrida K 3 N terbentuk). Kalium bereaksi dengan beberapa logam, membentuk senyawa intermetalik atau solusi yang solid(paduan kalium). Paduan dengan natrium, yang ditandai dengan aktivitas kimia yang tinggi, memiliki kepentingan praktis yang paling besar; diperoleh dengan paduan logam dalam atmosfer inert atau dengan aksi logam natrium pada KOH hidroksida atau KCl klorida.
Kalium logam adalah zat pereduksi kuat: bereaksi kuat (dalam kondisi normal dengan ledakan dan penyalaan logam) dengan air (kalium hidroksida KOH terbentuk), bereaksi hebat (terkadang dengan ledakan) dengan asam (membentuk garam yang sesuai, misalnya kalium dikromat, kalium nitrat, kalium permanganat, kalium fosfat, kalium sianida), mereduksi oksida B, Si, Al, Ag, Bi, Co, Cr, Cu, Hg, Ni, Pb, Sn, Ti menjadi elemen; sulfat, sulfit, nitrat, nitrit, karbonat, dan fosfat dari logam lain - hingga oksida dari logam yang bersangkutan. Logam kalium larut perlahan dalam amonia cair membentuk larutan biru tua dengan konduktivitas logam; logam terlarut secara bertahap bereaksi dengan amonia membentuk urea: 2K + 2NH 3 = 2KNH 2 + H 2. Kalium berinteraksi dengan berbagai macam senyawa organik: alkohol (terbentuk alkohol, misalnya etil C 2 H 5 OK), asetilen (asetilenida KS≡CH dan KS≡SK), alkil halida (kalium alkil, misalnya etilpotasium C 2 H 5 K) dan aril halida (kalium aril , misalnya fenilkalium C 6 H 5 KE). Logam kalium memulai reaksi polimerisasi alkena dan diena. Dengan ligan polisiklik donor N dan O (eter mahkota, kriptan, dan ionofor lainnya), kalium membentuk senyawa kompleks.
Saat bekerja dengan kalium, perlu diperhitungkan reaktivitasnya yang tinggi, termasuk kemampuannya terbakar jika terkena air. Demi keamanan, Anda harus menggunakan sarung tangan karet, kacamata pengaman atau masker. Kalium dalam jumlah besar harus dikerjakan di ruang khusus dalam atmosfer inert (argon, nitrogen). Kalium digunakan untuk memadamkan api garam meja NaCl atau soda abu Na 2 CO 3.
Peran biologis . Kalium adalah elemen biogenik. Kebutuhan harian kalium manusia sekitar 2 g. Dalam organisme hidup, ion kalium berperan peran penting dalam proses pengaturan metabolisme, khususnya pengangkutan ion melalui membran sel(lihat, misalnya, artikel Pompa ion).
Kuitansi. Dalam industri, kalium diperoleh dengan mereduksi lelehan KOH hidroksida atau KCl klorida dengan logam natrium dalam kolom arus berlawanan, diikuti dengan kondensasi uap kalium. Menjanjikan metode vakum-termal produksi kalium berdasarkan reduksi KCl klorida melalui pemanasan dengan campuran aluminium atau silikon dengan kalsium oksida (6KCl + 2Al + 4CaO = 6K + 3CaCl 2 + CaO Al 2 O 3 atau 4Kl + Si + 4CaO = 4K + 2CaCl 2 + 2CaO∙SiO 2), serta metode yang didasarkan pada produksi paduan kalium-timbal dengan elektrolisis K 2 CO 3 karbonat atau KCl klorida dengan katoda timbal cair dan selanjutnya distilasi paduan kalium. Volume produksi kalium global sekitar 28 ton/tahun (2004).
Aplikasi. Logam kalium adalah bahan elektroda di dalamnya sumber kimia saat ini, katalis dalam proses produksi karet sintetis. Berbagai senyawa kalium banyak digunakan: peroksida K 2 O 2 dan superoksida KO 2 - komponen komposisi untuk regenerasi oksigen (on kapal selam, pesawat ruang angkasa dan di tempat lain di dalam ruangan), KH hidrida adalah zat pereduksi dalam sintesis kimia, paduan kalium dengan natrium (10-60% Na berdasarkan berat, cair pada suhu kamar) - pendingin dalam reaktor nuklir, zat pereduksi dalam produksi titanium, reagen untuk memurnikan gas dari oksigen dan uap air; Garam kalium digunakan sebagai pupuk kalium dan komponen deterjen. Kompleks kalium dengan ionofor merupakan model untuk mempelajari pengangkutan ion kalium melintasi membran sel. Radioisotop 42 K (T 1/2 12,36 jam) digunakan sebagai indikator radioaktif dalam kimia, kedokteran dan biologi.
Lit.: Natrium dan kalium. L., 1959; Stepin B.D., Tsvetkov A.A. Kimia anorganik. M., 1994; Kimia anorganik: kimia unsur / Diedit oleh Yu D. Tretyakov. M., 2004.Vol.2.
Kalium - logam alkali, yang cukup tersebar luas di Bumi. Senyawa kalium sudah dikenal masyarakat sejak lama. Unsur ini ditemukan pada tahun 1807 dan awalnya diberi nama kalium. Namun, namanya tidak melekat dan tak lama kemudian unsur tersebut diberi nama kalium.
Sejak zaman dahulu, manusia memperoleh kalium (kalium karbonat) dari hasil pembakaran. Itu digunakan sebagai deterjen, dan kemudian mulai digunakan untuk produksi berbagai pupuk pertanian, untuk produksi kaca dan keperluan lainnya. Saat ini, kalium bahkan merupakan bahan tambahan makanan yang terdaftar secara resmi.
Ciri-ciri kalium
Sifat fisik

Elemen tersebut memiliki warna perak pucat. Kilauan khas muncul pada permukaan yang baru terbentuk. Kalium adalah logam ringan. Mudah meleleh. Ini dapat dilarutkan dalam merkuri, suatu proses yang menghasilkan amalgam. Terbakar dengan nyala api ungu kemerahan.
Sifat kimia

Kalium adalah logam dan memiliki segalanya properti yang sesuai. Unsur tersebut juga termasuk dalam golongan basa. Hal ini menjelaskan peningkatan aktivitas kimianya. Kalium, ketika bereaksi dengan zat lain, menyumbangkan elektron dan merupakan zat pereduksi kuat.
- Bereaksi hebat dengan oksigen, membentuk kalium superoksida.
- Saat dipanaskan, ia bereaksi dengan hidrogen.
- Bereaksi dengan baik terhadap semua orang unsur bukan logam, membentuk nitrida, fosfida, sulfida dan senyawa lainnya.
- Bereaksi dengan banyak orang zat kompleks: garam, oksida, dan juga dengan air. Reaksi dengan air berlangsung sangat hebat, dengan ledakan.

Senyawa kalium cukup umum ditemukan di alam. Kalium tidak dapat ditemukan dalam bentuk murni. Alasannya adalah peningkatan aktivitas kimianya.
Di mana Anda bisa menemukan kalium di alam?
- Pertama, potasiumnya cukup jumlah besar ditemukan di kerak bumi. Isinya diperkirakan sekitar 2,4%. Kalium merupakan komponen penting tanah dan batuan.
- Kedua, deposit besar garam kalium telah tercatat di lokasi penguapan laut purba.
- Perairan Samudra Dunia juga mengandung sejumlah besar potasium. Di perairan Samudra Dunia, konsentrasi kalium sekitar 0,06%. Di beberapa perairan (misalnya Laut Mati), konsentrasi kalium bisa mencapai 1,5%. Seperti peningkatan konsentrasi membuat penambangan kalium menguntungkan secara ekonomi. Jadi, di Yordania ada pabrik untuk mengekstraksi kalium perairan Orang Mati laut.
Area penerapan kalium
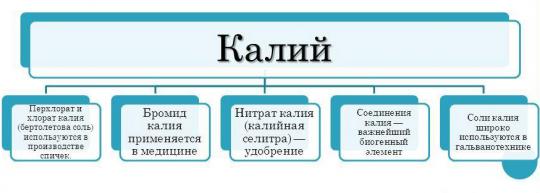
Cakupan penggunaan kalium jauh lebih sempit dibandingkan dengan natrium yang sama. Hal ini disebabkan oleh fakta bahwa kalium memiliki aktivitas kimia yang lebih besar. Selain itu, kalium adalah logam yang lebih mahal. Namun, potasium masih digunakan berbagai industri industri.
- Kalium paling aktif digunakan dalam industri kimia untuk produksi pupuk. Kalium merupakan unsur penting bagi tanaman. Seringkali, tanaman kekurangan kalium, sehingga tanaman tidak dapat menggunakan potensi pertumbuhannya secara maksimal. Tanaman melemah, tumbuh lambat, batang melemah, daun menguning dan rontok, serta benih menjadi kurang mampu bertahan. Kekurangan kalium dalam kasus seperti itu diimbangi dengan bantuan pupuk. Pupuk kalium adalah produk utama penggunaan kalium. Pupuk kalium yang paling umum adalah kalium klorida (KCl).
- Selain itu, unsur dan senyawanya digunakan dalam teknik mesin. Kalium hidroksida - elemen penting untuk pembuatan baterai.
- Senyawa kalium juga digunakan dalam industri makanan. Sebuah contoh yang mencolok- kalium nitrat. Zat tersebut merupakan bahan tambahan pangan. Digunakan sebagai pengawet.
Halaman 1
Kalium murni merupakan logam berwarna putih keperakan dengan massa jenis 0 86, lunak, meleleh pada suhu 63 55 C, titik didih 760 C. Secara kimia, kalium sangat aktif. Di udara ia teroksidasi dengan cepat.
Kalium murni merupakan logam berwarna putih keperakan dengan massa jenis 0 86, lunak, meleleh pada suhu 63 55 C, titik didih 760 C. Secara kimia, kalium sangat aktif.
| Isoterm kesetimbangan dalam sistem KX Na K NaX bergantung pada anion (X (data Rink. |
Untuk mendapatkan kalium murni, uapnya mengalami perbaikan. Produk jadi mengandung 99 5% potasium. Untuk 1 ton kalium yang dihasilkan, dikonsumsi 3 2 ton KC1, 0 73 ton natrium, 620 m3 nitrogen murni, dan 8000 kWh listrik.
| Kurva ketergantungan koefisien emisi sekunder o pada kecepatan elektron primer (dalam volt o / (. /. |
Untuk logam alkali murni 8 kecil (kalium murni 8 1). pekerjaan kecil KELUAR.
Di tempat kerja dengan pusat buatan penguapan, percobaan pertama kali dilakukan pada kalium murni, dan kemudian pada paduan natrium-kalium pada konsentrasi hingga -63 berat.
Dalam labu alas bulat berkapasitas 500 ml, dilengkapi pengaduk dengan segel merkuri, lemari es dengan es kering, ditutup dengan tabung soda kapur (semua senyawa digiling), 150 ml amonia didistilasi dan 7 8 g (atom 0 2 g) ditambahkan dalam potongan kecil sambil diaduk. kalium murni, yang diubah menjadi kalium di tengah dengan menambahkan sepotong kecil besi berkarat. Sumbat kaca tanah diganti dengan corong tetes.
Meskipun terdapat perbedaan yang signifikan dalam nilai tekanan uap kalium dan timbal, tidak mungkin memperoleh kalium murni tanpa timbal dalam kondensat dengan sekali distilasi. Untuk mendapatkan kalium murni tanpa timbal, diperlukan distilasi sekunder atau desain proses yang menyediakan refluks parsial uap logam.
Wehler (dia menggunakan kalium murni untuk reaksinya), dia juga memiliki deskripsinya sifat kimia aluminium
Kalium meleleh pada suhu 63 7 C. Dengan kelarutan oksigen yang tinggi di dekat titik pemadatan, kalium murni tidak dapat dimurnikan secara memuaskan dari oksigen dalam perangkap dingin. Dalam paduan kalium-natrium, oksigen terikat pada natrium; kelarutan Na O dalam logam paduan dan kalium sama dengan natrium. Hal ini memungkinkan Anda menggunakan perangkap dingin untuk membersihkan logam. Namun, penambahan khusus natrium ke kalium untuk memurnikannya dari oksigen memerlukan pertimbangan metode lain, yang disebut metode pemurnian pengambil. Ini terdiri dari memasukkan aditif ke bagian sirkuit yang panas, yang membentuk ikatan yang lebih kuat dengan oksigen daripada logam yang sedang dibersihkan.
Bagaimana menjelaskan bahwa pada suhu di atas 700 C, logam natrium (logam yang kurang aktif) mampu menggantikan kalium (logam yang lebih aktif) dari senyawanya. Bisakah proses seperti itu ditemukan aplikasi praktis saat mendapatkan kalium murni.
Sintesis dilakukan dalam labu leher tiga yang dilengkapi dengan pengaduk Gershberg, kondensor refluks, dan sumbat kaca. Setelah peralatan dikeringkan, kalium metoksida dibuat dengan menambahkan metanol absolut ke dalam 0,9 g (0,23 mol) kalium murni di bawah lapisan benzena. Pelarut dihilangkan pada tekanan tereduksi dan 1,180 g (0,0197 mol) M O-chevina - N 5 dalam 4 ml metanol absolut ditambahkan ke residu kering. 4 3 g (0 02 mol) asetamidomalon eter dilarutkan dalam 8 ml metanol dan larutan yang dihasilkan segera dituangkan dalam satu bagian ke dalam larutan urea. Campuran direfluks dan diaduk selama 4 jam.
Kalium (K) adalah unsur kimia dengan nomor atom 19. Kalium murni adalah logam alkali berwarna putih keperakan, sangat mirip dengan aluminium, hanya saja lebih lembut.
Kalium adalah logam yang secara kimia sangat aktif. Di udara, sangat cepat teroksidasi menjadi oksida dan hidroksida karena interaksi dengan oksigen udara dan uap air yang terkandung di dalamnya. Jika sepotong kalium dimasukkan ke dalam air, ia akan terbakar dengan nyala ungu atau bahkan meledak. Oleh karena itu, kalium murni tidak terdapat di alam.
Namun, kalium adalah unsur kimia yang cukup umum di Bumi, yang terdapat dalam bentuk garam yang larut dalam air air laut, serta sejumlah besar mineral lainnya (mika, feldspar, sylvinite, karnalit, kainite, dll.). Konsentrasi kalium rata-rata dalam air laut adalah 380 mg/l. Secara umum, di antara semuanya unsur kimia ia menempati peringkat ke-7 dalam prevalensinya, dan ke-5 di antara semua logam. Bumi mengandung 2,4% potasium.
DI DALAM secara kimia kalium sangat mirip dengan natrium, meskipun agak lebih aktif dibandingkan natrium. Namun secara biologis, kalium merupakan antagonis natrium, tetapi akan dibahas lebih lanjut nanti.
Orang-orang telah mengenal senyawa kalium sejak dahulu kala. Jadi, kalium yang terkenal (campuran karbonat, kalium klorida dan sulfat dan soda) digunakan sebagai deterjen kembali pada abad ke-11. Cara pengambilannya begini: jerami atau kayu dibakar, lalu dicampur dengan air dan dikocok, lalu disaring lalu diuapkan.
Unsur kalium pertama kali diisolasi pada tahun 1807 dengan elektrolisis kalium hidroksida (kalium kaustik). Penemuan kalium jatuh ke tangan ahli kimia Inggris Davy.
Pentingnya kalium bagi tubuh manusia
Kalium, tanpa berlebihan, unsur biogenik. Ini dapat ditemukan dalam jumlah yang bervariasi di hampir semua organisme hidup: tumbuhan, jamur dan hewan. Semua tanaman sangat sensitif terhadap kekurangan kalium dalam tanah, dan ini mungkin menjadi penyebab utama kemiskinan tanah. Bukan suatu kebetulan bahwa hampir 90% dari semua mineral kalium yang diekstraksi dari lapisan tanah bawah digunakan sebagai pupuk kalium, dan tanaman yang mengekstraknya selalu menempati posisi terdepan dalam perekonomian. Mengingat populasi dunia yang terus meningkat, kebutuhan akan pupuk kalium akan semakin meningkat.
Dalam organisme hidup, kalium ditemukan terutama di cairan antar sel. Di dalam sel itu sendiri, konsentrasinya kira-kira 40 kali lebih rendah.
Fungsi utama kalium dalam setiap organisme hidup adalah untuk menyediakan tekanan osmotik antara sel dan sitoplasma. Mekanisme keseimbangan air-mineral itu sendiri telah dipelajari dengan baik: selama hidup sel, kelebihan ion kalium menembus melampaui sitoplasma, dan untuk mempertahankan konsentrasi yang diperlukan, ion tersebut harus masuk kembali ke dalam sitoplasma sel, yang dijamin oleh yang disebut. pompa natrium-kalium.
Satu lagi fungsi yang paling penting kalium - menciptakan kondisi adanya potensi membran, yang menjamin transmisi kontraksi otot Dan impuls saraf, serta menjaga keseimbangan asam basa.
Kalium juga mengaktifkan sistem enzim tubuh, memastikan metabolisme karbohidrat dan protein (diperlukan untuk sintesis protein dan mengubah glukosa menjadi glikogen), meningkatkan aktivitas usus, dan diperlukan untuk menjaga fungsi ginjal dalam menghilangkan kelebihan air dari tubuh bersama dengan produk metabolisme. .
Setiap hari orang dewasa membutuhkan 1,8-5,0 g kalium, dosis anak (tergantung usia) - 0,6-1,7 g Kebutuhan asupan kalium sangat tergantung pada berat badan, keadaan fisiologis, aktivitas fisik, kondisi iklim.
Sumber kalium
Pada makanan hewani, konsentrasi kalium kira-kira sama dengan makanan nabati, namun preferensi harus diberikan pada makanan hewani, karena dalam hal ini seseorang menerima kandungan kalium dan natrium yang seimbang. Saat mengonsumsi makanan nabati, konsentrasi kalium dalam tubuh akan meningkat, dan natrium akan menurun, yang dapat menyebabkan konsekuensi yang tidak diinginkan. Perlu diingat bahwa karena kelarutan senyawa kalium yang tinggi, hampir seluruhnya (95%) diserap ketika masuk ke dalam tubuh. Bagian utama kalium diserap di usus kecil.
- daging sapi (241 mg%);
- ikan (dari 200 mg%);
- susu (127 mg%).
Produk tanaman tinggi kalium:
- kedelai (1800 mg%);
- kacang-kacangan (1050 mg%);
- kacang polong (900 mg%);
- kentang (429 mg%);
- roti (240 mg%);
- bit (155 mg%);
- kubis (149 mg%;);
- wortel (129 mg%);
- cokelat;
- bayam, semangka, melon, apel, aprikot (termasuk aprikot dan aprikot kering), kiwi, pisang, buah jeruk (terutama jeruk bali), anggur (termasuk kismis), alpukat.
Kekurangan potasium dalam tubuh manusia
Kekurangan kalium dalam tubuh merupakan fenomena yang cukup umum terjadi. Penyebab khas kekurangan kalium adalah:
- asupan makanan yang tidak mencukupi;
- gangguan metabolisme kalium;
- penyakit ekskresi dan sistem pencernaan(usus, hati, ginjal, paru-paru);
- muntah, penggunaan obat pencahar dan diuretik, diare berkepanjangan, keringat berlebih dan dehidrasi lainnya;
- kelebihan neuropsikik, kelelahan kronis;
- asupan berlebihan antagonis kalium (natrium, rubidium, cesium, talium) ke dalam tubuh.
Gejala Defisiensi Kalium di dalam tubuh:
- kelelahan neuropsikik, kelelahan kronis, depresi;
- penurunan kekebalan;
- kelemahan otot (miastenia gravis);
- penurunan fungsi adrenal dan ginjal, sering buang air kecil;
- hipertensi;
- mual, muntah, sembelit atonik;
- aritmia jantung, disfungsi miokard, gagal jantung, serangan jantung;
- gangguan sistem pernapasan(pernapasan cepat dan dangkal);
- rambut dan kuku rapuh, kulit kering;
- tukak lambung pada sistem pencernaan, maag;
- penyakit pada alat kelamin, infertilitas, erosi serviks.
Perlu Anda ketahui juga bahwa selama proses memasak, terutama saat direbus, makanan kehilangan sebagian besar potasiumnya. Alasannya adalah tingginya kelarutan senyawa kalium. Oleh karena itu, jika terjadi kekurangan kalium, sebaiknya menyiapkan makanan dengan cara dipanggang atau direbus. Anda bisa meningkatkan penyerapan kalium dengan menyeimbangkan konsumsi makanan yang mengandungnya dengan vitamin B6 atau makanan tinggi vitamin tersebut.
Konsumsi alkohol secara signifikan mengurangi penyerapan kalium. Ngomong-ngomong, yang paling banyak cara cepat menyebabkan kekurangan kalium dalam tubuh - minum bir secara sistematis dengan acar (ikan kering dan asap, keripik, kacang-kacangan, kerupuk, dll.).
Kelebihan kalium dalam tubuh manusia
Semuanya baik-baik saja dalam jumlah sedang. Oleh karena itu, sebelum mengandalkan makanan yang mengandung kalium, Anda perlu memastikan dosisnya tepat. Jadi, bahkan dosis tunggal 6 g kalium (secara alami, sebagai bagian dari garam) dapat menyebabkan gejala kelebihan, dan 14 g dianggap sebagai dosis yang mematikan.
Penyebab kelebihan kalium dalam tubuh dapat menjadi:
- konsumsi berlebihan makanan nabati tinggi potasium (misalnya, pola makan kentang terus-menerus);
- mengonsumsi suplemen makanan dan mineral kompleks dengan kandungan kalium tinggi;
- gangguan metabolisme kalium;
- keadaan kekurangan insulitis;
- gangguan fungsi ginjal, termasuk gagal ginjal;
- disfungsi sistem simpatoadrenal, dll.
Gejala kelebihan kalium:
- gugup, hiperaktif, peningkatan kecemasan, berkeringat;
- kelemahan otot dan gangguan neuromuskular lainnya;
- distonia neurosirkulasi;
- aritmia;
- disfungsi usus (kolik di usus kecil);
- kelumpuhan otot rangka;
- peningkatan diuresis;
- peningkatan risiko terkena diabetes.








