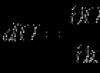Në kimi, koncepti i "masës molekulare" është jashtëzakonisht i rëndësishëm. Masa molekulare shpesh ngatërrohet me masën molare. Si ndryshojnë këto sasi dhe çfarë vetish kanë ato?
Pesha molekulare
Atomet dhe molekulat - grimca të vogla ndonjë kimikatet A. Nëse përpiqeni të shprehni masën e tyre në gram, do të merrni një numër në të cilin do të ketë rreth 20 zero para presjes dhjetore. Prandaj, matja e masës në njësi të tilla si gram është e papërshtatshme. Për të dalë nga kjo situatë, disa shumë masë e ulët marrë si një, dhe të gjitha masat e tjera të shprehura në lidhje me të. Kjo njësi është 1/12 e masës së një atomi karboni.
Masa molekulare relative është masa e një molekule të një substance, e matur në njësi të masës atomike. Masa molekulare është e barabartë me raportin e masës së një molekule të një substance me 1/12 e masës së një atomi karboni. Tregon sa herë është masa e molekulës një substancë të caktuar më shumë se 1/12 e masës së një atomi karboni.

Oriz. 1. Tabela e peshës molekulare lëndë organike.
Njësi atomike masa (a.m.u.) është e barabartë me 1,66 * 10 me fuqinë -24 dhe përfaqëson 1/12 e masës së një atomi karboni, domethënë një atom të një izotopi të elementit karbon, numri i masës së të cilit është 12. Një element kimik në natyra mund të ketë disa izotope të qëndrueshme, prandaj, kur flitet për masën atomike relative të një elementi ose, siç thuhet shpesh, masën atomike të elementit A, duhet të merret parasysh masa atomike e të gjithë nuklideve të qëndrueshme.
Masa molekulare shpesh ngatërrohet me masën molare, njësia e së cilës është g/mol. Dhe me të vërtetë, numerikisht këto dy sasi janë absolutisht identike, por dimensionet e tyre janë krejtësisht të ndryshme.
Masa molekulare relative mund të gjendet duke mbledhur masat atomike
Për të llogaritur masën molekulare të substancave të thjeshta dhe komplekse, është e nevojshme të gjendet shuma e masave atomike relative të atomeve që përbëjnë molekulën. Për shembull, pesha molekulare relative e ujit Mr (H 2 O), i cili, siç dihet, përbëhet nga dy atome hidrogjeni dhe një atom oksigjeni, është e barabartë me 1*2+16=18.
Kjo do të thotë se masa e një molekule uji është 18 herë më e madhe se 1/12 e masës së një atomi karboni. Dhe pesha molekulare e ajrit është 29.

Oriz. 2. Formula e peshës molekulare relative.
Masa atomike
Masa atomike e një elementi kimik është gjithashtu një nga emërtimet më të rëndësishme në kimi. Masa atomike është vlera mesatare nga masa të qëndrueshme atomike izotopet natyrore të këtij elementi, duke marrë parasysh përmbajtjen e tyre relative në natyrë (përhapjen e tyre natyrore). Kështu, në natyrë ekzistojnë dy izotope të qëndrueshme të elementit klori Cl me numra masiv 35 dhe 37:
Ar(Cl)=(34,97*0,7553)+(36,95*0,2447)=35,45 – kjo është vlera e miratuar për elementin klor si masë atomike relative të tij.
Llogaritjet e para të peshave atomike u bënë nga D. Dalton. Ai lidhi peshat atomike të elementeve me peshën atomike të hidrogjenit, duke e marrë atë si unitet. Sidoqoftë, peshat e atomit të oksigjenit dhe disa elementëve të tjerë të llogaritur në përputhje me parimin e tij të "thjeshtësisë më të madhe" rezultuan të pasakta.

Oriz. 3. D. Dalton.
Masat e vërteta atomike janë të vogla. Një atom hidrogjeni peshon 1,674 * 10 deri në gram -24, një atom oksigjeni peshon 26,67 * 10 deri në -24 gram, dhe një atom karboni peshon 19,993 * 10 deri në gram -24.
Kimia. (I gjithë kursi shkollor në diagrame dhe tabela) Barabbas N.E.

M.: 20 1 4. - 2 40 s.
I gjithë kursi shkollor në kimi është paraqitur në formën e diagrameve logjike dhe tabelave informuese. Një prezantim vizual, i qartë dhe skematik i materialit ju lejon të asimiloni shpejt një sasi të madhe informacioni, të lehtësoni kuptimin e ligjeve, koncepteve, përkufizimeve komplekse, të përgjithësoni dhe sistematizoni njohuritë. Publikimi do t'i ndihmojë studentët të përgatiten në mënyrë efektive për dhënien e Provimit të Unifikuar të Shtetit në kimi.
Formati: pdf
Madhësia: 7.6 MB
Shikoni, shkarkoni:drive.google
përmbajtja
1. BAZAT TEORIKE TË KIMISË
1.1. Elementi kimik 8
1.1.1. Përfaqësimet moderne për strukturën e atomit. Struktura e predhave elektronike të atomeve
elementet e katër periudhave të para: s-, p- dhe d-elementet. Konfigurimi elektronik i një atomi. Gjendjet tokësore dhe të ngacmuara të atomeve 8
1.1.2. Ligji periodik dhe Tabela periodike elementet kimike D. I. Mendeleev.
Rrezet atomike, të tyre ndryshime periodike në një sistem elementesh kimike. Modelet e ndryshimeve në vetitë kimike të elementeve dhe përbërjeve të tyre sipas periudhave dhe grupeve 30
1.2. Lidhja kimike dhe struktura e materies 33
1.2.1. Lidhja kimike kovalente, varietetet e saj (polare dhe jopolare), mekanizmat e formimit. Karakteristikat lidhje kovalente(gjatësia dhe energjia e lidhjes). Lidhja jonike. Lidhje metalike. Lidhja hidrogjenore 33
1.2.2. Elektronegativiteti. Gjendja e oksidimit dhe valenca e elementeve kimike 40
1.2.3. Substancat molekulare dhe strukturë jo molekulare. Varësia e vetive të substancave nga veçoritë e rrjetës së tyre kristalore 41
1.3. Jo kimia organike 45
1.3.1. Klasifikimi dhe nomenklatura substancave inorganike 45
1.3.2. Karakteristikat e përgjithshme metalet e nëngrupeve kryesore grupet I-III në lidhje me pozicionin e tyre në tabelën periodike të elementeve kimike të D. I. Mendeleev dhe tiparet strukturore të atomeve të tyre 46
1.3.3. Karakteristike elementet e tranzicionit- bakri, zinku, kromi, hekuri - sipas pozicionit të tyre në Tabelën Periodike të Elementeve Kimike të D.I. dhe veçorive strukturore të atomeve të tyre 47
1.3.4. Karakteristikat e përgjithshme të jometaleve të nëngrupeve kryesore të grupeve IV-VII në lidhje me pozicionin e tyre në Tabelën Periodike të Elementeve Kimike të D.I. dhe veçoritë strukturore të atomeve të tyre 49
1.3.5. Karakteristike vetitë kimike substanca të thjeshta - metale: alkali, tokë alkaline, alumin, metale kalimtare (bakër, zink, krom, hekur) 53
1.3.6. Vetitë kimike karakteristike të substancave të thjeshta - jometaleve: hidrogjen, halogjene, oksigjen, squfur, azot, fosfor, karbon, silic 71
1.3.7. Vetitë kimike karakteristike të oksideve: bazike, amfoterike, acidike 106
1.3.8. Vetitë kimike karakteristike të bazave dhe hidroksidet amfoterike 109
1.3.9. Vetitë kimike karakteristike të acideve 113
1.3.10. Vetitë kimike karakteristike të kripërave: të mesme, acidike, bazike; komplekse (duke përdorur shembullin e komponimeve të aluminit dhe zinkut). . . 118
1.4. Kimi Organike 128
1.4.1. Teoria e strukturës komponimet organike. Izomerizmi - strukturor dhe hapësinor. Homologë dhe seri homologe 128
1.4.2. Llojet e lidhjeve në molekulat e substancave organike. Hibridizimi i orbitaleve atomike të karbonit. Radikale. Grupi funksional 133
1.4.3. Klasifikimi dhe nomenklatura e përbërjeve organike 135
1.4.4. Vetitë kimike karakteristike të hidrokarbureve: alkanet, cikloalkanet, alkenet, dienet, alkinet 138
1.4.5. Vetitë kimike karakteristike hidrokarburet aromatike: benzen dhe toluen 148
1.4.6. Vetitë kimike karakteristike të alkooleve të ngopura monohidrike dhe polihidrike; fenol 152
1.4.7. Vetitë kimike karakteristike të aldehideve, acideve karboksilike të ngopura, estereve 157
1.4.8. Vetitë kimike karakteristike të përbërjeve organike që përmbajnë azot: aminat dhe aminoacidet 163
1.4.9. Substancat biologjikisht të rëndësishme: yndyrnat, proteinat, karbohidratet (monosakaridet, disaharidet, polisaharidet) 166
1.5. Reaksioni kimik 172
1.5.1. Klasifikimi i reaksioneve kimike në kiminë inorganike dhe organike 172
1.5.2. Efekti termik i një reaksioni kimik. Ekuacionet termokimike 174
1.5.3. Shpejtësia e reagimit, varësia e saj nga faktorë të ndryshëm 175
1.5.4. Reaksionet kimike të kthyeshme dhe të pakthyeshme. Ekuilibri kimik. Zhvendosja e ekuilibrit kimik nën ndikimin e faktorëve të ndryshëm 177
1.5.5. Shpërbërja elektrolitike e elektroliteve në tretësirat ujore. Elektrolite të forta dhe të dobëta 179
1.5.6. Reaksionet e shkëmbimit të joneve 182
1.5.7. Hidroliza e kripërave. e mërkurë tretësirat ujore: acid, neutral, alkalik 183
1.5.8. Reaksionet redoks. Korrozioni i metaleve dhe metodat e mbrojtjes ndaj tij. . 185
1.5.9. Elektroliza e shkrirjeve dhe tretësirave (kripëra, alkale, acide) 188
1.5.10. Mekanizmat e reaksioneve të zëvendësimit dhe të shtimit në kiminë organike. Rregulli i V.V. Markovnikov 189
1.5.11. Reagimet që konfirmojnë marrëdhënien klasa të ndryshme 191
2. METODAT E NJOHJES SË SUBSTANCAVE DHE REAKSIONET KIMIKE
2.1. Bazat eksperimentale të kimisë 193
2.1.1. Rregullat e punës në laborator. Rregullat e sigurisë kur punoni me substanca dhe produkte kaustike, të ndezshme dhe toksike kimikate shtëpiake 193
2.1.2. Metodat shkencore hulumtimi i substancave kimike dhe i transformimeve. Metodat për ndarjen e përzierjeve dhe substancave të pastrimit 195
2.1.3. Përcaktimi i natyrës së mjedisit të tretësirave ujore të substancave. Treguesit 196
2.1.4. Reaksionet cilësore ndaj substancave dhe joneve inorganike. Identifikimi i përbërjeve organike 196
2.2. Metodat e përgjithshme marrja e substancave 203
2.2.1. Metodat e përgjithshme të marrjes së metaleve. Gjeneral parimet shkencore prodhimi kimik (duke përdorur shembullin e prodhimit industrial të amoniakut, acidit sulfurik, metanolit) 204
2.2.2. Burimet natyrore dhe përpunimi i hidrokarbureve 207
2.2.3. Komponimet me peshë të lartë molekulare. Reaksionet e polimerizimit dhe polikondensimit. Polimere. Plastika, fibra, goma 209
2.2.4. Reaksionet që karakterizojnë vetitë themelore dhe metodat e marrjes së 212
2.3. Llogaritjet duke përdorur formulat kimike dhe ekuacionet e reaksionit 217
2.3.1. Llogaritja e masës së një lënde të tretur që përmbahet në një masë të caktuar të një tretësire me një pjesë të njohur të masës 224
2.3.2. Llogaritjet: raportet vëllimore të gazeve në reaksionet kimike 225
2.3.3. Llogaritja e masës së një substance ose vëllimit të gazeve nga një sasi e njohur e një lënde, masë ose vëllim të një prej substancave që marrin pjesë në reaksion 226
2.3.4. Llogaritja e efektit termik të reaksionit 229
2.3.5. Llogaritja e masës (vëllimit, sasisë së substancës) të produkteve të reaksionit, nëse njëra nga substancat jepet me tepricë (ka papastërti) 231
2.3.6. Llogaritja e masës (vëllimit, sasisë së substancës) të produktit të reaksionit, nëse njëra nga substancat jepet në formën e tretësirës me një pjesë të caktuar të masës së substancës së tretur 233
2.3.7. Gjetja e formulës molekulare të një lënde. 234
2.3.8. Llogaritja e masës ose fraksion vëllimor rendimenti i produktit të reaksionit nga teorikisht e mundshme 236
2.3.9. Llogaritja e pjesës masive (masës) përbërje kimike në përzierje 238
Transkripti
1 E.V. Savinkina G.P. Loginova KIMIA NË TABELA DHE DIAGRAME Klasat manuale të referencës Shtëpia botuese AST Moskë
2 UDC 373:54 BBK 24ya721 C13 C13 Savinkina, Elena Vladimirovna. Kimia në tabela dhe diagrame: manual referimi: klasa / E.V. Savinkina, G.P. Loginova. Moskë: Shtëpia Botuese AST, (1) f. ISBN (Shtëpia Botuese AST LLC) (E re kurrikula shkollore) ISBN (Shtëpia Botuese AST SH.PK) (Përgatitja për Provimin e Unifikuar të Shtetit) Libri i referencës paraqet një kurs shkollor të kimisë në formën e diagrameve dhe tabelave të arritshme. Prezantimi vizual, i thjeshtë dhe i përshtatshëm i materialit kontribuon në asimilimin dhe memorizimin më të mirë të tij. Libri do të ofrojë ndihmë efektive në studimin dhe rishikimin e temave të së kaluarës, si dhe në përgatitjen për provimin e unifikuar të shtetit në kursin e kimisë. Mësuesit e kimisë mund ta përdorin në mësime si a diagramet e referencës. UDC 373:54 BBK 24ya721 ISBN (Shtëpia Botuese AST LLC) (Programi i ri shkollor) ISBN (Shtëpia Botuese AST LLC) (Përgatitja për provimin e unifikuar të shtetit) Savinkina E.V., Loginova G.P. LLC "Shtëpia Botuese AST"
3 PËRMBAJTJA Parathënie BAZAT TEORIKE TË KIMISË Struktura e atomit Tabela 1. Atomi Tabela 2. Parimet themelore teoria kuantike struktura atomike Tabela 3. Nivelet e energjisë dhe nënnivelet Skema 1. Format e orbitaleve Tabela 4. Rregullat për mbushjen e orbitaleve atomike (në gjendjen bazë të atomit) Skema 2. Sekuenca e mbushjes AO me elektrone Tabela 5. Blloqet e elementeve Tabela 6. Konfigurimet elektronike atomet neutrale në gjendjen bazë për elementet e katër periudhave të para Ligji periodik D.I. Mendeleev Tabela 7. Numrat e periudhave dhe grupeve Tabela 8. Modelet e ndryshimeve në vetitë në grupe Tabela 9. Modelet e ndryshimeve në vetitë në periudha Tabela 10. Ndryshimet në përbërjen dhe vetitë e komponimeve të hidrogjenit, oksidet më të larta dhe hidroksidet e elementeve të Periudha e tretë e sistemit periodik
4 4 Lidhjet kimike Tabela 11. Llojet lidhje kimike Tabela 12. Përshkrimi i një lidhjeje kovalente Tabela 13. Mekanizmat e formimit të një lidhjeje kovalente Tabela 14. Skema e lidhjeve të shumëfishta 3. Orbitalet e mbivendosura Tabela 15. Formulat e molekulave Tabela 16. Parametrat e një lidhjeje kimike Tabela 17. Valenca. Gjendja e oksidimit Tabela 18. Përcaktimi i gjendjes së oksidimit Tabela 19. Llojet grila kristalore Klasifikimi i reaksioneve kimike Tabela 20. Klasifikimi sipas ndryshimit të përbërjes së substancave Tabela 21. Klasifikimi sipas gjendja e grumbullimit substanca Tabela 22. Klasifikimi në bazë të kthyeshmërisë Tabela 23. Klasifikimi i bazuar në efekt termik Shpejtësia e reaksionit kimik Tabela 24. Sasitë bazë Tabela 25. Varësia e shpejtësisë së reaksionit nga përqendrimi Tabela 26. Ndryshimi në shpejtësinë e reaksionit kimik Tabela e ekuilibrit kimik 27. Parimi i Le Chatelier Tabela 28. Zhvendosja e ekuilibrit kimik Disociimi elektrolitik i produkteve të tabelës29.
5 Tabela 30. Disa acide të forta dhe bazat Tabela 31. Shkalla e disociimit Reaksionet e këmbimit në tretësirë Tabela 32. Rregullat e Berthollet Tabela 33. Molekulare dhe ekuacionet jonike Hidroliza Tabela 34. Hidroliza e substancave inorganike Tabela 35. Hidroliza e kthyeshme e kripërave Tabela 36. Medium në tretësirë kripërat e acidit Reaksionet redoks Tabela 37. Funksionet e një agjenti oksidues dhe një agjenti reduktues Tabela 38. Format e oksiduara dhe të reduktuara të disa substancave Tabela 39. Llojet e reaksioneve redoks Tabela 40. Seritë e tensionit elektrokimik të metaleve Tabela 41. Një seri jometalesh Tabela 42 Shembuj të agjentëve oksidues dhe reduktues Tabela 43. Metoda bilanc elektronik Tabela 44. Inhibimi i korrozionit Elektroliza Tabela 45. Elektrodat Tabela 46. Elektroliza e shkrirjeve Tabela 47. Elektroliza e tretesirave Mekanizmat e reaksionit ne kimine organike Tabela 48. Mekanizmat baze te reaksionit
6 Tabela 49. Mekanizmi i reaksionit të zëvendësimit Tabela 50. Rregulla e Markovnikovit KIMIA INORGANIKE Klasat e substancave inorganike Tabela 51. Substancat inorganike Tabela 52. Substancat e thjeshta Tabela 53. Pozicioni i jometaleve në sistemin periodik të elementeve Tabela5 Komplekset5. Orto- dhe metaforat e hidroksideve Tabela 56. Emra të parëndësishëm disa acide që përmbajnë oksigjen dhe anionet e tyre Tabela 57. Klasifikimi i hidroksideve dhe oksideve Tabela 58. Klasifikimi i kripërave Skema 4. Klasifikimi i përgjithshëm substancat inorganike Metalet Tabela 59. Reaksionet e metaleve Jometalet Tabela 60. Reaksionet e jometaleve Oksidet Tabela 61. Reaksionet oksidet bazë Tabela 62. Reaksionet oksidet e acidit Tabela 63. Reaksionet oksidet amfoterike Bazat dhe hidroksidet amfoterike Tabela 64. Reaksionet e bazave Tabela 65. Reaksionet e hidroksideve amfoterike
7 Acidet Tabela 66. Reaksionet e acideve Tabela 67. Produktet e reduktimit në tretësirat ujore të anioneve të acideve oksiduese (nitrik dhe sulfurik të koncentruar) me metale të ndryshme Kripërat Tabela 68. Reaksionet e kripërave mesatare Tabela 69. Reaksionet e kripërave acidike Tabela 70. kripërat bazë Tabela 71. Reaksionet e kripërave komplekse (komplekset hidroksore) Tabela 72. Zbërthimi i nitrateve (në varësi të pozicionit të metaleve në serinë e sforcimeve) Tabela 73. Zbërthimi i kripërave të amonit Marrëdhënia ndërmjet klasave të substancave inorganike Tabela 74. Transformimet e substancave inorganike KIMIA ORGANIKE Struktura e substancave organike Tabela 75. Teoria e strukturës së substancave organike A. M. Butlerov Tabela 76. Llojet e përbërjeve organike Tabela 77. Lidhjet karbon-karbon Tabela 78. Atomi i karbonit Tabela 79. Llojet e hibridizimit Tabela 80. Përbërja molekulat organike Tabela 81. Klasat e përbërjeve organike.. 73 Tabela 82. Izomeret Tabela 83. Ndikimi i ndërsjellë atomet në molekula
8 8 Nomenklatura e substancave organike Tabela 84. Përbërësit e emrave të përbërjeve organike Tabela 85. Emrat e vargjeve karbonike Tabela 86. Përcaktimi i shkallës së ngopjes së lidhjeve Tabela 87. Emrat e grupeve karakteristike të përbërjeve organike Tabela 88. Emrat e disa komponimet aromatike Tabela 89. Emrat e disave radikalet hidrokarbure Tabela 90. Parashtesa numerike (tregoni numrin e identikeve elementet strukturore) Tabela 91. Hartimi i emrit te nje substance Hidrokarburet Tabela 92. Klasifikimi i hidrokarbureve Tabela 93. Reaksionet e hidrokarbureve te ngopura Tabela 94. Reaksionet hidrokarburet e pangopura Tabela 95. Reaksionet e hidrokarbureve aromatike Tabela 96. Reaksionet e hagalenakanit Komponimet organike që përmbajnë oksigjen Tabela 97. Alkoolet dhe fenolet Tabela 98. Reaksionet e alkooleve dhe fenoleve Tabela 99. Përbërjet karbonike Tabela 100. Reaksionet e aldeboneve10. Tabela 102. Reaksionet e acidit karbonik Komponimet organike që përmbajnë azot Tabela 103. Aminet Tabela 104. Reaksionet e amineve
9 Tabela 105. Emrat e disave aminoacide natyrale Tabela 106. Vetitë e aminoacideve Substancat biologjikisht të rëndësishme Skema 5. Yndyrnat Tabela 107. Acidet karboksilike që përbëjnë yndyrnat Tabela 108. Karbohidratet Tabela 109. Nivelet e strukturës së molekulave të proteinave Tabela 110. Vetitë kimike të reaksionit të proteinave Tabela e proteinave Tabela 111. Ndërlidhja e përbërjeve organike Tabela 112 Katalizatorët e përdorur në kiminë organike Skema 6. Lidhja gjenetike komponimet organike METODAT E NJOHURIVE NË KIMI Puna me substanca dhe pajisje kimike Tabela 113. Rregullat themelore për punën në laborator kimik Tabela 114. Enët dhe pajisjet kimike të qelqit Tabela 115. Teknikat themelore të punës në një laborator kimik Tabela 116. Rregullat e përdorimit të substancave në jetën e përditshme Metodat shkencore për studimin e kimikateve dhe transformimeve Tabela 117. Metodat e kërkimit Tabela 118. Metodat për ndarjen e përzierjeve
10 Tabela 119. Ngjyrosja e treguesve Tabela 120. Reaksionet cilësore ndaj kationeve Tabela 121. Reaksionet cilësore ndaj anioneve Tabela 122. Zbulimi i gazeve Tabela 123. Njohja e përbërjeve organike Metodat e përftimit të substancave Tabela 124. Metoda e përftimit të substancave2 të thjeshta5. për marrjen e oksideve Tabela 126. Metodat për prodhimin e bazave dhe hidroksideve amfoterike Tabela 127. Metodat për prodhimin e acideve Tabela 128. Metodat për prodhimin e kripërave Tabela 129. Metodat për prodhimin e hidrokarbureve të ngopura Tabela 130. Met. e alkeneve Tabela 131. Metodat e prodhimit të alkineve (acetileni) Tabela 132. Metodat për prodhimin e areneve (benzenit) Tabela 133. Metodat e përftimit alkoolet monohidrike Tabela 134. Metodat e marrjes alkoolet polihidrike Tabela 135. Metodat për prodhimin e fenoleve Tabela 136. Metodat për prodhimin e aldehideve dhe ketoneve Tabela 137. Metodat për prodhimin e acideve karboksilike Prodhim industrial substanca Tabela 138. Metodat për prodhimin e metaleve Tabela 139. Metodat metalurgjike Skema 7. Procesi i furrës së zjarrit
11 Tabela 140. Disa procese industriale Tabela 141. Produktet e distilimit fraksional të naftës Tabela 142. Rafinimi kimik i naftës Tabela 143. Prodhimi komponimet me peshë të lartë molekulare(polimere) Tabela 144. Klasifikimi i polimereve Tabela 145. Polimeret ne baze te etilenit dhe derivateve te tij Llogaritjet duke perdorur formulat kimike dhe ekuacionet e reaksionit Tabela 146. Marredheniet midis sasive ne tretesire Tabela 147. Pergatitja e tretesirave Tabela 148. Llogaritjet me te rendesishme per sasite 149. Marrëdhëniet ndërmjet vlerave Normale kushtet fizike Tabela 150. Ligjet stoikiometrike Tabela 151. Llogaritjet duke përdorur ekuacionet e reaksionit Tabela 152. Gjetja e formulës molekulare të një lënde SHTOJCA Tabela 1. Tabela periodike e elementeve D.I. Mendeleev Tabela 2. Elementet kimike: numri atomik, masë atomike(i rrumbullakosur), elektronegativiteti Tabela 3. Tretshmëria komponimet inorganike në ujë
12 PARATHËNIE Në ndihmë të nxënësve dhe mësuesve ofrohet një manual, i cili paraqet një paraqitje të përgjithësuar në tabela dhe diagrame vizuale të të gjitha rregullave, ligjeve, formulave dhe llogaritjeve bazë për lëndën e kimisë organike dhe inorganike. Përfshihen të gjitha fushat kryesore të kimisë që mësohen në klasë. Kjo është struktura e atomit, ligji periodik i D.I Mendeleev, struktura e sistemit periodik të elementeve kimike, llojet e lidhjeve kimike, substancat dhe përzierjet, klasat e përbërjeve inorganike, klasifikimi i reaksioneve kimike, shpejtësia e reaksioneve kimike dhe kimike. ekuilibri, mekanizmat e reagimit në kiminë organike, metalet dhe jometalet dhe vetitë e tyre, vetitë kimike të substancave komplekse, marrëdhëniet midis klasave të substancave inorganike, substancave organike dhe strukturës së tyre, përbërja e molekulave organike, izomereve, nomenklatura e substancave organike, hidrokarburet, klasifikimi dhe vetitë e tyre, komponimet organike që përmbajnë azot, substancat biologjikisht të rëndësishme, struktura dhe vetitë e molekulave të proteinave, karbohidratet, marrëdhënia e përbërjeve organike. Për më tepër, manuali përshkruan rregullat dhe metodat themelore të punës në një laborator kimik, jep karakteristikat e kimikateve
13 anije dhe pajisje, jep shembuj të llogaritjeve të bazuara në formula dhe ekuacione të reagimit, si dhe shembuj reagimet cilësore. Shtojca e manualit përmban tabelën periodike të elementeve të D.I Mendeleev dhe një tabelë të tretshmërisë së përbërjeve inorganike në ujë. Një prezantim i shkurtër dhe i përmbledhur i materialit do t'i ndihmojë studentët në mënyrë të pavarur ose me ndihmën e një mësuesi të përsërisin kursin e tyre të kimisë në shkollë dhe të përgatiten me sukses për provimin e unifikuar të shtetit në klasën 11. Struktura e manualit korrespondon me strukturën e kodifikuesit të elementeve të përmbajtjes në kimi për përpilimin e matjes së kontrollit Materialet e Provimit të Unifikuar të Shtetit dhe i përgjigjet logjikës së të mësuarit dhe përsëritjes kursi shkollor kimisë. Në manual përdoren shkurtesat e mëposhtme: përmbledhje. tretësirë e përqendruar, n. u. në kushte normale, shume mire div. zgjidhje shumë e holluar, praktikisht praktike, diss. tretësirë e holluar, teorike teorike.
14 BAZAT TEORIKE TË STRUKTURËS SË KIMISË TË ATOMIT Tabela 1 Elektrone (e) Protonet e bërthamës (p +) neutronet (n 0) Numri i masës (A) numri i përgjithshëm protonet dhe neutronet në bërthamën atomike Ngarkesa e bërthamës atomike (Z) e barabartë me numrin protonet në bërthamë dhe numri i elektroneve në atom A = N(n 0) + N(р +) Z = N(р +) = N(e) Tabela 2 Dispozitat themelore të teorisë kuantike të diskretitetit të strukturës atomike të energjia e elektronit natyra e dyfishtë (valë-korpuskulare) e pamundësisë së elektronit për të përcaktuar trajektoren e elektroneve (parimi i pasigurisë) 14
15 Nivelet dhe nënnivelet e energjisë Tabela 3 Nivelet e energjisë (EL) Nënnivelet e energjisë (ESU) Numri i elektroneve 1 1s 2 2 2s 2p 3 3s 3p 3d 4 4s 4p 4d 4f Orbitale atomike(AO) karakterizon rajonin e hapësirës në të cilin probabiliteti që një elektron të ketë një energji të caktuar është më i madhi. Format orbitale Skema 1 s-orbitale p-orbitale 15
Provimi i Unifikuar i Shtetit në KIMI, identifikues i elementeve të përmbajtjes dhe kërkesave për nivelin e formimit të maturantëve organizatat arsimore për të kryer një të unifikuar provimin e shtetit në kimi
Përmbajtja Parathënia e redaktorit... 3 Hyrje... 5 Pjesa I. BAZAT E KIMISË TË PËRGJITHSHME Seksioni 1. Konceptet dhe ligjet themelore të kimisë 1.1. Përkufizimi dhe lënda e kimisë...9 1.2. Informacioni fillestar për strukturën e atomeve.
REZULTATET E PROVIMIT TË UNIFIKUAR SHTETËROR NË KIMI (11 Qershor 2009) Korolev 2009 1 Përmbajtja Rezultatet kryesore të provimit të kimisë 2009 3 Struktura e punimit provues.4 Shpërndarja e detyrave
Provimi i Unifikuar i Shtetit në KIMI Specifikimi i testeve materialet matëse Provimi i unifikuar shtetëror 00 në kimi i përgatitur nga Shteti Federal institucioni shkencor
MINISTRIA E ARSIMIT DHE SHKENCËS E FEDERATËS RUSE Buxheti federal i shtetit institucioni arsimor më të larta arsimi profesional"Shteti Humanitar dhe Teknologjik i Kaukazit të Veriut
Ministria e Arsimit dhe Shkencës Federata Ruse INSTITUCIONI ARSIMOR BUXHETAR FEDERAL I ARSIMIT TË LARTË PROFESIONAL "UNIVERSITET SHTETËROR TEKNOLOGJIK SIBERIAN"
PROGRAMI I TESTIT HYRËS NË KIMI Programi i kimisë për ata që hyjnë në universitet përbëhet nga katër pjesë. Pjesa e parë paraqet kryesoren konceptet teorike kimia që duhet
PËRMBAJTJA PROGRAMORE Pjesa 1. Elementi kimik Tema 1. Struktura e atomeve. Ligji periodik dhe sistemi periodik i elementeve kimike D.I. Mendelejevi. Idetë moderne për strukturën e atomeve.
ÓÄÊ 373.167.1:54 ÁÁÊ 24ÿ7 Ì 55 Ì 55 Måkîkova O. Â. ÅÃÝ. Fjalë kyçe: sinonime zyrtare / O.V. Makova. M. : ßóçà-ïråsñ, 2013. 352 f. (fjalë në anglisht). ISBN 978-5-99550-658-4
BILETA PER KLASAT 10-11 KIMIA. BILETA 1 1. Ligji periodik dhe sistemi periodik i elementeve kimike D.I. Mendeleev bazuar në idetë për strukturën e atomeve. Rëndësia e ligjit periodik për
Bileta 1 1. Ligji periodik dhe sistemi periodik i elementeve kimike të D.I Mendeleev bazuar në idetë për strukturën e atomeve. Kuptimi ligji periodik për zhvillimin e shkencës. 2. Hidrokarburet e ngopura,
Autonome Komunale institucioni arsimor Mesatarja e qytetit të Kaliningradit shkolla e mesme 38 KONSIDERUAR në mbledhjen e Rajonit të Moskës, procesverbali "9" gusht 06 "PAKONI" në mbledhjen e protokollit të PS
Raport për kryerjen e një provimi provues në kimi në rrethin Krasnogvardeisky të Shën Petersburgut 1. Struktura e punës Çdo version i veprës përbëhet nga tre pjesë dhe përfshin 43 detyra. Pjesa 1 përmban
PROJEKTI Gjith-rus punë testuese në KIMI PËRSHKRIMI I PUNËS TË TESTIMIT TË GJITHËRUSË NË KIMIA Klasa 11 e përgatitur nga Institucioni Shkencor Federal i Buxhetit të Shtetit "INSTITUTI FEDERAL
STANDARD I ARSIMIT TË PËRGJITHSHËM TË MESËM (TË PLOTË) NË KIMI NIVEL BAZË Studimi i kimisë në nivelin bazë të mesëm (i plotë) arsimi i përgjithshëm ka për qëllim arritjen e qëllimeve të mëposhtme: zotërimin e njohurive
Pyetje për certifikimi i ndërmjetëm në kimi në klasat 10-11 për 2012-2013 viti akademik Libër mësuesi G.E., Rudzitis, F.G Feldman "Klasa e kimisë 10", "Klasa e kimisë 11" Moskë 2010 1. Ligji periodik dhe periodik.
Shënim shpjegues Programi i punës në kimi përpilohet në bazë të: komponentës federale të shtetit standardi arsimor arsimi i mesëm (i plotë) i përgjithshëm. M.: "Iluminizmi" 2004,
TEORIA PROGRAMORE E KIMISË E STRUKTURËS SË LËNDËS. LIGJET THEMELORE TË KIMIS Teoria e strukturës së materies Atomi. Molekula. Element kimik. Substanca. molekulare dhe formulat strukturore. Kompleksi bërthamat atomike. Struktura
Menaxheri i "MIRATUAR". Shërbimi Federal për mbikëqyrjen në fushën e arsimit dhe shkencës “PAKONI” Kryetar i Këshillit Metodologjik Shkencor të FIPI në Kimi Provimi i Unifikuar i Shtetit në KIMI SPECIFIKIMI
PROGRAMI I PROVIMIT HYRJES NË KIMIA Një aplikant në universitet duhet të demonstrojë njohuri të elementeve bazë dispozitat teorike kimia si një nga më të rëndësishmet shkencat natyrore, të cilat qëndrojnë në themel të kuptuarit shkencor
Skica e një përmbledhjeje mbi temën Alkanet (hidrokarburet e ngopura ose të ngopura, parafinat) Mbiemri, emri, grupi Alkanet është për të shkruar përkufizimin Seri homologe alkanet: bëni një tabelë me dhjetë përfaqësuesit e parë
E planifikuar rezultatet e lëndës zhvillimin lëndë akademike Si rezultat i studimit të kimisë në nivelin bazë, studenti duhet të dijë/të kuptojë më të rëndësishmen konceptet kimike: substancë, element kimik, atom,
Departamenti i Arsimit i Institucionit Arsimor Autonom Komunal të Qarkut Artemovsk të Rrethit të Qytetit Artemovsk "Shkolla e mesme e përgjithshme 56 me studim të thelluar
KIMI, klasa Specifikimi i materialeve matëse kontrolli për kryerjen e provimit të unifikuar të shtetit në KIMIA në vitin 0 Provim i unifikuar i shtetit në KIMI Specifikimi i materialeve matëse të kontrollit
Kimi 10 klasa e 11 FC GOS ( niveli bazë) Përmbajtja kryesore e lëndës akademike Metodat e njohurive në kimi Metodat shkencore të njohjes së substancave dhe dukurive kimike. Roli i eksperimentit dhe teorisë në kimi. Modelimi
KIMI, klasa Specifikimi i materialeve matëse kontrolli për kryerjen e provimit të unifikuar të shtetit në KIMIA në vitin 0 Provim i unifikuar i shtetit në KIMI Specifikimi i materialeve matëse të kontrollit
KIMIA, klasa Provim i Unifikuar Shtetëror në KIMI Specifikimi i materialeve matëse të kontrollit për kryerjen e Provimit të Unifikuar të Shtetit në Kimi në vitin 0 është përgatitur nga Shteti Federal
Departamenti i Arsimit i Qytetit të Moskës Institucioni arsimor profesional buxhetor shtetëror i qytetit të Moskës "KOLEGJI AUTOMOBILE DHE RRUGOR MOSKË IM. A.A.NIKOLAEV" PROGRAMI I PUNËS
Analiza HSC Lënda Kimi. Klasa e 8 paralele Tema e kontrollit: “Konceptet fillestare kimike” Data: Nëntor 2014 8A/1 18 5 8 5 0 100% 72% 4.0 8B/1 15 0 8 6 1 93% 53% 3.5 8B/1 21 1 1 1 %
RAPORT ANALITIK I KOMISIONIT SUBJEKT PËR REZULTATET E PËRDORIMIT NË KIMI 1 Raporti është përgatitur nga A.N Levkin, nënkryetar i komisionit lëndor në kimi 2 1. PËRGATITJA PËR SHTETIN E UNIFIKUAR.
Shënim shpjegues Programi i punës është përpiluar në bazë të komponentit federal të Standardit shtetëror të arsimit të mesëm (të plotë) të përgjithshëm në kimi (niveli bazë), përdoret programi
PROGRAM testi i hyrjes në kimi për shtetas të huaj Aplikantët për programet universitare dhe të specializuara Programi është i destinuar për aplikantët në fushat e mëposhtme:
Shkenca atomike-molekulare. Molekulat. Atomet. Element kimik, substancë e thjeshtë, kompleks. Shenjat e elementeve kimike dhe formulat kimike. Llogaritja e pjesës masive të një elementi kimik në një substancë
Shtojca 10 e Urdhrit 311/1 të datës 28 gusht 2015 “Për miratimin e programeve të arsimit të përgjithshëm bazë të arsimit bazë të përgjithshëm (SHPSF), arsimit të përgjithshëm bazë, arsimit të mesëm të përgjithshëm”.
Kimia 1. Konceptet themelore kimike. Lënda e kimisë. Trupat dhe substancat. Metodat themelore të njohjes: vëzhgim, matje, përshkrim, eksperiment. Fizike dhe dukuritë kimike. Rregullat e sigurisë
1 Shënim shpjegues Ky program zhvilluar në bazë të Shembuj të programeve arsimi bazë i përgjithshëm në kimi (niveli bazë), që korrespondon me komponentin federal standard shtetëror
Planifikimi kalendar dhe tematik Lënda: kimi Klasa: 11 Orë në javë: 2 Orë totale në vit: 68 tremujori I. Javët totale: 10.6, orët totale: 22. p/p Seksioni. Tema e mësimit Tema 1. Struktura dhe periodiciteti atomike
PROGRAMI I KIMISË Programi hartohet në bazë të përmbajtjes minimale të detyrueshme të arsimit të mesëm (të plotë) të përgjithshëm dhe përbëhet nga tre seksione. Pjesa e parë i kushtohet bazat teorike kimisë. NË
2 Specifikimi i materialeve matëse të kontrollit për Provimin e Bashkuar të Shtetit në KIMI 2016 Provimi i Unifikuar i Shtetit në KIMI Specifikimi i materialeve matëse të kontrollit
PROGRAMI I PROVIMEVE PRANUESE NË KIMIA NË UNIVERSITETIN MJEKËSOR SHTETËROR SARATOV 2009 1. Lënda e kimisë, detyrat e saj. Vendi i kimisë ndër shkencat e natyrës, marrëdhënia e shkencave me kiminë.
BILETA E PROVIMIT PR CERTIFIKIM PERFUNDIMTARE SHTETEROR N KIMI PER PROGRAMET BAZE TE ARSIMIT TE PERGJITHSHEM Bileta 1 1. Sistemi periodik i elementeve kimike te D. I. Mendeleev dhe struktura e atomeve:
Planifikimi i mësimit në kimi, klasa 11, (1 orë në javë, gjithsej 34 orë), materiale mësimore të O. S. Gabrielyan Tema mësimore Elementet e përmbajtjes Kërkesat për nivelin e përgatitjes së nxënësve Eksperiment Detyrë shtëpie Data
Struktura e programit të punës: 1. Shënim shpjegues i programit të punës 2. Planifikimi kalendar dhe tematik për klasat 10-11 3. Kërkesat për nivelin e njohurive të nxënësve 4. Format e vlerësimit të njohurive
Programe testimi në kimi Lënda dhe detyrat e kimisë. Vendi i kimisë ndër shkencat e natyrës. Shkenca atomike-molekulare. Molekulat. Atomet. Qëndrueshmëria e përbërjes së substancës. atomike relative dhe relative
Provimi i unifikuar i shtetit ne KIMI PROJEKT KIMIA shkalla 11 2 Specifikimi i materialeve matëse kontrolli për zhvillimin e provimit të unifikuar të shtetit në KIMI 2017 Specifikimi i materialeve të kontrollit
2 Rezultatet e planifikuara të zotërimit të lëndës akademike Si rezultat i studimit të kimisë, studenti duhet të dijë/të kuptojë: simbolet kimike: shenjat e elementeve kimike, formulat e substancave kimike dhe ekuacionet kimike.
PROGRAMI PËR KRYERJEN E TESTIT HYRËSOR NË LËNDËN “KIMI” Në provimin e kimisë, aplikanti në universitet duhet: - të tregojë njohuri për parimet bazë teorike; - të jetë në gjendje të zbatojë teorinë
PROGRAMI I TESTIT HYRJES NË KIMI Programi është hartuar në bazë të përmbajtjes minimale të detyrueshme të arsimit të mesëm (të plotë) të përgjithshëm dhe përbëhet nga tre seksione. Pjesa e parë i kushtohet teorisë
Programi i punës së lëndës zgjedhore “Kimi” për klasën e 11-të për vitin akademik 2016-2017 autor: mësuese e biologjisë dhe kimisë Kolosnitsyna S.V. s.zubovo 2016 Shënim shpjegues Lëndë me zgjedhje"Kimi" është menduar
KIMIA Teoria e strukturës së materies Atomi. Përbërja e bërthamave atomike. Element kimik. Qëndrueshmëria e përbërjes së substancës. Masa relative atomike dhe molekulare relative. Ligji i ruajtjes së masës, kuptimi i tij
Planifikimi tematik për vitin shkollor 2015-2016 kimia klasa 10 Teksti mësimor O.S. Gabrielyan i mësimit Data Titulli i seksionit, tema e mësimit (duke treguar numrin e orëve) Njohuritë, aftësitë dhe aftësitë që zhvillohen. Mënyrat e veprimtarisë
Provimi i Unifikuar i Shtetit në KIMI. Specifikimi i materialeve matëse të kontrollit për kryerjen e Provimit të Unifikuar të Shtetit në Kimi në vitin 0 është përgatitur nga Buxheti Federal i Shtetit.
PROGRAMI I TESTEVE HYRËSE NË KIMI PËR APLIKANTËT NË URFU 2014 Gjatë përgatitjes për provimin, një aplikant në universitet duhet të tregojë njohuri për parimet themelore teorike të kimisë si një nga shkencat më të rëndësishme natyrore.
PROGRAMI I KIMIS UDHËZIME TË PËRGJITHSHME Në provimin e kimisë, një aplikant në akademi duhet të tregojë: 1) një njohuri të qartë të ligjeve bazë të kimisë dhe parimeve të teorisë së strukturës së materies, në të cilën bazohet gjithçka moderne.
STANDARDI I ARSIMIT TË PËRGJITHSHËM BAZË NË KIMI Studimi i kimisë në nivelin e arsimit bazë të përgjithshëm synon arritjen e qëllimeve të mëposhtme: zotërimin e njohurive më të rëndësishme për konceptet dhe ligjet bazë.
Lista e elementeve të përmbajtjes të kontrolluara provimi pranues në KIMI Testimi i lëndëve ju lejon të vlerësoni nivelin e trajnimit të arsimit të përgjithshëm në kiminë e të diplomuarve të klasave IX të arsimit të përgjithshëm
PROGRAMI I TESTIMIT TË HYRJES NË KIMI NË FSBEI HE "PSU" 2016 PËRMBAJTJA PJESË E PROGRAMIT TË KIMIS për aplikantët Seksioni 1. BAZET TEORIKE TË KIMISË Ide moderne rreth strukturës
Shënim shpjegues për notën 0. Programi është i ndryshëm në përputhje me komponentin federal të standardit arsimor shtetëror të arsimit të mesëm të përgjithshëm dhe në bazë të programit për arsimin e përgjithshëm
2 Shënim shpjegues Programi është zhvilluar në bazë të përmbajtjes minimale të detyrueshme të arsimit të mesëm (të plotë) të përgjithshëm në kimi. Përmbajtja e programit 1. Lënda dhe detyrat e kimisë. Dukuritë fizike
Një aplikant në një universitet duhet të demonstrojë njohuri për parimet themelore teorike të kimisë si një nga shkencat natyrore më të rëndësishme që qëndron në themel të kuptimit shkencor të natyrës. Ekzaminuesi duhet të jetë në gjendje të përdorë
Ky udhëzues referencë përmban një të kondensuar dhe të mbivendosur formë e aksesueshme Materiali bazë për një kurs të kimisë në shkollë: kimia e përgjithshme, kimia inorganike, kimi organike. Manuali është paraqitur në formën e tabelave dhe diagrameve. Rekomandohet për nxënësit e shkollës, aplikantët dhe mësuesit e shkollës.
Ligji periodik.
Vetitë e elementeve kimike, si dhe format dhe vetitë e përbërjeve të elementeve, varen periodikisht nga ngarkesa e bërthamave të atomeve të tyre.
1. Numri serial element - e barabartë me ngarkesën bërthama dhe numri i elektroneve.
2. Numri i periudhës - numri i niveleve.
3. Numri i grupit - valenca (maksimumi shkallë pozitive oksidimi).
4. Vetitë metalike elementet rriten nga lart poshtë dhe nga e djathta në të majtë. Këto veti shfaqen nga elementë me një numër të vogël elektronesh valente.
KIMIA E PËRGJITHSHME
Konceptet dhe ligjet themelore të kimisë.
Shkenca atomike-molekulare.
Mol. Masa molare substancave.
Reaksionet kimike,.
Ligji i ruajtjes së masës së lëndës.
Ligji i qëndrueshmërisë së përbërjes së materies.
Ligjet e gazit.
Ligji periodik i D.I.Mendeleev.
Struktura e atomit.
Modeli i gjendjes së një elektroni në një atom.
Ligji periodik.
Lidhja kimike.
Lidhja kovalente.
Lidhja jonike.
Molekulat polare. Molekula jo polare.
Lidhje metalike.
Lidhja hidrogjenore.
Rrjetë kristali. Llojet e rrjetave kristalore.
Formulat strukturore.
Gjendja e oksidimit.
Valence.
Shpejtësia e reaksioneve kimike, ekuilibri kimik.
Energjia e aktivizimit.
Koncepti i katalizës dhe katalizatorëve.
Reaksione të kthyeshme dhe të pakthyeshme.
Bilanci kimik. Parimi i Le Chatelier.
Zgjidhjet. Teoria disociimi elektrolitik.
Shprehja numerike e përbërjes së tretësirave.
Tretshmëria e substancave në ujë.
Dukuritë termike gjatë tretjes.
Elektrolite dhe joelektrolite.
Teoria e disociimit elektrolitik. Mekanizmi.
Shpërbërja e acideve, bazave dhe kripërave në tretësirat ujore.
Shkalla e disociimit. Reaksionet e shkëmbimit të joneve.
Shpërndarja e ujit.
Klasat më të rëndësishme të përbërjeve inorganike.
Oksidet.
Acidet.
Hidroksidet.
Kripë.
Reaksionet redoks.
Teoria e reaksioneve redoks.
Hartimi i ekuacioneve të reaksioneve redoks.
Ndikimi i mjedisit në natyrën e reaksioneve.
Klasifikimi.
Elektroliza.
KIMIA INORGANIKE.
Hidrogjeni.
Komponimet e hidrogjenit.
Metalet alkali. Grupi I. Nëngrupi kryesor.
Metalet alkaline të tokës. Grupi IIA. (Kalcium).
Elementet e grupit III A (Alumini).
Elementet e grupit IV A (Karboni, silici).
Elementet e grupit UA (Azot, fosfor).
Elementet e grupit VI. Kalkogjenët (Oksigjen, squfur).
Elementet e grupit VIIA. Halogjenet (Klori).
Elementet e nëngrupeve anësore.
Nëngrupi i kromit.
Nëngrupi i hekurit.
KIMIA ORGANIKE.
Hidrokarburet.
Hidrokarburet e ngopura.
Hidrokarburet e pangopura.
Hidrokarburet aromatike.
Komponimet organike që përmbajnë oksigjen.
Alkoolet.
Fenolet.
Aldehidet.g.
Polikondensimi.
Ketonet.
Acidet karboksilike.
Esteret.
Komponimet organike që përmbajnë azot.
Aminat.
Anilina.
Aminoacidet.
ketrat.
Shkarkim falas e-libër në një format të përshtatshëm, shikoni dhe lexoni:
Shkarkoni librin Kimia në tabela dhe diagrame, Kurmasheva K.K., 2002 - fileskachat.com, shkarkim i shpejtë dhe pa pagesë.
- Vetë-mësues i lezetshëm i gjuhës angleze për fillestarë dhe fillestarë, Dragunkin A.N., 2002 - Në ditët e sotme, ka ndodhur një ngjarje që, me sa duket, pas njëfarë kohe do të quhet edhe një moment historik, "civilizues". Kjo ngjarje është… Libra në anglisht
- Libër i ri referimi për kimistin dhe teknologun, Vetitë themelore të përbërjeve inorganike, organike dhe organoelementare, 2002